白曲霉酸性蛋白酶在黑曲霉中表达
李杰,吴婷,马南,王欣,杨建乐,李健友,张会
(东北农业大学生命科学学院,哈尔滨 150030)
白曲霉酸性蛋白酶在黑曲霉中表达
李杰,吴婷,马南,王欣,杨建乐,李健友,张会
(东北农业大学生命科学学院,哈尔滨 150030)
研究分析固态发酵酸性蛋白酶生产菌株及其产品,ITS序列鉴定结果表明,该菌株为曲霉属,质谱分析结果表明其产品为Aspergillus saitoi酸性蛋白酶Aspergillopepsin I(EC.3.4.23.18)。根据Aspergillus saitoi酸性蛋白酶Aspergillopepsin I基因序列pep1(GI:473517)设计引物,以固态发酵酸性蛋白酶生产菌株基因组DNA为模板,利用PCR技术扩增获得pep1基因。序列分析结果表明,扩增片段与白曲霉Aspergillus kawachii酸性蛋白酶基因组序列相似性为99%,其编码蛋白与白曲霉Aspergillus kawachii酸性蛋白酶(GAA90749.1)相似性为100%,将该基因命名为pepB。构建黑曲霉表达载体pSZHG-pepB,通过农杆菌介导法转化黑曲霉CICC2462,筛选得到在glaA位点发生同源重组纯合转化子。经摇瓶发酵后,对产物进行SDS-PAGE、酶活检测以及酸性蛋白酶酶学性质和酶稳定性研究。结果表明,纯合同源重组菌株经SDS-PAGE检测时在47 ku左右处有明显目的蛋白条带,其发酵产物酸性蛋白酶酶活达5 543 U·mL-1,为出发菌株152倍。对菌株所产酸性蛋白酶酶学性质研究发现,该酶最适反应温度为50℃,最适反应pH 3.0,在4℃和25℃条件下,酶在pH 3.0~4.0时较稳定。
酸性蛋白酶;黑曲霉;同源重组;分泌表达
李杰,吴婷,马南,等.白曲霉酸性蛋白酶在黑曲霉中表达[J].东北农业大学学报,2016,47(5):29-35.
Li Jie,Wu Ting,Ma Nan,et al.Expression of acid protease fromAspergillus kawachiiinAspergillus niger[J].Journal of Northeast Agricultural University,2016,47(5):29-35.(in Chinese with English abstract)
酸性蛋白酶主要源于动物器脏(胃蛋白酶等)和微生物分泌,能在较低pH(最适pH 2.0~4.0)环境中将蛋白质水解为氨基酸和小肽酶类[1-3]。酸性蛋白酶潜能开发受到关注。如提高原料利用率和动物对蛋白饲料利用率,缩短育肥时间[4-7]及医药消炎作用。酸性蛋白酶生产方面,研究和应用生产菌株以真菌为主,唐宝英等采用单菌分离和甲基磺酸乙醋处理交替方法,获得一株黑曲霉诱变菌株EDFIO99,经液体发酵后,酸性蛋白酶发酵酶活达3 300 U·mL-1,提高近l倍[8]。韩志双等对高产酸性蛋白酶米曲霉菌株Y-9及F-5进行两轮连续基因组改组,得到高产酸性蛋白酶米曲霉菌株G11酸性酶活为769.25 U·g-1,较出发菌株F-5高276.25%,较Y-9高253.37%[9]。李乃强等对宇佐美曲霉产酸性蛋白酶菌株逐级诱变育种和发酵条件正交试验优化,最终使酸性蛋白酶产量从2 800 U·mL-1提高到8 400 U·mL-1[10]。研制高产酸性蛋白酶黑曲霉工程菌可提高酸性蛋白酶发酵产量、降低生产成本。
固态发酵酸性蛋白酶液态稳定,适合生产液体酸性蛋白酶,具有广阔应用前景。但固态发酵生产方式劳动强度大、质量不稳,限制规模化生产。液态发酵具有机械化程度高、技术管理严格、酶产率高及质量稳定、产品回收率高等特点。本试验选用适合于液态发酵糖化酶生产菌黑曲霉CICC2462为转化受体菌,构建表达固态发酵酸性蛋白酶工程菌,为液态发酵生产稳定液体酸性蛋白酶探索新途径。
1 材料与方法
1.1 材料
1.1.1 试验材料
固态发酵酸性蛋白酶生产菌株、商品酸性蛋白酶和糖化酶生产菌株黑曲霉CICC2462由肇东市日成酶制剂有限公司惠赠;大肠杆菌DH5α、农杆菌AGL1由东北农业大学遗传学实验室保存;pMD-18T购于TaKaRa公司;质粒pSZHG由东北农业大学遗传学实验室构建并保存。
1.1.2 试剂
Primer STAR DNA Polymeras、Taq酶(TaKaRa公司);限制性内切酶NheⅠ、HindⅢ(TaKaRa公司);T4DNA Ligase(康为世纪公司);DNA片段回收试剂盒(天根生物工程公司);质粒快速提取试剂盒(康为世纪生物科技有限公司);PCR引物(上海生工);Hygromycin B、Xylan(from beechwood)(Sigma公司);利福平、卡那霉素、氨苄霉素、乙酰丁香酮(Sangon公司);化学试剂(国产分析纯)。
1.1.3 仪器与器材
高速离心机(德国Thermo Fisher Scientific);PCR仪(比朗实验设备有限公司);HPS-400生化培养箱(哈尔滨市东联电子技术开发有限公司);HZQ-Z1组合震荡培养箱、全温震荡箱(哈尔滨市东联电子技术开发有限公司);蛋白质电泳系统(美国伯乐公司);电子天平(北京赛多利斯科学仪器有限公司);立式超低温保存箱、医用低温保存箱(青岛海尔特种电器有限公司);磁力搅拌器(江苏荣华仪器制造有限公司);紫外可见分光光度计(上海元析仪器有限公司)。
1.2 方法
1.2.1 基因扩增
结果见表1。
以白曲霉酸性蛋白酶生产菌株基因组DNA为模版,利用引物pepB sense与pepB antisense扩增出pepB基因片段,与pMD-18T载体连接,将连接产物转入大肠杆菌DH5α感受态细胞中,获得质粒pMD-18T-pepB后用NheⅠ、HindⅢ限制性内切酶双酶切鉴定,将鉴定正确大肠杆菌转化子送公司测序,测序结果在NCBI上进行Blast比对分析。
1.2.2 黑曲霉表达载体构建
用限制性内切酶NheⅠ、HindⅢ对鉴定正确pMD-18T-pepB质粒酶切,并将得到pepB基因片段纯化回收。载体pSZHG中含有NheⅠ和HindⅢ酶切位点,限制性内切酶NheⅠ、HindⅢ酶切载体pSZHG,并将载体片段纯化回收。T4DNA Ligase将回收目片段和载体片段进行连接,经23℃连接30 min,转化大肠杆菌DH5α,在卡那抗性筛选下,双酶切鉴定,获得黑曲霉表达载体pSZHG-pepB。

表1 引物介绍Table 1Primere introduction
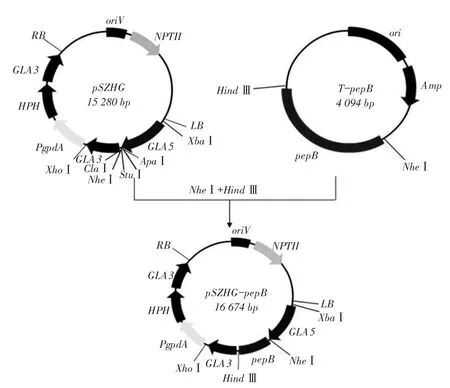
图1 pSZHG-pepB表达载体构建图谱Fig.1Construction of expression vector pSZHG-pepB
1.2.3 农杆菌介导法转化黑曲霉
冻融法将已经鉴定正确大肠杆菌转化子转化进入农杆菌中,水为阴性对照,大肠杆菌转化子质粒为阳性对照,利用基因引物进行PCR验证,获得pSZHG-pepB农杆菌转化子。再通过农杆菌介导法转化黑曲霉,将筛选培养基上长出黑曲霉单菌落分别接种于含有潮霉素液体PDA培养基中二次筛选。
1.2.4 重组黑曲霉工程菌表达
将筛选获得黑曲霉同源重组转化子接种于发酵培养基(葡萄糖10%、豆饼粉2%、玉米浆2%),pH 5.5~6.0,30℃,300 r·min-1震荡培养,培养4 d后取样,13 000 r·min-1离心5 min,收集发酵液上清,取10 μL用于SDS-PAGE蛋白检测。
1.2.5 pSZHG-pepB重组菌株酸性蛋白酶基因活性检测
用Folin法测定,在pH 3.0,温度40℃条件下,1 mL液体酶每分钟水解酪蛋白产生1 μg酪氨酸所需酶量为1个蛋白酶活性单位。
1.2.6 pSZHG-pepB重组菌株中酸性蛋白酶酶学性质分析
检测25~60℃不同温度和2.0~7.0不同pH下酶活力,分析温度和pH对酶活力影响,确定重组菌株所产酸性蛋白酶最适温度和最适pH。
1.2.7 pSZHG-pepB重组菌株中酸性蛋白酶稳定性分析
测定不同温度及pH下酸性蛋白酶稳定性变化。将发酵粗酶液和商品酸性蛋白酶酶液均调成3.0~7.0不同pH,分别置于4和25℃环境中,24 h后检测酶活变化。
2 结果与分析
2.1 固态酸性蛋白酶生产菌株鉴定
从固态酸性蛋白酶生产菌株基因组DNA得到ITS序列,经公司测序后,在NCBI上经Blast比对分析,得知商品酸性蛋白酶生产菌株与曲霉属(JF838357.1),(HQ014696.1),(HQ014690.1)相似度达100%。
2.2 商品酸性蛋白酶鉴定
对酶粉10倍稀释,通过SDS-PAGE检测,在47 ku左右处得到酸性蛋白酶蛋白条带,将目条带切下做质谱分析。分析可知该商品酶为曲霉属酸性蛋白酶(Aspartic protease pep1 OS=Aspergillus saitoi)。
2.3 白曲霉pepB基因扩增
以商品酶生产菌株基因组DNA为模板,利用基因引物扩增得到目片段后与pMD18-T连接,转化大肠杆菌感受态,经鉴定测序后可知:扩增片段与白曲霉Aspergillus kawachii酸性蛋白酶基因组序列相似性为99%,编码蛋白与白曲霉Aspergillus kawachii酸性蛋白酶(GAA90749.1)相似性为100%,可确定商品酶为白曲霉酸性蛋白酶。

图2 PCR扩增结果Fig.2PCR amplification of gene

图3 商品酸性蛋白酶SDS-PAGE检测Fig.3Detection of pepB using SDS-PAGE
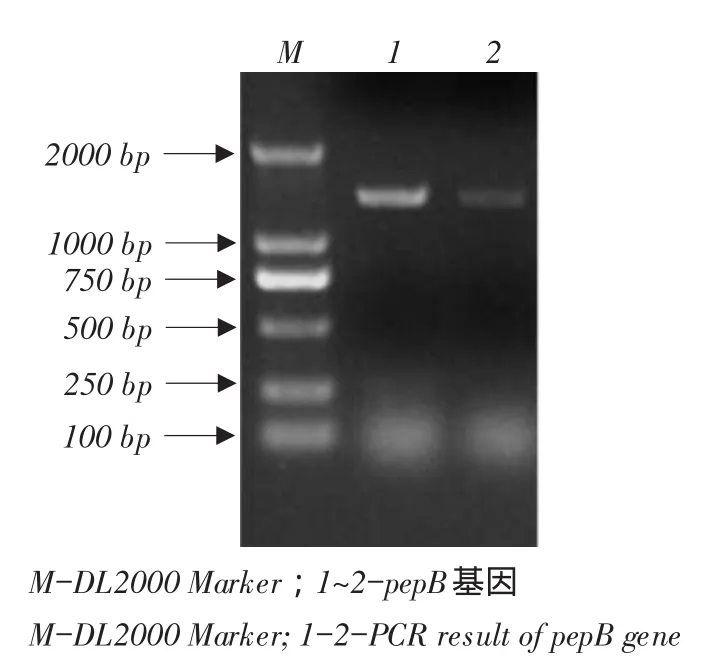
图4 pepB片段PCR扩增结果Fig.4PCR amplification of pepB
2.4 酸性蛋白酶pepB基因黑曲酶表达载体pSZHG-pepB构建
质粒pMD-pepB和表达载体pSZHG用相同限制性内切酶双酶切回收后T4DNA Ligase连接,转化大肠杆菌DH5α后,再双酶切经过卡那抗性筛选大肠杆菌转化子,构建正确表达载体pSZHG-pepB。
2.5 黑曲霉转化子筛选与鉴定
首先将农杆菌和黑曲霉共培养于含有乙酰丁香酮(AS)PDA固体培养基上,2 d后在筛选培养基上一次筛选,液体PDA培养基中二次筛选,5 d左右提取基因组DNA,利用糖化酶同源臂特异性引物PCR扩增,黑曲霉转化子均扩增出3 694 bp条带。
2.6 黑曲霉纯合同源重组转化子鉴定
经黑曲霉阳性转化子鉴定后,选7号在有潮霉素PDA固体培养基上继续筛选,再次用糖化酶同源臂特异性引物PCR扩增后得到8号菌株仅有与pSZHG-pepB质粒扩增出3 694 bp一条带,无出发菌株扩增出条带,表明8号pSZHG-epB菌株为纯合同源重组菌株。
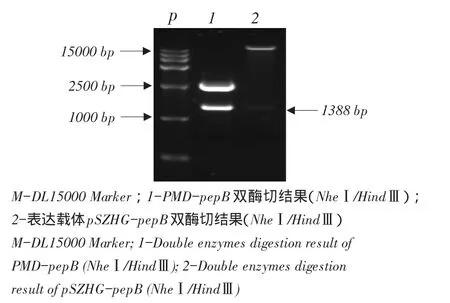
图5 表达载体pSZHG-pepB转入大肠杆菌中双酶切结果Fig.5Double enzymes digestion result of expression vector pSZHG-pepB transferred into E.coli
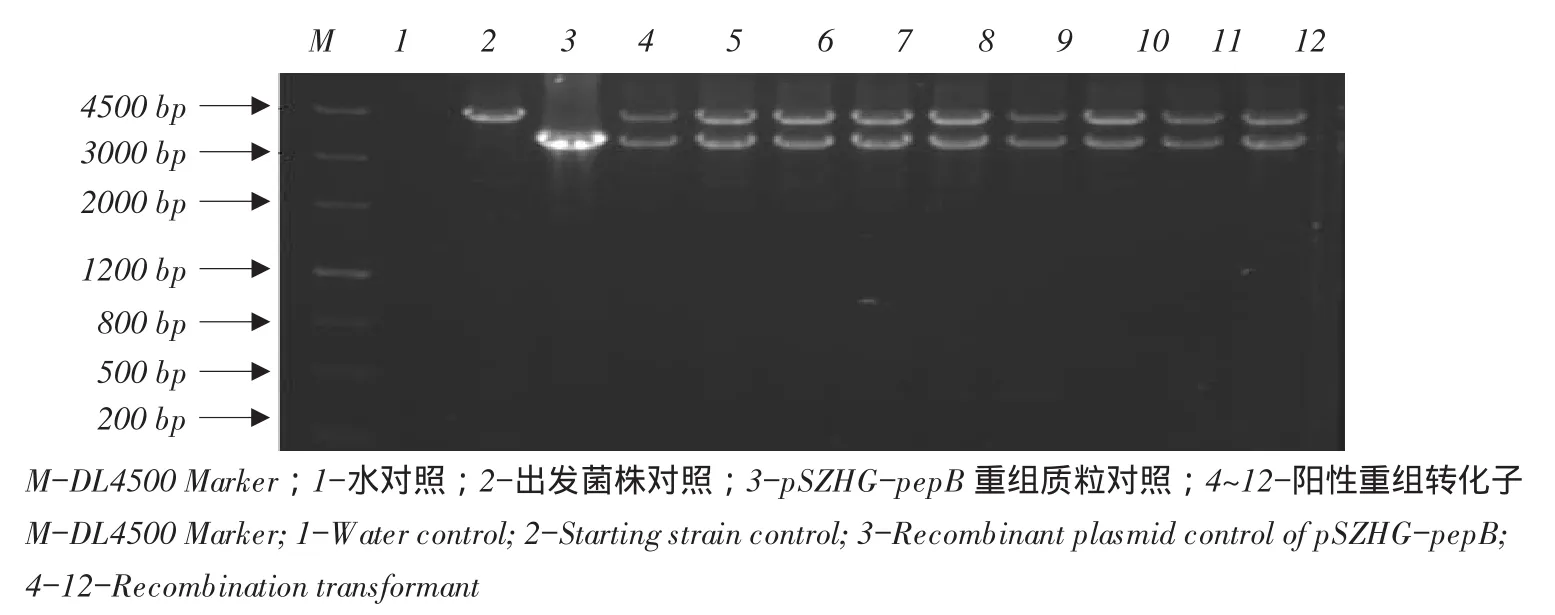
图6 pSZH-pepB重组阳性转化子PCR鉴定结果Fig.6Results of identification pSZHG-pepB recombination transformants by PCR

图7 pSZH-pepB重组阳性转化子PCR鉴定结果Fig.7Results of identification pSZHG-pepB recombination transformants by PCR
2.7 pSZHG-pepB重组菌株酸性蛋白酶基因SDSPAGE检测
将菌量足够出发菌株与pSZHG-pepB纯合同源重组菌株接种于发酵培养基中,取上清进行SDSPAGE检测。结果见图8。
由图8可知,pSZHG-pepB纯合同源重组菌株相对分子质量为47 ku左右,与黑曲霉所产糖化酶条带近似重合,且随着发酵天数增加,酸性蛋白酶条带明显加深,蛋白量较出发菌株提高。糖化酶则在发酵后有所降解,条带略变浅。

图8 SDS-PAGE蛋白表达凝胶电泳图谱Fig.8SDS-PAGE gel electrophoresis profile of protein expression
2.8 pSZHG-pepB重组菌株酸性蛋白酶基因活性检测
取4~10 d发酵上清液,pSZHG-pepB纯合同源重组菌株在第9天达到较高酶活5 543 U·mL-1,第10天后酶活逐步下降。其中出发菌株随发酵天数增加酶活逐步增大且第7天达到最大酶活36 U·mL-1,第8天后开始下降,重组菌株最高酶活力比出发菌株高152倍。

图9 重组菌株pSZHG-pepB在不同发酵培养时间酶活力Fig.9Enzyme activity of pSZHG-pepB in supernatant of fermentation broth at different time
2.9 pSZHG-pepB重组菌株中酸性蛋白酶酶学性质分析
分别测定25~60℃不同温度和2.0~7.0不同pH下酶活力,结果如图11~12所示。试验结果表明pSZHG-pepB纯合同源重组菌株在检测25~60℃酶活时,在50℃有较高酶活,可确定50℃温度为酸性蛋白酶最适温度;在pH 2.0~7.0时检测pSZHG-pepB纯合同源重组菌株酶活,在pH 3.0时有较高酶活,可确定pH 3.0为酸性蛋白酶最适pH,且当pH低于3.0或高于3.0时,酶活力明显降低。
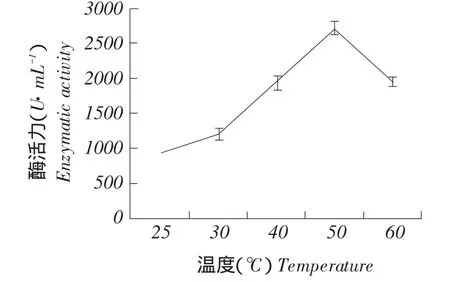
图10 温度对酶活影响Fig.10Effect of temperature on enzyme activity
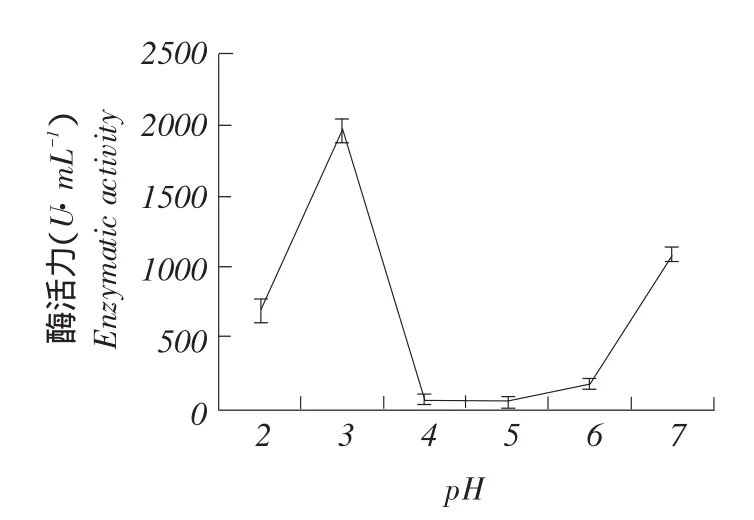
图11 pH对酶活影响Fig.11Effect of pH on enzyme activity
2.10 pSZHG-pepB重组菌株中酸性蛋白酶稳定性分析
主要测定不同温度及pH下重组酸性蛋白酶和商品酸性蛋白酶稳定性。将发酵粗酶液和商品酸性蛋白酶酶液均调成3.0~7.0不同pH,分别置于4℃和25℃环境中,24 h后检测酶活变化。结果显示,在4℃中,pSZHG-pepB重组菌株中酸性蛋白酶及商品酶均在pH 3.0时稳定性较好,残余酶活力仍较高,而pH 4.0~7.0时,两者均有所下降情况下商品酸性蛋白酶酶活较重组菌株稳定性更高。

图12 pSZHG-pepB重组菌株中酸性蛋白酶与商品酶在4℃不同pH时稳定性分析Fig.12Effects of different pH on enzyme stability under 4℃
3 讨论
黑曲霉作为丝状真菌中重要蛋白生产宿主,凭借自身强大而丰富聚合物降解酶系和优秀生物安全性,成为重要酶制剂生产菌种和异源蛋白表达优良宿主。糖化酶生产菌黑曲霉2462菌丝体短、菌丝粗壮、发酵液粘度低、产酶能力强、耐高渗,适合于高密度深层液体发酵。尤其是其糖化酶基因启动子PglaA转录水平很高,分泌糖化酶可达20 g·L-1。本实验室前期以其为受体高水平表达同源木聚糖酶以及内切葡聚糖酶等[11-12]。在本研究中,白曲霉蛋白霉基因获得高水平表达,证明该系统表达同源和近源分泌蛋白基因潜力较大。
本试验构建酸性蛋白酶黑曲霉工程菌,液体酶稳定性较商品酶稳定性略低,原因是本研究获得酸性蛋白酶为粗酶液,未添加任何稳定剂和保护剂。学者对液体酸性蛋白酶稳定剂进行研究,探讨防腐剂、醇类、糖及金属离子等作为稳定剂效果,证明可通过添加复合稳定剂或保护剂,提高液体酸性蛋白酶稳定性,延长保存时间[2,13],添加复合稳定剂或保护剂提高该工程菌生产液体酸性蛋白酶稳定性有待进一步研究。
4 结论
重组菌株所产酸性蛋白酶最高酶活力为5 543 U·mL-1,为出发菌株酶活力152倍,有明显提高,经测定最佳反应温度为50℃,最佳反应pH 3.0,且该酶在4和25℃、pH 3.0~4.0时较稳定。25℃时,pH 3.0~4.0时酸性蛋白酶酶活力稳定性较好,且重组菌株在pH高于4.0时酶活力降低,商品酶在pH高于5.0后稳定性开始下降。

图13 pSZHG-pepB重组菌株中酸性蛋白酶与商品酶在25℃不同pH时稳定性分析Fig.13Effects of different pH on enzyme stability under 25℃
[1]肖竞,孙建议,李卫芬.酸性蛋白酶及其在畜牧业中应用[J].饲料博览,2003(3):27-29.
[2]曹治云.黑曲霉产酸性蛋白酶催化机制与稳定剂研究[D].福州:福建师范大学,2005:1-3.
[3]邱重晏.酸性蛋白酶基因克隆及表达[D].无锡:江南大学,2005.
[4]邹东恢,李国全,李琰.啤酒生产技术与装备新发展展望[J].农产品加工,2008,89(7):67-70.
[5]吕远平,姚开.高活力酸性蛋白酶菌株在酱油酿造中应用[J].中国酿造,2002,119(3):10-11.
[6]刘鑫,李佳,刘克武.黑曲霉酸性蛋白酶在食醋酿造中催化效应[J].化学研究与应用,2004,16(4):482-484.
[7]李永泉.羊毛生物整理复合酶高产菌激光选育[J].菌物系统, 2001,20(2):196-200.
[8]唐宝英,曹建民.酸性蛋白酶高产菌株选育[J].食品与发酵工业,1998,24(3):16-18.
[9]韩志双,刘军,郇阿梅,等.应用基因组改组技术选育米曲霉酸性蛋白酶高产菌株[J].中国调味品,2015,40(1):18-22.
[10]李乃强,蓝蕾,潘军华,等.宇佐美曲霉酸性蛋白酶摇瓶发酵工艺条件优化[J].粮食与饲料工业,2002,212(1):29-31.
[11]李杰,高博,江连洲,等.内切葡聚糖酶基因在黑曲霉中同源表达[J].东北农业大学学报,2014,45(9):56-61.
[12]李杰,张会,张莹莹,等.食品级木聚糖酶黑曲霉工程菌构建[J].东北农业大学学报,2013,14(44):7-11.
[13]吴京平.金属离子对蛋白酶活力和热稳定性影响[J].中国皮革,2004,33(11):32-35.
Expression of acid protease fromAspergillus kawachiiinAspergillus niger
LI Jie,WU Ting,MA Nan,WANG Xin,YANG Jianle,LI Jianyou,ZHANG Hui
(School of Life Sciences,Northeast Agricultural University,Harbin 150030,China)
In this study,solid fermentation acid protease's producing strain from Zhaodong Richeng enzyme Ltd.and its products were analyzed,ITS sequence indicated that the strain belongs to the genusAspergillusand mass spectrometric analysis showed that its product was acidic protease Aspergillopepsin I(EC.3.4.23.18)ofAspergillus saitoi.According to gene sequence of pep1(GI: 473517)from acid protease Aspergillopepsin I ofAspergillus saitoi,primers were designed,producing strain's genomic DNA from Solid-state fermentation acid protease as the template,and by the method of PCR,pep1 gene was cloned.Sequence analysis showed that amplified fragment was 99%similar to acid protease's genome sequence ofAspergillus kawachiiand encoding protein was 100%similar to acid protease ofAspergillus kawachii,and it was named aspepB.FurthermoreAspergilluse niger expression vector pSZHG-pepB was constructed and the homozygous transformation of homologous recombination at the glaA site was selected by Agrobacterium mediated transformation ofAspergillus niger CICC2462 By shaking flask fermentation,the product was studied by SDS-PAGE and the activitywas detected,acid protease's characterization and stabilitywas studied.Experimental results showed that the pure homologous recombination strains had about 47 ku protein band which was found by SDS-PAGE and acid protease activity of fermentation product was 5 543 U·mL-1which is 152 times of the activity of starting strain.By studying the acid protease's characterization and stability of this strain, we found that the enzyme optimum reaction temperature is 50℃,the optimal pH was 3.0,what's more, enzyme activity is stable when the pH is between 3.0 and 4.0 meanwhile the temperature is 4℃or 25℃.
acid protease;Aspergillus niger;homologous recombination;secretory expression
Q815
A
1005-9369(2016)05-0029-07
2016-03-16
黑龙江省应用技术研究与开发计划重大项目(GA15B203)
李杰(1972-),男,副教授,博士,研究方向为微生物工程。E-mail:lijie_neau@126.com
时间2016-5-27 10:08:51[URL]http://www.cnki.net/kcms/detail/23.1391.S.20160527.1008.010.html

