白藜芦醇对人脑胶质瘤U87细胞自噬的影响*
胡火军,黄益玲,汪 雷,郭金满,马金阳
(1.三峡大学第一临床医学院/宜昌市中心人民医院神经外科,湖北宜昌 443003;2.三峡大学医学院病理学系,湖北宜昌 443002)
白藜芦醇对人脑胶质瘤U87细胞自噬的影响*
胡火军1,黄益玲2△,汪 雷1,郭金满1,马金阳1
(1.三峡大学第一临床医学院/宜昌市中心人民医院神经外科,湖北宜昌 443003;2.三峡大学医学院病理学系,湖北宜昌 443002)
目的 研究白藜芦醇对脑胶质瘤U87细胞自噬的诱导作用及其可能的作用机制。方法 分别用不同浓度的白藜芦醇处理脑胶质瘤U87细胞12、24、48 h后,采用四甲基偶氮唑蓝(MTT)法检测白藜芦醇对U87细胞生长的抑制作用;电子显微镜观察药物处理后U87细胞自噬空泡的出现;逆转录PCR及Western blot分别检测白藜芦醇作用后自噬相关基因微管相关蛋白Ⅰ轻链3(LC-3)、抗Bax交互作用因子(Bif-1)mRNA及蛋白表达的变化。结果 随着药物浓度的增加及作用时间的延长,白藜芦醇对U87细胞的生长抑制作用逐渐增大。电镜检测发现未使用白藜芦醇处理的细胞未出现自噬空泡,而白藜芦醇处理过的细胞出现明显的自噬空泡。白藜芦醇能剂量依赖性地增强自噬相关基因LC-3、Bif-1 mRNA及蛋白水平的表达。结论 白藜芦醇可以通过诱导细胞自噬来抑制U87细胞增殖,LC-3、Bif-1基因表达上调是其诱导自噬的可能机制。
神经胶质瘤;自噬;白藜芦醇;U87细胞
白藜芦醇(resveratrol)是含有芪类结构的非黄酮类多酚化合物,广泛存在于葡萄、松树、花生等天然植物或果实当中,具有调节脂质代谢、抑制血小板聚集、保护心血管、抗炎、抗肿瘤等多种生物学活性[1-2]。近年来研究发现,肿瘤细胞中的自噬活动可以在一些治疗因素作用下被激活,过度自噬导致的细胞死亡可以杀灭肿瘤细胞[3-4]。白藜芦醇能否通过诱导自噬抑制脑胶质瘤的生长尚未见报道。本研究以人脑胶质瘤U87细胞为模型,探讨白藜芦醇对脑胶质瘤U87细胞的自噬诱导作用,并初步探讨其作用机制,为白藜芦醇的抗肿瘤作用提供试验依据。
1 材料与方法
1.1 材料 白藜芦醇购自Sigma 公司;DMEM培养基和胎牛血清(FBS)购自美国Gibcobrl公司;RPMI 1640 培养基和FBS购自美国Gibcobrl公司;四甲基偶氮唑蓝(MTT)购自Amresco公司;Trizol总RNA抽提试剂购自Invitrogen公司;GeneRulerTM100 bp Plus DNA Ladders购自Fermentas公司(试剂来源见文献[5]),引物由Sigma公司合成;一抗Bax交互作用因子(Bax-interacting factor-1,Bif-1)、β-actin、二抗辣根过氧化物酶(HRP)标记的IgG抗体购于Santa Cruz Biotechnology公司;微管相关蛋白Ⅰ轻链3-β(LC-3)购自Cell Signal公司。
1.2 方法
1.2.1 细胞培养 脑胶质瘤细胞U87细胞为本室传代保存,培养于5%CO2,37 ℃湿化孵箱中。培养基DMEM含10%胎牛血清(FBS),0.1 U/L青霉素,0.1 g/L链霉素,取对数生长期细胞待用[5]。
1.2.2 MTT法测定 取对数生长期的U87细胞接种于 96 孔细胞培养板中(每孔2×104),12 h后加入不同浓度的白藜芦醇(0、12.5、25.0、50.0、100.0、150.0、200.0 μmol/L),每个浓度设6个平行孔,继续培养12、24、48 h,每孔加入5 g/L MTT 溶液 20 μL;继续培养4 h后加入200 μL二甲基亚砜(DMSO)溶解,测定MTT-甲臜化合物在570 nm处的光密度(OD)值,按公式:相对抑制率=(1-试验组平均OD值/对照组平均OD值)×100%计算细胞生长抑制率。
1.2.3 电镜观察细胞自噬小泡 U87细胞接种于12孔板,细胞密度70.0%~80.0%时,各孔分别加入不同浓度白藜芦醇处理12 h,收集各组细胞,800 g离心10 min,冰磷酸盐缓冲液(PBS)清洗细胞沉淀,2.5%戊二酸醛4 ℃固定过夜,0.5%四氧化锇孵育30 min后,用含2.0%醋酸双氧铀的50.0%乙醇着色、脱水后,环氧树脂812包埋,60 ℃聚合48 h,80 nm切片后枸椽酸铅染色,采用JEOL100CX11透射电子显微镜观察拍照。
1.2.4 逆转录PCR(RT-PCR)检测自噬相关基因LC3和Bif-1 mRNA的表达 收集经白藜芦醇处理的U87细胞,用Trizol按说明书提取总RNA,nano drop测定RNA的水平,用逆转录酶和Oligo(dT)20引物合成cDNA第1链,合成条件为70 ℃ 5 min、37 ℃ 5 min、42 ℃ 60 min、70 ℃ 10 min。以反转录的cDNA为模板,所用引物,退火温度(Tm)及产物长度见表1。PCR产物行1.2%琼脂糖凝胶电泳,紫外拍照分析。

表1 自噬相关基因引物序列
1.2.5 Western blot检测自噬相关基因LC3和Bif-1蛋白的表达 按文献[4]的方法,离心收获细胞,加入适量的细胞裂解液(临用前加入各种蛋白酶抑制剂)提取蛋白,调整蛋白水平,加入等量2×十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)电泳加样缓冲液,置95~100 ℃沸水中变性5 min,行SDS-PAGE垂直电泳,电转膜,加50 g/L脂奶粉于4 ℃冷库封闭过夜。 PBST洗膜后,分别加相应一抗37 ℃孵育1 h,PBST洗膜;加相应二抗37 ℃孵育1 h,PBST洗膜,等量的电化学发光(ECL)发光液A和B混合后加至膜上1 min,最后X线片显影。

2 结 果
2.1MTT法测定白藜芦醇对U87细胞增殖的抑制作用 白藜芦醇对U87细胞的生长抑制作用随其浓度的增大而加强,与0μmol/L白藜芦醇,差异有统计学意义(P<0.01),见图1。
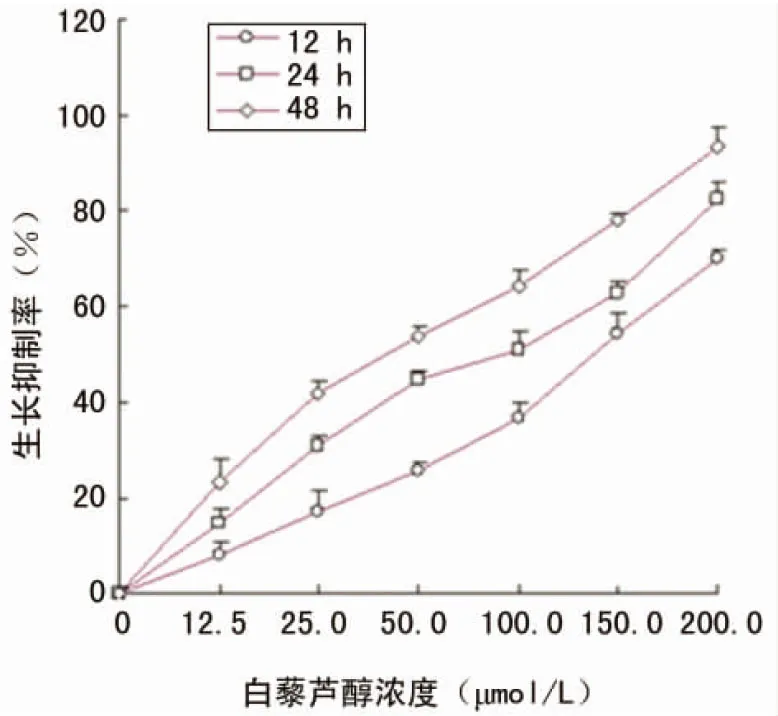
图1 不同浓度白藜芦醇作用12、24、48 h对U87细胞的增殖抑制作用
2.2 白藜芦醇对细胞自噬的影响 自噬是以细胞质空泡化为特征的依赖于溶酶体的一种降解途径,在电子显微镜下可以观察到自噬性空泡的出现。0μmol/L白藜芦醇处理的U87细胞无明显自噬空泡,经25μmol/L白藜芦醇处理12h的U87细胞开始出现自噬空泡,50μmol/L白藜芦醇处理U87细胞后出现的自噬空泡更为明显,见图2。
2.3 白藜芦醇对细胞自噬相关基因mRNA的影响RT-PCR检测发现,白藜芦醇能增强自噬相关基因LC-3、Bif-1mRNA表达水平,并具有剂量依赖性,见图3。
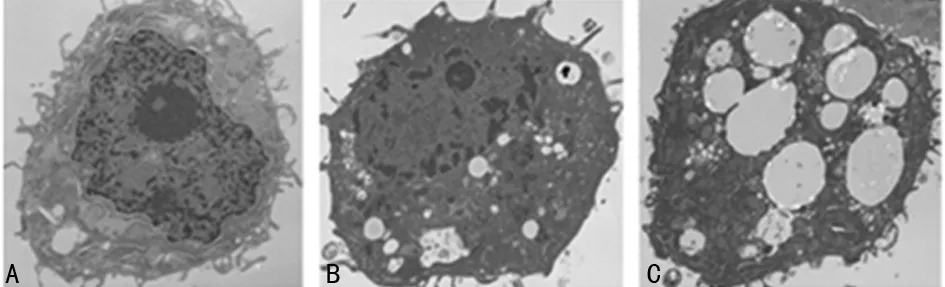
图2 白藜芦醇对细胞自噬的电镜改变
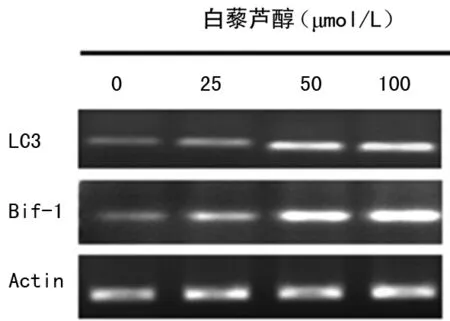
图3 白藜芦醇对自噬相关基因LC-3、Bif-1 mRNA表达的影响(RT-PCR)
2.4 白藜芦醇对自噬相关蛋白的影响Westernblot检测发现,白藜芦醇作用后可明显升高LC3-Ⅱ水平,Bif-1的表达也逐渐升高,见图4。

图4 白藜芦醇对自噬相关蛋白LC-3、Bif-1表达的影响(Westerm blot)
3 讨 论
脑胶质瘤是最常见的颅内原发性肿瘤,约占颅内肿瘤的46%,具有侵袭性生长的特征,手术不易完全切除,术后复发率高,积极研究有效的抗脑胶质瘤药物尤其必要[6]。从天然药物中寻找能够抑制肿瘤细胞生长的化合物单体或前体化合物,是目前国内外肿瘤治疗药物研发的热点。白藜芦醇属于非黄酮类多酚化合物,近年研究发现白藜芦醇对乳腺癌、前列腺癌、肝癌、白血病、皮肤癌等多种肿瘤细胞的生长均具有显著的抑制作用[7]。白藜芦醇抑制肿瘤细胞生长的机制不尽相同,Liu等[8]研究发现白藜芦醇可通过PTEN/PI3K/Akt和Wnt/β-catenin信号通路抑制结肠癌细胞的生长。李明新等[9]研究发现白藜芦醇能诱导黑色素瘤细胞发生凋亡,其发生机制与线粒体膜电位破坏,半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)活性增强及B淋巴细胞瘤-2基因 (bcl-2)表达水平降低有关。
近年来,自噬性程序性细胞死亡吸引了越来越多科学家的关注,有关自噬研究的文献在最近几年呈爆炸式增长,自噬性程序性细胞死亡的研究可能会像细胞凋亡一样成为近几年科技领域的热点之一[10-11]。细胞自噬在维持细胞的正常生长、发育中起着重要作用,自噬过度或自噬不足会导致疾病的发生[12]。
自噬性程序性细胞死亡的形态学特征主要表现为细胞质中出现大量包裹着细胞质和细胞器的空泡样结构,即自噬空泡,同时伴有溶酶体对空泡内成分的降解。LC-3定位于前自噬泡和自噬泡膜表面,是细胞自噬泡膜的通用标记物[13]。在自噬泡形成的早期阶段,LC-3的主要形式是LC3-Ⅰ。在哺乳动物E1泛素样酶Atg7和E2泛素样酶Atg3的催化下,LC3-Ⅰ与位于自噬泡膜表面的磷脂酰乙醇胺(PE)结合形成LC3-Ⅱ。LC3-Ⅰ的相对分子质量为16×103,LC3-Ⅱ的相对分子质量为14×103。LC3从LC3-Ⅰ到LC3-Ⅱ的转变是自噬发生的标志之一,LC3-Ⅱ的水平或LC3-Ⅱ/LC3-Ⅰ的比例通常与细胞中自噬空泡的数量呈正相关[14-15]。
Bif-1,又名EndophilinB1,属于Endophilin蛋白家族,它首先在Bax的绑定蛋白中被发现。最近研究发现,Bif-1介导Bax构象变化,激活Bax促凋亡功能,调控细胞凋亡通路[16];另一方面,Bif-1可通过UVRAG蛋白与Beclin-1结合,从而激活VPS34蛋白,参与调控细胞自噬的发生[17-18]。
本研究用白藜芦醇处理脑胶质瘤U87细胞,电镜下可见明显的自噬空泡,且从mRNA及蛋白水平均检测到自噬相关基因LC-3和Bif-1表达水平的上调,表明白藜芦醇作用后可以引发自噬过程的发生,诱导细胞自噬也是白藜芦醇发挥肿瘤抑制作用的机制之一,有关白藜芦醇诱导凋亡及引发自噬的相关关系尚待进一步研究。
[1]RaederstorffD,KunzI,SchwagerJ.Resveratrol,fromexperimentaldatatonutritionalevidence:theemergenceofanewfoodingredient[J].AnnNYAcadSci,2013,1290(8):136-141.
[2]吕林林,许丽娜,彭金咏.抗脑胶质瘤中药的研究进展[J].中国现代应用药学,2014,31(8):1024-1031.
[3]KanzawaT,GermanoIM,KomataT,etal.Roleofautophagyintemozolomide-inducedcytotoxicityformalignantgliomacells[J].CellDeathDiffer,2004,11(4):448-457.
[4]占贞贞,陈思,叶艳,等.自噬及自噬性细胞死亡抑制紫杉醇诱导的胃癌细胞凋亡[J].安徽医科大学学报,2007,42(2):123-127.
[5]黄益玲,黄利鸣,尤程程,等.内质网应激途径在天花粉蛋白诱导的Hela细胞凋亡中的作用[J].中国妇幼保健,2011,26(7):5423-5425.
[6]黄强,董军.王之敏主编神经肿瘤学[M].北京:人民卫生出版社,2011:215.
[7]NakataR,TakahashiS,InoueH.Recentadvancesinthestudyonresveratrol[J].BiolPharmBull,2012,35(3):273-279.
[8]LiuYZ,WuK,HuangJ,etal.ThePTEN/PI3K/AktandWnt/β-cateninsignalingpathwaysareinvolvedintheinhibitoryeffectofresveratrolonhumancoloncancercellproliferation[J].IntJOncol,2014,45(1):104-112.
[9]李明新,李健,樊伟英.白藜芦醇诱导人脉络膜恶性黑色素瘤细胞凋亡及其机制研究[J].中华实验外科杂志,2012,29(12):2566-2568.
[10]SharmaK,LeN,AlotaibiM,etal.Cytotoxicautophagyincancertherapy[J].IntJMolSci,2014,15(6):10034-10051.
[11]MeijerAJ,CodognoP.Regulationandroleofautophagyinmammaliancells[J].IntJBiochemCellBiol,2004,36(12):2445-2462.
[12]ShintaniT,KlionskyDJ.Autophagyinhealthanddisease:adouble-edgedsword[J].Science,2004,306(5698):990-995.
[13]KabeyaY,MizushimaN,UenoT,etal.LC3,amammalianhomologueofyeastApg8p,islocalizedinautophagosomemembranesafterprocessing[J].EMBOJ,2000,19(21):5720-5728.
[14]KabeyaY,MizushimaN,YamamotoA,etal.LC3,GABARAPandGATE16localizetoautophagosomalmembranedependingonform-Ⅱformation[J].JCellSci,2004,117(Pt13):2805-2812.
[15]夏立平,李凌云,费喜峰,等.自噬参与6-羟基多巴胺诱导多巴胺能神经元死亡的实验观察[J].南方医科大学学报,2010,30(12):2649-2651.
[16]TakahashiY,KarbowskiM,YamaguchiH,etal.LossofBif-1suppressesBax/Bakconformationalchangeandmitochondrialapoptosis[J].MolCellBiol,2005,25(21):9369-9382.
[17]TakahashiY,CoppolaD,MatsushitaN,etal.Bif-1interactswithBeclin1throughUVRAGandregulatesautophagyandtumorigenesis[J].NatCellBiol,2007,9(10):1142-1151.
[18]TakahashiY,MeyerkordCL,WangHG.Bif-l/endophilinB1:acandidateforcreseentdrivingforceinautophagy[J].CellDeathDiffer,2009,16(7):947-955.
The effect of resveratrol on human glioma U87 cell autophagy*
HuHuojun1,HuangYiling2△,WangLei1,GuoJinman1,MaJinyang1
(1.DepartmentofNeurosurgery,theFirstClinicalHospitalofChinaThreeGorgesUniversity/CentralPeople′sHospitalofYichangCity,Yichang,Hubei443003,China;2.DepartmentofPathology,MedicalCollege,ChinaThreeGorgesUniversity,Yichang,Hubei443002,China)
Objective To study the autophagy induction effect of resveratrol(Res) on glioma U87 cells and to explore the possible mechanism.Methods Glioma cell line U87 was treated with different concentration of Res.Cell growth inhibition was detected by MTT assay.Electronic microscope was used to observe the typical autophagic vacuoles.RT-PCR and Western blot analysis were used to detect the mRNA and protein expression level of LC-3 and Bif-1 gene.Results With the increase of drug concentration and the prolongation of action time,the inhibition effect of Res on the growth of U87 cells was gradually increased.Electron microscopic examination showed that the control group did not appear autophagic vacuoles,but the experiment group showed obvious autophagic vacuoles.Res increased the expression of autophagy related gene LC-3 and Bif-1 in both mRNA and protein levels in a dose-dependent manner.Conclusion Resveratrol could inhibit the proliferation of U87 cells by inducing autophagic cell death;the up-expression of autophagy related gene LC-3 and Bif-1 might mediate this process.
glioma;autophagy;resveratrol;U87 cell
湖北省自然基金面上项目(2014CFB682);宜昌市中心人民医院科研发展基金项目(KFJ2011005)。 作者简介:胡火军(1972-),副主任医师,博士,主要从事脑肿瘤方面研究。△
论著·基础研究
10.3969/j.issn.1671-8348.2016.23.008
R739.4
A
1671-8348(2016)23-3190-03
2016-04-16
2016-06-24)

