雷公藤甲素对U251细胞自噬活性的影响及机制研究*
惠 双,郭宏强,王 博,王 媛,张成辉
(1.河南省南阳市中心医院肿瘤内科 473000;2.郑州大学附属肿瘤医院肿瘤内科,郑州 450000)
雷公藤甲素对U251细胞自噬活性的影响及机制研究*
惠 双1,郭宏强2,王 博1,王 媛1,张成辉1
(1.河南省南阳市中心医院肿瘤内科 473000;2.郑州大学附属肿瘤医院肿瘤内科,郑州 450000)
目的 探讨雷公藤甲素对U251细胞自噬活性的影响及机制。方法 采用四甲基偶氮唑蓝(MTT)法检测雷公藤甲素对U251细胞的增殖抑制率、半数抑制浓度(IC50);免疫荧光化学法测定细胞中LC3-Ⅱ表达,Westernblot法测定LC3-Ⅱ/LC3-Ⅰ、Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表达。结果 雷公藤甲素作用于U251细胞后,细胞增殖受抑制,24h的IC50为0.73μmol/L,48h的IC50为0.27μmol/L。免疫荧光法测定6、12、24h后LC3-Ⅱ水平增高;Westernblot法测定LC3-Ⅱ水平、LC3-Ⅱ/LC3-Ⅰ比值随时间增高;Beclin-1水平增高,磷酸化P70、磷酸化Erk表达降低、磷酸化AKT无明显变化。结论 雷公藤甲素可抑制U251细胞增殖并促进自噬,并可通过上调Beclin-1表达和抑制mTOR的活性来促进自噬。
雷公藤内酯;自噬;胶质母细胞瘤;U251细胞
胶质瘤是源于神经外胚层间质细胞的颅内恶性肿瘤,约占颅脑肿瘤的50%。其中多形胶质母细胞瘤是较常见的一种病理类型,标准治疗为手术和术后放射治疗。其恶性程度高,治疗效果差,接受标准治疗患者的中位生存期仅为9个月[1]。近年来,对该病治疗进展主要在替莫唑胺同步放化疗并联合化疗或靶向治疗,但仍未能明显提高其疗效[2]。因此,寻求有效的治疗药物对于多形胶质母细胞瘤的治疗有着重要意义。雷公藤甲素是中药材雷公藤的一种提取成分,具有抗炎、免疫抑制、抗肿瘤、抗生育等多种作用[3-6]。有文献表明雷公藤甲素可影响胶质瘤细胞周期调控和促进凋亡[7-8]。雷公藤甲素作用于多形胶质母细胞瘤细胞系U251细胞,发现其能促进细胞自噬和抑制细胞增殖,本研究初步研究其发生机制,现报道如下。
1 材料与方法
1.1 材料 U251细胞系由郑州大学附属肿瘤医院中心实验室提供;雷公藤甲素标准品由福建汉堂生物制药公司提供;四甲基偶氮唑蓝(MTT)、免疫荧光试剂盒、细胞总蛋白提取试剂盒为上海生物工程有限公司产品;鼠抗人单克隆抗体、兔抗鼠酶标二抗为上海碧云天生物公司产品;PE标记单抗、流式细胞仪(FACSCanto Ⅱ型)为美国BD公司产品;酶联免疫吸附实验(ELISA)比色仪:Metertech.∑960型,蛋白电泳仪:A131154型。
1.2 方法
1.2.1 细胞培养 实验选用含有10%灭活小牛血清,青霉素和链霉素各100 KU/L的RPMI-1640培养液,将U251细胞加入该培养液置于37 ℃、5%CO2孵箱内悬浮培养。
1.2.2 细胞增殖抑制的检测 将处于对数生长期U251细胞以3×108/L浓度接种于96孔培养板,加入终浓度为0、0.01、0.10、0.30、0.50 μmol/L的雷公藤甲素,对照组加入等量的RPMI-1640培养液,各孵育60 h。每12 h收集各组U251细胞,使用MTT法在ELISA比色仪570 nm处记录吸光度(A)值,并计算出不同浓度组雷公藤甲素在各时间点对U251细胞的增殖抑制率及半数抑制浓度(IC50)。每浓度组设5个平行副孔测均值。增殖抑制率=(对照孔A值-各浓度孔A值)/对照孔A值×100%,IC50由线性回归方程求得。
1.2.3 免疫荧光法测定U251细胞LC3-Ⅱ蛋白的表达 将加入0.20 μmol/L雷公藤甲素培养的U251细胞组设为实验组,加入等量生理盐水的U251细胞设为对照组。培养6、12、24 h后收集各组细胞,上离心机以3 000 r/min 分离细胞,用磷酸盐缓冲液(PBS)洗涤后于多聚赖氨酸玻片上进行细胞涂片;使用4%多聚甲醛固定30 min后,用PBS洗涤3次后晾干。置于37 ℃用山羊血清封闭20 min,加入鼠抗人LC3-Ⅱ一抗置4 ℃冰箱过夜。再次用PBS洗涤3次后,加入荧光素标记兔抗鼠二抗,置于37 ℃孵育15 min后,封片剂封片。荧光显微镜下观察并摄像。
1.2.4 Western blot法测细胞自噬相关蛋白的表达 分组及培养方法同免疫荧光法。各组收集细胞2×107,用细胞总蛋白提取试剂盒,裂解细胞,4 ℃离心机以12 000 g分离蛋白。加入PBS液煮沸5 min后上样,12%聚丙烯酰胺凝胶进行电泳。电转法转膜后,用2%牛血清清蛋白-磷酸盐缓冲液(BSA-PBS)封闭过夜,次日加鼠抗人单抗于37 ℃孵育4 h,PBS依次冲洗3次,加辣根过氧化物酶(HRP)标记的二抗置37 ℃孵育1 h,PBS再次冲洗3次,加电化学发光(ECL)发光液显色,置暗室曝光显影,用图像分析软件记录图片数据带灰度分析,用该法测定实验组和对照组LC3-Ⅰ、LC3-Ⅱ、Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表达。

2 结 果
2.1 雷公藤甲素对U251细胞的增殖抑制 不同浓度雷公藤甲素对U251细胞均存在增殖抑制作用,见表1、图1。24、48h的雷公藤甲素对U251细胞的IC50为0.73μmol/L和0.27μmol/L。

图1 不同浓度雷公藤甲素对U251细胞增殖抑制率曲线

表1 不同浓度雷公藤甲素对U251细胞的增殖抑制作用
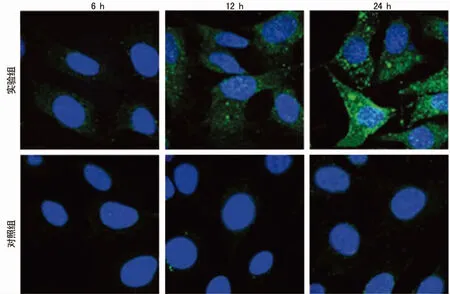
图2 免疫荧光法测定U251细胞中LC3-Ⅱ蛋白的表达

图3 Western blot法测定LC3-Ⅰ和LC3-Ⅱ蛋白的表达
2.2 免疫荧光显微镜下观察细胞 将实验组和对照组细胞置于荧光显微镜下发现,对照组细胞质中LC3-Ⅱ荧光信号极低且随时间无明显变化,实验组细胞质LC3-Ⅱ荧光信号随时间而明显增强,见图2。
2.3Westernblot法测定LC3-Ⅰ和LC3-Ⅱ蛋白的表达 随时间延长,实验组LC3-Ⅱ蛋白表达明显增加,LC3-Ⅱ/LC3-Ⅰ比值也逐渐增高。对照组LC3-Ⅱ表达较低,随时间无明显变化,见图3。实验组与对照组相比,在6、12、24h后,LC3-Ⅰ相对表达度、LC3-Ⅱ相对表达度、LC3-Ⅱ/LC3-Ⅰ比值差异有统计学意义(P<0.05)。
2.4Westernblot法测定Beclin-1、磷酸化P70、磷酸化Erk、磷酸化AKT蛋白的表达 用Westernblot法测定第24h的实验及对照组各蛋白表达差异,发现实验组Beclin-1组较对照组明显增高,而实验组磷酸化P70、磷酸化Erk较对照组明显降低,磷酸化AKT两组无明显差异,见图4。实验组与对照组相比,Beclin-1、磷酸化P70、磷酸化Erk蛋白相对表达度差异有统计学意义(P<0.05),磷酸化-AKT蛋白相对表达度差异无统计学意义(P>0.05)。

图4 Western blot法测定Beclin-1、磷酸化-P70、磷酸化-Erk、磷酸化-AKT蛋白的表达
3 讨 论
细胞自噬是真核生物细胞内溶酶体依赖性的蛋白质或细胞器降解过程,是细胞应激的一种表现。自噬与肿瘤的增殖调控,能量代谢,凋亡调控,免疫逃逸,转移浸润,微环境改变等诸多生物学行为密切相关[9-13],研究肿瘤细胞的自噬属性对于肿瘤的防治有着重要的意义。
微管相关轻链蛋白3 (LC3)在自噬体的输送和与溶酶体的融合过程起重要作用,其活性体LC3-Ⅱ定位于自噬体外膜,LC3-Ⅱ/LC3-Ⅰ比值是反映自噬强度的一个重要指标[13-14]。Beclin-1在自噬体隔膜隔离和囊泡封闭过程中起重要作用,其可与P53蛋白、B细胞淋巴瘤2(Bcl-2)蛋白家族等多种蛋白相互作用而影响自噬[15]。雷帕霉素靶蛋白(mTOR)是自噬信号转导通路的一个枢纽,活化型mTOR复合体通过抑制ULK1-FIP200-Atg13复合体激活从而抑制自噬,P70是mTOR一个重要底物,实验常以P70数量反映mTOR活性[9,16],Ras/MAPK/Erk/mTOR通路和PI3KI/AKT/mTOR通路是mTOR上游2个重要通路,由多种生长因子信号介导,通过激活mTOR实现对自噬的抑制[16-17]。本实验发现雷公藤甲素可诱导U251细胞自噬而抑制其生长,并明确了此作用的部分机制:(1)增强Beclin-1表达;(2)下调Erk表达,从Ras/MAPK/Erk/mTOR通路抑制mTOR活性。
本研究为临床应用雷公藤甲素治疗胶质母细胞瘤提供了理论依据和实验室数据。雷公藤甲素诱导U251细胞自噬的其他机制,本课题组正在研究中并将陆续发表研究成果。
[1]StewartLA.Chemotherapyinadulthigh-gradeglioma:asystematicreviewandmeta-analysisofindividualpatientdatafrom12randomisedtrials[J].Lancet,2002,359(9311):1011-1018.
[2]StuppR,HegiME,MasonWP,etal.EffectsofradiotherapywithconcomitantandadjuvanttemozolomideversusradiotherapyaloneonsurvivalinglioblastomainarandomisedphaseⅢstudy:5-yearanalysisoftheEORTC-NCICtrial[J].LancetOncol,2009,10(5):459-466.
[3]居星耀.雷公藤甲素诱导H22细胞凋亡作用研究[J].现代中西医结合杂志,2007,16(5):586-587,597.
[4]于艳秋,张义侠,金玉楠,等.雷公藤多甙对急性移植物抗宿主病小鼠的作用[J].中国实验血液学杂志,2006,14(5):928-933.
[5]PhillipsPA,DudejaV,MccarrollJA,etal.Triptolideinducespancreaticcancercelldeathviainhibitionofheatshockprotein70[J].CancerRes,2007,67(19):9407-9416.
[6]AntonoffMB,ChughR,Borja-CachoD,etal.Triptolidetherapyforneuroblastomadecreasescellviabilityinvitroandinhibitstumorgrowthinvivo[J].Surgery,2009,146(2):282-290.
[7]ZhangHP,ZhuWB,SuXW,etal.Triptolideinhibitsproliferationandinvasionofmalignantgliomacells[J].JNeurooncol,2012,109(1):53-62.
[8]LinJ,ChenL,LinZ,etal.Inhibitoryeffectoftriptolideonglioblastomamultiformeinvitro[J].JIntMedRes,2007,35(4):490-496.
[9]RabinowitzJD,WhiteE.Autophagyandmetabolism[J].Science,2010,330(6009):1344-1348.
[10]SuiX,ChenR,WangZ,etal.Autophagyandchemotherapyresistance:apromisingtherapeutictargetforcancertreatment[J].CellDeathDis,2013(4):e838.
[11]WhiteE.Deconvolutingthecontext-dependentroleforautophagyincancer[J].NatRevCancer,2012,12(6):401-410.
[12]MathewR,WhiteE.Autophagyintumorigenesisandenergymetabolism:friendbyday,foebynight[J].CurrOpinGenetDev,2011,21(1):113-119.
[13]TanidaI,UenoT,KominamiE.LC3andAutophagy[J].MethodsMolBiol,2008,445(1):77-88.
[14]KumaA,MatsuiM,MizushimaN.Aggregatesindependentofautophagy:cautionintheinterpretationofLC3localization[J].Autophagy,2007,3(4):323-328.
[15]BlanderJM.Along-awaitedmergerofthepathwaysmediatinghostdefenceandprogrammedcelldeath[J].NatRevImmunol,2014,14(9):601-618.
[16]YangZF,KlionskyDJ.Mammalianautophagy:coremolecularmachineryandsignalingregulation[J].CurrOpinCellBiol,2010,22(2):124-131.
[17]BaehreckeEH.Autophagy:dualrolesinlifeanddeath?[J].NatRevMolCellBiol,2005,6(6):505-510.
The influence and mechanism of Triptolide on autophagy in human glioma cell line U251*
HuiShuang1,GuoHongqiang2,WangBo1,WangYuan1,ZhangChenghui1
(1.DepartmentofOncology,CentralHospitalofNanyangCity,Nanyang,Henan473000,China;2.DepartmentofOncology,AffiliatedTumorHospitalofZhengzhouUniversity,Zhengzhou,Henan450000,China)
Objective To explore the variation of autophagic activity in U251 cells after treatment with Triptolide and its mechanisms.Methods We measured the proliferation inhibition rate,half inhibitory concentration (IC50) by MTT assay;LC3-Ⅱ protein expression were tested by immunofluorescence assay;protein expression of LC3-Ⅱ/LC3-Ⅰ,Beclin-1,Phospho-P70,Phospho-Erk and Phospho-AKT were measures by Western blot.Results After treatment with Triptolide,the proliferation of U251 cells was inhibited,with theIC50of 0.73 μmol/L at 24 h and theIC50of 0.27 μmol/L at 48 h;the expression of LC3-Ⅱ were increased at 6,12,24 h;the expression of LC3-Ⅱ,LC3-Ⅱ/LC3-Ⅰ and Beclin-1 increased,the expression of Phospho-P70 and Phospho-Erk decreased and the expression of Phospho-AKT had no obvious change.Conclusion Triptolide could inhibit the proliferation of U251 cells and induce cell autophagy;Triptolide could increase the autophagy by upregulating Beclin-1 expression and inhibiting the activity of mTOR.
Triptolide;autophagy;glioblastoma;U251 cells
国家自然科学基金青年基金(81101797)。 作者简介:惠双(1976-),副主任医师,硕士,主要从事肿瘤的内科治疗及肿瘤的分子病理学方面研究。
论著·基础研究
10.3969/j.issn.1671-8348.2016.23.004
R
A
1671-8348(2016)23-3179-03
2016-04-16
2016-06-21)

