NLRP3与NOD2受体激活对下游炎症因子表达的影响*
韩浩贤,王虹艳,曲 鹏,田云朋
(1.天津医科大学护理学院,天津 300070;2.大连医科大学附属第二医院心内科,大连 116027;3.天津市第一中心医院心内科,天津 300070)
NLRP3与NOD2受体激活对下游炎症因子表达的影响*
韩浩贤1,王虹艳2△,曲 鹏2,田云朋3
(1.天津医科大学护理学院,天津 300070;2.大连医科大学附属第二医院心内科,大连 116027;3.天津市第一中心医院心内科,天津 300070)
目的 核苷酸结合寡聚化结构域样受体蛋白3(NLRP3)与核苷酸结合寡聚化结构域2(NOD2)受体被其特异性配体激活后对下游炎症因子表达的影响。方法 实验分为4组:空白对照组、TATP组、TMDP、TMDP+ATP组。用酶联免疫吸附试验(ELISA)测定白细胞介素(IL)-1β及IL-18的表达, 逆转录PCR测定NLRP3、半胱氨酸天冬氨酸蛋白酶1(Caspase-1)的表达情况。结果TMDP组、TATP组、TMDP+ATP组的IL-1β和IL-18水平均高于空白对照组(P<0.05),且TMDP+ATP组水平增高更显著。TMDP组、TATP组、TMDP+ATP组的NLRP3和Caspase-1表达均高于空白对照组(P<0.05),且TMDP+ATP组水平增高更显著(P<0.05)。结论NOD2的特异性配体胞壁酰二肽,NLRP3的特异性配体腺苷三磷酸单独刺激THP-1后NLRP3及下游炎症因子的表达很弱或无表达,联合刺激后可显著增强NLRP3及下游炎症因子的表达,二者之间存在相互促进及协同作用。
白细胞介素-18;白细胞介素-1β;半胱氨酸天冬氨酸蛋白酶1;NLRP3
随着经济水平的提高,我国冠心病的发病率和病死率也逐年升高,并呈年轻化趋势,造成冠状动脉狭窄或阻塞的最常见原因是动脉粥样硬化。近年研究表明,细胞膜表面的Toll样受体和细胞质内的核苷酸结合寡聚化结构域样受体蛋白3(NIRP3)样受体是介导先天免疫系统和动脉粥样硬化的桥梁[1],目前核苷酸结合寡聚化结构域(NOD)参与形成动脉粥样硬化的研究逐渐受到重视。Duewell等[2]研究证实NLRP3炎症小体可能参与了动脉粥样硬化的发生和发展 。白细胞介素1β(IL-1β)和白细胞介素18(IL-18)等炎症因子介导的免疫机制参与了冠心病动脉粥样硬化形成的早期阶段,促进了微血栓的形成及不稳定斑块的破裂。胞质受体NLRP3和NOD2恰是以此形式来启动机体的免疫和炎症反应,从而在动脉粥样硬化的形成及发展过程中发挥了重要作用[3]。NOD2和NLRP3是先天免疫模式识别受体最具有代表性的2个成员,目前关于二者的特异性配体胞壁酰二肽(MDP) 、腺苷三磷酸(ATP)联合刺激细胞后是否可以引起NLRP3及下游炎症因子表达显著增加的报道较少。本实验旨在探讨NLRP3与NOD2这两个胞内受体的激活对其下游炎症因子表达的影响,以期为动脉粥样硬化的治疗提供新的治疗靶点。
1 材料与方法
1.1 材料
1.1.1 实验细胞株 单核细胞株(THP-1)购自中科院上海生命科学研究院。
1.1.2 主要试剂、实验设备和仪器 MDP(Sigma公司);ATP(Sigma公司);IL-1β、IL-18酶联免疫吸附试验(ELISA)试剂盒(Bioscience 公司);NLRP3抗体(100 μL,Sigma公司);半胱氨酸天冬氨酸蛋白酶1(Caspase-1)抗体(100 μL,Sigma公司);CO2孵箱(Thermo Forma,美国);电泳仪(六一仪器厂,北京);逆转录PCR(RT-PCR)仪(Bio-Rad iQ5,美国);倒置显微镜CK40-F200型(Olympus公司,日本)。
1.2 方法
1.2.1 实验分组 空白对照组:加入磷酸盐缓冲液(PBS)100 μL后放入孵箱恒温孵育24 h;TMDP组:加入25 μL MDP,使其浓度至10 μmol/L,放入孵箱恒温孵育24 h[5];TATP组:加入256 μL ATP,使其浓度至100 μmol/L,放入孵箱恒温孵育24 h[6];TMDP+ATP组:加入25 μL MDP,使其浓度至10 μmol/L,放入孵箱恒温孵育2 h进行MDP的预处理,再加入256 μL ATP,使其浓度至100 μmol/L,最后再置孵箱恒温孵育24 h。
1.2.2 用ELISA测定细胞培养物IL-1β及IL-18的水平 严格按照试剂盒说明书步骤进行显色,用酶标仪在450 nm测定光密度(OD)值,绘制标准曲线,根据标准曲线,求得样本水平浓度。
1.2.3 单核细胞RNA提取及RT-PCR Trizol法提取细胞RNA,并进行RNA水平的测定。PCR引物由天津赛尔生物技术有限公司合成(表1)。逆转录反应体系严格按照试剂盒说明书操作。运用SYBR Premix Ex TaqTM(TaKaRa)进行RT-PCR反应。反应条件:SYBR Green Mix(2x)10.0 μL;ROX Reference Dye Ⅱ 0.4 μL;Primer 1(5 pmol/μL)1.0 μL;Primer 1(5 pmol/μL)1.0 μL;Primer 1(5 pmol/μL)1.0 μL;Primer 2(5 pmol/μL)1.0 μL;Template 0.5 μL;双蒸水ddH2O 7.1 μL;每孔20.0 μL。热循环:94 ℃ 4 min;94 ℃ 30 s;56 ℃ 60 s;72 ℃ 40 s;40个循环。

表1 目的基因和内参β-actin的引物序列

2 结 果
2.1MDP、ATP单独刺激及联合刺激THP-1后对IL-1β和IL-18表达的影响MDP、ATP及MDP+ATP对单核细胞株分泌IL-1β、IL-18的影响:MDP、ATP及MDP+ATP作用于单核细胞株24h后,上清液中IL-1β、IL-18的水平升高(P<0.05),而TMDP+ATP组所致的IL-1β、IL-18水平与TMDP组、TATP组比较显著升高(P<0.05),见表2。

表2 MDP、ATP及MDP+ATP对单核细胞株分泌IL-1β、IL-18的影响
2.2RNA总电泳图RNA提取浓度0.5~2.0μg/μL, OD260/OD2801.8~2.0,RNA提取纯度可满足本实验要求;所有标本在凝胶电泳图上均可见清晰28、18、5s3条带,其中28s条带的亮度达到18s亮度的两倍以上,符合本实验要求,见图1。

图1 RNA总电泳图
2.3MDP、ATP单独刺激及联合刺激THP-1后对NLRP3、Caspase-1mRNA表达的影响 所有标本均重复检测3次取均值,MDP、ATP及MDP+ATP均可增加单核细胞株NLRP3、Caspase-1mRNA的表达(P<0.05),但TMDP+ATP组可以明显增加上述炎症因子的表达(P<0.05),见表3、4。

表3 各组对单核细胞株NLRP3 mRNA的表达
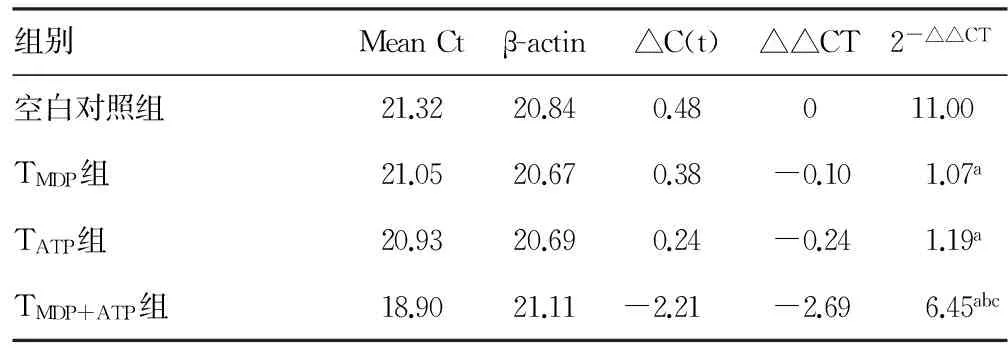
表4 各组对单核细胞株Caspase-1 mRNA的表达的影响
3 讨 论
研究表明ATP是NLRP3的特异性配体,无活性的NLRP3必须通过ATP聚合最终产生有活性的NLRP3来切割Caspase-1前体(Pro-caspase-1)并使其活化,活化后的Caspase-1再次切割IL-1β、IL-18等底物,诱发少量IL-1β和IL-18的成熟和泌出[4]。本实验ELISA结果与既往的研究结果相符[5-6]。特异性配体MDP与NOD2结合后可启动核因子κB(NF-κB)经典信号通路,活化的NF-κB可增强NOD2的基因表达,彼此形成一个正反馈环路,增强了IL-1β、IL-18前体的转录,最终加快了促炎症因子的产生和泌出,从而参与炎症反应,并具有调控炎症反应的功能[7-8]。有研究证实NOD2可通过激活NALP1最终致使Caspase-1活化,并分泌少量炎症因子[9]。至此可知活化的NOD2和NLRP3均可以激活Caspase-1。由此猜想NOD2和NLRP3在产生IL-1β和IL-18的过程中也有一定的交互关系。本研究单独MDP、ATP刺激单核细胞后,IL-1β、IL-18的水平比较微弱表达,但与空白对照组相比较差异有统计学意义。MDP预处理后的单核细胞中加入ATP,ELISA测试后发现IL-1β、IL-18的水平显著高于空白对照组,较二者单独刺激后有明显差异。但IL-1β差异较显著,这可能与它自身特性有关,胞外的IL-1β与胞内的核因子κB(NF-κB)、胞内的NF-κB与细胞质内的NOD2构成两对正反馈环路,从而放大最初的炎症信号,导致机体损伤及微循环障碍加重[10]。
由Real-timePCR结果猜想可能与以下因素有关:(1)采纳的MDP预处理时间与NF-κB达到峰值的时间相符;(2)MDP所致NF-κB信号通路的活化,为大量炎症前体基因的转录提供了前提条件。Caspase-1的活化不仅是ATP激活NLRP3的结果,而且是MDP激活NLRP1的结果,Caspase-1是二者联合刺激后产生效应的关键点[11];(3)MDP的预刺激既提供了大量无活性的NLRP3蛋白寡聚体又加强了NLRP3对ATP的敏感性,从而导致更多Caspase-1的自身激活[12];(4)MDP激活NOD2后促使正反馈环路形成,大量的NOD2凭借NLRP1这条途径切割Pro-Caspase-1,诱发大量IL-1β、IL-18分泌到细胞外,而细胞外IL-1β的增多又促进了其上游因子间正反馈环路的构成。
综上,MDP、ATP单独刺激单核细胞后NLRP3及下游炎症因子的表达很微弱,MDP联合ATP刺激细胞后可促进NLRP3及下游炎症因子的表达显著增加,二者之间存在促进及协同作用,但产生协同效应的具体机制及信号途径的具体位点尚不清楚,有待于进一步研究去证实。NLRP3及炎症因子参与了动脉粥样硬化的形成与发展,干预其下游因子及调控其信号通路将为治疗动脉粥样硬化的形成提供新的方向。
[1]FukataM,VamadevanAS,AbreuMT.Toll-likereceptors(TLRs)andNod-likereceptors(NLRs)ininflammatorydisorders[J].SeminImmunol,2009,21(4):242-253.
[2]DuewellP,KonoH,RaynerKJ,etal.NLRP3inflammasomesarerequiredforatherogenesisandactivatedbycholesterolcrystals[J].Nature,2010,464(7293):1357-1361.
[3]WangL,QuP,ZhaoJ,etal.NLRP3anddownstreamcytokineexpressionelevatedinthemonocytesofpatientswithcoronaryarterydisease[J].ArchMedSci,2014,10(4):791-800.
[4]MayorA,MartinonF,DeSmedtT,etal.AcrucialfunctionofSGT1andHSP90ininflammasomeactivitylinksmammalianandplantinnateimmuneresponses[J].NatImmunol,2007,8(5):497-503.
[5]WangL,QuP,ZhaoJ,etal.NLRP3anddown-streamcytokineexpressionelevatedinthemonocyofpatientswithcoronaryarterydisease[J].ArchMedSci,2014(10):791-800.
[6]HoegenT,TremelN,KleinM,etal.TheNLRP3inflammasomecontributestobraininjuryinpneumococcalmeningitisandisactivatedthroughATP-dependentlysosomalcathepsinBrelease[J].JImmunol,2011,187(10):5440-5451.
[7]ParkJH,KimYG,McdonaldC,etal.RICK/RIP2mediatesinnateimmuneresponsesinducedthroughNod1andNod2butnotTLRs[J].JImmunol,2007,178(4):2380-2386.
[8]StroberW,MurrayPJ,KitaniA,etal.SignallingpathwaysandmolecularinteractionsofNOD1andNOD2[J].NatRevImmunol,2006,6(1):9-20.
[9]FranchiL,EigenbrodT,NúezG.Cuttingedge:TNF-alphamediatessensitizationtoATPandsilicaviatheNLRP3inflammasomeintheabsenceofmicrobialstimulation[J].JImmunol,2009,183(2):792-796.
[10]DinarelloCA.AclinicalperspectiveofIL-1βasthegatekeeperofinflammation[J].EurJImmunol,2011,41(5):1203-1217.
[11]HsuLC,AliSR,McgillivrayS,etal.ANOD2-NALP1complexmediatescaspase-1-dependentIL-1betasecretioninresponsetoBacillusanthracisinfectionandmuramyldipeptide[J].ProcNatlAcadSciUSA,2008,105(22):7803-7808.
[12]JarryA,ValletteG,CassagnauE,etal.Interleukin1andinterleukin1betaconvertingenzyme(caspase1)expressioninthehumancolonicepithelialbarrier.Caspase1downregulationincoloncancer[J].Gut,1999,45(2):246-251.
Affect of NLRP3 and NOD2 activated on the downstream inflammatory cytokines*
HanHaoxian1,WangHongyan2△,QuPeng2,TianYunPeng3
(1.theSchoolofNursing,TianjinMedicalUniversity,Tianjin300070,China;2.CardiovascularInternalMedicine,theSecondAffiliatedHospitalofDalianMedicalUniversity,Dalian,Liaoning116027,China;3.CardiovascularInternalMedicine,theFirstCentralHospitalofTianjin,Tianjin300070,China)
Objective To explore the affect of NLRP3 and NOD2 activated on the downstream inflammatory cytokines.Methods The cases were divided into 4 groups:blank control group,TMDPgroup,TATPgroup and TMDP+ATPgroup.The expression of IL-1β and IL-18 were determined by enzyme-linked immunosorbent assay (ELISA),and the expression of NLRP3 and Caspase-1 were tested by real-time PCR.Results The levels of IL-1β and IL-18 in TMDPgroup,TATPgroup and TMDP+ATPgroup were higher than that of blank control group(P<0.05),and the group of TMDP+ATPlevels increased more significantly(P<0.05).The expression of NLRP3 and Caspase-1 in TMDPgroup,TATPgroup and TMDP+ATPgroup were higher than that of blank control group(P<0.05),and the levels of TMDP+ATPgroup increased more significantly(P<0.05).Conclusion The expression of NLRP3 and downstream inflammatory factors are weak or no expressions occur when MDP (specific ligand of NOD2) and ATP (specific ligand of NOD2) independently stimulate THP-1.However,the expression is enhanced significantly after the joint stimulation,which means that MDP and ATP have synergistic and promoting relationship.
IL-18;IL-1β;Caspase-1;NLRP3
辽宁省自然科学基金(2013023025) 。 作者简介:韩浩贤(1983-),实验师,硕士,主要从事心血管病方面研究。△
E-mail:hongyanwang1967@aliyun.com。
论著·基础研究
10.3969/j.issn.1671-8348.2016.23.005
R
A
1671-8348(2016)23-3182-03
2016-04-01
2016-06-23)

