猪源Bb SC-SN株的分离鉴定及其皮肤坏死毒素(DNT)全基因序列分析
肖 璐,邬旭龙,王 印,2,姚学萍,2,杨泽晓,2,胡 凌,林星宇,任梅渗,曾相杰,罗忠永
(1 四川农业大学 动物医学院,四川 成都,611130;2 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
猪源Bb SC-SN株的分离鉴定及其皮肤坏死毒素(DNT)全基因序列分析
肖 璐1,邬旭龙1,王 印1,2,姚学萍1,2,杨泽晓1,2,胡 凌1,林星宇1,任梅渗1,曾相杰1,罗忠永1
(1 四川农业大学 动物医学院,四川 成都,611130;2 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
【目的】 了解当前支气管败血波氏杆菌(Bb)地方菌株皮肤坏死毒素(DNT)基因的变异特点。【方法】 利用分离培养、PCR及16S rRNA扩增片段同源性分析,对采自四川遂宁某规模化猪场有明显萎缩性鼻炎症状的鼻拭子进行病原分离鉴定,并对分离株的DNT基因进行克隆和序列分析,对其抗原域、氨基酸二级结构、特定区域位于蛋白质表面可能性等参数进行预测,分析其B细胞抗原表位。【结果】 成功分离得到一株支气管败血波氏杆菌,命名为支气管败血波氏杆菌SC-SN株。分离株DNT基因序列全长4 357 bp,与其他11株菌DNT基因的核苷酸序列同源性为93.1%~100.0%,但由于其356位插入碱基A,使得该序列仅编码1 426个氨基酸,与上述11株DNT基因编码的氨基酸序列同源性仅为12.8%~47.0%。遗传进化树显示,SC-SN 分离株与S798日本株和未知1株的亲缘关系最近。软件预测结果显示,Bb SC-SN株DNT基因编码氨基酸B细胞抗原表位发生较大变化。【结论】 经鉴定,分离株确为支气管败血波氏杆菌,且SC-SN株的DNT基因序列变异较大,第356位插入的碱基A,对其氨基酸序列、ORF及B细胞抗原表位分布产生了较大的影响。
支气管败血波氏杆菌;分离鉴定;皮肤坏死毒素基因;猪
支气管败血波氏杆菌(Bordetellabronchiseptica, Bb)从首次分离至今,其分类经4次更改,最后由Moreno-Lopez[1]将其归为波氏菌属。该菌为革兰氏阴性菌,可致犬、猫、兔等数种动物呼吸系统疾病,在猪中主要与多杀性巴氏杆菌(Pasteurellamultocida,Pm)混合感染导致猪的萎缩性鼻炎(Atrophicrhinitis,AR),好发于仔猪[2-3]。该菌还能与猪链球菌(Streptococcussuis,S.suis)、副猪嗜血杆菌(Haemophilussuis,HPS)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)等病原混合感染[4-6],从而增加呼吸道疾病的发病率,加重病情,诱发猪呼吸道疾病综合症(Porcine respiratory disease complex,PRDC),引起猪只死亡,给养猪业造成巨大危害[7]。Mattoo等[8]和Brockmeier等[9]指出Bb的主要毒力因子有粘附素和毒素。粘附素主要包括丝状血凝素(Filamentous hemagglutinin, FHA)、百日咳杆菌粘附素(Pertactin)以及菌毛(Fimbriae),毒素主要包括腺苷环化酶溶血素(Adenylate cyclase-hemolisin,AC-Hly)、气管细胞毒素(Tracheal cytotocin,TCF)和皮肤坏死毒素(Dermonecrotic toxin,DNT)以及Ⅲ型分泌系统。DNT 是Bb导致猪发生鼻甲骨萎缩的重要直接致病因子[10],也是Bb定居于上呼吸道的必备因子。DNT存在于Bb胞浆内,对福尔马林敏感,不耐热,灭活后仍具有抗原性,可刺激机体产生抗毒素中和抗体[11]。此外Bb的免疫原性强弱很有可能与DNT有关[12]。鉴于此,对DNT基因的研究意义重大。目前在NCBI上可查到的BbDNT的全基因序列较少,国内对DNT的研究也相对较少。本试验通过对采集于四川的BbDNT基因克隆、测序及拼接,得到其全基因序列,并对其进行分析,以期为支气管败血波氏杆菌病的理论研究、疫苗研制、疫病防控等提供理论依据。
1 材料与方法
1.1 主要试剂
pMD19-T载体、大肠杆菌DH5ɑ,均购自TaKaRa公司;胶回收试剂盒、细菌基因组DNA提取试剂盒(TIAN amp Bacteria DNA Kit),均购于北京天根生化科技有限公司;SPF鼠,购于成都达硕实验有限公司。其他试剂均为国产分析纯。
1.2 Bb菌株的分离鉴定及动物回归试验
2015年采集四川遂宁某规模化猪场有明显萎缩性鼻炎症状的猪鼻腔拭子,于胰蛋白胨大豆琼脂培养基(TSA)上进行Bb的分离。挑疑似菌落革兰氏染色镜检后,取纯化单一菌落于胰蛋白胨大豆肉汤培养基(TSB)中扩大培养,使用TIAN amp Bacteria DNA Kit提取细菌基因组DNA,-20 ℃保存,备用。使用细菌16S rRNA 通用引物及Fla基因合成特异性引物[13](表1)对分离株进行PCR鉴定,引物由InvitrogenTM公司合成。PCR反应体系为25 μL:2×TaqPCR Master Mix 12.5 μL,上、下游引物各1.5 μL,模板2 μL,ddH2O补至25 μL。阴性对照的模板采用ddH2O。反应条件:94 ℃预变性4 min;94 ℃ 变性30 s,按表1温度退火30 s,72 ℃延伸45 s,30个循环;72 ℃总延伸10 min。扩增产物经1%琼脂糖凝胶电泳后于紫外凝胶成像系统观察,回收16S rRNA扩增产物,送InvitrogenTM测序,在NCBI上用BLAST进行同源性比对。
将分离株接种至TSB中扩大培养,用磷酸盐缓冲液(PBS)调整细菌密度为109CFU/mL,取菌液腹腔注射30~40 d SPF鼠5只作试验组,每只0.2 mL,同时用同批次同日龄健康鼠5只腹腔注射等量PBS作为对照组。
1.3DNT基因的克隆
1.3.1DNT基因的分段扩增 根据NCBI上发布的DNT基因序列(GenBank登录号:U59687),使用Primer 5设计3对特异性引物(表1),对DNT基因分3段(DNT1、DNT2、DNT3)进行PCR扩增(图1),引物由InvitrogenTM公司合成。PCR反应体系:2×TaqPCR Master Mix 12.5 μL,上、下游引物各1.5 μL,模板2 μL,ddH2O补至25 μL。试验设阴性对照,模板采用ddH2O。反应条件:94 ℃ 4 min;94 ℃ 30 s,按表1温度退火30 s,72 ℃ 45 s,30个循环;72 ℃,10 min。产物经1%琼脂糖凝胶电泳后,于全自动紫外凝胶成像系统观察。
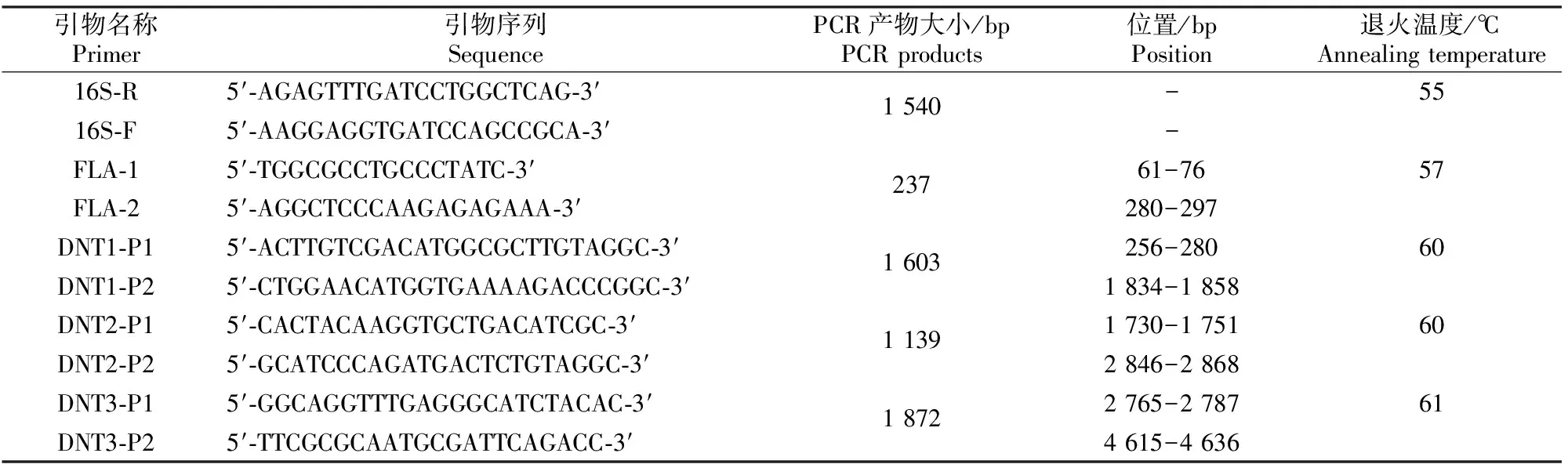
表 1 本试验PCR所用引物信息

图 1 Bb DNT基因扩增示意图
1.3.2DNT分段克隆及鉴定 纯化回收上述3段PCR产物,分别与pMD19-T 16 ℃连接过夜,将连接产物转化大肠杆菌DH5α,均匀涂布于含0.1 mg/mL 氨苄青霉素LA培养基上,37 ℃培养24 h。取单个鉴定为阳性的质粒扩大培养,送InvitrogenTM公司测序。
1.4DNT基因的序列分析
利用NCBI上的BLAST及DNAMAN对测序结果初步分析,再利用DNA STAR中Seq Man模块,将所测3段序列拼接得分离株DNT基因全序列,利用Meg Align模块中 Clustal W对序列同源性及进化关系进行分析,再采用Protean模块的Chou-Fasman结合Gamier-Robson预测分离株DNT的1 426 个氨基酸的二级结构分布情况,再利用Jameson-Wolf预测潜在的蛋白抗原决定簇,用Emini预测特定区域位于蛋白质表面的可能性,用Karplus-Schulz预测蛋白质骨架区的柔韧性,用Kyte-Doolittle结合Hopp-Woods预测蛋白质的亲水区和疏水区。采用ExPASy Prot Param tool(http://web.expas20.5y.org/protparam/)及ORF finder(http://www.ncbi.nlm.nih.gov/projects/gorf/)在线软件,对克隆DNT序列与NCBI中已登录的11株波氏菌属菌株DNT序列进行比对和分析。参比DNT序列信息见表2。
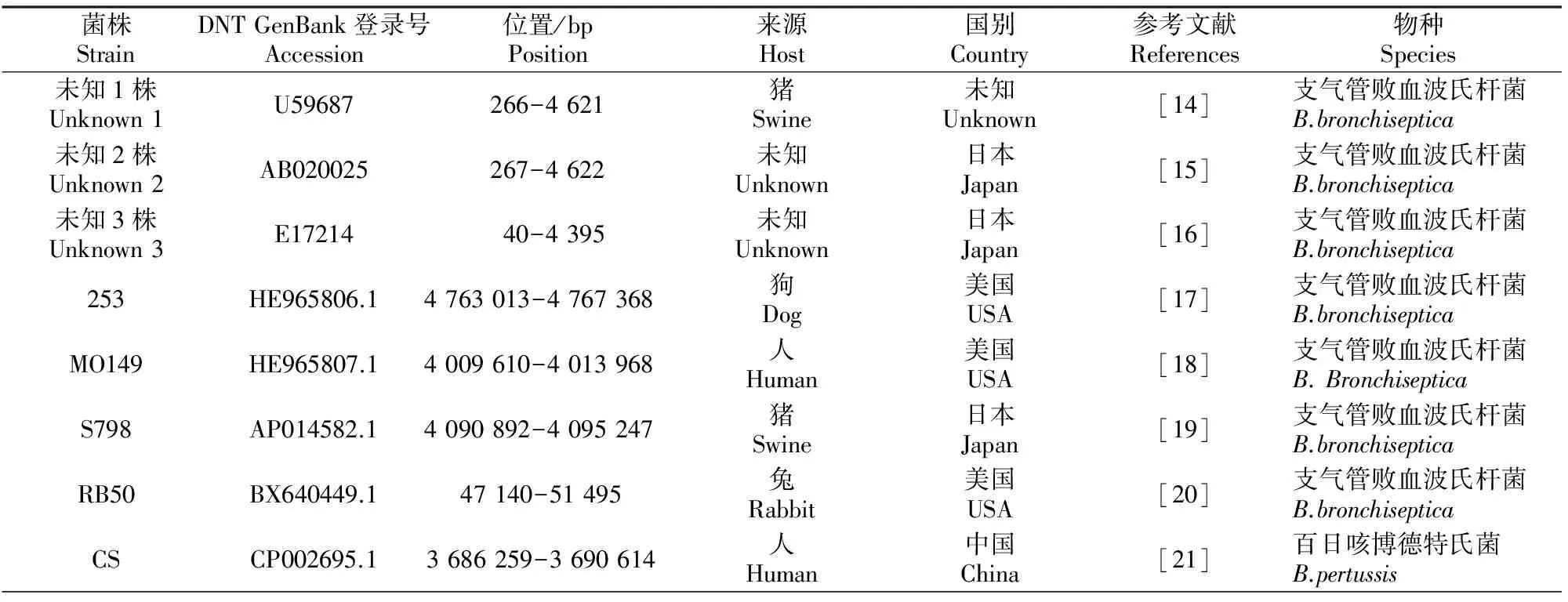
表 2 参比11株波氏菌属菌株DNT序列的主要信息
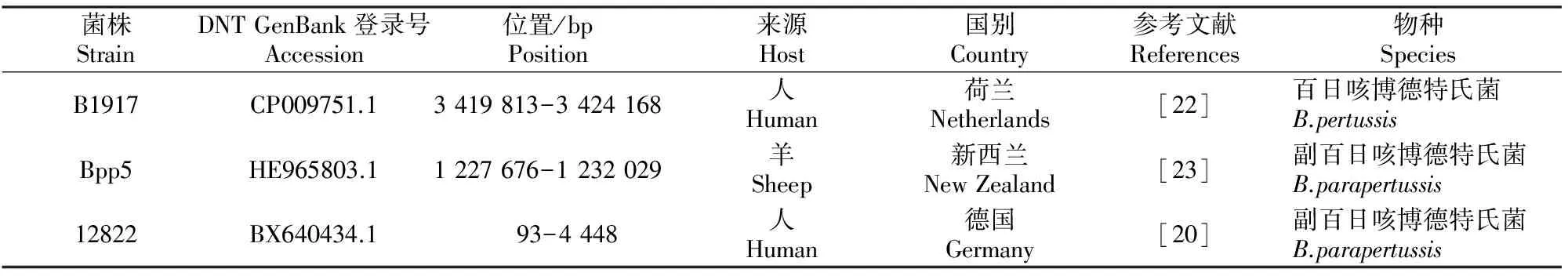
表 2(续) Continued table 2
2 结果与分析
2.1 Bb病原菌的分离鉴定及动物回归试验
分离株在TSA上长出圆形隆起、不透明菌落,革兰氏染色镜检可见两极浓染的革兰氏阴性杆菌(图2-A)。用FLA-1/FLA-2及16S rRNA通用引物16S-R/16S-F的扩增产物经1% 琼脂糖凝胶电泳,分别可见长度约237,1 540 bp的条带,阴性对照无条带(图2-B)。16S rRNA序列经BLAST比对后结果显示,分离株与未知1株、S798株等序列同源性均达99%。说明该分离菌株确为支气管败血波氏杆菌,命名为Bb SC-SN株。
动物回归试验结果显示,注射菌液的试验组5只小鼠在24~36 h死亡,对照组未见异常。蘸取死亡小鼠脾脏,于TSA上培养分离得到与猪源分离的Bb形态一致的细菌,经鉴定证实鼠内脏分离菌确为Bb,推知分离Bb对小鼠具有较强致病性。

A.革兰氏染色镜检图(1 000×);B.PCR鉴定,M.DL2000 DNA Marker,1.FLA,2.FLA阴性对照,3.16S rRNA,4.16S rRNA阴性对照
图 2 Bb的分离与PCR鉴定结果
Fig.2 Bb isolation and PCR identification
2.2 BbDNT基因的分段克隆及鉴定
用3对特异性引物对DNT基因进行PCR扩增,产物经1%琼脂糖凝胶电泳,可见长度约为1 603,1 139和1 872 bp 的条带,阴性对照无条带(图3),证明DNT的3段基因均克隆成功。
2.3 BbDNT基因的序列分析
分析显示,Bb SC-SN株DNT基因核苷酸序列与其他11个参比序列的同源性为93.1%~100.0%(表3),其中SC-SN株DNT与日本株S798同源性高达100.0%;与美国株MO149同源性最低,仅93.1%。用DNAMAN软件对上述12个序列进行分析发现,SC-SN株DNT在356位插入碱基A,其对应氨基酸序列与比对序列同源性仅12.8%~47.0%。由绘制进化树(图4)可知,SC-SN株DNT基因与日本分离株S798及未知1株的亲缘关系最近。
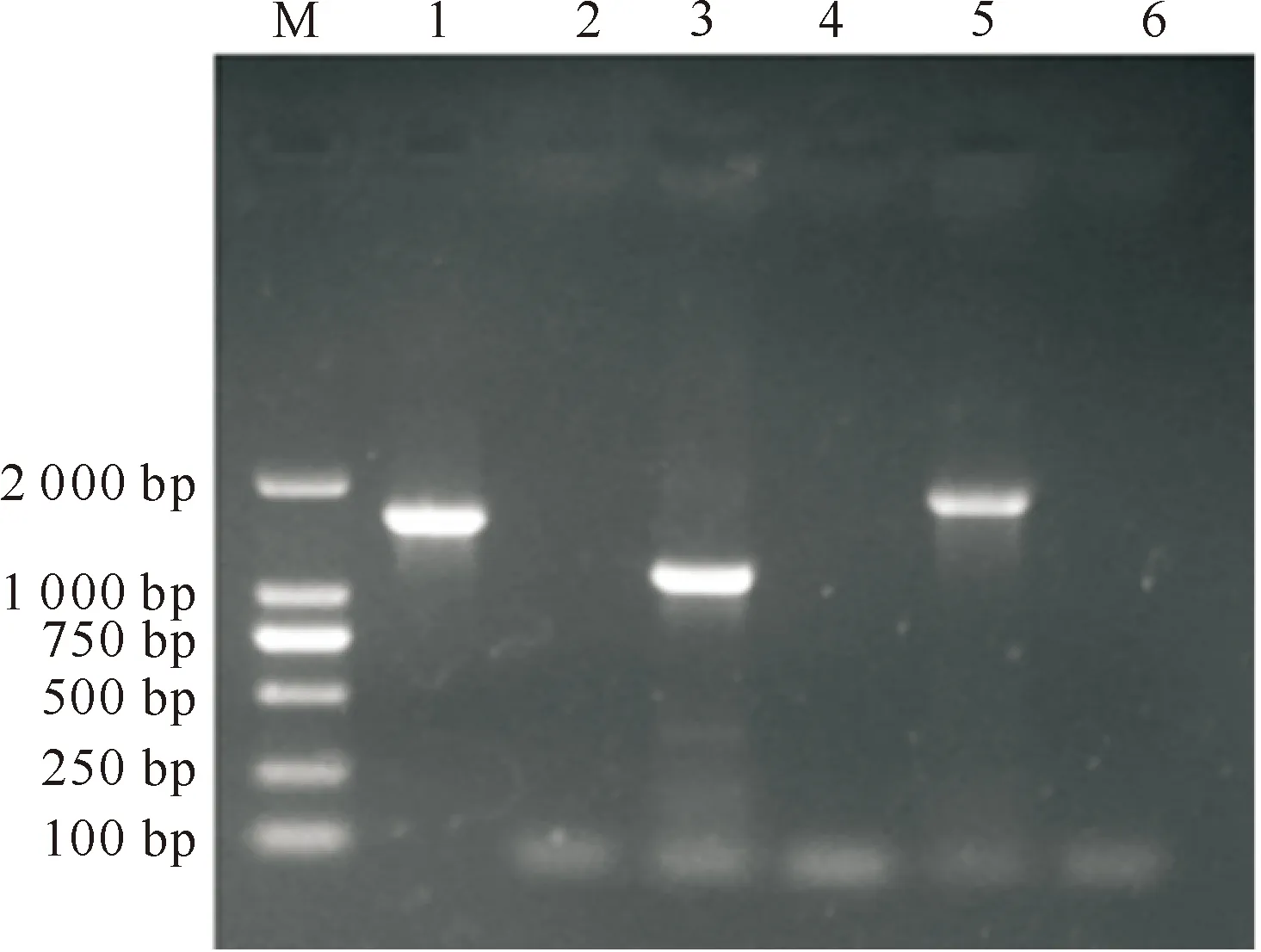
M.DL2000 DNA Marker;1.DNT1(1 603 bp);2.DNT1阴性对照 Negative control of DNT1;3.DNT2(1 139 bp);4.DNT2阴性对照 Negative control of DNT2;5.DNT3(1 872 bp);6.DNT3阴性对照 Negative control of DNT3
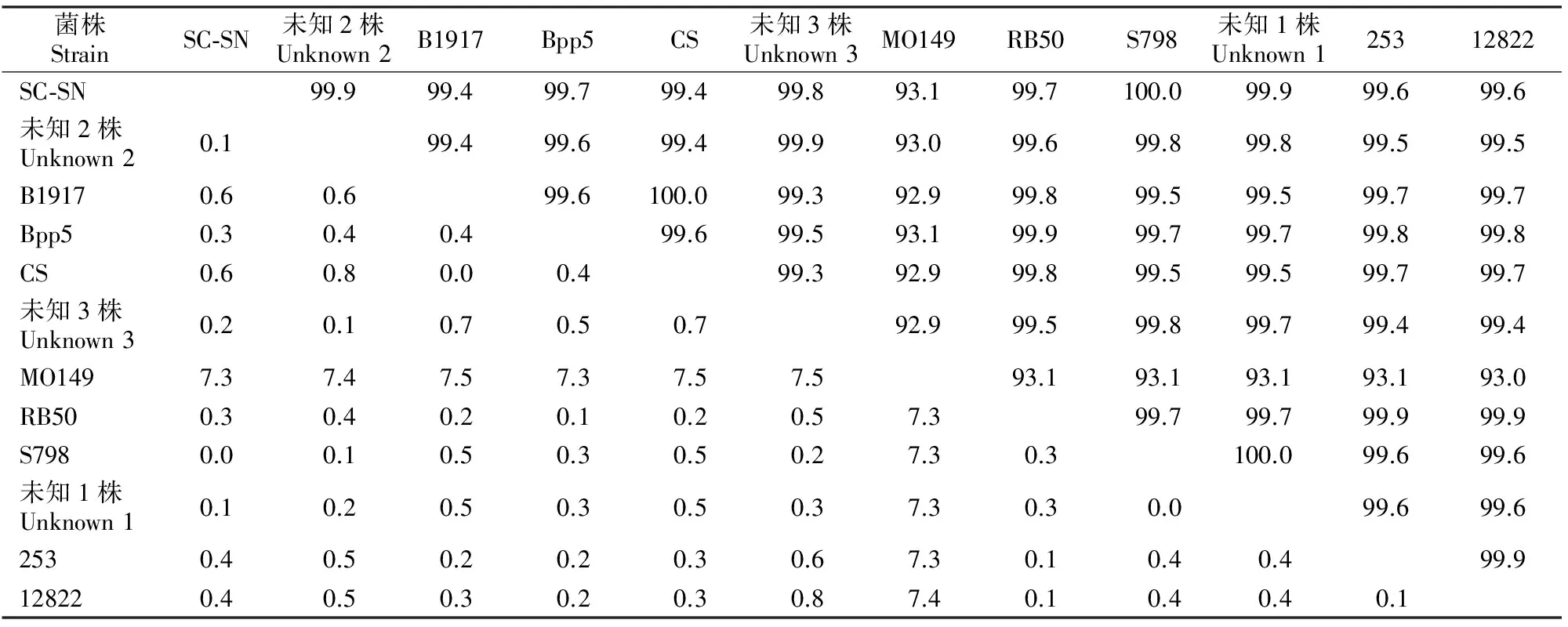
菌株StrainSC⁃SN未知2株Unknown2B1917Bpp5CS未知3株Unknown3MO149RB50S798未知1株Unknown125312822SC⁃SN99.999.499.799.499.893.199.7100.099.999.699.6未知2株Unknown20.199.499.699.499.993.099.699.899.899.599.5B19170.60.699.6100.099.392.999.899.599.599.799.7Bpp50.30.40.499.699.593.199.999.799.799.899.8CS0.60.80.00.499.392.999.899.599.599.799.7未知3株Unknown30.20.10.70.50.792.999.599.899.799.499.4MO1497.37.47.57.37.57.593.193.193.193.193.0RB500.30.40.20.10.20.57.399.799.799.999.9S7980.00.10.50.30.50.27.30.3100.099.699.6未知1株Unknown10.10.20.50.30.50.37.30.30.099.699.62530.40.50.20.20.30.67.30.10.40.499.9128220.40.50.30.20.30.87.40.10.40.40.1
注:对角线以上表示不同菌株DNT基因核苷酸序列同源性,对解线以下表示不同菌株DNT基因核苷酸序列同源性差异。
Note:The right upper showed the homology ofDNTnucleotide of different strain,the left lower showed the homology divergence ofDNTnucleotide of different strain.

图 4 Bb SC-SN株DNT的遗传进化分析
将SC-SN 株DNT基因序列与其亲缘性最近的序列分析发现,其与未知1株的序列相比,核苷酸一致性达99.93%,除在356位插入碱基A外,224位、554位及617位也发生变异;与S798株DNT序列相比,核苷酸一致性达99.95%,在第356位插入碱基A,617位发生变异。但SC-SN 株DNT氨基酸序列与未知1株及S798株氨基酸序列同源性较低,均为20.5%,使用ExPASy Prot Param tool在线软件对上述3个氨基酸序列分析得知其理化特性差异较大(表4)。
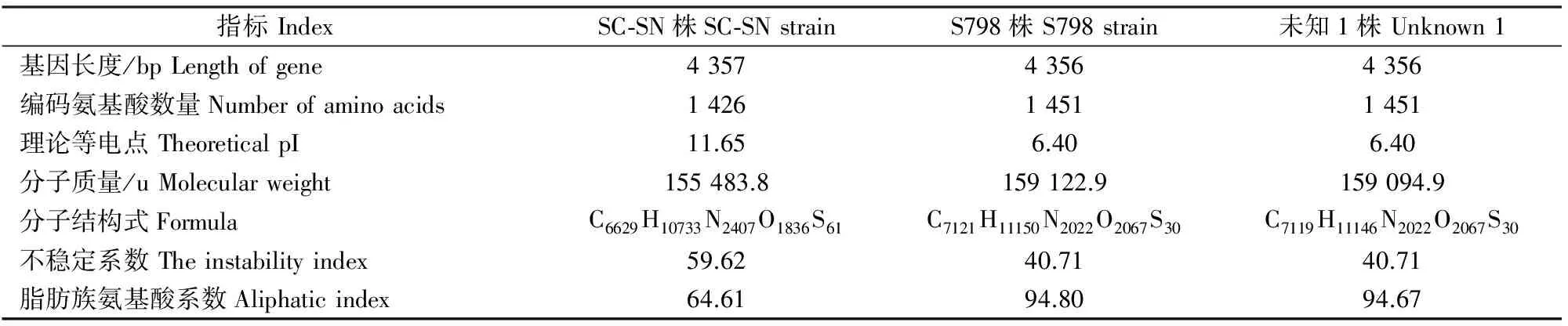
表 4 Bb DNT基因编码氨基酸理化性质比对结果
使用NCBI中ORF finder对SC-SN 株、未知1株及S798株DNT基因的开放阅读框(ORF)进行分析,预测结果显示,SC-SN株、未知1株及S798株DNT基因分别有11,10,9个ORF,小于200 bp的ORF无差异,但SC-SN株DNT序列预测最大ORF为4 008 bp,增加了一个807 bp的ORF。据此可知SC-SN 株DNT虽与其余11个比对序列的核苷酸同源性较高,但其在第356位插入的碱基A,可能对该核苷酸序列编码的氨基酸序列、ORF及蛋白质理化性质的预测结果有一定影响。
2.4 SC-SN株DNT相关预测
经对DNT基因编码氨基酸二级结构、潜在蛋白抗原决定簇区、骨架区柔韧性、亲水区和疏水区等因素的综合分析,推测SC-SN株DNT基因编码氨基酸B细胞抗原表位最可能位于以下10处:15-24,213-226,283-302,353-365,580-610,636-654,745-755,804-837,1 090-1 111,1 186-1 192氨基酸残基。同法预测未知1株和S798DNT基因编码氨基酸的B细胞抗原表位最可能位于以下14处:15-24,106-120,210-217,416-425,515-522,616-623,705-718,839-852,971-986,1 098-1 106,1 169-1 186,1 216-1 221,1 373-1 384,1 401-1 416氨基酸残基。可知DNT基因编码氨基酸B细胞抗原表位预测差别较大,预测的SC-SN株抗原表位主要在900位以下,而未知1株和S798的900位以上抗原表位有6处。另外,以上3个菌株的DNT序列在第100-700位的预测差异也较大,仅第15-24位之间的预测结果相同。
将SC-SN株、未知1株及S798株的DNT氨基酸序列进行比对,从118位之后的预测蛋白抗原决定簇区域、特定区域位于蛋白质表面可能性、蛋白质骨架区柔韧性及亲、疏水区均发生较大变化,推测这与SC-SN株DNT基因 356位插入碱基A有较大关联。
3 讨 论
Bb常以直接或间接方式与呼吸道病原协同致病,加重病情,造成损失,其潜在威胁不可小觑。DNT作为Bb最重要的致病因子,对Bb地方性猪波氏菌病的防治意义重大。
本试验通过细菌分离培养、PCR鉴定及序列分析,成功分离出一株支气管败血波氏杆菌,并分3段对SC-SN株DNT基因进行克隆及序列分析。核苷酸同源性分析可知,SC-SN株DNT基因核苷酸序列与其他11株波氏菌属的DNT序列相似性较高;进化树显示,SC-SN株DNT基因与CS中国株亲缘性较低,与S798日本株及未知1株亲缘关系最近。但由于SC-SN株DNT基因在第356位插入碱基A,使得其118位后的氨基酸排列发生较大变化,预测蛋白质理化性质也发生较大变化,与S798日本株及未知1株相比编码氨基酸个数减少25个,序列同源性骤降,同时引起ORF发生较大变化。鉴于碱基插入引起的改变,对DNT基因编码氨基酸的B细胞抗原表位进行预测,发现SC-SN株DNT基因编码氨基酸相比其他DNT基因编码氨基酸少了4个抗原表位,356位插入的碱基A理论上对应第118-119氨基酸残基,通过对预测结果对比,推测该碱基的插入可能仅影响106位后的B细胞的抗原表位分布预测,对15-24位区域的抗原表位预测影响较小。但该碱基的插入是否导致SC-SN株DNT基因编码蛋白质理化性质、ORF改变及B细胞抗原表位的改变,以及该碱基的插入是否会引起该菌的皮肤毒性、致病力等特性的改变,还需要进行进一步研究探讨。另外,关于DNT序列的生物学信息研究及DNT编码的蛋白功能域的相关研究目前相对较少,可能是今后Bb研究的热点之一。
[1]Moreno-Lopez,Pittman M,Wardlaw A C.The genusBordetella[M].The Berlin:Springer Berlin Heidelberg,1981:1075-1085.
[2]Niels,Taekken,Foged.Pasteurella multicoda toxin the characterization of the toxin and its significance in the diagnostic and prevention of PAR in pigs [J].A PMIS,1992,100(25):51-56.
[3]陈溥言.兽医传染病学 [M].5版.北京:中国农业出版社,2006:260-261.
Chen P Y.Veterinary lemology [M].5th ed.Beijing:China Agriculture Press,2006:260-261.
[4]Vecht U,Wisselink H J,van Dijk J E,et al.Virulence ofStreptococcussuistype 2 strains in newborn germfree pigs depends on phenotype [J].Infection and Immunity,1992,60:550-556.
[5]Brockmeier S L.Prior infection withBordetellabronchisepticaincreases nasal colonization byHaemophilusparasuisin swine [J].Veterinary Microbiology,2004,99(1):75-78.
[6]Brockmeier S L,Loving C L,Nicholson T L,et al.Coinfection of pigs with porcine respiratory coronavirus andBordetellabronchiseptica[J].Veterinary Microbiology,2008,128(1/2):36-47.
[7]刘翠权.广西395个规模猪场猪呼吸道疾病综合征的病原学调查及防控措施 [D].南京:南京农业大学,2011.
Liu C Q.Aetiological investigation and control and prevention measures of porcine respiratory disease complex in large scale pig farms in Guangxi [D].Nanjing:Nanjing Agricultural University,2011.
[8]Mattoo S,Cherry J D.Molecular pathogenesis,epidemiology,and clinical manifestations of respiratory infections due toBordetellapertussisand otherBordetellasubspecies[J].Clinical Microbiology Review,2005,18:326-382.
[9]Brockmeier S L,Register K B,Magyar T,et al.Role of the dermonecrotic toxin ofBordetellabronchisepticain the pathogenesis of respiratory disease in swine [J].Infection and immunity,2002,70(2):481-490.
[10]Zhao Z Q,Xue Y,Pei J,et al.Cloning,expression and characterization of the dermonecrotic toxin gene ofBordetellabronchiseptica[J].Journal of Henan Agricultural Sciences,2011,27(12):1172-1182.
[11]陆承平.兽医微生物学 [M].3版.北京:中国农业出版社,2002:158-159.
Lu C P.Veterinary microbiology [M].3rd ed.Beijing:China Agriculture Press,2002:158-159.
[12]Woo S H,Moon S Y,Byon Y Y,et al.Evaluation of the immunogenicity ofBordetellabronchiseptica,a vaccine antigen [J].Korean Journal of Veterinary Research,2014,54(2):75-79.
[13]Hozbor D,Fouque F,Guiso N.Detection ofBordetellabronchiseptica,by the polymerase chain reaction [J].Research in Microbiology,1999,150(5):333-341.
[14]Pullinger G D.Cloning,expression,and molecular characterization of the dermonecrotic toxin gene ofBordetellaspp. [J].Infection & Immunity,1996,64(10):4163-4171.
[15]Kashimoto T.Identification of functional domains ofBordetelladermonecrotizing toxin [J].Infection & Immunity,1999,67(8):3727-3732.
[16]Horiguchi Y,Imagawa T.Vaccine and diagnostic agent for porcine atrophic rhinitis:JP 1998251298-A [P].1998-09-22.
[17]Buboltz A M,Nicholson T L,Parette M R,et al.Replacement of adenylate cyclase toxin in a lineage ofBordetellabronchiseptica[J].Journal of Bacteriology,2008,190(15):5502-5511.
[18]Diavatopoulos D A,Cummings C A,Schouls L M,et al.Bordetellapertussis,the causative agent of whooping cough,evolved from a distinct,human-associated lineage ofB.bronchiseptica[J].PLoS Pathogens,2005,1(4):e45.
[19]Horiguchi Y,Sugimoto N,Matsuda M.Stimulation of DNA synthesis in osteoblast-like MC3T3-E1 cells byBordetellabronchisepticadermonecrotic toxin [J].Infection and Immunity,1993,61(9):3611-3615.
[20]Parkhill J,Sebaihia M,Preston A,et al.Comparative analysis of the genome sequences ofBordetellapertussis,BordetellaparapertussisandBordetellabronchiseptica[J].Nature Genetics,2003,35(1):32-40.
[21]Zhang S,Xu Y,Zhou Z,et al.Complete genome sequence ofBordetellapertussisCS,a Chinese pertussis vaccine strain [J].Journal of Bacteriology,2011,193(15):4017-4018.
[22]Bart M J,Van G M,van H G,et al.Comparative genomics of prevaccination and modernBordetellapertussisstrains [J].Bmc Genomics,2010,11(20):736.
[23]Brinig M M.Genomic features ofBordetellaparapertussiscla-des with distinct host species specificity [J].Genome Biology,2006,7(9):91-96.
Identification of an Bb SC-SN isolated from Sichuan and sequence analysis ofDNTgene
XIAO Lu1,WU Xulong1,WANG Yin1,2,YAO Xueping1,2,YANG Zexiao1,2,HU Ling1,LIN Xingyu1,REN Meishen1,ZENG Xiangjie1,LUO Zhongyong1
(1 College of Veterinary Medicine,Sichuan Agricultural University,Chengdu,Sichuan 611130,China;2KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,Chengdu,Sichuan611130,China)
【Objective】 This study investigated the variation characteristics ofBordetellabronchisepticaDNTgene in Sichuan.【Method】 ABordetellabronchisepticastrain was identified from swine nose swab with respiratory disease from a pig farm in Suining,Sichuan by cultivation,PCR and 16S rRNA homology analysis.Then,DNTof the strain was cloned,the sequence,antigenicity,amino acid secondary structure,certain location surface accessibility in protein and B cell epitopes were analyzed.【Result】 ABordetellabronchisepticastrain was separated successfully and named Bb SC-SN.The sequence analysis showed that the length ofDNTwas 4 357 bp,and it coded 1 426 amino acids with A inserted in the 356th position.TheDNTsequence of SC-SN strain shared 93.1%-100.0% homology with other 11 strains,but the homology of amino acid sequences was 12.8%-47.0%.Phylogenetic tree showed thatDNTof SC-SN strain had closest relationship to S798.The B cell epitopes of Bb SC-SNDNTamino acid changed greatly according to model prediction.【Conclusion】 The isolated SC-SN strain wasBordetellabronchiseptica,and itsDNTvaried greatly.The base A at the 356th position had great influence on amino acids,ORFs and B cell epitopes.
Bordetellabronchiseptica;identification;DNT;swine
时间:2016-10-20 16:36
10.13207/j.cnki.jnwafu.2016.12.002
2015-07-10
国家“十二五”科技支撑计划项目(2013BAD12B04)
肖 璐(1991-),女,四川什邡人,硕士,主要从事预防兽医研究。E-mail:yaanxiaolu@163.com
王 印(1968-),男,四川南充人,教授,博士,博士生导师,主要从事预防兽医研究。E-mail:yaanwangyin@tom.com
S855.1+2
A
1671-9387(2016)12-0009-07
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20161020.1636.004.html

