光纤药物溶出实时测定仪结合f2法评价阿折地平片自制制剂与原研制剂溶出曲线的相似性
张 晖,张 伟,郭庆明,萧 伟#(1.江苏康缘药业股份有限公司,江苏连云港 222001;2.中药制药过程新技术国家重点实验室,江苏连云港 222001)
光纤药物溶出实时测定仪结合f2法评价阿折地平片自制制剂与原研制剂溶出曲线的相似性
张 晖1,2*,张 伟1,2,郭庆明1,2,萧 伟1,2#(1.江苏康缘药业股份有限公司,江苏连云港 222001;2.中药制药过程新技术国家重点实验室,江苏连云港 222001)
目的:评价阿折地平片自制制剂与原研制剂溶出曲线的相似性,为其质量控制和临床使用提供参考。方法:采用桨法,转速为50 r/min,分别以500 ml的pH1.2盐酸-氯化钠缓冲液、pH4.0乙酸盐缓冲液、pH6.8磷酸盐缓冲液和水为溶出介质进行溶出度试验,用光纤药物溶出实时测定仪测定阿折地平片自制制剂与原研制剂中主成分在不同时间点的累积溶出度,并与紫外-可见分光光度法测定结果进行比较,进而绘制溶出曲线,采用相似因子(f2)法评价二者溶出曲线的相似性。结果:光纤药物溶出实时测定仪测定的累积溶出度结果与紫外-可见分光光度法测定结果无明显差异。阿折地平片自制制剂与原研制剂在各溶出介质中溶出曲线的f2均>50,说明二者溶出曲线具有相似性,但在后3种溶出介质中自制制剂较原研制剂溶出度略低。结论:采用光纤药物溶出实时测定仪能够准确、方便地提供药物的实时溶出度数据,反映药物的动态溶出过程,为全面考察药物的内在质量提供有力的检测手段。而阿折地平片自制制剂的处方和工艺仍有待进一步研究。
阿折地平片;光纤药物溶出实时测定仪;溶出曲线;相似因子法;评价
阿折地平为新一代二氢吡啶类钙离子阻滞药,由日本Sankyo公司与Ube公司联合开发成功并于2003年首次在日本上市,商品名为Calblock®。该药可通过抑制钙离子内流使外周血管和冠脉血管扩张,临床用于轻度及中度高血压的治疗。其作为一种长效抗高血压药物,克服了其他一些抗高血压药物如硝苯地平和尼卡地平等起效过快、效力不持久的缺点,能扩张血管,降低外周血管和冠脉血管阻力,增加冠状窦血流,改善心脏和肺的血流动力学。该药对轻度或中等症状的原发性高血压以及重度高血压的降压作用均较好[1]。
对于口服固体制剂,其体外溶出度试验和溶出曲线考察不仅可预测药物体内生物利用度,还可用于:(1)指导新制剂开发;(2)评价制剂批间质量的一致性;(3)当制剂生产过程中某些因素发生变化,如处方、生产工艺、生产场所变更或生产工艺放大后,确保其质量和疗效的一致性[2]。溶出曲线相似性的评价方法有多种,自1999年美国食品与药品管理局(FDA)推荐采用相似因子(f2)法[3]以来,该法己被普遍采用。本研究参照《日本药品品质再评价工程》[4],并参考国家食品药品监督管理总局(CFDA)发布的《普通口服固体制剂溶出度试验技术指导原则》[5],选用模拟人体消化道内体液的4种溶出介质进行溶出度试验,并采用光纤药物溶出实时测定仪(Fiber-optic dissolution test,FODT)测定阿折地平片自制制剂与原研制剂中主成分在不同时间点的累积溶出度,同时与阿折地平片自拟标准中溶出度测定方法紫外-可见分光光度法(UV)测定结果进行比较,进而绘制溶出曲线,采用f2法评价二者溶出曲线的相似性,旨在为自制制剂质量控制和临床使用提供参考。
1 材料
1.1 仪器
FODT-601型FODT、FAVD-25型智能真空脱气仪(上海富科思分析仪器有限公司);UV-2401PC型UV计(日本岛津公司);XP6型电子天平(瑞士Mettler-Toledo公司);PB-10型pH计(德国赛多利斯公司);KQ5200V型超声仪(昆山市超声仪器有限公司,功率:200 W,频率:40 kHz)。
1.2 药品与试剂
阿折地平片(自制制剂,江苏康缘药业股份有限公司,批号:131001、131002、131003,规格:8 mg;原研制剂,日本第一三共株式会社,批号:GHA2014,规格:8 mg);阿折地平对照品(江苏康缘药业股份有限公司,批号:130701,纯度:99.7%);所用试剂均为分析纯,水为纯化水。
2 方法与结果
2.1 溶液的制备
2.1.1 对照品溶液 精密称取阿折地平对照品20 mg,置于50 ml量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,量取2 ml,置于50 ml量瓶中,用pH1.2盐酸-氯化钠缓冲液稀释至刻度,制成每1 ml约含16µg阿折地平的对照品溶液(以pH4.0乙酸盐缓冲液、pH6.8磷酸盐缓冲液和水制备的对照品溶液均有沉淀析出,故不予采用)。
2.1.2 空白溶液 按自制制剂处方称取辅料适量(约22.4 mg),置于100 ml量瓶中,加pH1.2盐酸-氯化钠缓冲液超声处理5 min,溶解并稀释至刻度,摇匀,滤过,取续滤液作为空白溶液。
2.1.3 溶出介质 pH1.2盐酸-氯化钠缓冲液(a)——取氯化钠2.0 g,加水适量使溶解,加盐酸7 ml,用水稀释至1 000 ml,摇匀,即得;pH4.0乙酸盐缓冲液(b)——取乙酸钠1.22 g,加2 mol/L乙酸溶液(取120 g冰乙酸加水稀释至1 000 ml,摇匀,即得)20.5 ml,用水溶解并稀释至1 000 ml,摇匀,即得;pH6.8磷酸盐缓冲液(c)——取磷酸二氢钾1.7 g和无水磷酸氢二钠1.775 g,加水溶解并稀释至1 000 ml,摇匀,即得;水(d)——纯化水。
2.2 FODT测定条件的确定
取“2.1”项下阿折地平对照品溶液(16µg/ml)适量,在FODT上扫描吸收光谱。结果显示,在269 nm波长处有最大吸收,故选用269 nm作为测定波长,并选择550 nm为参比波长,进行双波长空白校正。根据Lamber-Beer定律,当光程为1.0 cm(探头规格为5 mm)时,阿折地平在双波长下吸光度的差值与质量浓度呈良好的线性关系。故确定FODT的测定条件为:测定波长269 nm,参比波长550 nm,探头规格5.0 mm,测定光程1.0 cm,取样时间间隔30 s。
2.3 方法学考察
2.3.1 线性关系考察 精密称取阿折地平对照品20.08 mg,置于50 ml量瓶中,用无水乙醇溶解并稀释至刻度,摇匀,分别精密量取1、2、3、4、8 ml,置于100 ml量瓶中,加pH1.2盐酸-氯化钠缓冲液稀释至刻度,摇匀,制得质量浓度分别为4.016、8.032、12.048、16.064、32.128µg/ml的系列对照品溶液。使用FODT按“2.2”项下条件测定吸光度(6个通道),以质量浓度(x,µg/ml)为横坐标、双波长吸光度的差值ΔA(y)为纵坐标进行线性回归,回归方程见表1。
由表1可以看出,6个通道测定结果均一性良好,阿折地平检测质量浓度线性范围为4.016~32.128µg/ml。

表1 6个通道的回归方程Tab 1 Regression equations of 6 pathways
2.3.2 精密度试验 将FODT的6个探头分别浸入“2.3.1”项下的低、中、高3种质量浓度(8.032、12.048、16.064µg/ml)的对照品溶液中,按“2.2”项下条件测定吸光度,连续测定6次,计算RSD。结果,阿折地平6个通道ΔA的RSD=0.86%~1.63%(n=6),表明仪器精密度良好。
2.3.3 回收率试验 根据处方比例,分别按标示量的50%、80%、100%精密称取对照品(4、6.4、8 mg),辅料按处方量的100%称取,每个水平各3份,按照2015年版《中国药典》(四部)0931“溶出度与释放度测定法”项下的第二法(桨法)[6],以pH1.2盐酸-氯化钠缓冲液为溶出介质,介质体积500 ml,转速50 r/min,温度(37.0±0.5)℃,依法操作,经60 min,在FODT中按“2.2”项下条件测定吸光度并计算回收率,结果见表2。
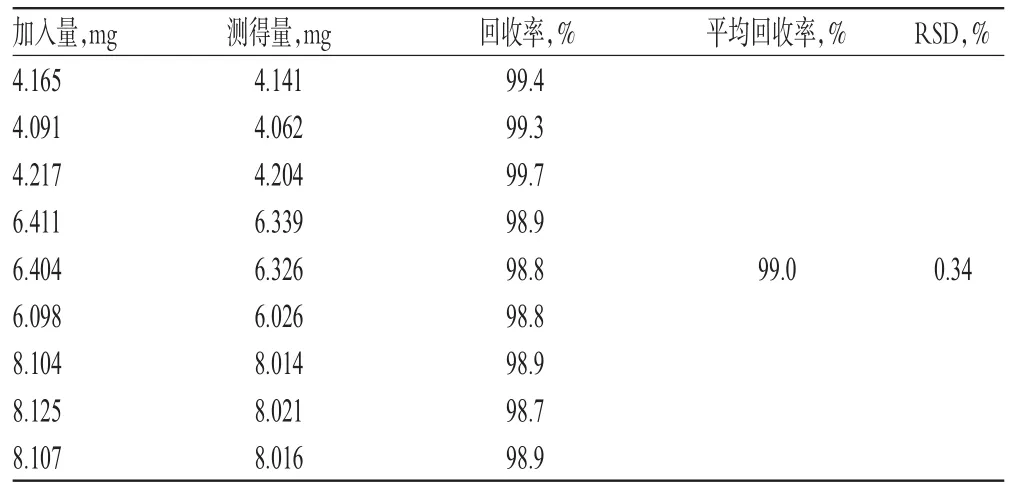
表2 回收率试验结果(n=9)Tab 2 Results of recovery test(n=9)
2.4 溶出度测定及溶出曲线绘制
采用2015年版《中国药典》(四部)0931“溶出度与释放度测定法”项下的第二法(桨法)[6],转速为50 r/min,分别将500 ml脱气后的4种溶出介质(pH1.2盐酸-氯化钠缓冲液、pH4.0乙酸盐缓冲液、pH6.8磷酸盐缓冲液和水)加入各溶出杯内,待溶出介质温度恒定在(37.0±0.5)℃时,开始溶出度试验。将FODT光纤探头定位于杯中标准的取样位置,打开FODT实时监测系统,首先扫描空白溶出介质检测探头有无异常情况,若无异常情况,分别将3批自制制剂和1批原研制剂样品(每批测12片)投入溶出杯中,按“2.2”项下测定条件,监测时间为60 min,由计算机实时监测样品的溶出过程获得溶出曲线。与此同时,选择1批自制制剂(批号:131001)和原研制剂(批号:GHA2014),于10、20、30、45、60 min时分别取样5 ml(及时补充相同体积的空白溶出介质),滤过,弃去初滤液,以UV计在269 nm波长处测定吸光度,计算各时间点的累积溶出度。阿折地平片自制制剂与原研制剂在各溶出介质中的平均累积溶出度测定结果见表3,溶出曲线见图1。
由图1可知,在pH1.2盐酸-氯化钠缓冲液中,在10 min时自制制剂药物累积溶出度较原研制剂稍高;到20 min时两种制剂药物累积溶出度均>75%,到60 min时两种制剂药物累积溶出度均>90%。而在pH4.0乙酸盐缓冲液、pH6.8磷酸盐缓冲液和水介质中,10~20 min时两种制剂药物溶出接近饱和,60 min时两种制剂药物累积溶出度均<50%,原研制剂略高于自制制剂。

表3 阿折地平片自制制剂与原研制剂在各溶出介质中的平均累积溶出度(n=12)Tab 3 Cumulative dissolution of the self-prepared and original preparations in the different dissolution media(n=12)

图1 阿折地平片自制制剂与原研制剂在各溶出介质中的溶出曲线(n=12)A.以pH1.2盐酸-氯化钠缓冲液为介质;B.以pH4.0乙酸盐缓冲液为介质;C.以pH6.8磷酸盐缓冲液为介质;D.以水为介质Fig 1 Dissolution curves of the self-prepared and original preparations in the different dissolution media(n=12)A.pH1.2 HCL-NaCL as medium;B.pH4.0 acetate buffer as medium;C. pH6.8 phosphate buffer as medium;D.water as medium
2.5 溶出曲线的相似性评价
采用美国FDA推荐的f2法评价口服固体制剂体外溶出曲线是否具有相似性。f2计算公式如下:

式中,n为取样时间点数;Rt和Tt分别为参比制剂(原研制剂)和受试制剂(自制制剂)第t时间点的平均累积溶出度。若f2≥50,则认为两种制剂的溶出曲线相似;若f2<50,则认为两种制剂的溶出曲线不相似。经计算,阿折地平片自制制剂与原研制剂在各溶出介质中溶出曲线的f2见表4。
由表4可知,3批自制制剂与原研制剂样品在4种溶出介质中溶出曲线的f2均>50,说明二者溶出曲线具有相似性。
3 讨论
3.1 FODT法与UV法的比较

表4 阿折地平片自制制剂与原研制剂在各溶出介质中溶出曲线的f2Tab 4 f2similar factor of the self-prepared and original preparations in the different dissolution media
本试验结果显示,FODT法与UV法溶出度测定结果无明显差异,而与传统UV法相比,FODT法优势明显:UV法需在规定的时间点抽取一定体积的样品溶液,必须经滤过、稀释后测定吸光度,经计算得到结果,过程繁杂,容易引入人为操作误差;FODT法则通过选择不同规格的光纤探头和参比波长,实现药物的连续、原位、在线、实时测定,避免了稀释、滤过等操作对试验结果的影响。仪器操作通过相关控制软件的图形用户界面进行,测定的时间间隔以秒计算,取样时间非常精确,同时其可以很方便地计算出评价溶出曲线相似性的f2,极大地提高了工作效率。近年的研究和大量的应用实践证明[7-9],FODT性能稳定、可靠,能实时、准确地监测口服固体制剂的动态溶出过程,是评价药物体外溶出行为的有力手段。
3.2 溶出介质的影响
由不同溶出介质中溶出曲线可知,随着介质pH值增大制剂中药物累积溶出度减少,说明阿折地平的溶解度呈pH值依赖性,易溶于酸性介质。以pH1.2盐酸-氯化钠缓冲液为溶出介质时,自制制剂和原研制剂在60 min内均全部溶出;而以pH4.0乙酸盐缓冲液、pH6.8磷酸盐缓冲液和水为溶出介质时,自制制剂较原研制剂溶出度略低,可能与原料的粒度、辅料类型、制剂工艺、检测方法等因素有很大关系。通过上述试验表明自制制剂的处方、工艺及检测方法等仍有待进一步研究。
[1] 舒成仁,卫乐乐,葛苗苗.阿折地平片的人体药动学研究[J].中国药房,2012,23(10):896.
[2] 魏农农,王霞,苏敏.药物溶出度试验方法研究进展[J].中国新药杂志,2013,22(10):1 119.
[3] U.S.Department of Health and Human Services Food andDrug Administration Center for Drug Evaluation and Research(CDER).Guidance for Industry Dissolution Testing of Immediate Release Solid Oral Dosage Forms[S]. 1997.
[4] 谢沐风.评日本“药品品质再评价”工程有感[C]//中国药学杂志岛津杯全国药物分析优秀论文评选交流会论文集.北京:中国药学会药物分析专业委员会,2005.
[5] 国家食品药品监督管理总局.普通口服固体制剂溶出度试验技术指导原则[S].2014.
[6] 国家药典委员会.中华人民共和国药典:四部[S].2015年版.北京:中国医药科技出版社,2015:121.
[7] 张启明,谢沐风,宁保明,等.采用多条溶出曲线评价口服固体制剂的内在质量[J].中国医药工业杂志,2009,40(12):946.
[8] 金丽,古卓良,周国华.运用光纤药物溶出度实时测定仪评价缬沙坦胶囊的溶出行为[J].中国药房,2012,23(45):4 278.
[9] 方继辉,陈英.光纤药物溶出仪在线考察和评价头孢克洛颗粒溶出度[J].广东药学院学报,2012,28(4):375.
(编辑:周 箐)
Evaluation of the Similarity of Dissolution Curves in vitro of Azelnidipine Tablet between the Self-prepared and Original Preparations by Fiber-optic Dissolution Tester and f2
ZHANG Hui1,2,ZHANG Wei1,2,GUO Qingming1,2,XIAO Wei1,2(1.Jiangsu Kanion Parmaceutical Co.,Ltd.,Jiangsu Lianyungang 222001,China;2.State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process,Jiangsu Lianyungang 222001,China)
OBJECTIVE:To evaluate the similarity of dissolution curves in vitro of Azelnidipine tablet between the self-prepared and original preparations,and provide reference for its quality control and clinical application.METHODS:Paddle method was used at rate of 50 r/min,and dissolution test was conducted with media of 500 ml pH1.2 Hydrochloric acid sodium chloride solution,pH4.0 Acetate buffer solution,pH6.8 Phosphate buffer solution,fiber-optic dissolution tester was used to detect the cumulative dissolution the main ingredients in Azelnidipine tablet between the self-prepared and original preparations at different time points,and compared with the results of UV-visible spectrophotometry,then dissolution curve was plotted,f2was used to evaluate the similarity of their similarity.RESULTS:There was no obvious difference in the results between fiber optic drug dissolution real-time detector and UV-visible spectrophotometry.f2Similarity factors were more than 50 and the dissolution curves of the self-prepared and original preparations were similar in the different dissolution media,while the dissolution was relatively low in the last 3 media.CONCLUSIONS:Fiber-optic dissolution tester can accurately and conveniently provide the real-time dissolution and reflect its dynamic dissolution process,which provides an effective way to investigate the inner quality of drug completely.However,the formulation and technology of the self-prepared preparation of Azelnidipine tablet need to be further studied.
Azelnidipine tablet;Fiber-optic dissolution tester;Dissolution curve;f2;Evaluation
R927
A
1001-0408(2016)33-4739-04
2015-12-03
2016-10-08)
*工程师。研究方向:新药研发。电话:0518-81152332。E-mail:huizhang_96@163.com
#通信作者:研究员级高级工程师,博士。研究方向:中药新药研发。电话:0518-81152367。E-mail:kanionlunwen@163.com
DOI 10.6039/j.issn.1001-0408.2016.33.44

