食微比对丙氨酸菌渣厌氧消化的影响
汤若昊, 刘 洋, 郁 亮, 贾士儒, 陈树林, 李德茂
(1.天津科技大学 生物工程学院工业微生物教育部重点实验室, 天津 300308; 2.中国科学院 天津工业生物技术研究所工业生物系统与生物加工工程重点实验室, 天津 300457; 3. 安徽华恒生物科技股份有限公司, 安徽 合肥 230041)
食微比对丙氨酸菌渣厌氧消化的影响
汤若昊1,2, 刘 洋3, 郁 亮2, 贾士儒1, 陈树林2, 李德茂2
(1.天津科技大学 生物工程学院工业微生物教育部重点实验室, 天津 300308; 2.中国科学院 天津工业生物技术研究所工业生物系统与生物加工工程重点实验室, 天津 300457; 3. 安徽华恒生物科技股份有限公司, 安徽 合肥 230041)
文章在中温(35℃)条件下对丙氨酸菌渣进行厌氧消化试验,比较5种食微比(0.5,1,2,4,8)接种对500 mL厌氧消化体系的pH值,TS,VS,COD,氨氮,VFA,产气量和甲烷含量的影响。结果表明,在F/M=2时,系统的TS,VS去除率,COD去除总量,产气总量和平均甲烷含率都为最高。其中,反应pH值为7.4~7.9,TS和VS去除率分别达到46.67%和26.64%,COD去除总量达到4029 mg,产气总量达到840 mL,甲烷含率为50.2%。此外,反应过程中氨氮浓度稳定在2.4~2.8 g·L-1,表明氨基酸菌渣处理过程中的氨氮产生得到了控制。
丙氨酸菌渣; 厌氧消化; 食微比; 产甲烷能力
废弃菌渣是利用发酵生产丙氨酸后的废弃物,主要包含灭活后的菌体、残余培养基及菌体产生的丙氨酸和其他代谢产物等。其含水量和有机质成分都很高,极易对环境造成危害。但由于其中含有大量丙氨酸(70 g·L-1)和其他营养物质,也具有很高的利用价值。在对废弃菌渣的处理方面,氨基酸发酵菌渣被鉴定为危险废弃物[1],不能直接将其作为饲料添加剂进行处理[2],必须按照危险物质处置方法处置[3-4]。早期一直采用焚烧的方式进行处理,这种处理方法成本高,且没有将废弃菌渣中的有机质成分利用起来,所用十分不合理[5]。在现阶段,厌氧消化的方法被广泛的利用于处理废弃菌渣。但废弃菌渣相比一般的生活垃圾又具有一定的特殊性,一般废弃菌渣中C/N较低,很容易积累氨氮造成对产甲烷菌的抑制,另外废弃菌渣的有机质含量高,且易水解,这导致在厌氧消化过程中反应体系有机负荷很高,这对系统内的水解细菌和产甲烷菌的活性都有影响[6]。苏建文[7]等人在中温条件下对红霉素菌渣进行了单级厌氧消化的研究,得到系统稳定运行的最高负荷为1.42 kgVS·m-3,平均产气量为21.97 L·d-1,证明了厌氧消化技术可以有效处理红霉素菌渣并且获得沼气。张文彬[8]等人通过利用四级厌氧反应系统对螺旋霉素发酵菌渣进行处理,也得到了很好的处理效果和产气效率。然而,这些研究及一些传统处理过程中对污泥的接种方式都采用按反应器体积比例来进行接种,但由于废弃菌渣高有机含量、高抑制物浓度的特殊性,在厌氧消化过程中底物和接种物的配比变得十分重要,如果在厌氧消化过程中底物和接种之间的配比过高或者过低,则可能造成反应系统负荷过大,反应周期变短,处理效率和产气率低的情况发生。或者引起消化过程中营养物质的不足,严重影响消化反应的效率[9]。食微比(F/M)是在发酵体系中加入底物VS与接种物VS之比,其通过改变体系中厌氧微生物的数量和种群稳定性,影响厌氧消化过程[10]。所以,在处理氨基酸废弃菌渣的过程中调整厌氧消化的食微比来优化处理效果和产气效果是十分值得研究的。
笔者根据不同的F/M对废弃菌渣和接种污泥进行配比,通过对整个厌氧消化过程中各项参数的追踪,来找到最适宜进行废弃菌渣消化的F/M值,为下一步研究和利用到实际生产中做准备。
1 材料与方法
1.1 材料
1.1.1 菌渣废液
菌渣废液取自安徽华恒生物科技有限公司,主要成分是大肠杆菌发酵丙氨酸后的废弃菌渣和残余发酵液,其中含有大量的蛋白、氨基酸和盐分。菌渣废液的主要性质见表1。
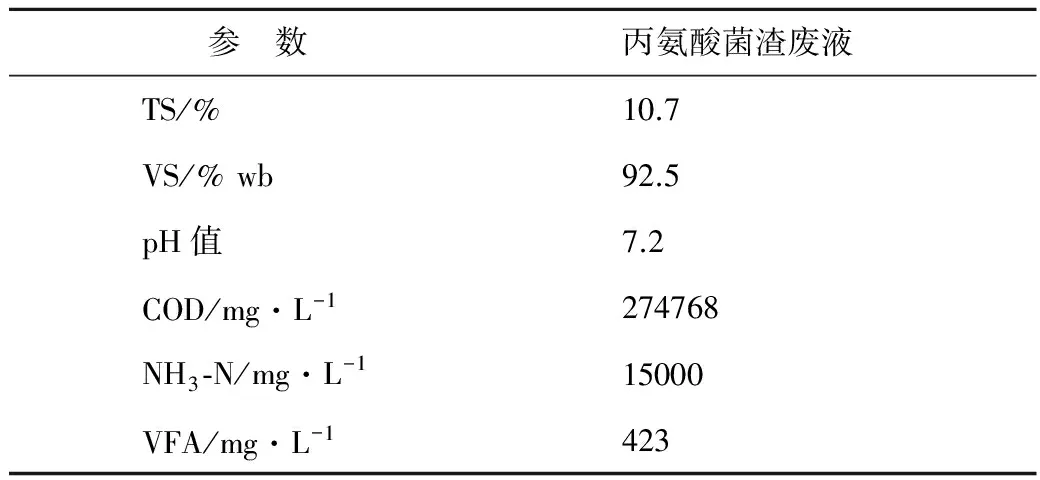
表1 底物丙氨酸菌渣废液的主要性质
1.1.2 接种物
试验所用的接种物是取自天津碧海环技术咨询有限公司的大型USR反应器中的厌氧污泥,其主要性质见表2。
1.2 实验装置
实验装置由500 mL消化瓶(有效体积450 mL)和500 mL的集气袋组成。反应瓶放入水浴中,并保证水浴液面高于反应瓶内液面。水浴用加热棒控温在35℃±1℃。

表2 接种污泥的主要性质
1.3 试验方法
试验根据F/M的值不同分为5组,每组3个平行。其中每一组都添加200 mL的厌氧污泥作为接种物,然后根据不同的F/M值来添加不同量的底物,最后都用蒸馏水补齐至450 mL。以450 mL废弃菌渣作为对照。反应设置如表3所示。发酵过程持续10天,每12小时摇动一次反应瓶,保证有机质被充分利用。每天用注射器从消化瓶中取样5 mL液体进行参数测定,取样前将瓶内液体摇匀。
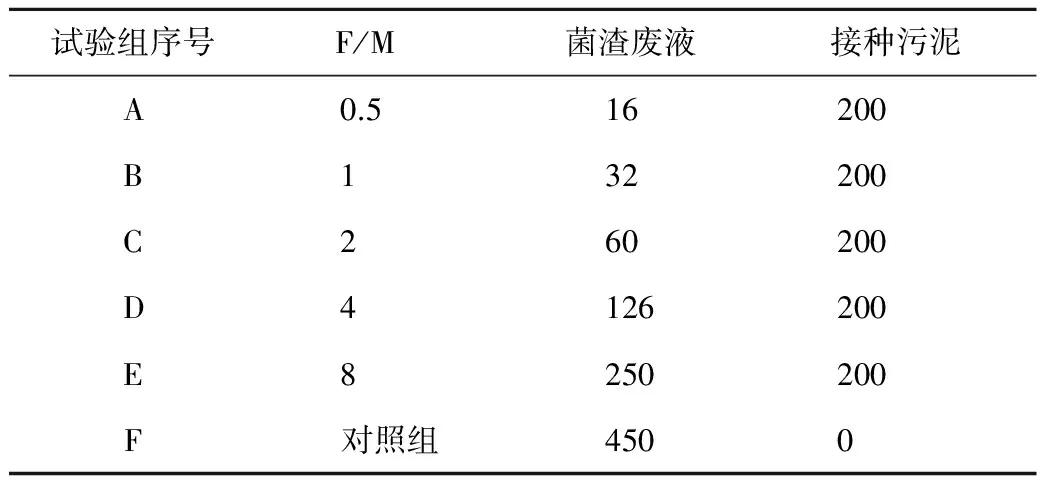
表3 各实验组组成 (mL)
1.4 参数测定及方法
pH值,总固体(TS),可挥发性固体(VS),化学需氧量(COD)等常规参数使用标准方法进行测定[11]。挥发性脂肪酸(VFA)利用高效液相色谱法进行测定,色谱柱为HPX-87H,紫外检测器,温度30℃,反应时间50分钟,检测样品中甲酸、乙酸、丙酸、丁酸、正戊酸的量,其总和即为样品中VFA的浓度。CH4含量利用气象色谱法进行测定,色谱柱使用PEG-20M毛线管柱,以氮气为载气,流速30 mL·min-1。柱箱,进样器和检测器的温度分别是180℃,180℃和200℃。
2 结果与讨论
2.1 F/M对pH值的影响
厌氧消化过程中各组份pH值变化规律如图1所示。A组pH值在第一天达到了8.1,随后恢复到8.0以下,其后一致稳定在7.4到7.9之间。B, C两组的pH值变化基本保持一致,一直稳定在7.4到7.9之间。D组pH值从第4天起下降并一致低于其他4组。E组pH值在7.3到7.8之间波动,但其波动幅度较大。
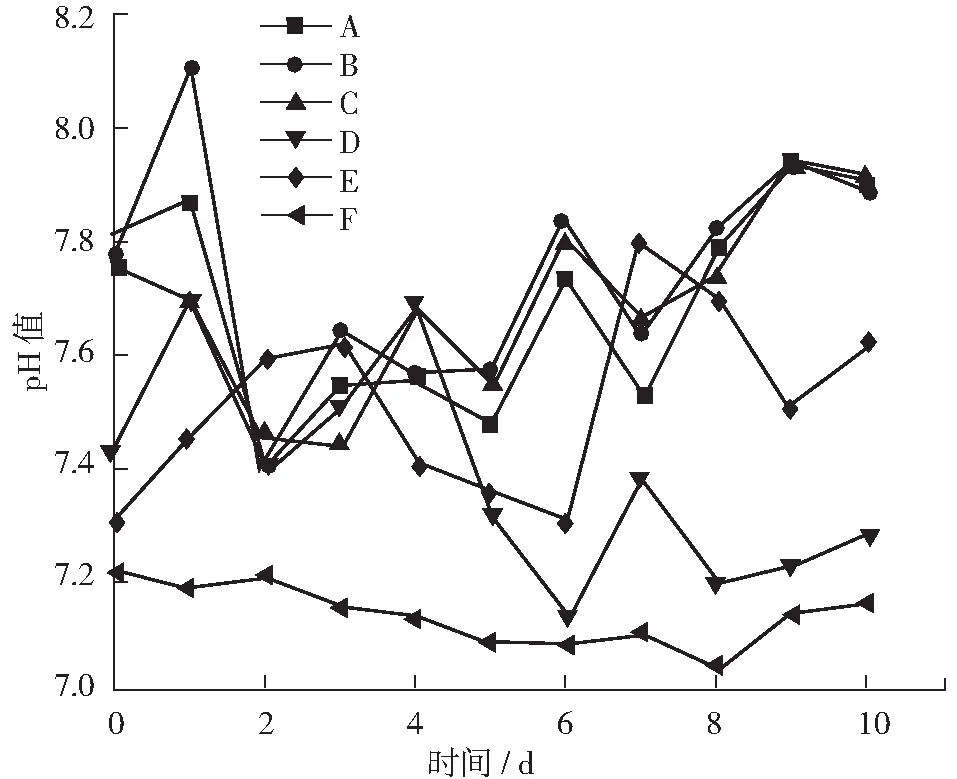
图1 厌氧消化中pH值变化曲线
在整个反应过程中A, B, C 3组的pH值变化相对稳定并一致,说明反应过程中有机酸的产生和氨氮的生成处于一个平衡的状态,并未引起pH值的较大波动。而D, E两组在整个反应过程中pH值波动较大,在反应结束后的pH值也偏低,这是因为这两组的原料F/M都较高,消化过程中的水解反应比其余三组相对活跃,但反应过程中pH值较大的波动也说明消化过程中各个反应之间并不平衡。然而,在整个发酵过程中,各组份的pH值都有小范围波动,但都未下降至7.0以下,一直保持在产甲烷菌最适宜的范围当中,有利于产甲烷活动的进行[12]。这说明废弃菌渣及其发酵液作为原料进行厌氧消化的过程并不易发生酸化。
2.2 F/M对TS和VS的影响
厌氧消化过程中TS和VS的变化如图2,图3所示。 A, B, C, D, E的TS去除率分别为28.57%, 33.33%, 46.67%, 32.14%, 27.59%。C组的TS去除率明显高于其他组,这说明在底物和接种物按照F/M=2进行混合厌氧消化过程中对TS的降解效率最高。A, B, C, D, E 的VS去除率分别为26.3%,25.2%,26.24%,18.84%,13.84%。A, B, C三组的VS去除率都相近,D, E两组的VS去除率较低,但由于A, B两组的原料添加量都较少,所以C这一组的VS降解量最高。综合来看,C组(F/M=2)对于TS和VS的降解效果最好。
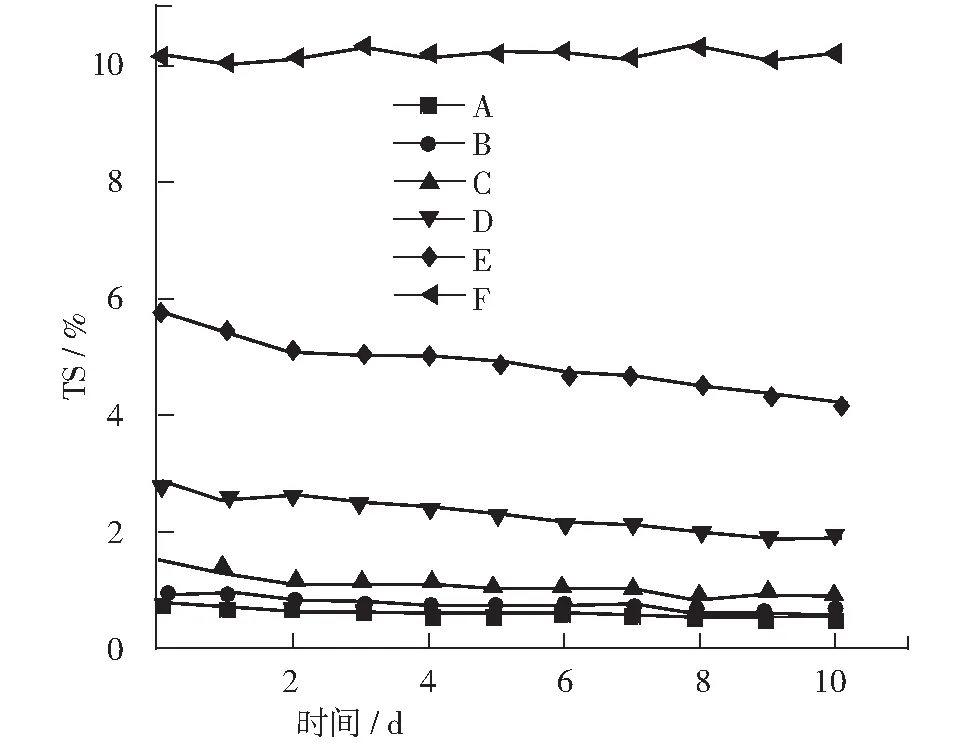
图2 厌氧消化中TS变化曲线
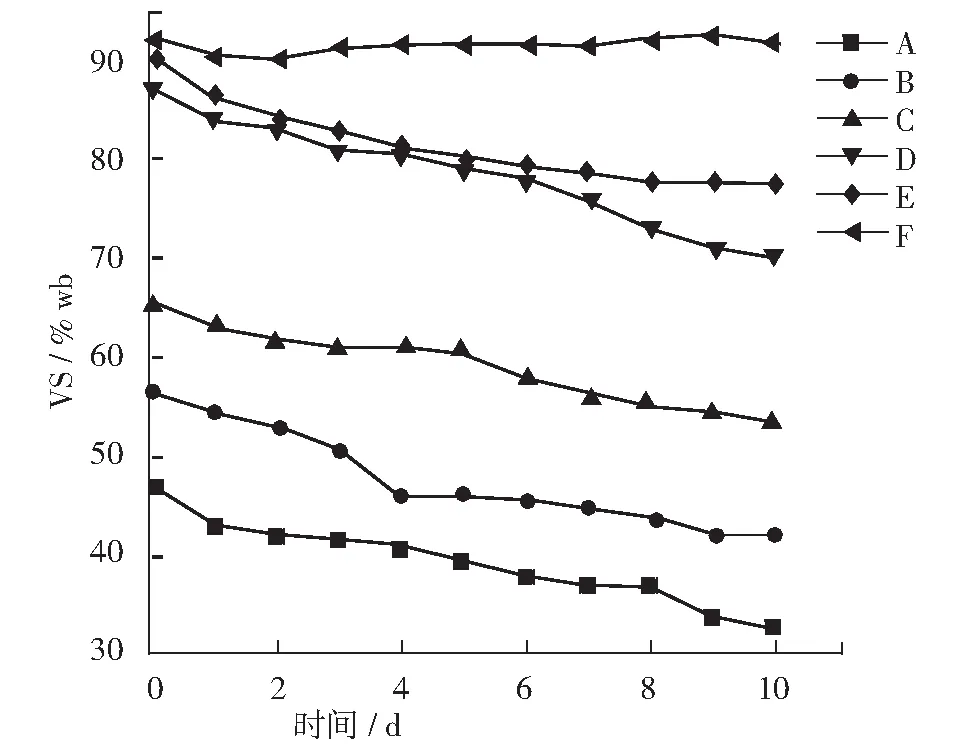
图3 厌氧消化中VS变化曲线
2.3 F/M对COD去除率和去除总量的影响
图4表明了厌氧消化过程中各组每天COD去除量的情况。在反应初期COD下降较快,原因是在发酵液和菌渣中残留的糖类等有机质被直接利用,这一步反应不受水解反应的限制,所以COD去除效率较高[13]。在第4天后,COD下降缓慢,有可能的原因是,水解反应进行缓慢对下一步的产酸产甲烷反应有所限制,还有可能是反应体系中的氨氮等有毒物质的积累造成了COD消耗量的下降。在反应结束时,A, B, C, D, E的COD去除率分别为55.66%,42.46%,20.24%,5.71%,3.36%。由于各组份初始COD差别很大,C, D, E这3组初始COD很高,消化反应的有机负荷较大,所以COD去除率较低。但从COD的去除总量来说,5组分别为1372 mg,1885 mg,4029 mg,2862 mg,2358 mg。去除COD的能力在F/M=2时达到最高点。由此来说,C组的处理能力相对最强。
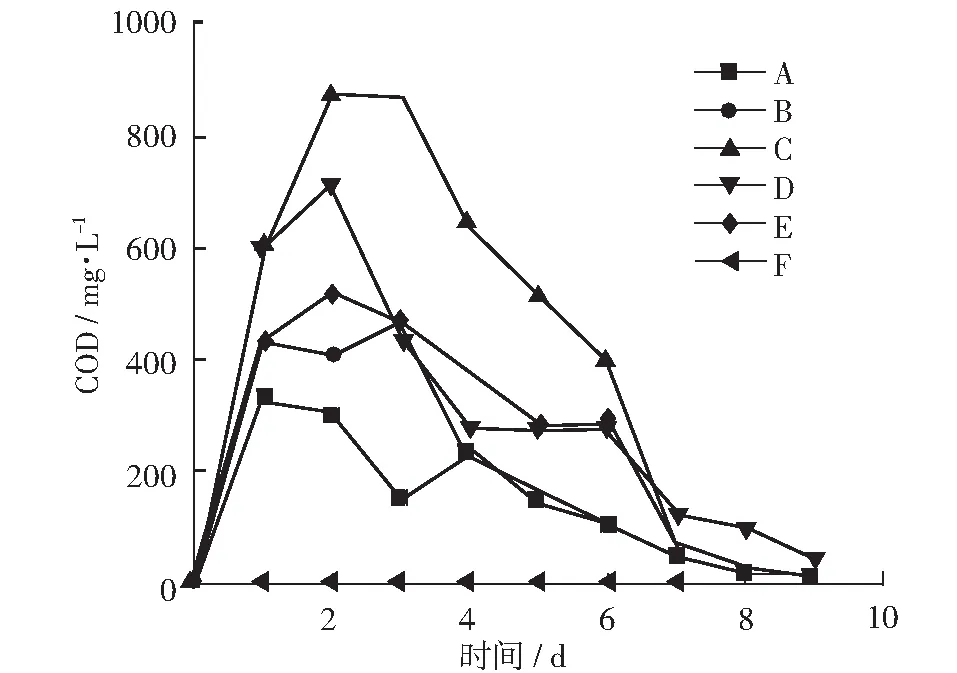
图4 厌氧消化中COD变化曲线
2.4 F/M对氨氮浓度的影响
图5显示在厌氧消化过程中各组氨氮的变化情况。其中,A, B, C这3组的氨氮含量是先上升,然后分别平稳的保持在0.4±0.1 g·L-1, 1.4±0.2 g·L-1, 2.6±0.2 g·L-1。由于这3组试验的消化反应仍在继续,所以这样的现象有可能是消化反应体系内氨氮的生成和利用保持平衡。D, E两组在整个厌氧消化过程中氨氮的含量都是持续上升的,最后分别达到了4.5 g·L-1和7.5 g·L-1。这样的氨氮浓度会对反应体系内的产甲烷菌产生抑制,严重影响整个体系产生甲烷的效率[14-16]。造成这两组氨氮浓度持续升高的原因有可能是D, E两组内有机质含量充足,细菌的水解反应较为活跃,产生大量氨氮,并抑制了下一步反应的进行,造成了氨氮的积累。所以可知,氨基酸废弃菌渣及其发酵液如果大量进行厌氧消化会积累过量的氨氮,造成消化反应的停滞。但利用F/M=2的条件进行接种,适当稀释底物浓度,对反应过程中的氨氮生成有很好的控制作用。
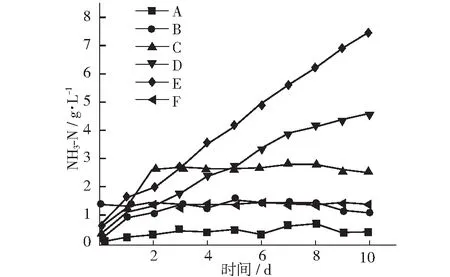
图5 厌氧消化中氨氮变化曲线
2.5 F/M对VFA的影响
图6显示了厌氧消化过程中各组VFA的变化情况。各组试验的VFA变化趋势均是在第2天达到峰值然后逐渐下降,各组的VFA峰值有所不同。其中C组的VFA峰值最大,达到3900 mg·L-1,在VFA下降过程中随着F/M的增加VFA的下降趋势越为缓慢。在反应结束时,A, B, C, D, E这5组的VFA值分别为2010 mg·L-1, 2130 mg·L-1, 2190 mg·L-1, 2379 mg·L-1, 2430 mg·L-1。从VFA的变化可以看出在C组在反应前期的VFA含量最高,说明其消化反应内的水解反应进行得最充分,所以其产气量也最高。这也进一步证明了C组的接种方式更有利于产气。
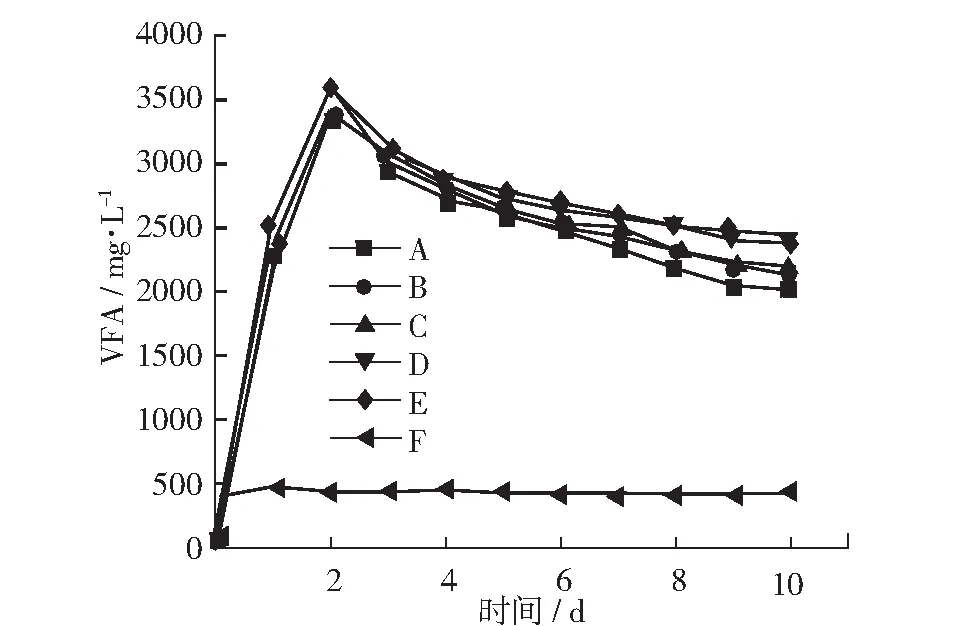
图6 厌氧消化中VFA变化曲线
2.6 F/M对产气量和甲烷含量的影响
图7显示了在厌氧消化过程中各组产气量的变化过程。A, B, C这3组在第2天前到达产气高峰,并且产气活动一直持续到第10天。其中,随着F/M的增大,产气高峰也逐步增大,C组在第2天的产气量最高,达到了245 mL。D, E两组的产气高峰出现在5~6天时,其中D组的最高产气量为239 mL,与C组相差不大。但D,E两组的产气持续性明显较弱,在反应进行到第8天后基本停止产气。这可能是由于D, E两组的反应体系中的负荷较大,氨氮含量持续升高,从而影响CH4,CO2等气体的产生。整个反应过程中,各组的产气总量分别为441 mL,638 mL,840 mL,740 mL,747 mL。此外,各组产生气体的平均甲烷含量分别为49.1%,47.3%,50.2%,35%,27.1%。由此可以看出C组在气体产量和甲烷产量上都具有优势,是最适合进行产气的消化条件。
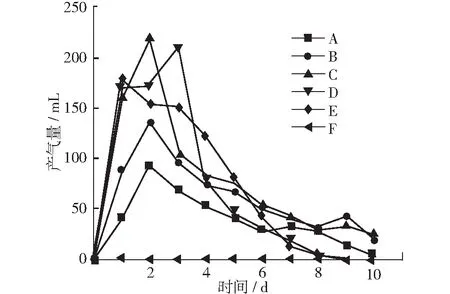
图7 厌氧消化中产气量变化曲线
3 结论
在利用F/M作为接种依据进行厌氧消化的实验中,发现F/M=2是最佳的接种比例。依据这一浓度进行接种,在整个消化过程中积累到了最高的产气量840 mL,并且平均甲烷含量也达到了最高的50.2%。同时,其TS,VS去除率分别达到46.67%和26.64%,相比其他组别都具有优势。其COD去除率达到了20.24%,与F/M=0.5,F/M=1两组相比较低,但其COD的去除总量达到了4029 mg,相比其他组具有明显的优势。在氨氮的积累上,F/M=2组在反应的中后期可以保持体系内氨氮生成和利用的基本平衡,氨氮浓度稳定在2.6±0.2 g·L-1,此浓度的氨氮不会对产甲烷菌的活性产生抑制,这也说明F/M=2的接种条件对消化过程中氨氮的生成有很好的控制。然而,对整个消化反应来看,其反应周期还相对较短,只能维持10天左右就完全停止产气,其原因有可能是反应体系某种营养物质的不足所造成的,所以下一步计划在厌氧消化过程进行原料的流加,以维持更长的反应周期,进一步增加产气量和处理效率。
[1] 环境保护部,国家发展和改革委员会.国家危险废物目录 [Z]. 北京: 环境保护部,国家发展和改革委员会, 2008.
[2] 农业部, 卫生部. 国家药品监督管理局公告第176号[J]. 饲料研究, 2002(9): 19.
[3] GB18597-2001. 危险废物贮存污染控制标准[S].
[4] GB18598-2001. 危险废物贮存污染控制标准[S].
[5] 石 鹏,艾 晗,王 辉,孙德智.抗生素制药菌渣的处理技术进展和分析[J].中国抗生素杂志,2015,40(7):486-494.
[6] Mata Alvarez J, Mace S, Llabres P. Anaerobic of organic solids wastes: An overview of research achievements and perspectives [J]. Bioresource Technology, 2000,74(1):3-16.
[7] 潘云霞,李文哲.接种物浓度对厌氧发酵产气特性影响的研究[J].农机化研究,2004,(1):187-188,192.
[8] 苏建文,王俊超,许尚营,王彩冬.红霉素菌渣厌氧消化实验研究[J].中国沼气,2013,31(5):25-28.
[9] 张文彬,张建斌,李继安,绍 雷,陈代杰.螺旋霉素发酵菌渣与废液处理工艺研究[J].2014,37(6):151-153,162.
[10] Forster Carneiro T, Perez M, Romero L I. Influence of total solid and inoculum contents on performance of anaerobic reactors treating food waste [J]. Bioresource Technology, 2008,99(15)
[11] APHA. Methods for Examination of Water and Wastewater, 20th ed. American Public Health Association/American Water Works Association/Water Environment Federation[M]. Washington, DC, USA,1998.
[12] 左剑恶,胡纪萃,陆正禹,等.厌氧消化过程中的酸碱平衡及pH 控制的研究[J].中国沼气, 1998, 16( 1) : 3-7.
[13] 胡 萍,严 群,宋任涛,阮文权.蓝藻与污泥混合厌氧发酵产沼气的初步研究[J].环境工程学报,2009,3(3):159-163.
[14] 何品晶,管冬兴,吴 铎,等.氨氮和林可霉素对有机物厌氧消化的抑制效应[J].化工学报,2011,62 ( 5) :1389-1394.
[15] 张 波,徐剑波,蔡伟民.有机废物厌氧消化过程中氨氮的抑制性影响[J].中国沼气, 2003, 21( 3) : 26-28.
[16] Koster I W. Anaerobic digestion at extreme ammonia conc-entrations [J].Biological Wastes, 1988,25(1):51-59.
Influence of Food to Microorganism Ratio on Anaerobic Digestion of Bacterial Residues from Alanine Production /
TANG Ruo-hao1,2, LIU Yang3, YU Liang2, JIA Shi-ru1, CHEN Shu-lin2, LI De-mao2/
(1. Key Laboratory of Industry Microbiology, Ministry of Education; Tianjin University of Science and Technology, Tianjin 300457, China; 2. Tianjin Key Laboratory for Industrial BioSystems and Bioprocessing Engineering, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300457, China; 3. Anhui Huaheng Biotechnology CO LTD, Hefei 230041, China)
Bacteria residue from Alanine production was treated by anaerobic digestion at 35℃. The effects of 5 food to microorganism ratio ( F/M 0.5, 1, 2, 4, 8) on pH, TS, VS, COD, ammonia nitrogen, VFA, gas output and methane content, were compared. The results showed that the F/M of 2 obtained the best of TS and VS degradation rate, COD removal efficiency, total gas production and average methane content, for which the pH were 7.4 ~ 7.9, the TS and VS degradation rate reached 46.67% and 26.64% respectively, the total COD removal was 4029 mg, total gas production was 840 mL, and the biogas methane content was 50.2%. The ammonia nitrogen concentration was maintained within 2.4 ~2.8g·L-1, which indicated the ammonia production was effectively controlled in the anaerobic digestion process.
bacterial residues from alanine production; anaerobic digestion; food to microorganism ratio; methane production
2016-01-11
汤若昊(1990- ),男,硕士研究生,研究方向为厌氧消化制沼,E-mail: tang_rh@tib.cas.cn
李德茂,E-mail:li_dm@tib.cas.cn
S216.4;X172
A
1000-1166(2016)02-0013-05

