pH及溶氧对重组大肠杆菌发酵生产5-氨基乙酰丙酸的影响
程雪莲,王倩*,祁庆生,2
(1.山东大学国家糖工程技术研究中心,山东济南250100;2.山东大学微生物技术国家重点实验室,山东济南250100)
pH及溶氧对重组大肠杆菌发酵生产5-氨基乙酰丙酸的影响
程雪莲1,王倩1*,祁庆生1,2
(1.山东大学国家糖工程技术研究中心,山东济南250100;2.山东大学微生物技术国家重点实验室,山东济南250100)
以重组大肠杆菌DALA为实验菌株,研究了该菌株在机械搅拌通风发酵罐发酵过程中pH以及溶解氧对5-氨基乙酰丙酸(ALA)积累的影响。结果发现,发酵前期(0~27 h)pH保持为6.5;稳定期后期(28~48 h),pH为6.0时有利于5-ALA的积累。其次,通过控制转速与通气量调节发酵液中的溶氧,发现发酵前期转速为500 r/min,通气量为2 vvm;稳定期后期,转速降低至250 r/min,通气量减少为1 vvm,有利于重组菌DALA发酵生产5-ALA,在此条件下发酵5-ALA的产量可达到3.46 g/L。
重组大肠杆菌;5-氨基乙酰丙酸;溶解氧
5-氨基乙酰丙酸(5-aminolevulinic acid,ALA)是生物体内的一种非蛋白质氨基酸,其分子式为C5O3NH9,水溶液中易两两结合发生缩合反应。ALA是吡咯化合物生物合成的重要中间产物,如维生素B12、血红素及植物细胞中叶绿素的合成均需要ALA作为前体物质。早期美国食品和药物管理局已经批准其可作为一种光动力学药物,应用于医学领域[1]。此外ALA在农业上可以作为一种有效的绿色农药-除草剂,还可以提高植物的抗逆性,提高农作物产量[2]。
目前ALA的制备方法有化学法和生物发酵法[3]。化学法生产ALA转化率低、副产物毒性大、易污染环境。近年来科学工作者们致力于研究采用微生物生产ALA[4-5]。在自然界生物体内,共有两条ALA生成途径。一条途径为C4途径[6-7](或Shemin pathway),主要存在于细菌中的α变形菌门中。琥珀酰辅酶A和甘氨酸经ALA合成酶催化反应生成ALA。另一条途径为C5途径[8](或Beale pathway),主要存在于植物、藻类、非α变形菌门的细菌以及古菌中,谷氨酸和相应的转移核糖核酸(transfer ribonucleic acid,tRNA)经谷氨酰tRNA合成酶(glutamyl-tRNA synthetase GluRS),gltX基因编码催化生成谷氨酰tRNA,谷氨酰tRNA在谷氨酰tRNA还原酶(glutamyl-tRNAreductaseHemA,基因hemA编码)的催化下还原为谷氨酰-1-半醛(glutamate-1-semialdehyde GSA)。之后GSA被谷氨酰-1-半醛氨基转移酶(glutamate-1-semialdehyde2,1-aminomutaseHemL),由hemL基因编码催化,转化为ALA。
关于C5途径产ALA的研究比较少,2011年,KANG Z等[9]将来自亚利桑那沙门氏菌(S.arizona)的hemA基因进行突变,使hemA基因可以更好地在宿主菌大肠杆菌DH5α中表达。将hemA基因与hemL基因共表达于大肠杆菌DH5α,同时在宿主体内表达了RhtA转运蛋白,得到重组大肠杆菌DALA。同年,KANG Z等[10]再次以大肠杆菌为宿主菌,同时表达C4途径与C5途径(见图1),成功地构建了两条途径同时合成ALA。2013年,LI F等[11]利用sRNA RyhB对大肠杆菌的血红素合成途径进行调控,提高了ALA的积累。
本实验在之前实验的基础上对重组大肠杆菌DALA进行发酵优化,进一步提高ALA产量。发酵过程中温度、pH、溶解氧会影响菌体的生长状况、各种关键酶的活性、产物的稳定性、副产物生物积累等。合适的温度、pH、溶解氧条件利于目标产物的积累[12-14]。在微生物体中,ALA是血红素代谢途径的中间产物,血红素的发酵条件对其有一定的参考价值。血红素的代谢与溶氧密切相关,而ALA在偏碱性环境中易发生两两聚合反应,在酸性环境中比较稳定。因此,本实验的目的是通过调节发酵罐中发酵液pH以及控制转速来调节发酵液中溶解氧优化发酵重组大肠杆菌DALA,探索合适的ALA生产条件。
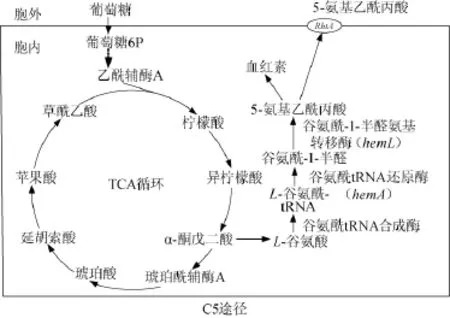
图1 5-氨基乙酰丙酸的C5生物合成途径Fig.1 C5 biosynthetic pathway of 5-aminolevulinic acid
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
重组大肠杆菌DALA:由本实验室构建。
1.1.2 培养基与相关试剂
LB液体培养基:蛋白胨10 g/L、酵母粉5 g/L、氯化钠10 g/L。
ALA发酵种子培养基:(NH4)2SO416.0 g/L、KH2PO43.0 g/L、Na2HPO4·12H2O 16.0 g/L、MgSO4·7H2O 1.0 g/L、MnSO4·H2O 0.01 g/L、酵母粉5.0 g/L、葡萄糖20 g/L。
ALA发酵培养基:(NH4)2SO416.0 g/L、KH2PO43.0 g/L、Na2HPO4·12H2O 16.0 g/L、MgSO4·7H2O 1.0 g/L、酵母粉2.0 g/L、MnSO4·H2O 0.01 g/L、葡萄糖20 g/L。
50%葡萄糖溶液配制:550 gD-葡萄糖,加双蒸水定容至1 L。
抗生素溶液工作质量浓度:氨苄青霉素100 μg/mL、壮观霉素25 μg/mL。
诱导剂异丙基硫代-β-D半乳糖(isopropylβ-d-thiogalactoside,IPTG)工作液浓度:0.2 mmol/L。
高效液相色谱缓冲液:5 mmol/L H2SO4∶98%H2SO4272 μL,加入1 L双蒸水中,并用0.22 μm水相滤膜过滤。
改良的Ehrlich's reagents[12](50 mL):称取1 g对-二甲基苯甲醛溶解于30mL冰醋酸中,然后加入8mL高氯酸(70%),最后用冰醋酸定容至50 mL,现配现用。
乙酸钠缓冲液:称取82 g无水乙酸钠至57 mL的冰醋酸中,加水定容至1 L。
1.2 仪器与设备
Eppendorfmini离心机:德国Eppendorf公司;YXQ-LS-S II型全自动立式电热压力蒸汽灭菌器:上海博讯实业有限公司;HZQ-Q型全温振荡培养箱:哈尔滨市东联电子技术开发有限公司;发酵罐:美国NBS公司;CLASS-VP10A高效液相色谱(high performance liquid chromatography,HPLC)、UV-1800型分光光度计:日本岛津公司;SBA-40C生物传感分析仪:山东省科学院生物研究所。
1.3 实验方法
1.3.1 发酵培养方法
一级种子培养:取出-80℃冰箱中保藏的DALA菌种接种于含有50 mL LB液体培养基的300 mL锥形瓶中,37℃、250 r/min振荡培养12 h。
二级种子培养:取6 mL一级种子培养液于含有200 mL ALA发酵种子培养基的1 L锥形瓶中,37℃、250 r/min振荡培养8 h。4 h时用5 mol/L NaOH调pH,使pH在6.5~7.0。
发酵培养:按照2%的接种量分别取已培养好的二级种子菌液接种于装有700mLALA发酵培养基的1L发酵罐中,同时加入0.2 mmol/L IPTG。初始葡萄糖含量均为20 g/L,发酵期间向罐中补加50%的葡萄糖母液,使发酵液中糖质量浓度维持在10~20 g/L。发酵温度37℃,发酵过程中用5 mol/L NaOH和3 mol/L H2SO4调节发酵液pH。通过调节转速与通气量控制发酵液中溶解氧,进而探索合适的溶氧条件使ALA发酵得到较高产量。培养期间每4 h取1 mL菌液至1.5 mL离心管中,12 000 r/min离心4 min,取上清至另一干净的1.5 mL离心管中,菌体用于测定OD值,上清用于产物ALA、发酵液中葡萄糖含量的测定以及其他副产物乙酸、乳酸、谷氨酸的测定。
1.3.2 分析测定方法
ALA浓度的测定:发酵液中ALA浓度的测定按照参考文献[15]制定的分光光度分析法,取离心保存的发酵液上清稀释合适的倍数,取400 μL稀释好的上清液至1.5 mL的离心管中,再依次加入200 μL乙酸钠缓冲液和100 μL乙酰丙酮,在振荡器上混匀,沸水浴中反应15 min。取出反应体系静置自然冷却至室温,加入700 μL改良的Ehrlich's reagent并来回颠倒混匀,反应20 min,使用分光光度计在波长554 nm处测吸光度值,根据ALA/OD554nm标准曲线计算ALA的浓度。
葡萄糖浓度的测定:发酵液中葡萄糖浓度使用SBA-40C生物传感分析仪测定。
发酵液中菌体OD的测定:根据菌体浓度稀释合适的倍数,使用分光光度计在波长600 nm处测OD600nm。
谷氨酸浓度的测定:使用SBA-40C生物传感分析仪测定。
乙酸、乳酸浓度的测定:使用HPLC检测。发酵液上清通过0.22 μm水相滤膜过滤除菌。HPLC采用阳离子交换柱(HPX-87,BioRadLabs),示差检测器ShimadzuRID-10A,流动相使用5 mmol/L的硫酸水溶液,流速0.6 mL/min。柱温箱的温度为65℃。
2 结果与分析
2.1 产ALA重组大肠杆菌DALA发酵pH优化
由于ALA在偏酸性的环境中稳定性较高,故先对重组大肠杆菌DALA发酵过程中的pH进行优化。在溶氧均为前期转速500 r/min,通气量2 vvm;后期转速200 r/min,通气量1 vvm的条件下,考察重组大肠杆菌DALA在(a)发酵前期pH6.0;稳定期后期pH5.5;(b)发酵前期pH6.5;稳定期后期pH6.0时的发酵结果。结果如图2所示。

图2 重组大肠杆菌DALA在不同pH条件下的发酵结果Fig.2 Fermentation results of recombinantE.coliDALA in different pH conditions
由图2可知,在不同pH条件下,发酵罐菌体生长趋势一致,副产物的积累量相近,而发酵前期pH为6.5,稳定期后期pH为6.0条件下发酵罐中积累ALA产量较高。在此条件下,ALA的量可达到3.39 g/L。因此,采用发酵前期pH6.5,稳定期后期pH6.0的方式控制发酵pH值。
2.2 产ALA重组大肠杆菌DALA发酵溶氧优化
ALA的发酵受溶氧条件影响较大,故对重组菌DALA发酵过程中的溶氧进行了优化,在pH均为发酵前期pH6.5,稳定期后期pH6.0的条件下,分别调整(a)发酵前期转速400 r/min,通气量2 vvm;稳定期后期转速200 r/min,通气量1 vvm;(b)发酵前期转速500 r/min,通气量2 vvm;稳定期后期转速250 r/min,通气量1 vvm。通过控制转速调控发酵过程中的溶氧,考察在不同溶氧条件下的发酵结果。结果见图3。

图3 重组大肠杆菌DALA在不同溶氧条件下的发酵结果。Fig.3 RecombinantE.coliDALA fermentation results under different conditions of dissolved oxygen
由图3可知,发酵罐菌体生长趋势一致,副产物的积累量相近,发酵前期转速为500 r/min,通气量为2 vvm;稳定期后期转速为250 r/min,通气量为1 vvm,有利于ALA的积累。ALA的产量最终可达3.46 g/L。因此,发酵前期转速为500 r/min,通气量为2 vvm;稳定期后期转速为250 r/min,通气量为1 vvm的方式控制发酵溶氧。
综上所述,首先对发酵液的pH进行优化,发酵前期发酵液pH维持6.5,一方面不影响菌体的正常生长繁殖与生理代谢;另一方面,pH值为6.5时,ALA在水溶液中还可以稳定存在。稳定期后期,菌体的活性开始下降,且发酵液中已经积累大量的ALA,继续降低发酵液的pH至6.0,此时菌体继续积累ALA,同时发酵液pH降低为6.0时加强了发酵液中ALA的稳定性。有利于重组大肠杆菌DALA积累ALA。其次,对发酵液的溶氧进行了优化。ALA是血红素合成的前体物质,血红素是生物呼吸电子传递链蛋白的重要组成部分,参与细胞中许多重要的生理代谢活动[16]。ALA的产生和菌体的呼吸状态密切相关,重组菌DALA在较高的溶解氧条件下有氧呼吸加强,生理代谢加快,一定程度上增加了ALA积累。但发酵液中一直保持较高的溶氧状态,易使菌体中积累大量的血红素,不利于ALA的持续性积累。因此发酵前期采用好氧发酵,使菌体快速繁殖,同时菌体呼吸较强,可以快速积累ALA。发酵后期菌体生长达到稳定,这时降低发酵罐的通气量和转速,改为微好氧发酵,既可以保证ALA的继续积累,减少ALA走向下游生成终产物血红素,同时又避免葡萄糖代谢流向副产物而造成碳源的浪费,节约资源。
由于该重组菌DALA发酵后期仍会积累副产物乳酸、乙酸,可能的原因是发酵后期转为微好氧发酵,三羧酸循环(tricarboxylic acid cycle,TCA)途径减弱,而乙酸、乳酸等产物途径没有被敲除,积累一定量的副产物不利于细胞的生理代谢,因而需要作进一步的基因改造,减少副产物的积累,使更多的葡萄糖用于ALA的生产。
本次发酵中前体物谷氨酸基本不积累,原因可能是谷氨酰tRNA还原酶和谷氨酰-1-半醛氨基转移酶可以有效地催化谷氨酸生成ALA,同时质粒上过表达rhtA基因产生大量的RhtA转运蛋白,RhtA转运蛋白是一种特异性不强的氨基酸转运蛋白,可以将细菌胞内积累的大量ALA运输到细胞外,进而解除ALA对自身积累的抑制,有利于ALA的生产。ALA的有效生产造成前体物谷氨酸不足,因而在发酵液中基本检测不到谷氨酸的积累。
3 结论
本实验主要对重组菌DALA发酵生产ALA过程中pH以及溶氧进行了优化,初步确定合适的发酵条件为:发酵前期(0~27h)pH保持在6.5,转速为500 r/min,通气量为2 vvm;稳定期后期(28~48 h)pH为6.0,转速降低至250 r/min,同时通气量减少为1 vvm,在该条件下有利于ALA的积累,产量可达到3.46 g/L。ALA化学性质的不稳定性,在水溶液中易发生两两缩合反应,随着溶液中pH的升高,ALA的稳定性降低,且这一性质随着发酵液中ALA的浓度增加而越来越明显。同时,利用大肠杆菌重组菌DALA发酵生产ALA时,ALA的积累受发酵液中溶氧的影响较大。太低的溶氧条件会造成菌体呼吸困难,不利于ALA的积累。而过高的溶氧又会促进ALA走向下游生成终产物血红素,血红素的生成一方面消耗ALA,另一方面反馈抑制ALA的合成。本实验获得的研究结果可以为将来的发酵放大实验提供理论依据和技术支撑。
[1]SAKAMOTO F H,LOPES J D,ANDERSON R R.Photodynamic therapy for acne vulgaris:a critical review from basics to clinical practice:part I.Acne vulgaris:when and why consider photodynamic therapy[J].J Am Acad Dermatol,2010,63(2):183-196.
[2]SASAKI K,WATANABLE M,TANAKA T.Biosynthesis,biotechnological production and applications of 5-aminolevulinic acid[J].Appl Microbiol Biotechnol,2002,58(1):23-28.
[3]付士凯,李伟华,时建刚.5-氨基乙酰丙酸的应用及合成方法[J].山东化工,2003,32(3):24-26.
[4]FU W,LIN J,CEN P.Expression of a hemA gene fromAgrobacterium radiobacterin a rare condon optimizingEscherichia colifor improving 5-aminolevulinate production[J].Appl Biochem Biotechnol,2010,160 (2):456-466.
[5]XIE L,HALL D,EITEMAN M A,et al.Optimization of recombinant aminolevulinate synthase production inEsherichia coliusing factorial design[J].Appl Microbiol Biotechnol,2003,63(3):267-273.
[6]VAN DER WERF M J,ZEIKUS J G.5-Aminolevulinate production by Escherichia colicontaining theRhodobacter sphaeroides hemAgene[J]. Appl Environ Microbiol,1996,62(10):3560-3566.
[7]LEE D H,JUN W J,SHIN D H,et al.Effect of culture conditions on production of 5-aminolevulinic acid by recombinantEscherichia coli[J]. Biosci Biotechnol Biochem,2005,69(3):470-476.
[8]BEALE S I.Biosynthesis of the tetrapyrrol pigment precursor,delta-aminolevulinic acid,from glutamate[J].J Plant Physiol,1990,93(4):1273-1278.
[9]KANG Z,WANG Q,QI Q,et al.EngineeringEscherichia colifor efficient production of 5-aminolevulinic acid from glucose[J].Metab Eng, 2011,13(5):492-498.
[10]KANG Z,WANG Q,QI Q,et al.Metabolic engineering to improve 5-aminolevulinic acid production[J].Bioeng Bug,2011,2(6):342-345.
[11]LI F,WANG Y,QI Q,et al.Constitutive expression of RyhB regulates the heme biosynthesis pathway and increases the 5-aminolevulinic acid accumulation inEscherichia coli[J].FEMS Microbiol Lett,2014,350 (2):209-215.
[12]朱钦豪,边亚西,吴昊,等.淡紫灰链霉菌H2产α-葡萄糖苷酶抑制剂发酵条件优化[J].中国酿造,2016,35(2):18-23.
[13]张松,李啸,石小丹,等.产酮基还原酶基因工程菌培养温度和转速条件的优化[J].中国酿造,2016,35(2):79-83.
[14]刘宽博,熊利霞,刘慧,等.抗单增李斯特菌枯草芽孢杆菌C3增菌培养条件优化[J].中国酿造,2016,35(2):48-52.
[15]MANZERALLD,GRANICKS.Theoccurrenceanddeterminationof deita-amino-levulinic acid and porphobilinogen in urine[J].J Biol Chem, 1956,219(1):435-446.
[16]MENSE S M,ZHANG L.Heme:a versatile signaling molecule controlling the activities of diverse regulators ranging from transcription factors to MAP kinases[J].Cell Res,2006,16(8):681-692.
Effect of pH and dissolved oxygen on the fermentation production of 5-aminolevulinic acid by recombinantEscherichia coli
CHENG Xuelian1,WANG Qian1*,QI Qingsheng1,2
(1.National Glycoengineering Center,Shandong University,Jinan 250100,China; 2.State Key Laboratory of Microbial Technology,Shandong University,Jinan 250100,China)
Using the recombinantEscherichia coliDALA as experimental strains,the effects of pH and dissolved oxygen on the 5-aminolevulinic acid (5-ALA)during fermentation in mechanical stirred fermentation tank were researched.The results showed that the pH was 6.5 in the early period of fermentation(0-27 h),and in the late period of stable stage(28-48 h),the pH was 6.5,which was conducive to the accumulation of 5-ALA.Besides, by controlling the rotate speed and the aeration to adjust dissolved oxygen in the fermentation liquid,it showed that in the early period of fermentation,the rotate speed was 500 r/min and aeration was 2 vvm.In the late period of stable stage,the rotate speed and aeration were reduced to 250 r/min and 1 vvm,respectively,which was conducive to the fermentation production of 5-ALA by recombinantE.coli.Under the conditions,the yield of 5-ALA was up to 3.46 g/L.
recombinantEscherichia coli;5-aminolevulinic acid;dissolved oxygen
Q939.99
0254-5071(2016)11-0145-04
10.11882/j.issn.0254-5071.2016.11.030
2016-04-19
国家自然科学基金(31370085);国家863计划项目子课题(2012AA022104);山东省自主创新及成果转化专项(201422CX02602)
程雪莲(1990-),女,硕士,研究方向为微生物生物合成代谢调控。
*通讯作者:王倩(1983-),女,讲师,博士,研究方向为微生物生物合成代谢调控。

