利巴韦林单克隆抗体制备以及酶联免疫试剂盒的研究
陈敏,崔海峰,冯才伟*,贾芳芳,杨春艳
(1.武汉中粮肉食品有限公司,湖北武汉430200;2.北京勤邦生物技术有限公司,北京102206;3.北京市食品安全免疫快速检测工程技术研究中心,北京102206)
利巴韦林单克隆抗体制备以及酶联免疫试剂盒的研究
陈敏1,崔海峰2,3,冯才伟2,3*,贾芳芳2,3,杨春艳2,3
(1.武汉中粮肉食品有限公司,湖北武汉430200;2.北京勤邦生物技术有限公司,北京102206;3.北京市食品安全免疫快速检测工程技术研究中心,北京102206)
首先合成出利巴韦林半抗原,通过免疫动物得到抗利巴韦林单克隆抗体,制备利巴韦林残留酶联免疫检测试剂盒,用于检测鸡肉、猪肉中利巴韦林残留量。结果表明:该试剂盒对鸡肉、猪肉的检测限分别为4.88 μg/kg、4.42 μg/kg,半抑制浓度(IC50)为7.9 μg/L,回收率为80%~105%,试剂盒的标准曲线线性范围为0~81 μg/L,批内、批间的相对标准标准偏差(RSD)均<10%。4℃下能够保存12个月,稳定性较好。
利巴韦林;半抗原制备;酶联免疫法
利巴韦林(ribavirin,RBV)是一种广谱抗病毒药物,该种药物具有高效性,被用于多种病毒治疗,然而不法分子将其用于畜牧养殖,在动物饲养过程中违规滥用,使得该类药物通过食物链进入人体内产生不良影响[1-4]。由于利巴韦林药物容易出现上述情况,因此农业部发布了2005年第560号公告《兽药地方标准废止目录》和农医发[2005]33号文件《关于清查金刚烷胺等抗病毒药物的紧急通知》,明确规定了禁止利巴韦林等药物的生产、经营和使用,违者按生产、经营假兽药和使用禁用兽药处理。
目前,常用于检测利巴韦林的方法有液相色谱法、液相色谱串联质谱法、气相色谱串联质谱法、放射免疫法等[5-9],而国内外尚无关于检测动物源性食品中利巴韦林残留的标准方法。原因可能是由于动物源性食品的基质复杂,前处理方法不完善造成的,另外,利巴韦林属于核苷类化合物,与动物组织中的某些自身物质结构相似,因此不易准确地进行检测。又由于利巴韦林检测的实际需求,本研究利用酶联免疫法(enzyme linked immunosorbent assay,ELISA)检测动物组织中利巴韦林药物的残留量,自主研发制备出检测成本低、操作方法简单、灵敏度较高的检测试剂盒,极易应用于实际检测中,而仪器方法不仅使用的仪器昂贵,需要专业的技术人员,而且大型仪器不适于现场检验,该试剂盒更适于基层实验室的应用。
1 材料与方法
1.1 材料与试剂
利巴韦林标准品:北京标准物质研究中心;洗涤液(向0.02 mol/L PBS中加入1%吐温)、封闭液(在0.02 mol/L PBS中加入0.05%牛血清蛋白(bovine serum albumin,BSA))、底物显色液(由A液和B液组成,A液为过氧化氢,B液为四甲基联苯胺)、终止液(2 mol/L H2SO4):北京百欣试剂公司;鸡肉、猪肉:市售;Balb/c小鼠、无病原体羊:北京市海淀区兴隆实验动物养殖厂。
1.2 仪器与设备
MK3酶标仪:上海雷勃分析仪器有限公司;HFJ-10振荡器、MX-F涡旋仪:湖南湘立科学仪器有限公司;2L/R201C旋转蒸发仪:上海一科仪器有限公司。
1.3 方法
1.3.1 抗原的制备
(1)半抗原的制备
a)取5-硝基-1H-1,2,4-噻唑-3-羧酰胺5 g,加β-D-呋喃核糖-1,2,3,5-四乙酸酯3.26 g,加二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,加双(对硝基苯基)磷酸酯1.2 g,油浴加热,170℃条件下反应2 h。停止反应,加水,乙酸乙酯萃取,蒸干,上硅胶柱,石油醚/乙酸乙酯2∶1(V/V)洗脱分离,得到中间体a(4.15 g)。
b)取中间体a加氢氧化钠水溶液溶解,60℃条件下反应2 h,停止反应,中和滴加6 mol/L的浓盐酸,中和至pH=7(采用1-14试纸监测),旋蒸蒸干,加80 mL无水乙醇。乙醇重结晶,得到硝基利巴韦林(2.11 g)。
c)取硝基利巴韦林(分子量415.31)2.1 g,加甲醇溶解,加催化剂(即摩尔分数5%的钯)钯碳,加氢气,三口圆底烧瓶中,换气,加氢气球。室温搅拌6 h,检测,薄层层析(thin layer chromatography,TLC)检测,展开剂二氯甲烷∶甲醇∶乙酸=500 μL∶500 μL∶20 μL,待原料反应完全,抽滤,除去钯碳,旋蒸蒸干,得到油状物,1,2-二氯乙烷重结晶,得到氨基利巴韦林半抗原产物(1.21 g)。利巴韦林半抗原合成途径见图1。

图1 利巴韦林半抗原合成途径Fig.1 Synthesis path of ribavirin hapten
(2)免疫原的制备
取15 mg氨基利巴韦林半抗原,溶解于1 mL二甲基甲酰胺(dimethylformamide,DMF)中,用pH 9.1的碳酸盐缓冲液(carbonate buffer solution,CB)稀释,加戊二醛0.2 mL,搅拌反应2 h,得到A液。称取牛血清蛋白(BSA)50 mg,使之充分溶解在4 mL CB(pH 9.5)中,将A液逐滴缓慢滴加到蛋白溶液中,并于室温条件下搅拌24 h,用0.01mol/L的磷酸盐缓冲液(phosphate buffer solution,PBS)于4℃条件透析(透析袋截留分子质量8 000~14 000 u)3 d,每天换3次透析液。分装,于-20℃保存备用。
(3)包被原的制备
取10 mg氨基利巴韦林半抗原,溶解于1 mL稀盐酸(0.12 mol/L)中,冷却到0℃搅拌,亚硝酸钠水溶液(含亚硝酸钠3 mg)0.5 mL,搅拌1 h,得到A液。称取卵清蛋白(ovalbumin,OVA)50mg,使之充分溶解在4mLCB(pH9.0)中,将A液逐滴缓慢滴加到蛋白溶液中,并于低温(0~5℃)条件下搅拌4 h;用0.01 mol/L的PBS于4℃透析(透析袋截留分子质量8 000~14 000 u)3 d,每天换3次透析液。分装,于-20℃保存备用。
1.3.2 制备酶标记抗体:是酶标记抗抗体,即酶标记二抗
按照1.3.1步骤得到免疫原后,将其注入到Balb/c小鼠体内,进行免疫,得到利巴韦林单克隆抗体[10],用该单克隆抗体免疫无病原体羊,得到羊抗鼠抗体[11],然后将羊抗鼠抗体与辣根过氧化物酶(horseradish peroxidase,HRP)偶联[12],即得到酶标记抗体。
1.3.3 筛选抗原包被浓度、单克隆抗体浓度,制备酶标板
在测定波长为450 nm,抗原稀释倍数依次为1∶4 000、1∶8 000、1∶16 000;单克隆抗体稀释倍数依次为1∶20 000、1∶40 000、1∶80 000、1∶160 000;酶标记抗体液的稀释倍数为1∶1 000时;分别测定0、1 μg/L质量浓度的利巴韦林标准品的吸光度值,并按如下公式计算百分吸光率:
百分吸光率(即抑制率)=(标准品或样本溶液的平均吸光度值/0 μg/L标准溶液的平均吸光度值)×100%
在酶标板每孔包被100 μL抗原包被液,在37℃条件下放置2 h,随后清洗酶标板,再加入150 μL质量分数为0.05%BSA的0.02 mol/L PBS缓冲液,在37℃条件下放置2 h[13],即完成酶标板的制备。
1.3.4 样本的前处理方法
称取(1.00±0.05)g绞碎的鸡肉或猪肉样本至50 mL聚苯乙烯离心管中,加入10 mL甲醇,用振荡器振荡2 min,混匀,3 000 g室温(20~25℃)离心5 min;移取1 mL上层有机相至10 mL洁净干燥玻璃管中,(50~60℃)水浴氮气流下吹干;加入1mL复溶工作液,涡动3min;取50mL用于分析。
1.3.5 利用酶标板检测样本
依次往酶标板中加入50 mL的标准品溶液(质量浓度为0、1 μg/L、3 μg/L、9 μg/L、27 μg/L、81 μg/L)及鸡肉、猪肉样本溶液,每孔均为50 mL,然后再加入50 mL抗体工作液,25℃条件下,避光反应30 min;洗涤酶标板,然后每孔加入100 mL酶标二抗,25℃条件下,避光反应30 min;洗涤酶标板,每孔先后加入50 μL过氧化氢和50 μL四甲基联苯胺,25℃条件下,避光反应15 min;每孔加入50 mL 2 mol/LH2SO4溶液终止显色反应,于波长450 nm处测定酶标板每孔的OD450nm值,每孔2个重复。
1.3.6 计算样本中利巴韦林含量
根据1.3.5测定的OD450nm值绘制标准曲线,横坐标为利巴韦林标准品质量浓度(μg/L)的对数值,纵坐标为lg(B(OD450nm(1 μg/L))/B0(OD450nm(0 μg/L)),然后将样本的OD450nm值代入标准曲线,即可得到其相应的质量浓度,用该质量浓度乘以稀释倍数即为动物样本中利巴韦林残留量。
1.3.7 检测性能
(1)计算检测限
测定鸡肉、猪肉空白样本各20份,计算其标准差,以3倍的标准差作为方法的检测限(limit of detection,LOD),即可检测出的最低被测物浓度[14]。
(2)精密度和准确度
分别向鸡肉、猪肉样本中添加利巴韦林,使其药物质量浓度达到2.5 μg/kg、5.0 μg/kg和10.0 μg/kg,测定添加回收率,以此评价试剂盒的准确度。测定3批酶标板,每个样本做4个平行),计算相对标准偏差(relative standard deviation,RSD),该指标可以评价试剂盒的精密度。
(3)测定稳定性
将试剂盒在4℃条件下保存12个月,每个月测定半抑制浓度(half inhibitory concentration,IC50)、450 nm波长条件下的最大吸光度值、鸡肉样本的添加回收率。
2 结果与分析
2.1 筛选抗原包被浓度、单克隆抗体浓度
测定不同单克隆抗体稀释倍数以及抗原稀释倍数条件下,质量浓度为0和1 μg/L的利巴韦林标准品的OD450nm值,并计算百分吸光率,结果见表1。

表1 抗原、抗体的浓度优选结果Table 1 Optimized detection results of antigen and antibody concentration
通过多年验证,当百分吸光率在70%~85%时,以抗原、单克隆抗体的最大稀释倍数作为抗原、单克隆抗体的最佳稀释倍数[15]。由表1结果可知,此次筛选的抗原稀释倍数为16 000,最佳单克隆抗体稀释倍数为160 000。
2.2 利巴韦林标准曲线
以利巴韦林标准品质量浓度对数值(x)为横坐标,lg(B/B0)(y)为纵坐标,绘制利巴韦林标准曲线,结果见图2。

图2 利巴韦林标准曲线回归方程Fig.2 Regression equation of standard curve of ribavirin
由图2可知,标准曲线回归方程为y=-1.735x+1.561,相关系数R2为0.997。结果表明,标准曲线的范围为0~81 μg/L,IC50为7.9 μg/L。
2.3 计算检测限
20个鸡肉、猪肉空白样本中利巴韦林的检测结果分别见表2、表3。检测限以测定平均值加3倍标准差计算。
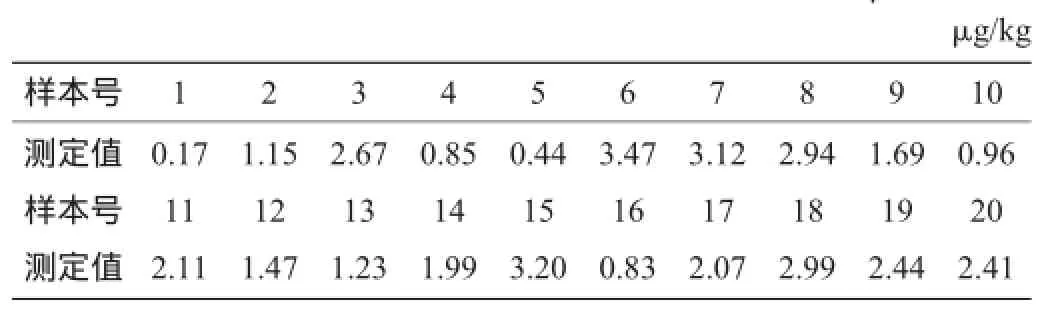
表2 鸡肉空白样本检测限测定结果Table 2 Detection limit results of chicken blank samples

表3 猪肉空白样本检测限测定结果Table 3 Detection limit results of pork blank samples
由表2、表3可知,20个鸡肉空白样本中利巴韦林的检测结果平均值为1.91 μg/kg,最低检测限为4.88 μg/kg;20个猪肉空白样本中利巴韦林的检测结果平均值为1.60 μg/kg,最低检测限为4.42 μg/kg。
2.4 精密度和准确度试验
测定添加不同质量浓度利巴韦林的鸡肉、猪肉样本,其精密度及准确度试验结果分别见表4、表5。
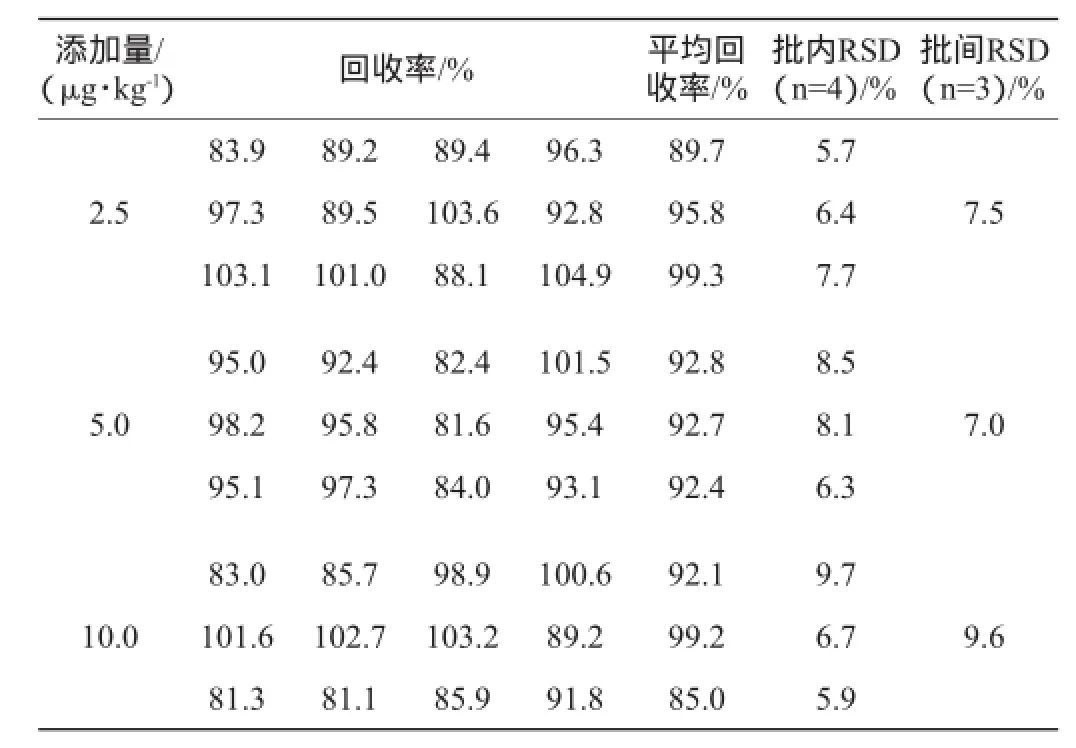
表4 鸡肉样本精密度及准确度试验结果Table 4 Precision and accuracy tests results of chicken samples
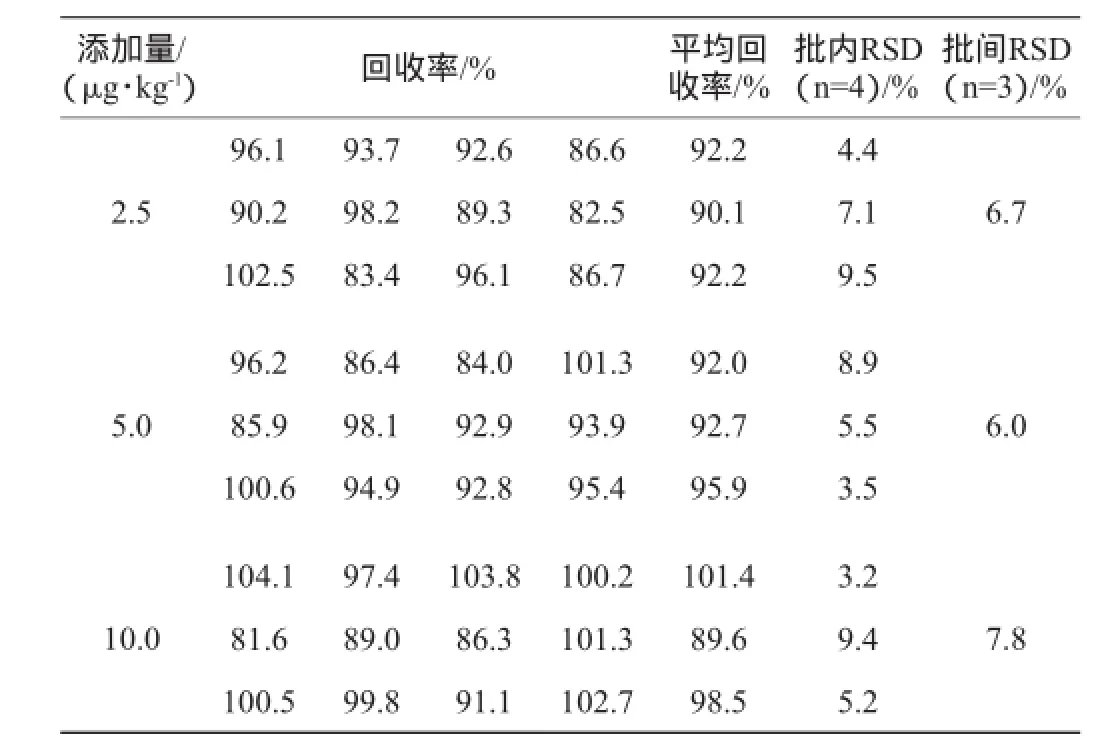
表5 猪肉样本精密度及准确度试验结果Table 5 Precision and accuracy tests results of pork samples
由表4可知,添加不同质量浓度利巴韦林的鸡肉样本,回收率范围是85.0%~99.3%,当添加量为2.5 μg/kg、5.0 μg/kg和10.0 μg/kg时,批内相对标准偏差(RSD)是5.7%~9.7%;批间相对标准偏差(RSD)为7.0%~9.6%。
由表5可知,添加不同质量浓度利巴韦林的猪肉样本,回收率范围是89.6%~101.4%,当添加量为2.5 μg/kg、5.0 μg/kg和10.0 μg/kg时,批内相对标准偏差(RSD)为3.2%~9.5%;批间相对标准偏差(RSD)是6.0%~7.8%。
2.5 稳定性试验
将试剂盒保存在4℃条件下,测定的试剂盒的最大吸光度值、IC50及回收率,结果见表6。由表6可知,测定的无添加利巴韦林试剂盒的最大百分吸光度值范围是1.51~1.92,IC50范围是6.7~8.3 μg/L,利巴韦林添加回收率范围是80.9%~103.3%,由此可见,各指标均在正常范围之内。从测定结果可知,该试剂盒在4℃条件下至少能够保存12个月。

表6 试剂盒在4℃保存的稳定性试验结果Table 6 Stability tests results of the kit kept at 4℃
2.6 讨论
2014年,陈燕等[16]对猪肉和鸡肉中的利巴韦林进行了测定,所用的方法是高效液相色谱-串联质谱法,检测限均为10 μg/kg。郑锌等[17-19]分别用超高效液相色谱-串联质谱法检测了鸡肉中的利巴韦林,检出限在1~4 μg/kg。目前检测畜禽肉中利巴韦林药物含量的方法集中在仪器方法,鲜有快速检测方法,本研究对鸡肉、猪肉的检测限分别为4.88 μg/kg、4.42 μg/kg,达到了和仪器检测利巴韦林相同水平的检测限数量级,而且快速检测方法在应用方面具有成本低、操作方便、快速等优势。
3 结论
本文通过制备利巴韦林半抗原、利巴韦林单克隆抗体,筛选出抗原包被浓度和单克隆抗体浓度,运用酶联免疫法研发出利巴韦林酶联免疫检测试剂盒,利巴韦林标准曲线范围为0~81 μg/L,对鸡肉、猪肉的检测限分别为4.88 μg/kg、4.42 μg/kg,回收率范围均在80%~105%,批内/批间相对标准偏差(RSD)均<10%。由于该试剂盒能够在4℃下保存12个月,表明该试剂盒稳定性较好[20]。
[1]强晓妍,朱监宝,徐敏,等.LC-MS/MS法测定大鼠血浆中利巴韦林及其毒代动力学参数[J].药学进展,2012,36(9):413-417.
[2]王维霞.LC-MS/MS对鸡肉中利巴韦林残留的分析[J].山东畜牧兽医,2013,34(7):8-9.
[3]魏秀丽,高迎春,杨林,等.超高效液相色谱-串联质谱法检测抗菌药物中非法添加利巴韦林的研究[J].中国家禽,2015,37(8):31-34.
[4]吴飞,丁黎.LC-MS法应用于利巴韦林颗粒剂的人体生物等效性研究[J].医学信息·中旬刊,2011(8):28-29.
[5]朱永林,邵德佳,蒋天梅,等.高效液相色谱-串联质谱法测定鸡肝中利巴韦林及其代谢物残留总量[J].中国兽药杂志,2008,42(7):22-25.
[6]刘凯,王丽娜,李建忠.饲料和鸡肉中利巴韦林的测定:超高效液相色谱-串联质谱法[J].现代畜牧兽医,2014(5):15-19.
[7]崔成富,陈创华,林海丹,等.中兽药散剂中非法添加利巴韦林的检测方法研究[J].中国兽药杂志,2011,45(9):32-35.
[8]邵琳智,姚仰勋,谢敏玲,等.亲水相互作用色谱-串联质谱法同时测定动物组织中金刚烷胺与利巴韦林[J].分析测试学报,2013,32(12):1448-1452.
[9]曲斌,朱志谦,陆桂萍,等.测定鸡肉中利巴韦林残留的固相萃取-UPLC-MS/MS法的研究[J].中国家禽,2013,35(15):37-40.
[10]刘小军,冯才伟,冯静,等.一种叶酸的酶联免疫快速检测试剂盒的研制[J].食品工业科技,2013,34(23):303-310.
[11]杨利国,胡少昶,魏平华,等.酶联免疫技术[M].江苏:南京大学出版社,1998:139-186.
[12]张欣,江鸿,赖增发.对药典中软胶囊崩解实验方法的讨论[J].海峡药学,2011,23(7):87-88.
[13]郑百芹,罗晓琴,冯才伟,等.一种喹诺酮类药物的酶联免疫快速检测试剂盒的研制[J].中国酿造,2014,33(2):130-133.
[14]冯仁丰.分析灵敏度(检测限)[J].上海医学检验杂志,2002,17(3):133-136.
[15]董李学,冯才伟,冯静,等.抗氧氟沙星单克隆抗体的制备及ELISA快速试剂盒的初步研制[J].中国畜牧兽医,2014,41(8):90-94.
[16]陈燕,李晓雯,刘畅,等.禽畜肉中利巴韦林残留量检测方法的研究[J].食品安全质量检测学报,2014,5(3):905-911.
[17]郑锌,汤晓艳,曹兴元,等.超高效液相色谱-串联质谱法检测蛋鸡体内抗病毒药物利巴韦林[J].食品科学,2016,37(4):197-201.
[18]白亚敏,杨小珊,毛庆,等.超高效液相色谱质谱法测定鸡肉中抗病毒类药物残留[J].食品工业科技,2014,35(24):76-78.
[19]云环,崔凤云,严华,等.超高效液相色谱-串联质谱法测定鸡肉中的利巴韦林和金刚烷胺[J].色谱,2013,31(8):724-728.
[20]唐伟国.医学检验诊断试剂的制备与应用[M].上海:上海科技文献出版社,1996:99.
Production of ribavirin monoclonal antibodies and its ELISA kit for rapid detection
CHEN Min1,CUI Haifeng2,3,FENG Caiwei2,3*,JIA Fangfang2,3,YANG Chunyan2,3
(1.COFCO Wuhan Meat Product Limited,Wuhan 430200,China; 2.Beijing Kwinbon Biotechnology Company,Beijing 102206,China; 3.Beijing Engineering Research Centre of Food Safety Immunodetection,Beijing 102206,China)
Synthesized ribavirin hapten was prepared from a sequence of reactions,and ribavirin monoclonal antibodies were prepared by animal immune.Enzyme linked immunosorbent assay(ELISA)kit was prepared which was used to test ribavirin in chicken and pork.Then the limit of detection and relative standard deviation(RSD)of ribavirin ELISA kit was studied.Results showed that the limit of detection was 4.88 μg/kg in chicken and 4.42 μg/kg in pork with half maximal inhibitory concentration(IC50)values of 7.9 μg/L.The recovery rates were between 80%-105%.The linear range of the standard curve was 0-81 μg/L,and the intra and inter-assay RSD were both less than 10%.The stability tests results revealed that the kit can be kept at 4℃for 12 months.
ribavirin;hapten preparation;ELISA
TS207.3
0254-5071(2016)11-0167-05
10.11882/j.issn.0254-5071.2016.11.035
2016-07-29
河北省科技计划项目(16275507D)
陈敏(1986-),女,助理工程师,本科,研究方向为食品检测。
*通讯作者:冯才伟(1978-),男,高级兽医师,硕士,研究方向为食品安全检测技术。

