可逆性后部白质脑病1例
赵彦沙, 王燕梅, 韩 虹*
(1山西医科大学儿科系儿科教研室,太原 030001; 2山西省儿童医院神经内科; *通讯作者,E-mail:991876618@qq.com)
可逆性后部白质脑病1例
赵彦沙1, 王燕梅2, 韩 虹2*
(1山西医科大学儿科系儿科教研室,太原 030001;2山西省儿童医院神经内科;*通讯作者,E-mail:991876618@qq.com)
可逆性后部白质脑病; 抽搐; 过敏性紫癜; 他克莫司
可逆性后部白质脑病(reversible posterior leukoencephalopathy syndrome,RPLS)是一种罕见的临床影像学综合征,1996 年由 Hinchey提出。国内对儿童发生RPLS的报道不多,为提高临床医师对该病的认识,现将我院收治的1例高度怀疑RPLS,经上级医院(北京儿童医院)复查完全恢复而确诊的病例做出报道。
1 病例报告
1.1 病例资料
患儿,男,7岁,因抽搐3 h于2016年7月11日16∶30入住我科。患儿于3 h前出现抽搐,表现为:双眼向右斜视,颜面、口周、四肢末端发绀,口吐白沫,四肢强直抖动,给予地西泮静点,共持续约3 h后缓解,病程中无视物不清、头痛、呕吐、昏迷、发热、皮疹等症状,大便正常,小便淡红色。入院查体:体重20 kg,体温37.2 ℃,血压97/61 mmHg,药眠状(地西泮),压眶有反应,心、肺、腹、神经系统查体未见异常。既往患儿43 d前因过敏性紫癜(混合型)于我院泌尿内科治疗7 d好转出院,约30 d前四肢再次出现皮疹,就诊于省中研所,给予静点甲泼尼龙(起始剂量40 mg,Qd)20多天,入院前2 d减量为甲泼尼龙(20 mg/d),加用他克莫司(1 mg/12 h)口服。入我院后的重要辅助检查:尿常规:葡萄糖(+),隐血(2+),蛋白质(3+)。血常规:白细胞计数20.51×109/L,中性粒细胞百分比88.2%,C反应蛋白81.63 mg/L。肝肾功、电解质、心肌酶基本正常。腹部彩超:双肾皮髓分界欠清稀。头颅CT示:颅内改变。脑脊液化验均正常;头颅MRI:双侧枕顶叶部分皮层及皮层下白质、左侧背侧丘脑异常信号,考虑为可逆性后部白质脑病(RPLS)?
1.2 诊疗经过
患儿以“抽搐待查”收治我科,入院诊断:癫痫?入院第3天出现发热,精神差,结合血象高,考虑颅内感染,完善相关检查。核磁结果(见图1)提示:可逆性后部白质脑病?结合脊液化验均正常,故更正诊断可逆性后部白质脑病,考虑RPLS所致的抽搐。入院以来给予营养神经、降颅压、抗感染等对症治疗8 d,因体温控制不理想,双下肢皮疹增多,家长签字离院上级医院诊治。出院时未复查头颅核磁,故出院诊断:可逆性后部白质脑病?过敏性紫癜(混合型),紫癜性肾炎,癫痫持续状态。半月后电话随访,核磁影像恢复正常,上级医院支持本院诊断。
2 讨论
RPLS是一组由多种原因引起,临床表现为头痛,恶心、眩晕、意识障碍,癫痫发作,精神异常等症状,核磁影像大多可逆性完全恢复的临床影像学综合征。其病因复杂多样,最常见的是高血压、妊高症、慢性肾衰竭、免疫抑制剂(环孢素、他可莫司等)、糖皮质激素等,随着报道的增多,很多病因被发现如:结缔组织病、过敏性紫癜、系统性红斑狼疮、丙种球蛋白冲击等。RPLS最常见的影像学异常是大脑半球后部白质水肿,特别是双侧顶枕叶,距状沟和旁中央枕叶结构通常不受累。随着对该病的探究,发现中脑、脑桥、小脑和延髓也有受损,也可累及额叶、基底节区、丘脑及脑室旁白质等部位,除了白质受损,可有灰质受损[1]。RPLS的发病机制是多方面的,目前仍存在争议,近年来主要有三种学说:①脑血管痉挛学说,②脑高灌注学说,③脑血管内皮损伤学说。不管哪种机制,最终引起血管内液体外渗,形成血管源性水肿[2]。
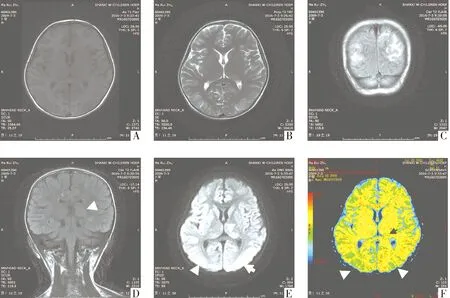
A.T1WI图:皮层及皮层下白质呈稍长T1信号;B.T2WI图:皮层及皮层下白质呈稍长T2信号, 左侧背侧丘脑可见斑片状稍长T2信号影;C.FLAIR图:皮层及皮层下白质呈高信号;D.FLAIR图:左侧背侧丘脑呈稍高信号;E.DWI图: 皮层及皮层下白质呈稍高信号,左侧背侧丘脑呈略高信号;F.ADC图: 皮层及皮层下白质呈等及稍高信号,左侧背侧丘脑呈等高信号图1 可逆性后部白质脑病患者头颅核磁影像
该患儿过敏性紫癜为基础病,入院时测血压正常,意识到RPLS后监测血压正常,结合病程中不存在高血压引起的神经系统症状,暂不考虑过敏性紫癜及紫癜性肾炎引起的高血压导致的RPLS。患儿外院应用激素20余天,发病前2 d激素减半,加用“他克莫司”。查阅国内相关文献,糖皮质激素引发RPLS目前已知的是冲击剂量[3],低剂量糖皮质激素联合免疫抑制剂是否会促进RPLS的发生未见报道,参考Ge等[4]的病例报道,考虑低剂量糖皮质激素联合免疫抑制剂促进RPLS的发生几率较小。故考虑本患儿RPLS为他克莫司所致。患儿发病急考虑与其对药物的敏感性高有关。目前国内外认为免疫抑制剂诱发RPLS的机制倾向于脑血管内皮损伤学说:①药物直接破坏内皮细胞或者抑制环前列腺素的释放来达到破坏细胞的完整性,而导致内皮细胞释放内皮素,导致大脑收缩或痉挛[5];②血管内皮功能损伤可导致血管反应性改变,导致血压升高,同时破坏了血管的完整性,通透性增加,引起血管源性水肿[6]。
RPLS原则是对症治疗,包括止惊、降压、利尿、改善循环、停用相关药物等。对于RPLS引起的癫痫,待影像学检查恢复后可停用抗癫痫药物,不需要长期维持[7]。RPLS一般预后良好,短期内可完全恢复,也有部分患者预后不良,Tajima等[8]认为:DWI高信号或脑干受累是预后不良的标志。
RPLS综合征后果严重,如果不及时治疗可能会致命,早期识别至关重要。该患儿入院当时未想到此病的原因有:①该病较为少见,儿童更是罕见,临床医师对此病的认识不足;②该患儿仅使用免疫抑制剂2 d就发病,发病时间很短;③患儿临床发病症状简单,仅以抽搐为唯一症状。因此在临床上对于应用免疫抑制剂的患者,出现突发抽搐、视力模糊、头痛等神经系统症状时,不论免疫抑制剂应用时间的长短,都需注意本病,尽快完善相关辅助检查,以免延误病情。
[1] Pereira PR,Pinho J,Rodrigues M,etal.Clinical,imagiological and etiological spectrum of posterior reversible encephalopathy syndrome[J].Arq Neuropsiquiatr,2015,73:36-40.
[2] 李红丽,李峰,马翔竑,等.可逆性后部白质脑病综合征研究进展[J].卒中与神经疾病,2013,20(1):53-55.
[3] 田培超,王怀立,陈国洪,等.糖皮质激素致儿童可逆性后部白质脑病综合征临床分析[J].中华实用儿科临床杂志,2014,29(20):1597-1598.
[4] Ge Yating,Liao Jinlan,Liang Wei,etal.Anti-glomerular basement membrane disease combined with igA nephropathy complicated with reversible posterior leukoencephalopathy syndrome:an unusual case[J].Am J Case Rep,2015,16:849-853.
[5] Zhang Pingping, Li Xiaofeng, Li Yating,etal.Reversible posterrior leukoencephalopathy syndrome secondary to systemic-onset juvenile idiopathic arthritis:A case report and review of the literature[J].Biomed Rep,2015,3(1):55-58.
[6] 杜大勇.可逆性后部白质脑病综合征的发病机制及研究进展[J].实用心脑肺血管病杂志,2014,(8):1-3.
[7] Banerjee AK.Posterior leukoencephalopathy syndrome[J].Postgrad Med J,2001,77(910):551-552.
[8] Tajima Y,Matsumoto A.Revesible posterior leukoencephalophy syndrome in p-ANCA-associated vasculitis[J].Inter Med,2006,45(20):1169-1171.
赵彦沙,女,1989-10生,在读硕士,E-mail:991876618@qq.com
2016-08-12
R742
B
1007-6611(2016)11-1049-03
10.13753/j.issn.1007-6611.2016.11.022

