RNA干扰沉默STC-1基因对结肠癌细胞株HCT116增殖的影响
訾永宏, 李小宝, 陈红梅
(1延安大学附属医院普外科,延安 716000;2延安职业技术学院医学系;*通讯作者,E-mail:ziyonghong2016@163.com)
RNA干扰沉默STC-1基因对结肠癌细胞株HCT116增殖的影响
訾永宏1*, 李小宝1, 陈红梅2
(1延安大学附属医院普外科,延安 716000;2延安职业技术学院医学系;*通讯作者,E-mail:ziyonghong2016@163.com)
目的 探讨RNA干扰技术沉默STC-1基因对结肠癌细胞株HCT116增殖的影响。 方法 将STC-1基因的si-RNA稳定转染至HCT116细胞;采用RT-PCR、Western blot鉴定干扰效果;以STC-1基因沉默细胞HCT116为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为阴性对照和空白对照组,采用四甲基偶氮唑蓝(MTT)法、细胞倍增时间、平板克隆形成实验、流式细胞术等分析沉默STC-1基因后,HCT116细胞生长速度、细胞周期、克隆形成能力等的改变。 结果 MTT实验结果表明,沉默STC-1基因后,实验组细胞的生长速度明显下降;其细胞周期也发生改变G1期细胞增多、S期细胞减少。空白对照组、阴性对照组和实验组细胞平均倍增时间为分别为(3.718±0.82)h,(3.981±0.918)h,(5.018±0.981)h;空白对照组,阴性对照组和实验组平均细胞克隆形成数目分别为65.68±4.826,71.28±4.662,45.95±4.432。实验组与对照组相比较,平均倍增时间和平均细胞克隆形成数目差异有统计学意义(P<0.05)。 结论 沉默 STC-1基因对结肠癌细胞HCT116的增殖具有重要的作用,这为进一步阐明结直肠癌发病机制奠定了坚实的基础。
RNA干扰; STC-1; 结肠癌; HCT116
斯钙素-1(stanniocalcin-1,STC-1)是一类先后在硬骨鱼、哺乳动物和人类中发现的糖蛋白激素,在调节钙、磷代谢,促进脑神经元的终末分化以及骨和肌肉的发育等方面都有重要作用[1,2]。近来研究发现,STC-1在人类肿瘤的发生发展过程中也起着十分重要的作用[3]。越来越多的研究表明,STC-1在结肠癌组织中的表达明显高于癌旁组织[4,5]。本实验前期也发现STC-1在结肠癌细胞株HCT116中高表达,但其对结肠癌发生过程中的作用目前还不十分清楚。因此,本实验拟进一步探讨STC-1对结肠癌细胞株HCT-116生物学表型的影响。
1 材料与方法
1.1 主要试剂与仪器
HCT116细胞由中南大学细胞中心保存,RPMI-1640培养基购自Gibico公司(美国),新生小牛血清购自Biology Industries公司(以色列),胰蛋白酶购自研科生物试剂公司,pGCsi/U6/GFP/si-STC-1购自上海吉凯基因有限公司,转染试剂Lipofectamine 2000 Reagent购自上海英维捷基贸易有限公司,MTT、G418、DMSO购自鼎国生物技术有限公司,细胞培养板购自Corning公司(美国),Giemsa染料、碘化丙啶(PI)购自Sigma公司(美国)。离心机( 湖南长沙平凡离心机厂,中国),酶标仪(Bio-TK公司产品,美国),细胞培养箱(Thermor公司产品,美国),显微镜(Olympus公司产品,日本)。
1.2 pGC/U6/GFP/si-STC-1重组载体构建
从基因Bank中提取STC-1基因 (序列号:NM_003155),设计3条STC-1的干扰序列:①5′-TTAGTCCAGGAAGCAATAGTA-3′;②5′-TAGATTGCTGCAAATTTCATG-3′;③5′-ACAAGGTAGTCAGCCAAGCAC-3′,由上海吉凯基因公司设计、合成干扰片段并定向克隆入pGCsi/U6/GFP载体,并以空载体pGCsi/U6/GFP(Mock)为对照。
1.3 细胞转染
将待转染细胞HCT116用培养基稀释至1×105cells/ml,接种于24孔板,培养过夜;待其密度至80%左右,将2 μl脂质体2000加入48 μl无血清RPMI 1640培养基中轻轻混匀,37 ℃孵育5 min,分别加入1 μg重组质粒pGC/U6/GFP/si-STC-1和1 μg对照质粒pGC/U6/GFP(Mock)至49 μl RPMI-1640无血清培养基中轻轻混匀,室温孵育5 min;将上述两种混合液,轻轻混匀,温箱中至少孵育20 min;D-Hank’s液洗1次,加入2 ml无抗生素的完全RPMI 1640培养基,再加入含有重组质粒的混合溶液,轻轻混匀,置于37 ℃培养箱中培养4-6 h;弃上清并换新鲜的RPMI 1640完全培养基37 ℃培养24-48 h,弃上清并传代,加入含400 μg/ml G418的培养基筛选阳性克隆。
1.4 RT-PCR鉴定干扰效果
总RNA抽提及RT-PCR按产品说明书进行。逆转录按FERMENTAS公司的试剂盒说明书操作。逆转录条件:42 ℃ 60 min,70 ℃ 10 min,反应终止后冰上冷却,-20 ℃保存。PCR条件:95 ℃ 1 min预变性;95 ℃ 30 s,60 ℃ 30 s,68 ℃ 90 s,循环30次;68 ℃延伸10 min。扩增产物用溴乙淀染色,1%琼脂糖凝胶电泳鉴定。其中人STC-1引物为:sense 5′-TTCTGGTGCTGGTGATCAGTG-3′,antisense 5′-TTTGGGCACAGTGGTCTGTCT-3′,产物大小为594 bp。GAPDH sense 5′- AATCCCATCACCATCTTCCA-3′,antisense 5′-CCTGCTTCACCACCTTCT TG -3′,产物大小为580 bp。
1.5 Western blot鉴定干扰效果
细胞蛋白质抽提按产品说明书进行。聚丙烯酰胺凝胶电泳(SDS-PAGE)分离胶浓度为10%、浓缩胶浓度为5%;上样时各取50 μg蛋白样品,加入5%的巯基乙醇,100 ℃变性5 min;电泳开始为恒压60 V,当样品进入分离胶后,把电压提高到100 V,电泳至溴酚兰刚跑到玻璃边缘时终止电泳,转膜。转膜完成后,将转印后的NC膜置含5%的脱脂奶粉的封闭液中,4 ℃封闭过夜。封闭后的NC膜经PBST洗板3次,每次5 min,加入含1∶400的鼠抗人STC-1的一抗,于摇床上室温反应2 h,将膜取出PBST洗3次, 每次5 min,加1∶3 000稀释的兔抗鼠IgG-HRP酶标二抗,于摇床上室温下避光反应1 h;PBST洗板3次,每次 5 min,暗室曝光、显影、定影,最后将其曝光结果扫描。
1.6 MTT法测定细胞生长曲线
以STC-1基因沉默组的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均按5×103/孔接种于96孔培养板,加高糖DMEM培养液(含20%小牛血清,无抗生素),置37 ℃、5% CO2,培养24 h贴壁后,每孔再加入MTT至终浓度为5 g/L,继续培养4 h,弃培养液,加入DMSO 200 μl,待蓝紫色结晶颗粒充分溶解后于490 nm处测OD值,每组设6个复孔,实验连续6 d,实验重复3次。然后以OD值为纵轴,时间为横轴绘制细胞生长曲线,比较实验组与对照组细胞的生长速度。
1.7 细胞倍增时间测定
以STC-1基因沉默的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均取对数生长期细胞消化后重悬并台盼蓝染色计数活细胞,按103/孔接种于24孔板,培养24 h,用胰酶消化并进行细胞计数,每组均设4个平行孔,实验连续5 d,实验重复3次。计算每组细胞的平均倍增时间。倍增时间公式如下:TD=t[lg2/(lgNt-lgN0)](TD为细胞倍增时间;t为培养时间;N0,Nt分别代表接种后及培养t小时后的细胞数)。
1.8 平板克隆形成能力测定
以STC-1基因沉默的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为阴性对照和空白对照组。取对数生长期细胞,胰酶消化后用含10%小牛血清的DMEM培养基重悬并用台盼染色计数活细胞,接种6孔细胞培养板,每孔加入100个细胞, 置37 ℃、5% CO2培养2-3周;弃上清液,PBS洗板2次,甲醇固定15 min;加Giemsa染色15 min,然后用水缓慢洗去染色液,空气干燥;显微镜下计数克隆数,细胞数大于50个的计数为1个克隆数。每个浓度组细胞均设3个平行样,每个实验重复3次,计算平均克隆形成数。
1.9 细胞周期的测定
以STC-1基因沉默的HCT116细胞为实验组,以转染空质粒的HCT116细胞和空白的HCT116细胞为对照组,每组细胞均取对数生长期细胞5×103接种于培养瓶,待贴壁后,用无血清培养基洗涤2次,再用无血清培养基继续培养24 h,用胰酶消化,离心收集细胞,PBS洗2次,PI染色30 min。300目尼龙网过滤后,上流式细胞仪分析,并按以下公式计算其增殖指数(proliferative index,PI):PI=(G2M+S)/(G0/1+S+G2M)×100%。
1.10 统计学分析

2 结果
2.1 HCT116/si-STC-1、HCT116/si-M细胞系的构建
分别将重组质粒HCT116/pGC/U6/GFP/si-STC-1-①、HCT116/pGC/U6/GFP/si-STC-1-②、HCT116/pGC/U6/GFP/si-STC-1-③和对照质粒pGC/U6/GFP用脂质体转染HCT116细胞,经400 μg/ml G418筛选约2周,挑单克隆扩大培养(见图1A,B),采用RT-PCR分别检测HCT116,HCT116/pGC/U6/GFP/si-STC-1-①、HCT116/pGC/U6/GFP/si-STC-1-②、HCT116/pGC/U6/GFP/si-STC-1-③和HCT116/pGC/U6/GFP细胞中的STC-1 mRNA表达水平,结果显示,在HCT116/pGC/U6/GFP/si-STC-1-①细胞中未检测到STC-1 mRNA的表达,而在HCT116、HCT116/pGC/U6/GFP/si-STC-1-②、HCT116/pGC/U6/GFP/si-STC-1-③和HCT116/pGC/U6/GFP细胞的STC-1 mRNA水平变化不明显,分别将HCT116/pGC/U6/GFP/si-STC-1-①和HCT116/pGC/U6/GFP细胞系命名为HCT116/si-STC-1和HCT116/si-M(见图1C)。进一步采用Western blot实验分别检测HCT116,HCT116/si-STC-1和HCT116/si-M细胞中STC-1蛋白的表达水平,结果显示,HCT116/si-STC-1细胞中未检测到STC-1蛋白的表达(见图1D),这一结果与RT-PCR检测结果相一致。这说明成功建立沉默STC-1的细胞系,可用于后续实验。
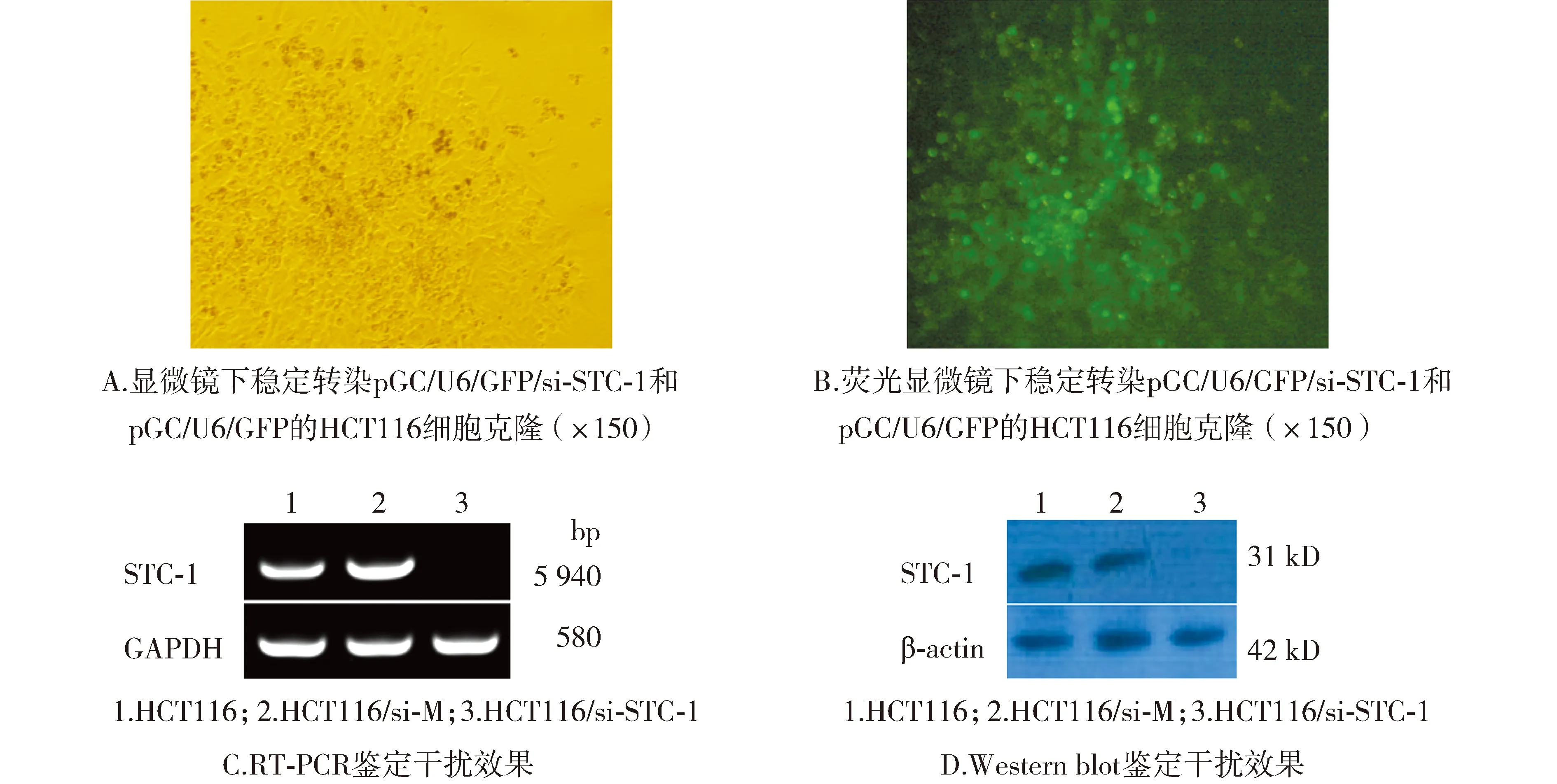
图1 稳定转染pGC/U6/GFP/si-STC-1和pGC/U6/GFP的实验结果Figure 1 Results of cells with stable transfection pGC/U6/GFP/si-STC-1and pGC/U6/GFP
2.2 细胞生长曲线
以STC-1基因沉默的HCT116细胞(HCT116/si-STC-1)为实验组,以转染空质粒的HCT116细胞(HCT116/si-M)和空白的HCT116细胞为对照组,用MTT实验检测其生长速度。结果表明,与对照组相比,实验组细胞HCT116/si-STC-1的生长速度明显下降(见图2)。
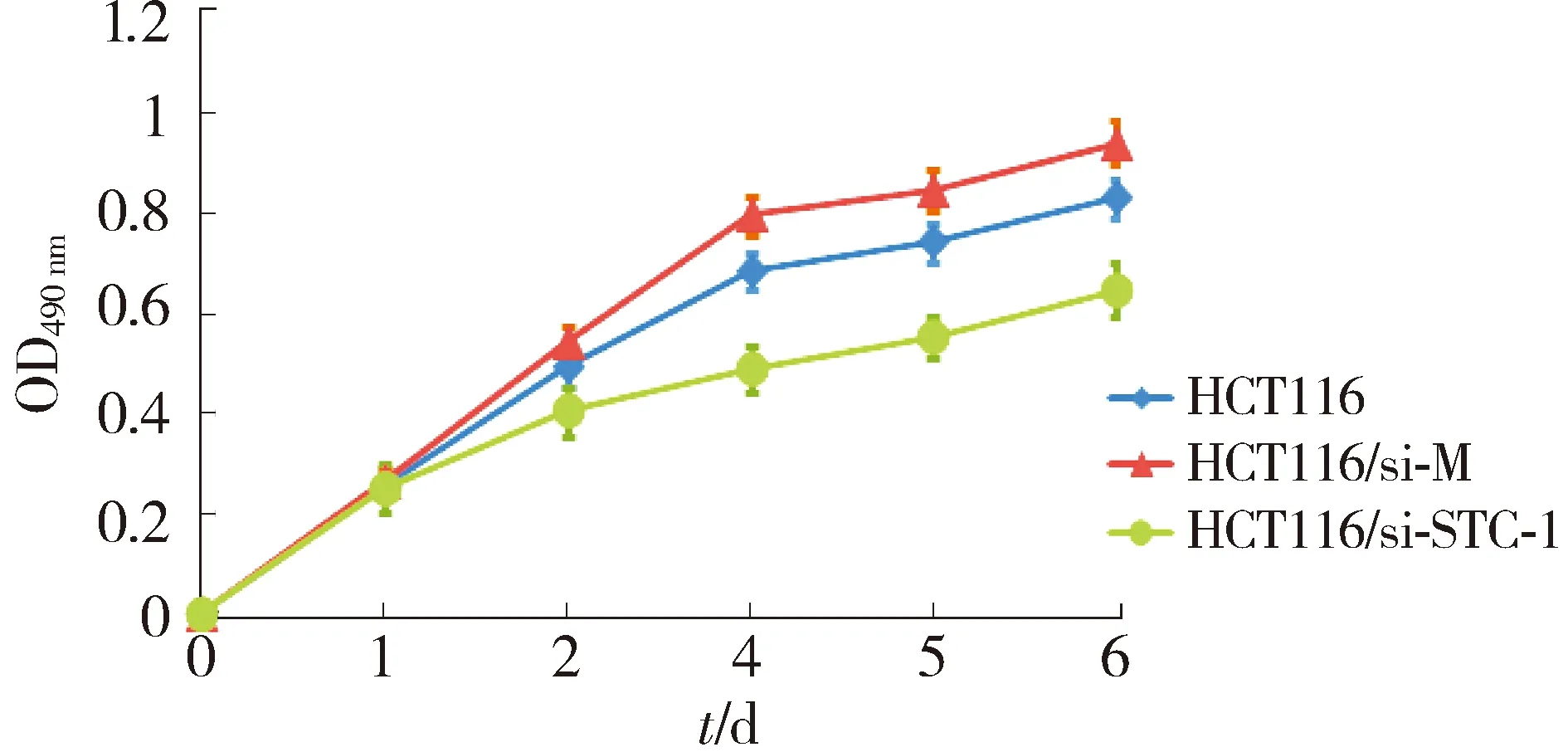
图2 MTT法检测STC-1沉默组细胞和对照组细胞的生长曲线Figure 2 Cell proliferation curve of HCT116 cells with or without STC-1 knockdown detected by MTT assay
2.3 细胞倍增时间
以STC-1基因沉默的HCT116细胞(HCT116/si-STC-1)为实验组,以转染空质粒的HCT116细胞(HCT116/si-M)和空白的HCT116细胞为对照组,检测其生长速度。结果发现,HCT116、HCT116/si-M、HCT116/si-STC-1细胞平均倍增时间为分别为(3.718±0.82)h、(3.981±0.918)h、(5.018±0.981) h。与对照组细胞相比,沉默STC-1基因后,实验组细胞平均倍增时间明显延长,差异有统计学意义(P<0.05,见图3)。
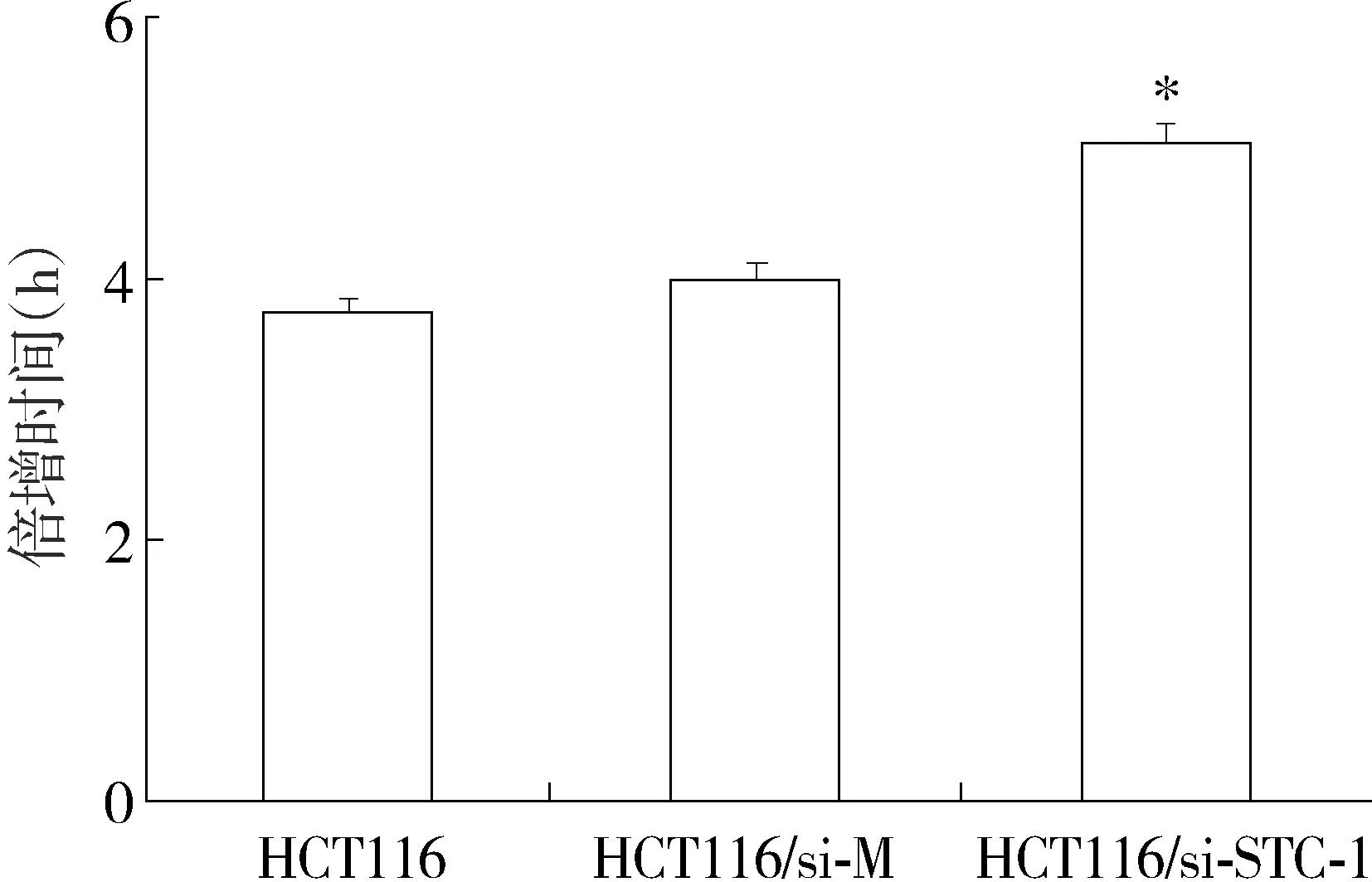
与其他两组比较,*P<0.05图3 沉默STC-1基因后HCT116细胞的平均倍增时间 Figure 3 The cells double time of HCT116 with or without STC-1 knockdown
2.4 克隆形成能力
以STC-1基因沉默的HCT116细胞(HCT116/si-STC-1)为实验组,以转染空质粒的HCT116细胞(HCT116/si-M)和空白的HCT116细胞为对照组,用平板克隆形成检测其克隆形成能力。结果显示:HCT116、HCT116/si-M、HCT116/si-STC-1细胞克隆形成数目分别为65.68±4.826,71.28±4.662,45.95±4.432。与对照组细胞相比,沉默STC-1基因后,实验组HCT116细胞的克隆形成能力明显减弱,差异有统计学意义(P<0.05,见图4)。
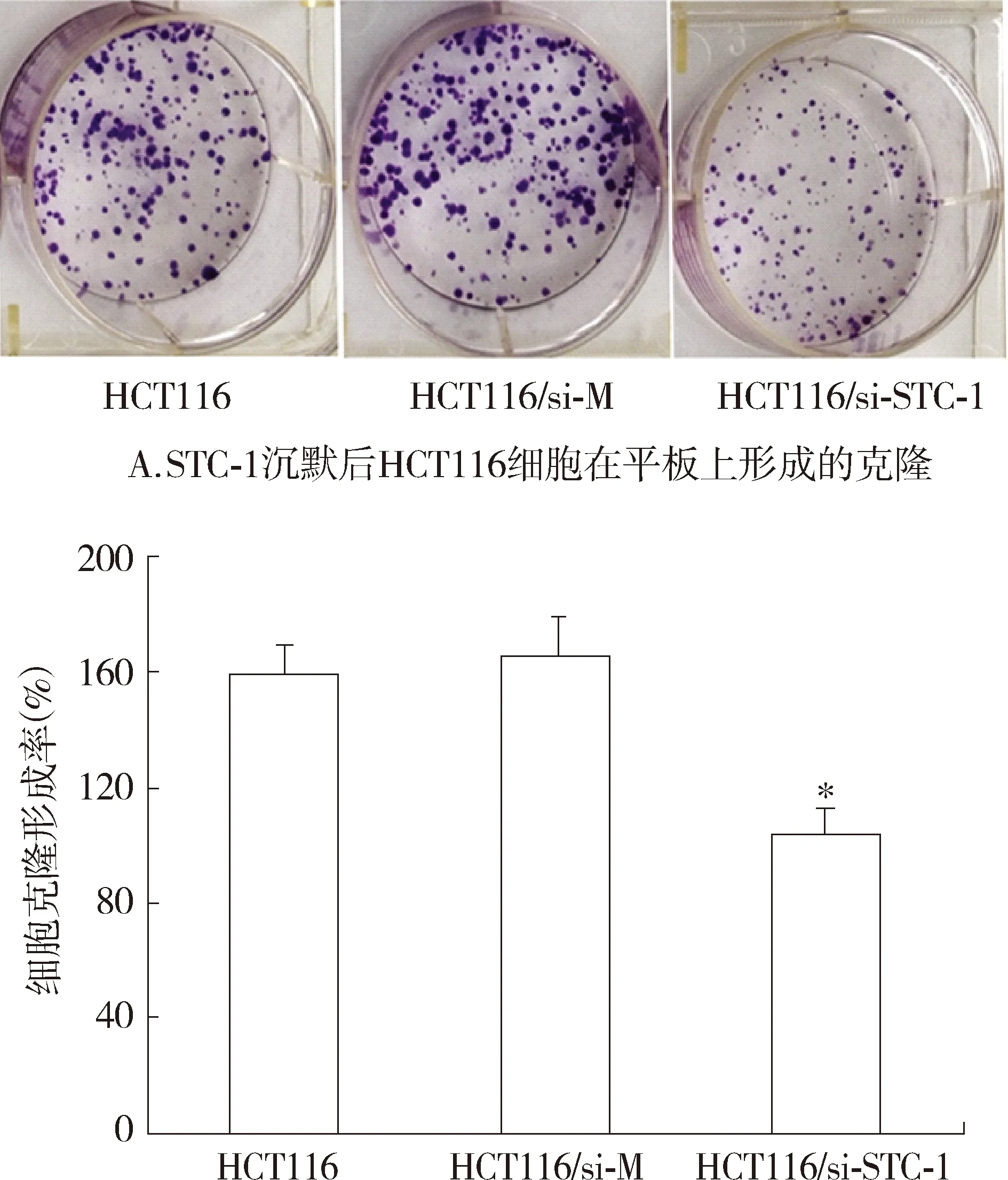
与其他两组比较,*P<0.05 B.STC-1沉默后HCT116细胞的克隆形成率 图4 平板克隆形成实验结果 Figure 4 Results of colony formation of HCT116 Cells
2.5 细胞周期的分布
以STC-1基因沉默的HCT116细胞(HCT116/si-STC-1)为实验组,以转染空质粒的HCT116细胞(HCT116/si-M)和空白的HCT116细胞为对照组,用流式细胞仪检测其细胞周期的分布。结果表明,实验组HCT116/si-STC-1细胞与对照组细胞HCT116、HCT116/si-M相比,实验组细胞HCT116/si-STC-1 G1期细胞增多,S期细胞减少(见图5),其结果与细胞生长曲线,平板克隆形成实验结果趋势相一致。
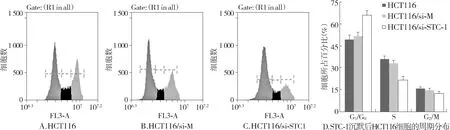
图5 STC-1基因沉默后HCT116细胞周期检测Figure 5 Cells cycle of HCT116 with or without STC-1 knockdown
3 讨论
STC-1是一种糖蛋白激素,以旁分泌或自分泌方式参与机体的多种生理功能。人类STC-1基因位于染色体8(8p11.2-p21的)的短臂,STC-1的cDNA 编码一个含247个氨基酸的蛋白质。近来研究发现,STC-1与肿瘤的关系密切,STC-1不同程度地过表达于肺癌[6]、肝癌[7]和甲状腺癌[8]等多种肿瘤组织,并参与胃癌[9]、乳腺癌[10]及肾癌[11]的发生、发展。但目前国内外有关STC-1与结肠癌的关系的研究报道很少。
STC-1在结肠癌组织中存在过表达[4,5],在结肠癌细胞株HCT116中高表达,本研究利用RNA干扰(RNA interference,RNAi)特异地抑制结肠癌细胞HTC116中STC-1基因的表达后,MTT、细胞倍增时间、平板克隆形成实验、流式细胞术实验显示对STC-1的抑制显著地抑制了结肠癌细胞HTC116的增殖,因此STC-1可能在结肠癌发生发展中扮演着重要角色。STC-1介导肿瘤细胞增殖的作用机制尚不明确。STC-1 在多种肿瘤中可能通过不同途径参与肿瘤形成。Yeung等[12]研究发现STC-1具有诱导肿瘤适应低氧环境的作用,其中内源性缺氧诱导因子(HIF)-1是关键因子。STC-1 在肾癌细胞中促进肿瘤增殖,其机制可能是HIF-1 调控STC-1 的表达,促进肿瘤生长[13]。Murai等[10]研究显示,在乳腺癌中,STC-1促进肿瘤细胞增殖、侵袭及转移是通过活化PI3K途径来发挥作用。关于STC-1在结肠癌中作用机制的研究是我们下一步研究的目标。
综上所述,干扰STC-1 基因表达可明显地引起细胞周期阻滞,继而导致细胞增殖能力和恶性程度的降低,提示STC-1 在结肠癌的发生发展中起着重要的作用,为以STC-1为靶点的结肠癌的诊断及治疗提供理论依据及靶向策略。
[1] Ohkouchi S,Ono M,Kobayashi M,etal.Myriad functions of stanniocalcin-1(STC1) cover multiple therapeutic targets in the complicated pathogenesis of idiopathic pulmonary fibrosis(IPF)[J].Clin Med Insights Circ Respir Pulm Med,2015,9(Suppl 1):91-96.
[2] Filvaroff EH,Guillet S,Zlot C,etal.Stanniocalcin 1 alter smuscle and bone structure and function in transgenic mice[J].Endocrinology,2002,143(9):3681-3690.
[3] Chang AC,Doherty J,Huschtscha LI,etal.STC1 expression is associated with tumor growth and metastasis in breast cancer[J].Clin Exp Metastasis,2015,32(1):15-27.
[4] Gerritsen ME,Soriano R,Yang S,etal.In silico data filtering to identify new angiogenesis targets from a largeinvitrogene profiling data set[J].Physiol Genomics,2002,10(1):13-20.
[5] Rezapour S,Bahrami T,Hashemzadeh S,etal.STC1 and NF-κB p65(Rel A) is constitutively activated in colorectal cancer[J].Clin Lab,2016,62(3):463-469.
[6] Du YZ,Gu XH,Cheng SF,etal.The oncogenetic role of stanniocalcin 1 in lung adenocarcinoma:a promising serum candidate biomarker for tracking lung adenocarcinoma progression[J].Tumour Biol,2016,37(4):5633-5644.
[7] Yeung BH,Shek FH,Lee NP,etal.Stanniocalcin-1 reduces tumor size in human hepatocellular carcinoma[J].PLoS One,2015,10(10):e0139977.
[8] Dai D,Wang Q,Li X,etal.Klotho inhibits human follicular thyroid cancer cell growth and promotes apoptosis through regulation of the expression of stanniocalcin-1[J].Oncol Rep,2016,35(1):552-558.
[9] Fang Z,Tian Z,Luo K,etal.Clinical significance of stanniocalcin expression in tissue and serum of gastric cancer patients[J].Chin J Cancer Res,2014,26(5):602-610.
[10] Murai R,Tanaka M,Takahashi Y,etal.Stanniocalcin-1 promotes metastasis in a human breast cancer cell line through activation of PI3K[J].Clin Exp Metastasis,2014,31(7):787-794.
[11] 朱致晖,谷江,张永春,等.斯钙素蛋白1下调钙离子及缺氧诱导因子1α水平调控肾癌细胞抗缺氧增殖平衡[J].浙江大学学报(医学版),2014,43(5):528-534.
[12] Yeung HY,Lai KP,Chan HY,etal.Hypoxia-inducible factor-1-mediated activation of stanniocalcin-1 in human cancer cells[J].Endocrinology,2005,146(11):4951-4960.
[13] Ma X,Gu L,Li H,etal.Hypoxia-induced overexpression of stanniocalcin-1 is associated with the metastasis of early stage clear cell renal cell carcinoma[J].J Transl Med,2015,13:56.
Effect of RNA interference-mediated STC-1 silencing on proliferation of colon cancer cell line HCT116
ZI Yonghong1*, LI Xiaobao1, CHEN Hongmei2
(1DepartmentofGeneralSurgery,AffiliatedHospitalofYan’anUniversity,Yan’an716000,China;2DepartmentofMedicine,Yan’anVocationalandTechnicalCollege;*Correspondingauthor,E-mail:ziyonghong2016@163.com)
ObjectiveTo investigate the effects of RNA interference-mediated STC-1 gene silencing on the proliferation of colon cancer cell line HCT116.MethodsColon cancer cell line HCT116 was transfected by STC-1 small interfering RNA(siRNA), and the expression of STC-1 was determined by RT-PCR and Western blot. HCT116 cells with STC-1 knockdown were chosen as experimental group, and HCT116 cells transfected with empty plasmid and blank HCT116 cells were chosen as negative and blank control groups. Then the proliferation of HCT116 was examined by MTT assay, the cell doubling time of HCT116 was examined by doubling time assay, the colony formation ability of HCT116 was examined by colony formation assay, and the cell cycle of HCT116 was examined by flow cytometry.ResultsCompared with control groups,the growth ability in experimental group was significantly decreased and G1phase cells increased and S phase cells decreased. The doubling time was(3.718±0.82)h,(3.981±0.918)h, (5.018±0.981)h in blank control group, negative control group and experimental group, respectively.The colony numbers were 65.68±4.826, 71.28±4.662, 45.95±4.432 in blank control group, negative control group and experimental group,respectively. The doubling time and colony numbers were significantly different between control groups and experimental group(P<0.05).ConclusionSTC-1 gene may play an important role in proliferation of colon cancer cell line HCT116,which lay a solid foundation for further study of the pathogenesis of colorectal cancer.Key words: RNA interference; STC-1; colon cancer; HCT116
陕西省教育厅科研计划基金资助项目(12JK0765)
訾永宏,男,1979-02生,本科,主治医师,E-mail:ziyonghong2016@163.com
2016-06-23
R735.35
A
1007-6611(2016)11-0973-05
10.13753/j.issn.1007-6611.2016.11.003

