HPLC法测定抗601合剂中(R,S)-告依春含量
朱 颖, 朱兴平
(1南京市食品药品监督检验院药品所, 南京 210038; 2凉山州第一人民医院马道分院急诊科; *通讯作者,E-mail:1012309328@qq.com)
HPLC法测定抗601合剂中(R,S)-告依春含量
朱 颖1, 朱兴平2*
(1南京市食品药品监督检验院药品所, 南京 210038;2凉山州第一人民医院马道分院急诊科;*通讯作者,E-mail:1012309328@qq.com)
目的 建立测定抗601合剂中(R,S)-告依春含量的HPLC法。 方法 选择甲醇-0.02%磷酸水溶液系统,采用梯度洗脱的办法;检测波长245 nm;色谱柱:Agilent Eclipse Plus-C18(250 mm×4.6 mm,5 μm),柱温35 ℃,流速1.0 ml/min。 结果 制剂中其他组分与主峰能完全分离,不干扰测定;(R,S)-告依春在1.056-21.12 μg/ml范围内与HPLC峰面积呈良好线性关系(r=0.999 8);平均加样回收率为99.78%,RSD%为0.8%(n=9)。 结论 HPLC法测定抗601合剂中(R,S)-告依春含量简便、准确。
高效液相色谱; 抗601合剂; (R,S)-告依春
抗601 合剂(Kang601 mixture)为南京市儿童医院自制中药复方制剂,由金银花、黄芩、大黄、黄柏、板蓝根五味药组成, 具有清热解毒, 抗病毒作用, 用于病毒性肺炎、感冒、急性支气管炎、扁桃腺炎、腮腺炎[1]等,具有很好的临床应用价值。目前该制剂质量标准尚无“含量测定”项,该院研究人员已经报道采用高效液相色谱法(high performance liquid chromatography,HPLC)测定其中黄芩苷[1]、绿原酸[2,3]的研究。板蓝根在方中担当清热解毒和抗病毒作用。2015年版《中国药典》通过HPLC法测定板蓝根中(R,S)-告依春的含量对其进行质量控制[4]。本文采用HPLC法测定抗601合剂中的(R,S)-告依春含量,为该制剂的质量评价增加了有效、可行的方法。
1 仪器药品
1.1 仪器
高效液相色谱仪(Shimadu-20A),METTLER TOLED X205DU分析天平(0.1 mg)。
1.2 药品与试药
抗601合剂(南京市儿童医院自制,批号:150704,150901,151002),(R,S)-告依春对照品(中国食品药品检定研究院,批号:111753-201304,含量99.9%,使用前无需干燥。甲醇为色谱纯,水为超纯水,磷酸为分析纯。
2 方法与结果
2.1 对照品溶液的配制
精密称取(R,S)-告依春对照品适量, 精密称定, 加水溶解并稀释制成每1 ml 含105.6 μg的溶液, 即得。
2.2 供试品溶液的制备
精密量取抗601合剂1 ml置10 ml量瓶中,加水稀释至刻度,摇匀,用前以0.22 μm微孔滤膜滤过,取续滤液即得。
2.3 色谱条件
采用Agilent Eclipse Plus-C18(250 mm×4.6 mm,5 μm),柱温35 ℃,流速1.0 ml/min,检测波长245 nm。经预试验,选择与2015年版《中国药典》[4]一致的甲醇-磷酸-水系统,并在主峰出峰后,加大有机相比例,将其余杂质洗脱下来,避免存于色谱柱中,影响下一份样品。梯度洗脱系统见表1。在此色谱条件下,(R,S)-告依春与其他组分完全分离,未见明显干扰,对照品和供试品色谱图见图1。对照品光谱图和供试品溶液主峰光谱图一致(见图2)。
表1 流动相梯度系统
Table 1 Gradient system of mobile phase
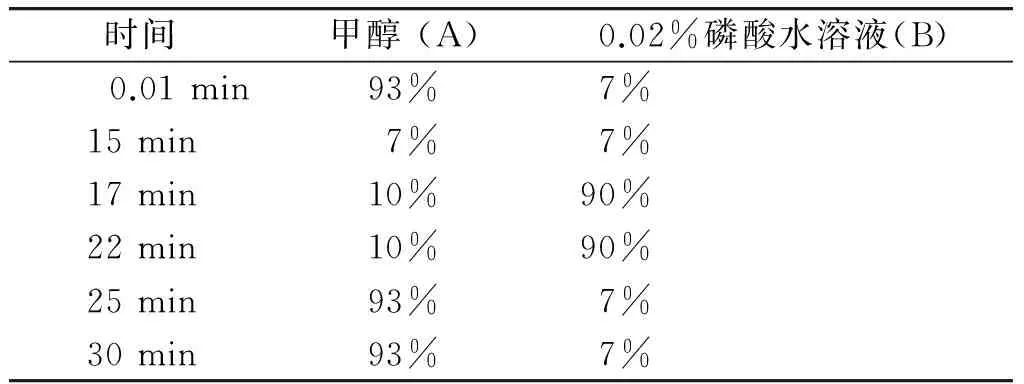
时间甲醇(A)0.02%磷酸水溶液(B) 0.01min93%7%15min7%7%17min10%90%22min10%90%25min93%7%30min93%7%
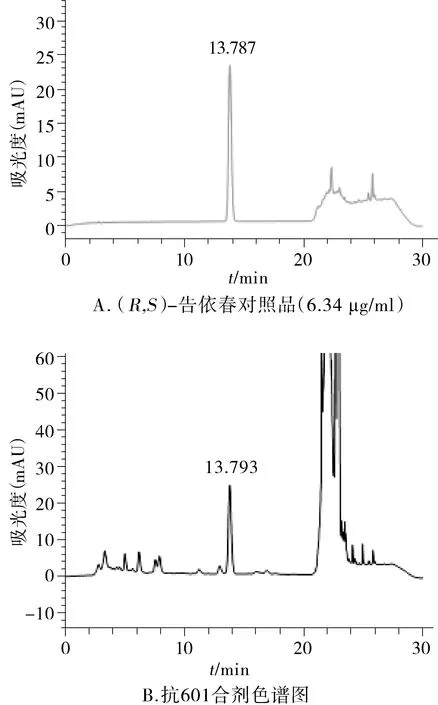
图1 (R,S)-告依春对照品和抗601合剂色谱图Figure 1 The chromatogram of(R,S)-goitrin reference substance and Kang 601 mixture
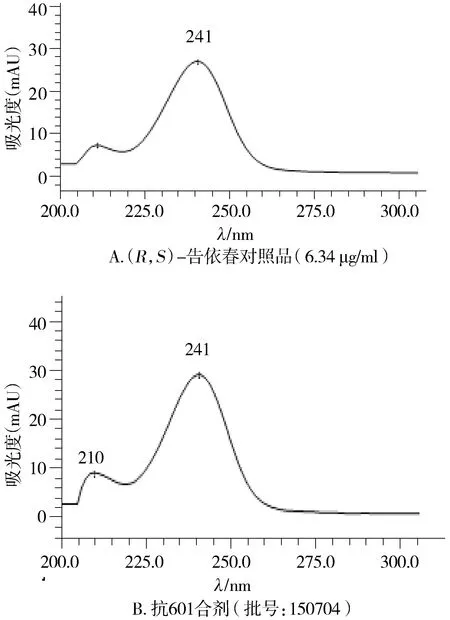
图2 (R,S)-告依春对照品和抗601合剂主峰光谱图(6.34 μg/ml)Figure 2 The spectrogram of(R,S)-goitrin reference substance(6.34 μg/ml)and main peak in Kang 601 mixture
2.4 标准曲线
精密吸取对照品溶液1,3,3,2,3,5 ml,分别置100,100,50,20,10,25 ml量瓶中,加水稀释至刻度,摇匀,得浓度分别为1.06,3.17,6.34,10.56,15.84,21.12 μg/ml的对照品溶液,分别进样10 μl,以峰面积对对照品浓度绘制曲线,回归方程为y=63 783x-314.5(r=0.999 8)。在浓度为1.06-21.12 μg/ml范围内,峰面积与浓度呈良好线性关系(见图3)。
2.5 精密度考察
取对照品溶液(6.34 μg/ml),进样10 μl,重复6次,记录(R,S)-告依春峰面积,计算峰面积RSD为0.07%,精密度良好。
2.6 重复性考察
平行制备6份供试品溶液(批号:150704),分别进样10 μl,记录主峰面积,计算平均含量为66.79 μg/ml,RSD%为0.8 %。试验表明,重复性良好。
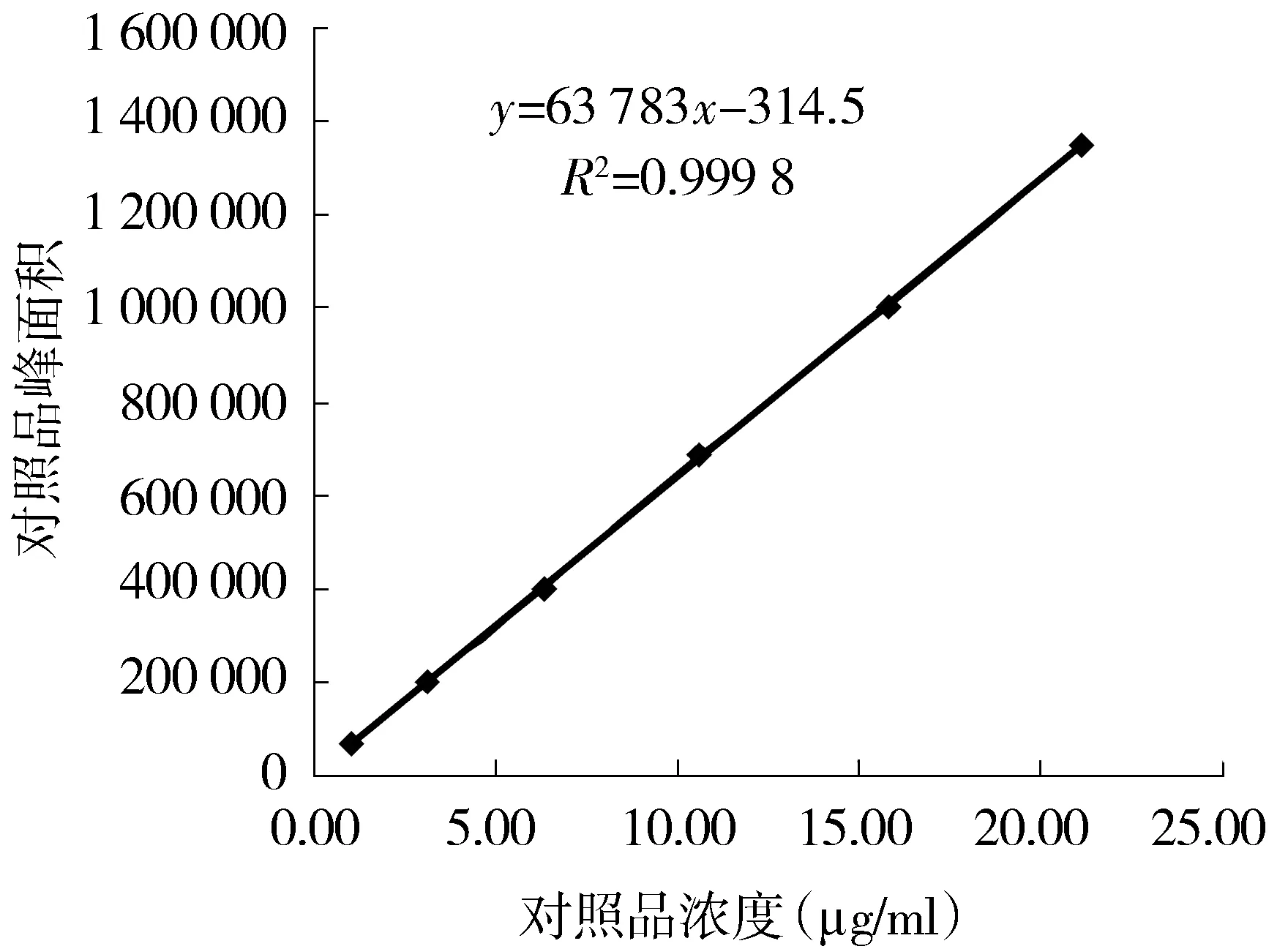
图3 (R,S)-告依春标准曲线Figure 3 The calibration curve of (R,S)-goitrin
2.7 稳定性考察
取供试品溶液一份(批号:150704),分别于0,2,4,8,12,24 h进样10 μl,记录主峰面积,计算峰面积RSD为0.25%,精密度佳。
2.8 准确度考察
精密吸取9份已知含量的抗601合剂(批号:150704)1.0 ml,置20 ml量瓶中,将一定量(R,S)-告依春对照品溶液分别加入9份供试品中, 分别加水稀释至刻度,摇匀,以0.22 μm微孔滤膜滤过,依法用HPLC测定,记录峰面积,计算加样回收率。结果表明,本法准确度较好(见表2)。
表2 抗601合剂中(R,S)-告依春加样回收率测定结果
Table 2 Results of recovery tests of(R,S)-goitrin in Kang 601 mixture
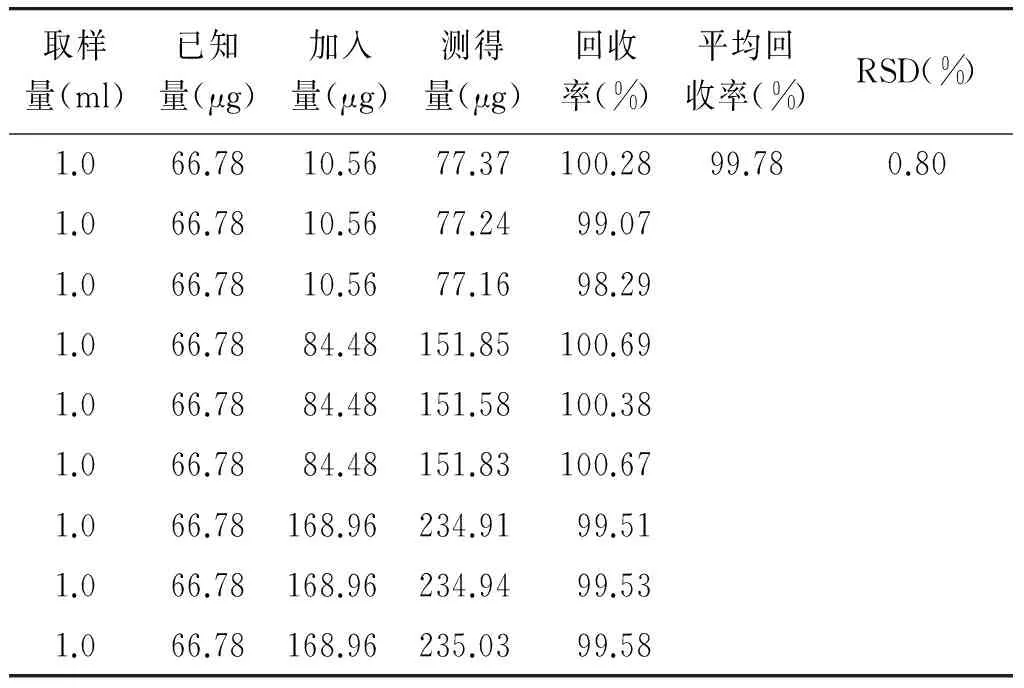
取样量(ml)已知量(μg)加入量(μg)测得量(μg)回收率(%)平均回收率(%)RSD(%)1.066.7810.5677.37100.2899.780.801.066.7810.5677.2499.071.066.7810.5677.1698.291.066.7884.48151.85100.691.066.7884.48151.58100.381.066.7884.48151.83100.671.066.78168.96234.9199.511.066.78168.96234.9499.531.066.78168.96235.0399.58
2.9 样品含量测定
取供试品3批次,依2.2项下方法制备供试品溶液,依法测定,每批次样品平行测定3份,分别计算含量。结果见表3。
表3 抗601合剂中(R,S)-告依春的含量测定 (μg/ml)
Table 3 The contents of(R,S)-goitrin in Kang 601 mixture (μg/ml)
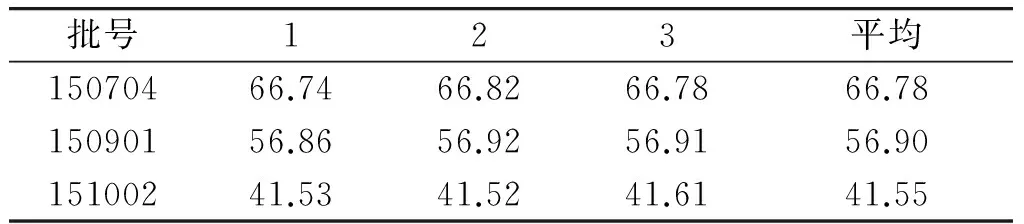
批号123平均15070466.7466.8266.7866.7815090156.8656.9256.9156.9015100241.5341.5241.6141.55
3 讨论
抗601合剂处方中含板蓝根,(R,S)-告依春(C5H7NOS)为板蓝根的主要抗病毒有效成分之一[5]。本文选择测定抗601合剂中(R,S)-告依春含量对该制剂质量评价进行补充和完善。(R,S)-告依春水溶性较好,无需再用有机溶剂进行提取,但为降低样品中其他成分对色谱柱的污染,将样品进行稀释[6]。试验中考察了稀释25倍和10倍,稀释倍数为25倍时,(R,S)-告依春峰面积过小不利于计算,因此选择稀释10倍。为避免误判,HPLC采用PDA检测器,分别采集对照品和样品供试液色谱图中与对照品保留时间一致的色谱峰在200-300 nm紫外吸收光谱,经比对,二者光谱一致,样品供试液中与对照品保留时间一致的色谱峰为(R,S)-告依春。
当前国内医院制剂普遍存在质量标准检测方法落后、质量标准严重缺项(尤其含量测定)等问题,达不到其控制制剂质量、保证患者用药安全有效的作用[7],提高医院制剂标准迫在眉睫。抗601合剂为医院制剂,与国内大多数医院制剂一样,目前其质量标准中尚无含量测定项。本文采用HPLC法测定601合剂中(R,S)-告依春含量,经方法学考察,本法准确度高、精密度好、稳定性佳、简单易行,可考虑补充到该制剂质量标准中。
[1] 孙芳,景霞,朱明媚.HPLC法测定抗601合剂中黄芩苷的含量[J].中国药师,2015,18(12):2180-2182.
[2] 王珊珊,黄薇薇,廖清船,等.HPLC法测定抗601合剂中绿原酸的含量[J].安徽医药,2011,15(2):162-163.
[3] 王绚,单晨啸,程莉华,等.UPLC法测定抗601合剂中黄芩苷、绿原酸的含量[J].南京中医药大学学报,2014,30(4):370-372.
[4] 国家药典委员会.中华人民共和国药典(一部)[M].北京:化学工业出版社,2015:205-206.
[5] 陈凯,窦月,陈智,等.板蓝根抗病毒与抗内毒素等清热解毒药效作用及化学基础研究进展[J].中国方剂学杂志,2011,17(18):275-278.
[6] 巩伟,孙旭,赵庆华,等.HPLC法测定双根口服液中(R,S)-告依春的含量[J].解放军药学学报,2014,30(2):167-169.
[7] 马佩杰,沈伟,张妍,等.医院制剂质量标准存在的问题分析及对策探讨[J].中国医学伦理学,2015,28(3):353-355.
Contents of (R,S)-goitrin in Kang 601 mixture with HPLC
ZHU Ying1, ZHU Xingping2*
(1NanjingInstituteforFoodandDrugControl,DrugInspection,Nanjing210038,China;2DepartmentofEmergency,FirstPeople’sHospitalofLiangshanPrefecture;*Correspondingauthor,E-mail:1012309328@qq.com)
ObjectiveTo establish a high performance liquid chromatography(HPLC) method for determining the content of(R,S)-goitrin in Kang 601 mixture.MethodsAgilent Eclipse Plus-C18column(250 mm×4.6 mm,5 μm) was used to separate(R,S)-goitrin in Kang 601 mixture. The mobile phase was composed of methanol and 0.02% phosphoric acid aqueous with a gradient elution.The detection wavelength was 245 nm. The column temperature was 35 ℃ and the flow rate was 1 ml/min.Results(R,S)-goitrin was thoroughly separated with its related substances. The calibration curve of(R,S)-goitrin showed good linear regression in the range of 1.056-21.12 μg/ml(r=0.999 8), and the average recovery was 99.78% with RSD of 0.8%(n=9).ConclusionThis HPLC method for determining the content of(R,S)-goitrin in Kang 601 mixture is simple and accurate.
high performance liquid chromatography; Kang 601 mixture; (R,S)-goitrin
朱颖,女,1982-12生,硕士,主管药师,E-mail:zhuyingunique@163.com
2016-09-01
R927.1
A
1007-6611(2016)11-0992-03
10.13753/j.issn.1007-6611.2016.11.007

