新生儿B族链球菌败血症的临床研究
沈艳华, 刘 红, 齐宇洁, 董世霄, 靳 绯, 翁景文, 吴海兰
(北京儿童医院新生儿中心NICU,北京 100045; *通讯作者, E-mail: liuhong200811@163.com)
新生儿B族链球菌败血症的临床研究
沈艳华, 刘 红*, 齐宇洁, 董世霄, 靳 绯, 翁景文, 吴海兰
(北京儿童医院新生儿中心NICU,北京 100045;*通讯作者, E-mail: liuhong200811@163.com)
目的 探讨新生儿B族链球菌(GBS)败血症的临床特点及诊治。 方法 回顾性分析2008-01~2014-01于我院新生儿重症监护病房收治、血培养阳性的21例GBS败血症新生儿,记录母亲孕产史,患儿围产期情况、临床表现、实验室检查、治疗经过及预后等,结合相关文献对新生儿GBS败血症临床特点进行探讨。 结果 共收治21例新生儿GBS败血症患儿,男15例,女6例;早产儿2例;<7 d发病7例,其中合并化脓性脑膜炎4例,≥7 d发病14例,其中合并化脓性脑膜炎10例。临床表现:21例均反应差,发热14例,呼吸异常10例,休克7例,惊厥5例。实验室检查:血WBC升高(>19.5×109/L)8例,降低(<5×109/L)13例;CPR升高21例。血培养无乳链球菌21例,脑脊液培养无乳链球菌6例。治疗:青霉素加头孢曲松11例,美平加青霉素8例,头孢曲松加万古霉素2例。转归:治愈12例,好转7例,放弃治疗后死亡2例。 结论 新生儿GBS败血症病情凶险,致残率高,病死率高。对于有高危因素的新生儿及孕母,应作为重点监测对象,做到早发现、早治疗。
B族链球菌; 败血症; 新生儿
20世纪20年代人类首先发现B族链球菌(group B streptococci,GBS,又称无乳链球菌)可引起牛乳腺炎,后又发现它是产后脓毒症的病原体。在20世纪70年代它被认为是美国新生儿细菌感染的首位致病菌,在孕期可造成孕妇的绒毛膜羊膜炎,导致流产、胎膜早破及宫内感染;在分娩过程中,新生儿经过母亲GBS污染的产道,可导致生后发生肺炎、脑膜炎、败血症等,GBS感染具有患病率、病死率、致残率高的特点,严重危害新生儿的健康。在美国、英国、瑞典等国家,GBS已成为新生儿细菌感染的主要病原菌之一(22%-60%),也是导致新生儿死亡的主要原因。我国近年新生儿GBS感染报道较前有增多趋势[1,2]。现将我院2008-01~2014-01新生儿中心NICU收治的21例GBS败血症进行分析总结。
1 对象和方法
1.1 研究对象
选择2008-01~2014-01我院新生儿重症监护病房(NICU)收治、血培养为GBS阳性的败血症患儿。新生儿败血症均符合第4版《实用新生儿学》新生儿败血症的诊断标准[3]。
1.2 方法
采用回顾性研究方法。查阅、复习病历,收集患儿一般情况、临床表现,检验检查结果以及治疗转归等资料,并进行出院后随访。
2 结果
2.1 一般资料
2008-01~2014-01我院NICU共诊断血培养阳性的新生儿败血症198例,其中血培养为无乳链球菌21例,占10.6%,其中男15例,女6例;早产儿2例,足月儿19例;出生体重1 860-3 780 g;发病日龄:<7 d发病7例,≥7 d发病14例。住院时间1-63 d。
2.2 胎儿及母亲围产期情况
胎膜早破12例(5-32 h),胎儿宫内窘迫7例,生后窒息3例,羊水浑浊12例(有交叉病例)。18例母亲分娩时或产后有血象升高,5例有产前、产时或产后发热。曾有不良孕产史者6例,其中3例为既往孕早期不明原因胎死宫内;2例流产史,1例为本次孕早期先兆流产。所有母亲孕期均未行GBS检测。
2.3 临床表现
7例早发型败血症的发病时间为生后0.5-42 h。临床表现为反应低下及呼吸系统症状,如气促、呻吟等,其中5例需气管插管机械通气,4例合并化脓性脑膜炎,3例合并感染性休克,2例惊厥。另外14例晚发型败血症患儿发病时间在生后第11-28天,以发热为首发症状,12 h内出现拒奶、反应差、抽搐等神经系统症状,10例合并化脓性脑膜炎,4例合并感染性休克,3例惊厥,1例脑疝,4例需气管插管机械通气。
2.4 实验室检查
2.4.1 血常规 WBC升高8例,(23.4-38.4)×109/L,降低13例,(1.36-3.68)×109/L。PLT降低19例,(21-93)×109/L。中性粒细胞绝对值<2×109/L 10例。
2.4.2 CRP 入院时正常9例,升高12例,入院后24-72 h内峰值均明显升高,其中最高值大于200 mg/L,平均56 mg/L。
2.4.3 血气分析 重度代谢性酸中毒7例,轻度代谢性酸中毒2例。
2.4.4 病原学检查和药敏试验 21例均在使用抗生素前行血培养结果GBS阳性,其中6例脑脊液培养GBS阳性,1例尿培养GBS阳性。21例血GBS阳性标本药敏试验均对万古霉素和青霉素敏感,18例对头孢曲松亦敏感。未出现青霉素耐药菌株。
2.4.5 胸部X线 7例早发型胸片均提示肺炎,其中5例表现为肺透光度明显下降,3例呈“白肺”样表现。
2.4.6 脑脊液 21例患儿均于入院后做腰椎穿刺检查,其中14例合并化脓性脑膜炎,其中早发型4例,晚发型10例。脑脊液培养GBS阳性6例,早发型2例,晚发型4例,2例早产儿均合并化脓性脑膜炎。2.4.7 颅脑CT或MRI 14例脑膜炎患儿有12例行颅脑影像学检查,入院3 d内头颅影像均无明显异常,治疗过程中(7-14 d)复查,3例提示颅内病变严重,表现为脑软化,出血、坏死等;3例合并硬膜下积液;1例轻度侧脑室扩张;5例头颅影像学检查未见明显异常。2例因病情危重未能外出行CT检查。2.5 治疗
21例患儿均考虑严重感染,于入院当天取血培养及腰穿后立即给予抗生素治疗。首选青霉素加头孢曲松11例,美罗培南加青霉素8例,头孢曲松加万古霉素2例;培养出结果后调整用药。12例给予静脉输注丙种免疫球蛋白。气管插管机械通气9例(2-18 d),经鼻持续气道正压通气(NCPAP)辅助呼吸10例(1-3 d)。
2.6 转归
治愈(复查两次血培养阴性,脑脊液完全正常,无并发症)12例,好转(2次血培养阴性,脑脊液培养阴性,细胞数正常,但脑脊液糖仍低于正常,或有症状性癫痫)出院7例,2例因病情危重,分别于住院第2-17天家长放弃治疗后死亡。
2.7 随访
治愈患儿中的12例及好转中的4例于出院后门诊随访6个月-1年,复查血常规、CRP、胸部X线片、眼底、听力、头颅CT或头颅B超等均正常,生长发育良好,继续电话随访至今,生长发育及神经运动发育均同正常同龄儿。好转出院当时头颅影像学改变严重的3例(脑软化、出血、坏死),均有严重神经系统后遗症,表现为脑瘫、癫痫,智体力发育明显落后。
2.8 典型病例介绍

2.8.2 治疗经过 入院予机械通气,扩容抗休克;美罗培南抗感染;完善检查。当天回报:脑脊液常规:黄色混浊,白细胞数20×106/L,多个核细胞数12。脑脊液生化:氯化物112 mmol/L,糖0.18 mmol/L,蛋白7 396.00 mg/l。血常规:WBC 1.73×109/L,N 41.6%,PLT 351×109/L,CRP 50 mg/L。因病原尚不明确,伴感染性休克,故加用万古霉素加强抗感染治疗,并予丙种免疫球蛋白免疫支持。患儿抽搐,予镇静及降颅压。休克于24 h纠正,但仍昏迷。第2天复查血常规:白细胞4.64×109/L,中性46.5%,血小板150×109/L,CRP 188 mg/L。第3天脑脊液培养:无乳链球菌(B群)。对万古霉素敏感。第4天血培养:无乳链球菌(B群)。继予万古霉素静点抗感染治疗。第5天复查腰穿,脑脊液常规:白细胞数1 590×106/L。多次复查血常规示血小板进行性减低,CRP持续大于160 mg/L。患儿仍昏迷,无自主呼吸,需机械通气,第7天床旁颅脑超声示脑实质内出血。第10天复查腰穿,脑脊液常规白细胞数降至125×106/L,但病情仍危重,复查血CRP 155 mg/L。第15天患儿再次出现抽搐,予止惊。入院第17天气管插管气囊加压给氧下外出行头颅CT检查。头颅CT(图1B)示:①双侧额叶、颞叶脑实质内可见大片低密度区,为脑梗死、脑水肿。②大脑半球各叶脑皮层密度增高,双侧丘脑内可见小片状高密度影,考虑为出血?脑皮层层状坏死?钙化?③两侧脑室及第三脑室轻度增宽,第四脑室重度扩张,为交通性脑积水。④双侧顶部头皮软组织肿。患儿仍昏迷,家长考虑预后差,要求停止一切治疗,脑疝死亡。
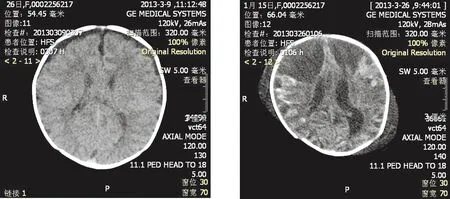
A.入院时 B.入院第17天 图1 典型病例入院时和入院第17天头颅CT表现Figure 1 CT features of brain at admission and at 17 d after admission
3 讨论
3.1 GBS的流行病学特征
B组链球菌,系革兰阳性、成对或成短链状排列的细菌。根据特异性的荚膜多糖抗原(S物质)不同,进一步分为Ⅰa、Ⅰb、Ⅱ、Ⅲ、Ⅳ、Ⅴ等多个血清型。GBS正常寄居于妇女阴道和人体肠道,30%健康人粪便及25%健康人泌尿生殖系统带有此菌,非妊娠妇女阴道带菌率10.56%。GBS也是婴儿鼻咽、直肠及皮肤的定植菌[3]。GBS感染的发病率在不同国家和地区均有不同,我国文献报道[4-6]:产前母体GBS带菌率3.4%-15.8%,胎盘带菌率10%,新生儿带菌率3.30%-9.95%,新生儿患病率0.83%。研究发现新生儿GBS侵袭性感染的血清型以Ⅲ型为主,欧美国家血清型流行病学研究发现,86.2%的脑膜炎为Ⅲ型菌株,败血症中的60.8%与Ⅲ型菌株有关[7];李丽等[8]研究显示发生严重新生儿侵袭性感染的病例以GBS基因型ST17为主。Alkuwaity等[9]研究结果显示,651例感染GBS病例中,ST17与超过80%的脑膜炎相关。
3.2 GBS感染的高危因素
GBS感染高危因素[10]包括:①出生胎龄<37周;②胎龄<37周伴胎膜早破;③胎膜早破>18 h和(或)母亲产褥期发热>38 ℃;④前一胎有GBS感染史;⑤母孕期有菌尿症。本研究中早产儿2例,胎膜早破12例,其中10例早破水时间大于18h,羊水浑浊12例,18例母亲分娩时或产后有血象升高,5例有产前、产时或产后发热。曾有不良孕产史者6例(其中3例为既往孕早期不明原因胎死宫内;2例流产史,1例为本次孕早期先兆流产),6例患儿母亲未正规产检,但所有母亲孕期均未行GBS检测。
3.3 GBS感染的临床特点
新生儿GBS败血症根据发病时间不同分为早发型及晚发型。早发型可表现为肺炎、呼吸衰竭,甚至出现快速进展的菌血症和败血症休克。具有患病率、病死率、致残率高的特点;晚发型多以高热为首发症状,易合并化脓性脑膜炎,肺部症状相对较轻,可导致严重的神经系统后遗症及听力丧失等不可逆损害[11,12]。
早发型常发生在生后5-7 d内,尤其是生后24 h内,本型多数由宫内感染或分娩时经母亲阴道感染。新生儿早发GBS感染性肺炎以出血、大量蛋白和中性粒细胞渗出进入肺泡为特征,引起肺上皮和内皮细胞广泛损伤。GBS对组成血脑屏障的内皮细胞亦具有特殊黏附性,感染机制与GBS黏附于内皮细胞、穿过宿主细胞屏障、逃避免疫清除、引起机体炎症反应等有关[13]。呼吸暂停、气促、呻吟、青紫等呼吸道症状常是感染最早出现的症状,25%患儿以低血压为首发症状。GBS宫内感染所致肺炎,在胸片上与肺透明膜病不易区分,可表现为“白肺”,临床诊断的肺透明膜病约50%以上可能由GBS感染所致[14]。本组病例中7例为早发型,6例于生后24 h内发病,1例生后48 h内发病,起病急骤,病情进展迅猛,其中5例需气管插管机械通气,4例合并化脓性脑膜炎,3例合并感染性休克,2例早产儿病情更为严重,胸片表现为“白肺”,并合并休克,1例肺出血死亡。提示临床上应常规对所有呼吸窘迫综合征(RDS)患儿进行血培养,并通过其他指标,如白细胞减少、血小板减少或C-反应蛋白增高,寻找感染的证据。同时应用针对GBS感染的抗生素,直至48 h培养阴性除外GBS败血症[15]。
晚发型发病于生后7 d-3月,多见于足月儿,常呈隐匿性发病,主要临床表现为发热、嗜睡和颅高压等。虽然病死率相对低,但因合并脑膜炎较多见,致残率较高。该型存活婴儿约30%-50%留有严重神经系统后遗症[16]。本组晚发型14例中,10例合并脑膜炎,3例患儿在入院时已发生惊厥,入院3 d内行头颅CT检查未见明显异常,但7-17 d后复查,均提示颅内病变严重,表现为脑软化,出血、坏死或脑梗死等。患儿临床表现为昏迷、持续惊厥状态等,1例合并脑疝患儿家长放弃治疗后死亡。随访另2例存活者有严重神经系统后遗症。对于合并化脓性脑膜炎的患儿,应动态监测头颅影像学,有助于对预后的判断。
3.4 GBS感染的治疗及监测
青霉素是GBS感染的首选药物,GBS对抗生素的耐药性研究显示[17,18]:GBS对青霉素或者氨苄西林、头孢菌素类、万古霉素高度敏感,3.8%-21.2%的新生儿对乙酰红霉素耐药,2.7%-20.0%的新生儿对克林霉素耐药。但也应注意到随着抗生素的广泛应用,青霉素中介率有升高趋势[19,20]。由于GBS败血症患儿入院时病情均较凶险,本组资料在抗生素的选择上趋向联合用药,广泛覆盖,11例入院时给予头孢曲松联合青霉素治疗,根据血培养及药敏回报,9例青霉素敏感,故停用头孢曲松;另外2例青霉素中介,头孢曲松敏感,停用青霉素。8例入院时给予美罗培南及青霉素联合治疗,血培养及药敏回报后停用美罗培南,继续予青霉素治疗,2例入院时即给予万古霉素及头孢曲松治疗。有3例脑膜炎患儿治疗过程中持续发热,复查脑脊液无明显好转,故停青霉素,改为万古霉素,治疗2-3 d热退,1例治愈出院,1例好转出院,1例因合并脑疝,家长放弃治疗后死亡。
静脉注射免疫球蛋白(IVIG)对GBS感染保护作用在新生动物试验中得到证实。其有效性依赖于IVIG含抗GBS特异性抗体的浓度。输入高效IVIG,可提供特异GBS抗体,增强吞噬细胞调理及杀菌作用[14]。本组21例患儿,有12例给予IVIG治疗。在积极控制感染同时,呼吸支持、抗休克、控制颅高压等综合治疗亦很重要[18]。
新生儿GBS败血症预防及监测至关重要。新生儿GBS感染主要以母亲生殖道定植细菌上行性感染和经阴道分娩细菌定植再发感染两种途径[21]。早发型病原菌来自于母亲感染或泌尿生殖系统定植,晚发型病原菌部分来自于母亲生殖系统细菌定植。目前还不清楚晚发型与母乳的关系,其病原往往是GBS血清Ⅲ型,研究还发现血清Ⅲ型与脑膜炎有关,所以有可能母亲定植的是GBS血清Ⅲ型,导致病原传播给新生儿并引起晚发感染。GBS菌株分型并非常规检查,所以难以明确[21]。我国目前产前GBS筛查尚未纳入常规产检。2010年美国CDC最新指南[16]建议:①35-37周的孕妇需进行阴道和直肠的细菌培养,阳性者在产程开始或胎膜破裂时应使用抗生素,在临产或破膜前选择性剖宫产则不需要使用抗生素治疗;②孕期有GBS菌尿的孕妇及曾经有孩子罹患GBS感染的孕妇,不必在35-37周进行阴道和直肠的细菌培养,而直接在产程中预防应用抗生素;③对于无GBS培养结果,但胎龄<37周、胎膜早破、产前发热的孕妇应在产程中预防性使用抗生素。2003-2004年的大样本群组研究结果显示,筛查率从48%提高至85%,产妇实际预防性使用抗生素的比例从74%升至85%。通过20多年的努力,新生儿早发型GBS感染的发病率从1.7‰活产儿降至<0.4‰活产儿。然而预防性使用抗生素对新生儿晚发型GBS感染没有预防作用,其发病率20年来始终稳定在0.4‰活产儿[21]。
任何出生后有败血症症状的新生儿,都应进行血培养、白细胞及血小板计数、脑脊液培养;有呼吸症状的新生儿予胸片检查,在评估期间对其进行治疗。母亲怀疑有绒毛膜炎的新生儿也需进行评估,在评估期间进行治疗。无临床症状的新生儿在分娩4 h前使用过充足抗生素预防的应观察≥48 h,足月且无胎膜早破18 h的无症状新生儿也需观察48 h,若早产或胎膜早破18 h以上的需进行临床评估并观察48 h以上[22]。有条件的医院对高危孕妇进行孕晚期GBS筛查非常必要,高危产妇分娩前4 h以上应用抗生素是防止新生儿GBS感染最有效的措施。
[1] 戴怡蘅,曾立军,高平明.新生儿B族链球菌败血症16例临床分析[J].中国新生儿科杂志,2012,27(1):44-46.
[2] 吴明法.新生儿B族链球菌败血症20例临床分析[J].当代医学,2012,18(16):70-71.
[3] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].北京:人民卫生出版社,2010:64-70.
[4] 时春艳,曲首辉,杨磊,等.妊娠晚期孕妇B族链球菌带菌状况的检测及带菌对妊娠结局的影响[J].中华妇产科杂志,2010,45(1):12-16.
[5] 应群华,严文卫,丁金龙.围产期生殖道菌群检测和B群链球菌筛查[J].中国微生态学杂志,2006,18(6):491-492.
[6] 马延敏,吴连方,黄醒华,等.孕妇B族溶血性链球菌带菌与母婴预后的探讨[J].北京医学,2005,27(9):516-518.
[7] Borchardt SM,Foxman B,Chaffin DO,etal.Comparison of DNA dot blot hybridization and lancefield capillary precipitin methods for group B streptococcal capsular typing[J].J Clin Microbiol,2004,42(1):146-150.
[8] 李丽,吴伟元,吴本清,等.B族链球菌基因分型与新生儿侵袭性感染临床表现的相关性研究[J].中国新生儿科杂志,2016,31(4):272-275.
[9] Alkuwaity K,Taylor A,Heckels JE.Group B streptococcus interactions with human meningeal cells and astrocytes in vitro[J].PLo S One,2012,7(8):e42660.
[10] Taminato M,Fram D,Torloni MR,etal.Screening for group B Streptococcus in pregnant women:a systematic review and meta-analysis[J].Rev Lat Am Enfermagem,2011,19(6):1470-1478.
[11] Chu SM,Hsu JF,Lee CW,etal.Neurocogical complications after neonatal bacteremia:the clinical characteristics,risk factors,and outcomes[J].PLoS One,2014,9:e105294
[12] Narara S,Rajaram G,Ramadevi A,etal.Prevention of perinatal group B streptococcal infection:a review with an Indian perspective[J].Indian J Med Microbiol,2014,32:6-12.
[13] 王爱华, 沈叙庄.新生儿B族链球菌感染分子机制研究进展[J].国际儿科学杂志,2008,35(2):134-136.
[14] 申阿东,张桂荣.新生儿GBS感染发病机制及治疗[J].新生儿科杂志,1996,11(5):234-235.
[15] 冯琪.欧洲新生儿呼吸窘迫综合征防治指南[J].中国新生儿科杂志,2007,22(6):390-392.
[16] Verani JR,McGee L,Schrag SJ,etal.Prevention of perinatal group B streptococcal disease revised guidelines from CDC,2010[J].MMWR Recomm Rep,2010,59(RR-10):1-36.
[17] 吴健宁,林润华,林健.孕妇泌尿生殖道112例无乳链球菌感染的耐药性分析[J].医学研究杂志,2008,37(3):88-89.
[18] 王萍,马建荣,王莹,等.早发型新生儿B族链球菌败血症的围生期临床特征[J].中国新生儿科杂志,2010,25(4):219-222.
[19] 吴健宁,林润华,林健.孕妇泌尿生殖道112例无乳链球菌感染的耐药性分析[J].医学研究杂志,2008,37(3):88-89.
[20] 申阿东,张桂荣,王咏红,等.B组链球菌的耐药性及红霉素耐药基因检测研究[J].中华儿科杂志,2005,43(9):661-664.
[21] Wessels M,蒋佩茹,曹云.围生期新生儿B族链球菌感染.中国循证儿科杂志,2011,6(4):241-244.
[22] 安晓霞.新生儿无乳链球菌感染的研究进展[J].临床和实验医学杂志,2012,11(20):1670-1671.
Retrospective study of group B hemolytic streptococci sepsis in newborn
SHEN Yanhua,LIU Hong*,QI Yujie, DONG Shixiao, JIN Fei, WENG Jingwen, WU Hailan
(NeonatalCenter,BeijingChildren’sHospitalAffiliatedtoCapitalUniversityofMedicalScience,Beijing100045,China;*Correspondingauthor,E-mail:liuhong200811@163.com)
ObjectiveTo explore the diagnosis and treatment of group B hemolytic streptococci(GBS) sepsis in the newborn.MethodsTotally 21 cases of GBS sepsis in the newborn admitted to Neonatal Intensive Care Unit of Beijing Children’s Hospital from January 2008 to January 2014 were enrolled in this study. The diagnosis of GBS sepsis was confirmed by blood culture. Clinical data were collected retrospectively including maternal history, perinatal events, clinical features, laboratory findings, treatment and prognosis. Literatures on GBS infection were reviewed.ResultsAmong 21 cases, 15 male and 6 female, 2 were preterm. There were 7 early onset cases(<7 d), including 4 cases complicated with purulent meningitis, and 14 cases of late onset(≥7 d), including 10 cases accompanied with purulent meningitis. All the 21 cases had poor response, and there were 14 cases of fever, 10 cases of respiratory symptoms, 7 cases of shock and 5 cases of convulsion. White blood cell count increased in 8 cases(>19.5×109/L) and decreased in 11 cases(<5×109/L). CRP was elevated in all of 21 cases, and blood culture was all positive. Six cases also had positive cerebrospinal fluid findings. Eleven cases were treated with penicillin combined with ceftriaxone, 8 cases were given meropenem combined with penicillin, and 2 cases were treated with ceftriaxone combined with vancomycin. Among 21 cases, 12 cases were cured, 7 cases exhibited improved clinical symptoms, and 2 infants died after withdraw.ConclusionNeonatal GBS sepsis is a serious clinical condition with high morbidity and mortality rates. Neonates and pregnant women with high risk should be monitored carefully in order to diagnose and give appropriate treatment promptly.
group B streptococci; septicemia; newborn
沈艳华,女,1978-11生,本科,副主任医师
2016-08-27
R631.3
A
1007-6611(2016)11-1041-05
10.13753/j.issn.1007-6611.2016.11.020

