腺嘌呤诱导幼鼠慢性肾功能衰竭模型建立的实验研究
李秀花, 赵丽君, 李 娜, 冯 杏, 贾晓静, 崔建军
(1山西医科大学公共卫生学院营养与食品卫生学教研室,太原 030001; 2山西省儿童医院肾内科; 3山西医科大学儿科医学系; *通讯作者,E-mail:yks5046@126.com)
腺嘌呤诱导幼鼠慢性肾功能衰竭模型建立的实验研究
李秀花1*, 赵丽君2, 李 娜3, 冯 杏3, 贾晓静3, 崔建军2
(1山西医科大学公共卫生学院营养与食品卫生学教研室,太原 030001;2山西省儿童医院肾内科;3山西医科大学儿科医学系;*通讯作者,E-mail:yks5046@126.com)
目的 探讨腺嘌呤灌胃法制作幼鼠慢性肾功能衰竭模型的效果。 方法 4周龄雄性Wistar大鼠24只,随机分为正常组和模型组,每组12只。模型组按200 mg/(kg·d)剂量灌胃给予2%腺嘌呤混悬液,诱导幼鼠慢性肾功能衰竭模型。测定血清尿素氮、肌酐及24 h尿蛋白含量,取肾组织进行HE、PAS、Masson染色,并用JG12免疫组化观察肾小球毛细血管的变化,评价模型的制作效果。 结果 腺嘌呤灌胃后32 d,模型组大鼠血清尿素氮、肌酐、24 h尿蛋白含量较正常组明显增高[BUN:15.22±4.25vs4.52±0.94,P<0.01;SCr:198.22±84.16vs42.81±9.07,P<0.01;24 h尿蛋白:73.37±31.08vs11.61±1.04,P<0.05]。肾脏病理染色结果发现部分肾小球硬化,肾小管萎缩、坏死、脱落,肾间质纤维化,JG12染色结果显示肾小球毛细血管细胞数目减少。 结论 成功建立幼鼠慢性肾功能衰竭模型,血生化指标及肾脏病理损伤符合慢性肾功能衰竭病理生理学特点。
腺嘌呤; 慢性肾衰竭; 慢性肾疾病
小儿慢性肾功能衰竭(chronic renal failure, CRF)是肾单位受到破坏而减少,导致肾脏的内分泌代谢功能及排泄调节功能发生一系列的病理生理改变,造成机体内环境紊乱的临床综合征[1]。近年来国内外许多研究者对CRF的实验动物模型进行了研究并取得了很大的进展[2]。腺嘌呤作为一种药物学造模方法,已证实可以建立接近临床实际的CRF动物模型[3],但关于幼鼠CRF模型的研究报道很少。因此,建立理想的,且适用广泛、简便、稳定、可控的幼鼠CRF模型,对研究探讨小儿CRF的病因、发病机制、血生化变化及病理学改变尤为重要。本研究采用腺嘌呤灌胃法制作幼鼠CRF模型,旨在为幼鼠CRF模型制作方法提供新的参考依据。
1 材料与方法
1.1 实验动物
清洁级雄性近交系的Wistar大鼠24只,4周龄,体重(90±10)g,购自中国军事医学科学院动物中心,动物质量合格证号:SCXK-(军)-2015-004。所有动物在山西医科大学公共卫生学院营养与食品卫生学教研室动物室内饲养,室温环境可控:温度(22±3)℃;相对湿度(55±5)%;12 h光暗交替,自由摄取标准饲料及饮水。
1.2 主要试剂
腺嘌呤(adenine,Sigma,USA)配制成2%混悬液备用,血尿素氮(BUN)测试盒(二乙酰肟法,南京建成生物工程研究所,货号C013-1)、肌酐(Cr)测试盒(苦味酸比色法,南京建成生物工程研究所,货号C011-1)、尿蛋白定量测试盒(CBB法,南京建成生物工程研究所,货号C035-2)、氨肽酶P(aminopeptidase P,JG12)小鼠抗大鼠单克隆抗体(Santa Cruz,USA)、SP-9002二步法免疫组化试剂盒(北京中衫金桥生物技术有限公司)。
1.3 模型制备及方法
大鼠适应性喂养1周,按体重随机分为2组,每组12只。模型组大鼠按200 mg/(kg·d )剂量,每日早晨灌胃给予2%腺嘌呤混悬液[4]。正常组大鼠每日一次灌胃给予蒸馏水10 ml/(kg·d )。两组大鼠连续灌胃32 d。所有大鼠每周称体重1次,每日观察大鼠饮食、饮水、精神状态、毛发及尿量等。
1.4 大鼠肾功能参数的检测
腺嘌呤灌胃第32天,将所有大鼠置于代谢笼收集24 h尿液,采用考马斯亮蓝法检测24 h尿蛋白含量;颈静脉采血,室温静置30 min,3 000×g离心10 min,取血清,二乙酰肟法检测血清尿素氮含量,苦味酸比色法检测肌酐的含量。处死各组大鼠,取双侧肾脏,剔除包膜,称重并测量肾脏的大小。
1.5 大鼠肾组织病理学的检测
肾组织经10%中性甲醛固定过夜,石蜡包埋后切片(4 μm),常规脱蜡至水后进行HE、PAS、Masson染色,显微镜下观察其病理学变化。
肾组织经10%中性甲醛固定过夜,石蜡包埋后切片(4 μm),常规脱蜡至水,浸于柠檬酸盐缓冲液中高压热修复抗原3 min。自然冷却后,3% H2O2封闭10 min,PBS冲洗3次,每次5 min。滴加JG12一抗(1∶50,Santa Cruz),4 ℃孵育过夜。PBS浸洗,加入二抗,37 ℃孵育30 min。DAB显色,镜下观察染色情况。根据JG12的染色结果,观察肾小球毛细血管的变化。
1.6 统计学分析

2 结果
2.1 大鼠一般情况的变化
腺嘌呤灌胃后,模型组大鼠表现为进食量减少,饮水量增加,体重增长缓慢,24 h尿量(ml)较正常组明显增多(40.75±3.19vs9.58±1.93,P<0.001),活动量减少,精神萎靡,蜷缩弓背,竖毛,鼠毛缺少光泽并有脱毛现象。正常组大鼠,活动、鼠毛、体重增长正常(见图1)。实验期间模型组死亡2只,正常组无死亡。
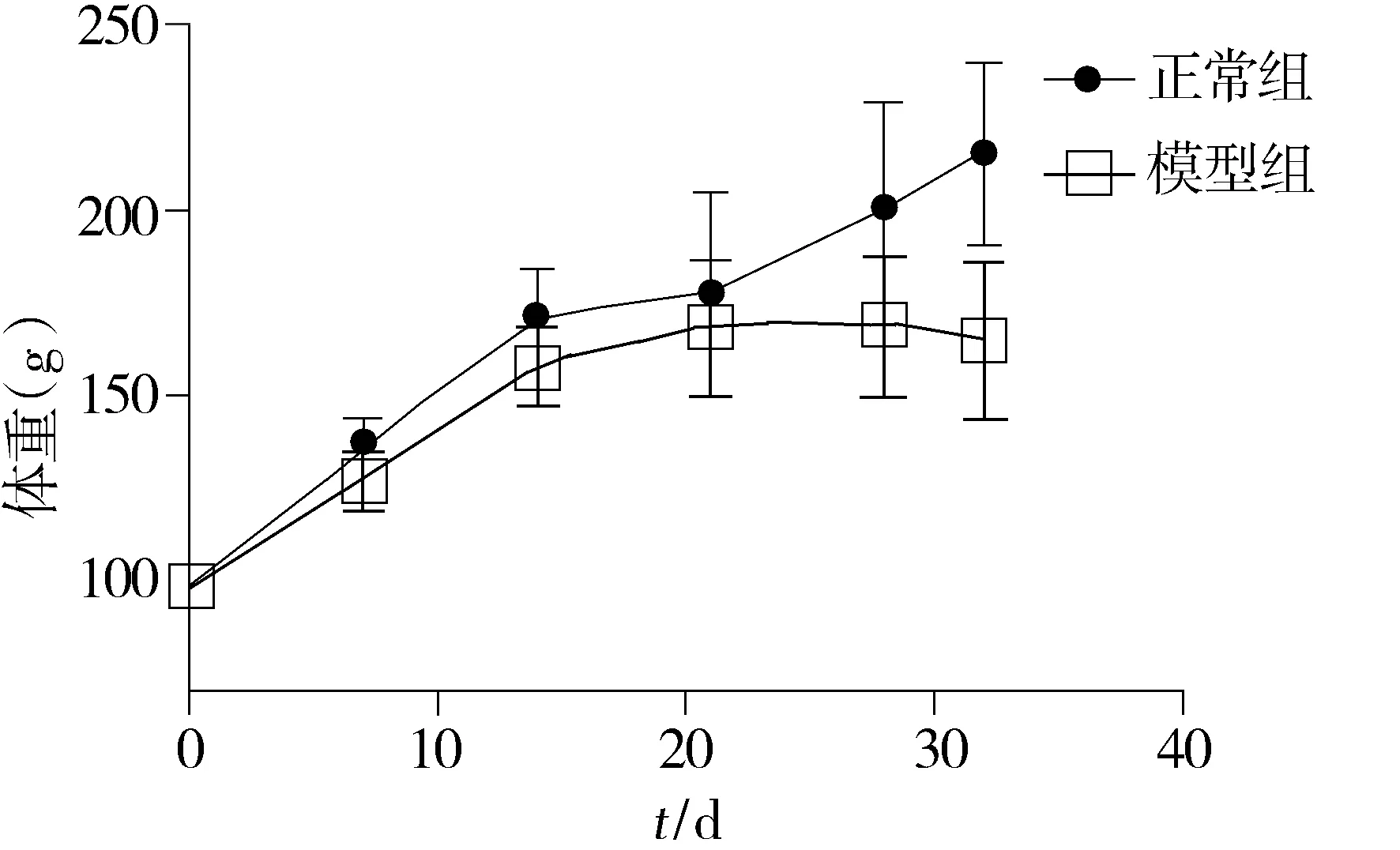
图1 正常组和模型组大鼠不同时间点的体重变化Figure 1 Changes of body weight at different time points in two groups
2.2 血清生化指标的变化
腺嘌呤灌胃32 d后,检测各组大鼠的肾功能,结果显示模型组大鼠血清BUN、SCr和24 h尿蛋白均较正常对照组升高,差异有统计学意义(见表1)。
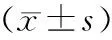
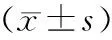

组别尿素氮(mmol/L)肌酐(μmol/L)尿蛋白(mg/24h)正常组4.52±0.94 42.81±9.07 11.61±1.04模型组15.22±4.25**198.22±84.16** 73.37±31.08*
与正常组比较,*P<0.05,**P<0.01
2.3 肾外观的变化
腺嘌呤灌胃32 d,模型组大鼠肾脏体积明显增大,灰白色,表面凹凸不平呈细颗粒状,类似人类的“大白肾”,切面观察肾皮髓质界限不清,部分可见髓质坏死。而正常组大鼠肾脏形态正常,如蚕豆大小,呈红褐色,表面有光泽,切面观察肾皮髓质分界清楚(见图2)。
2.4 肾脏病理损伤情况
光镜观察:正常组大鼠肾小球结构及数目正常,肾小球囊腔无扩张,球囊无粘连,肾小球毛细血管袢开放良好,基底膜无增厚,未见明显的系膜细胞及系膜基质增生。肾小管结构正常,管腔无萎缩,无管腔扩张,未见肾小管上皮细胞坏死,未见蛋白管型。肾间质未见明显的纤维组织增生,偶见少许炎细胞浸润。腺嘌呤灌胃后,大鼠肾组织的病理改变比较明显。模型组大鼠肾小球毛细血管数目减少较正常组明显的减少(33.21±2.08vs66.93±3.98,P<0.001),部分毛细血管袢分布不均、管腔闭合,肾小球囊腔缩小,球囊粘连、萎缩,可见少许球性硬化的肾小球,基底膜普遍增厚,系膜基质增生。肾小管上皮细胞空泡变性、坏死、刷毛缘脱落,部分肾小管管腔代偿性扩张,肾小管内可见大量褐色结晶物沉着,部分可见蛋白管型。肾间质有大量炎细胞浸润,间质纤维化明显,可见部分肾小动脉管壁增厚,玻璃样变性(见图3,4)。模型组肾小球硬化指数为2.69±0.24,正常组为0.30±0.01,两组之间差异有统计学意义(P<0.01)。模型组肾小管间质纤维化面积(%)为77.39±2.31,正常组为2.60±0.31,两组之间差异有统计学意义(P<0.01)。

图2 正常组和模型组肾脏外观的比较Figure 2 The appearance of the renal in CRF rats
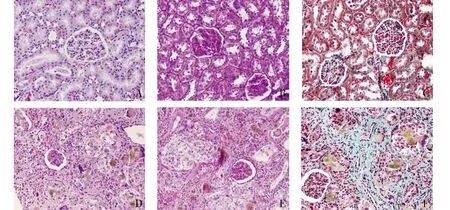
A-C.分别为正常组HE、PAS、Masson染色;D-F分别为模型组HE、PAS、Masson染色图3 正常组和模型组肾脏病理变化 (×200)Figure 3 Pathological changes of kidney in CRF rats and normal rats (×200)
3 讨论
慢性肾衰竭的幼鼠模型是研究探讨儿童CRF的病因、发病机制、治疗干预措施的一种重要工具。现阶段手术方法制备幼鼠CRF模型存在一定的局限性,包括手术操作技巧的要求,术后护理实验动物设施的需求以及高病死率,这促使我们开发一种基于腺嘌呤摄取引起肾功能衰竭的非手术模型。该方法已成功应用于成年大鼠,但关于幼鼠的研究报道比较少见。
本实验采用按体重灌胃给药,让每只动物尽可能获取同种程度的肾损害,使CRF动物模型标准化。根据腺嘌呤剂量的大小和喂养时间的长短制作成轻、中、重度的肾衰模型,病程稳定,适宜长期给药,成功率高[5]。研究者报道,高浓度的腺嘌呤通过黄嘌呤氧化酶的作用生成2,8-二羟基腺嘌呤,后者堵塞肾小管管腔,影响氮质化合物的排除,导致血清尿素氮、肌酐、尿酸显著上升;尿酸在血中呈过饱和状态形成结晶,沉积于肾小球、肾小管及肾间质部位,刺激局部引起异物肉芽肿性炎症,肾单位的大量丧失,最终导致肾功能衰竭[6]。这种由代谢改变复制的慢性肾疾病(chronic kidney disease,CKD)模型,以肾小管和肾间质结晶沉积,异物肉芽肿形成,肾间质纤维化为特征的小管间质性疾病,通常发生在许多CKD的患儿[7]。
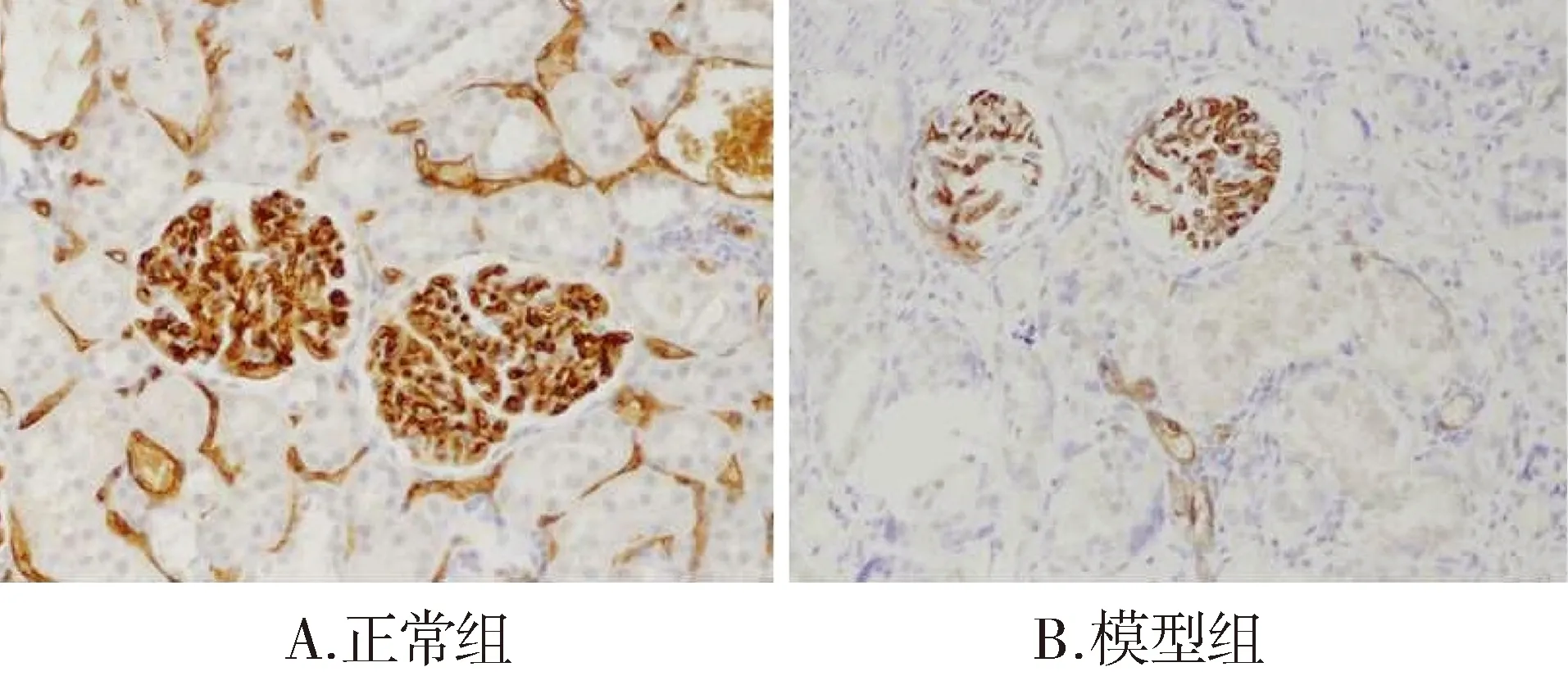
图4 正常组和模型组肾小球毛细血管变化 (×200)Figure 4 The changes of glomerular capillary in CRF rats and normal rats (×200)
CRF典型的病理学特征是微血管系统的受损缺失[8,9],既往对肾组织血管的研究主要是通过免疫组化方法特异性染色内皮细胞[10],再进行半定量分析。以前常用的普通血管内皮细胞标记物如CD34、CD31已被证实在淋巴管的内皮细胞中也有表达,这易造成淋巴管增生导致的内皮增生的假象。因此,本实验选取氨肽酶P(JG12)—一种新的血管内皮细胞标记物,较普通血管内皮细胞标记物更具有特异性,在肾脏特异表达于肾间质和肾小球毛细血管[11]。本研究以JG12阳性细胞个数计数肾小球毛细血管内皮细胞数目,发现腺嘌呤诱导的CRF大鼠肾小球毛细血管内皮细胞数目明显减少,毛细血管袢分布不均,部分毛细血管管腔闭合。这些与以前的实验研究相符,即慢性肾疾病共同通路是肾脏微血管系统的进行性缺失或闭塞,进而引起肾组织纤维化、肾单位丢失。进一步观察病理形态学变化,结果显示:肾小管及肾间质有大量咖啡色结晶沉积,部分肾小管完全破坏,间质纤维组织增生明显,部分肾小球出现节段性硬化,表明腺嘌呤造模是成功的。
腺嘌呤诱导的CRF模型简单,可复性好,不需要侵入性干预,与儿童首发的CKD小管间质病变相似。需要进一步的研究这种幼鼠模型的特征。研究发现,腺嘌呤诱导的慢性肾疾病幼鼠存在生长发育迟缓及软骨内骨化异常[12]。本研究观察到,腺嘌呤灌胃后,大鼠的体重增长缓慢,甚至出现体重下降。生长迟缓是儿童慢性肾疾病的主要表现。在临床研究中,还很难评估影响CKD患儿生长发育的各种致病因素,这可能为将来研究CKD患儿生长发育提供一种新的实验模型。
[1] Rodriguez-Iturbe B,Garcia GG.The role of tubulointerstitial inflammation in the progression of chronic renal failure[J].Nephron Clin Pract,2010,116(2):c81-88.
[2] 耿静.腺嘌呤所致大鼠慢性肾功能衰竭的实验研究[J].河南中医学院学报,2008,23(6):24-25.
[3] 刘洪彦,杨爱华,刘雪梅,等.腺嘌呤致大鼠慢性肾功能衰竭模型研究[J].中国实验诊断学,2011,15(12):2014-2017.
[4] 马月宏,许丽萍,王海生.腺嘌呤致大鼠慢性肾功能不全模型的评价及探讨[J].内蒙古中医药,2012,31(1):141-142.
[5] 刘强,马济民,候积寿.慢性肾衰动物模型的评价[J].国外医学:泌尿系统分册,1994,14(2):69-72.
[6] Bendich A,Brown GB,Philips FS,etal.The direct oxidation of adenine in vivo[J].J Biol Chem,1950,183(1):267-277.
[7] Claramunt D,Gil-Pena H,Fuente R,etal.Animal models of pediatric chronic kidney disease.Is adenine intake an appropriate model?[J].Nefrologia,2015,35(6):517-522.
[8] Mayer G.Capillary rarefaction,hypoxia,VEGF and angiogenesis in chronic renal disease[J].Nephrol Dial Transplant,2011,26(4):1132-1137.
[9] 陈平,周芸.血管内皮细胞与肾脏纤维化的关系[J].国际泌尿系统杂志,2013,33(4):563-566.
[10] Goto Y,Yamaguchi S,Tamura M,etal.A prostacyclin analog prevents the regression of renal microvascular network by inhibiting mitochondria-dependent apoptosis in the kidney of rat progressive glomerulonephritis[J].Prostaglandins Other Lipid Mediat,2014,112:16-26.
[11] Sun D,Wang Y,Liu C,etal.Effects of nitric oxide on renal interstitial fibrosis in rats with unilateral ureteral obstruction[J].Life Sci,2012,90(23-24):900-909.
[12] Claramunt D,Gil-Pena H,Fuente R,etal.Chronic kidney disease induced by adenine:a suitable model of growth retardation in uremia[J].Am J Physiol Renal Physiol,2015,309(1):F57-62.
Experimental study of juvenile rats with chronic renal failure induced by adeniene
LI Xiuhua1*, ZHAO Lijun2, LI Na3, FENG Xing3, JIA Xiaojing3, CUI Jianjun2
(1DepartmentofFoodNutritionandHygiene,SchoolofPublicHealth,ShanxiMedicalUniversity,Taiyuan030001,China;2DepartmentofNephrology,ShanxiProvincialChildren’sHospital;3DepartmentofPediatrics,ShanxiMedicalUniversity;*Correspondingauthor,E-mail:yks5046@126.com)
ObjectiveTo investigate the effect of adenine-induced chronic renal failure(CRF) model in juvenile rats.MethodsThe 4-week-old male Wistar rats were randomly divided into normal group(n=12) and CRF group(n=12). The 2% adenine suspension was gavaged to induce chronic renal failure in juvenile Wistar rats. The contents of urea nitrogen, creatinine in serum and 24 h urinary protein were determined. The renal tissue was taken to observe the histopathological changes by HE, PAS and Masson staining for evaluating the effect of the model.ResultsThe serum urea nitrogen, creatinine and 24 h urinary protein levels were significantly higher in rats with adenine-induced CRF than in normal rats[BUN: 15.22±4.25vs4.52±0.94,P<0.01;SCr:198.22±84.16vs42.81±9.07,P<0.01;24 h urinary protein:73.37±31.08vs11.61±1.04,P<0.05]. HE, PAS and Masson staining of kidney showed glomerular sclerosis, renal tubular atrophy,necrosis, abscission, and renal interstitial fibrosis.ConclusionThe model of chronic renal failure in juvenile rats by intragastric administration of adenine is successfully established. Blood biochemical indicators and renal pathological damage conform to pathological physiology of CRF.
adenine; chronic renal failure; chronic kidney diseases
山西省科技攻关基金资助项目(20100311102-1)
李秀花,女,1957-12生,大专,高级实验师,E-mail:yks5046@126.com
2016-05-30
R692.5
A
1007-6611(2016)11-0978-04
10.13753/j.issn.1007-6611.2016.11.004

