绿原酸对大鼠阻塞性黄疸导致的肝纤维化的治疗作用
吴多虎, 鲍传裕, 李龙鹤, 邹永平, 袁 巍, 王德森, 谢晋元, 宫晓光
(海南省人民医院急诊科,海口 570311; *通讯作者,E-mail: wdhhx@126.com)
绿原酸对大鼠阻塞性黄疸导致的肝纤维化的治疗作用
吴多虎, 鲍传裕, 李龙鹤, 邹永平, 袁 巍, 王德森, 谢晋元, 宫晓光*
(海南省人民医院急诊科,海口 570311;*通讯作者,E-mail: wdhhx@126.com)
目的 探索绿原酸(CA)对阻塞性黄疸导致的肝纤维化模型大鼠治疗作用及其作用机制。 方法 Wistar大鼠行胆总管结扎手术复制阻塞性黄疸肝纤维化模型,随机分为模型组、水飞蓟宾组(Sil,50 mg/kg)、绿原酸低、中和高剂量组(37.5,75,150 mg/kg),同时设假手术对照组。除模型组和对照组外,其他各组大鼠均按10 ml/kg体重灌胃相应剂量药物,持续4周。实验结束后计算肝脏指数,HE观察肝脏损伤及Masson观察纤维化程度,RT-PCR技术检测肝脏Ⅰ和Ⅲ型胶原、VEGF、TGF-β1的mRNA水平,免疫印迹法检测α-SMA蛋白的表达水平。 结果 胆总管结扎术诱导模型大鼠肝脏指数明显增加,肝组织出现明显病理改变,并伴有纤维化发生;与模型组相比,绿原酸中高剂量组肝脏指数明显降低,肝小叶结构清晰,炎症细胞浸润减少,肝小叶结构破坏缓解,同时Ⅰ、Collagen Ⅲ、TGF-β1、VEGF mRNA水平,α-SMA蛋白的表达显著降低(P<0.05)。 结论 绿原酸在可通过抑制TGF-β1、VEGF和α-SMA的表达从而降低胆总管结扎诱导的肝纤维化病变的风险。
绿原酸; 阻塞性黄疸; 肝纤维化
胆总管结扎手术是制备肝纤维化动物模型的方法之一,该模型在评估药物对肝脏的潜在保护作用研究方面具有重要的意义[1]。肝纤维化发生与肝星状细胞(hepatic stellate cell,HSC)的活化密不可分,活化的HSC可过量表达α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA),诱导大量细胞外基质如胶原等沉积,从而导致肝纤维化[2]。绿原酸(chlorogenic acid,CA)是植物在有氧呼吸过程中产生的一类苯丙类化合物,属于酚类抗氧化剂。大量文献报道,绿原酸对四氯化碳(CCl4)导致的肝损伤和肝纤维化有明显的抑制作用,高剂量的绿原酸治疗效果最明显[3,4]。在大鼠阻塞性黄疸导致的肝纤维化研究中发现,绿原酸在阻塞性黄疸早、中期可促进HSC凋亡,抑制纤维化肝组织胶原的产生与沉积减轻肝纤维化,降低肝脏损伤程度[5]。另外,绿原酸还能有效地保护对脂多糖诱导小鼠急性肝损伤[6]。最近的一项研究表明,绿原酸对治疗乙酰氨基酚引起的小鼠肝损伤有明显的解毒作用[7]。
本实验通过建立阻塞性黄疸大鼠模型,应用不同剂量的绿原酸进行干预,检测大鼠肝纤维化程度、纤维化相关因子mRNA水平,旨在研究绿原酸对大鼠肝纤维化的治疗效果及其作用机制。
1 材料与方法
1.1 实验动物
清洁级Wistar大鼠,雌雄各半,体重(250±15)g,由中国医学科学院实验动物研究所提供,合格证号SCXK(京)2004-0004。饲养在室温(22±2)℃、相对湿度55%±5%的动物房,明暗交替各12 h。
1.2 药物和主要试剂
绿原酸,纯度>99%,美国Sigma公司提供。水飞蓟宾(Silibinin,Sil)由天津天士力制药股份有限公司提供。三磷酸脱氧核苷(dNTP)混合液、逆转录酶(M-MLV)、DNA聚合酶(Taq)由宝生物工程有限公司提供;寡核苷酸引物Oligo(dT)16、PCR扩增引物由美国Invitrogen公司合成。兔抗α-SMA、羊抗β-actin、α-SMA-鼠抗兔IgG和β-actin-兔抗羊IgG均由美国Sigma公司提供。
1.3 阻塞性黄疸大鼠模型的建立
术前禁食12 h,腹腔内注射10%水合氯醛(350 mg/kg),深度麻醉后,取上腹部正中直切口,长约2 cm,逐层进腹,暴露十二指肠。找到胆总管和十二指肠,靠近十二指肠处用丝线两端结扎,依次关腹。对照组仅游离胆总管不予结扎,其他各组均采用胆总管结扎的方法。胆总管结扎第4周后,运用病理组织学方法检测模型组,肝纤维化程度为100%,视为建模成功。
1.4 实验动物分组及处理
模型大鼠随机分为模型组(n=12)、绿原酸低、中、高剂量组(37.5,75,150 mg/kg,各组n=11)、Sil组(50 mg/kg,n=11),同时设置假手术对照组(n=10)。除对照组和模型组大鼠灌胃蒸馏水外,绿原酸低、中、高剂量组和Sli组给予不同剂量的相应药物,灌胃体积按10 ml/kg体重计算,每日一次,持续4周。
1.5 肝脏指数检测
末次给药后2 h,大鼠腹腔注射10%水合氯醛(350 mg/kg)麻醉,仰卧位摘取全部肝脏,称取肝脏湿重。按照公式:肝脏指数=肝脏质量/体重×100%,计算每组大鼠的肝脏指数。
1.6 肝脏组织病理学观察
取大鼠肝脏大叶同一部分组织,用多聚甲醛溶液固定,常规脱水、透化、石蜡包埋,连续切片,片厚约5 μm,经脱蜡复水后。分别用HE染色和Masson染色,光学显微镜观察病理变化。
1.7 RT-PCR检测
利用Trizol试剂提取肝组织细胞的总RNA。将1 μl提取的总RNA(1 μg/μl)和1.0 μl Oligo(dT)16溶于6.0 μl DEPC的灭菌双蒸水中,制备模板RNA。取模板RNA6 μl加入到反转录反应体系中,内含5×M-MLV buffer 2 μl、dNTP Mixture(各10 μmol/L)0.5 μl、RNase inhibitor(40 U/μl)0.25 μl、RTase M-MLV,即RNase H-(200 U/μl)0.5 μl和RNase free dH2O 10 μl。42 ℃保温1 h,70 ℃保温15 min,冰上冷却,得到的cDNA溶液直接用于PCR。利用Primer Premier 6.0软件设计Collagen Ⅰ、Collagen Ⅲ、TGF-β1、VEGF 基因PCR扩增引物,并同时设计内参GAPDH基因扩增引物,引物序列见表1。用1.5%琼脂凝胶电泳检测Collagen Ⅰ,Collagen Ⅲ,TGF-β1和VEGF的mRNA表达水平,并采用Gle-pro分析系统对DNA条带进行半定量分析。目的基因与内参mRNA的比值表示目的基因的mRNA表达情况。
表1 目标基因和内参基因的引物序列
Table 1 Primer sequences of target genes and internal gene

基因名称引物序列VEGFFP:5'-CTGCTGTACCTCCACCAT-3'RP:5'-ACAGGACGGCTTGAAGAT-3'TGF-β1FP:5'-GCAACAACGCCATCTATG-3'RP:5'-CAAGGTAACGCCAGGAAT-3'CollagenⅠFP:5'-CAGAGTGGAAGAGCGATTA-3'RP:5'-CAAGGACAGTGTAGGTGAA-3'CollagenⅢFP:5'-GTCCACAGCCTTCTACAC-3'RP:5'-TTCCTGACTCTCCATCCTT-3'GAPDHFP:5'-TCTCCTGCGACTTCAACA-3'RP:5'-TGTAGCCGTATTCATTGTCA-3'
1.8 α-SMA蛋白印迹分析
取肝组织加入含50 mmol/L Trise-HCl(pH 7.5)、150 mmol/L氯化钠、1%NP-40、1 mmol/L EDTA、1 mmol/L EGTA和1 mmol/L PMSF的裂解液,冰上裂解10 min,15 000 r/min,4 ℃离心10 min,取上清液。SDS-PAGE电泳分离,转膜,3%BSA封闭,兔抗α-SMA(1∶1 000)和羊抗β-actin(1∶1 000)4 ℃过夜,二抗α-SMA-鼠抗兔IgG(1∶5 000);β-actin-兔抗羊IgG(1∶5 000)室温孵育1 h。通过光密度定量分析α-SMA蛋白谱带的相对强度。
1.9 统计学分析
2 结果
2.1 肝脏指数检测结果
与对照组比较,模型组大鼠肝脏指数显著升高(P<0.001);低剂量绿原酸组(37.5 mg/kg)大鼠肝脏指数组与模型组比较无明显差异(P>0.05),而中、高绿原酸剂量及水飞蓟宾可以明显降低肝脏指数(P<0.01,见图1)。
2.2 肝组织病理学变化
对照组大鼠肝小叶结构清晰,肝索排列整齐,以中央静脉为中心呈放射状,肝细胞正常,汇管区无炎性细胞浸润,肝血窦正常无充血(见图2);模型组大鼠肝小叶结构紊乱不清,肝索解离,可见汇管区炎细胞浸润逐渐加重(见图2),提示梗阻性黄疸肝损伤模型建立成功。绿原酸给药组大鼠肝组织浸润炎症细胞减少,肝小叶结构破坏现象缓解,尤其以高剂量组最为明显(见图2)。
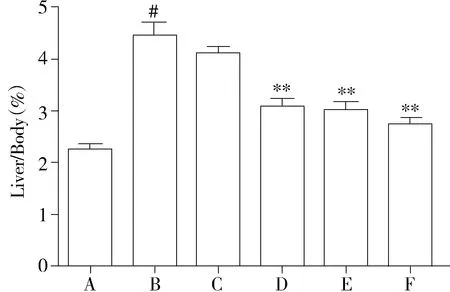
A.对照组;B.模型组;C.CA 37.5 mg/kg组;D.CA 75 mg/kg组;E.CA 150 mg/kg组;F.水飞蓟宾组;与对照组比较,#P<0.001;与模型组比较,**P<0.01图1 绿原酸对胆总管结扎手术模型大鼠肝脏指数的影响Figure 1 Effect of chlorogenic acid(CA) on liver index in bile duct ligation-induced rats
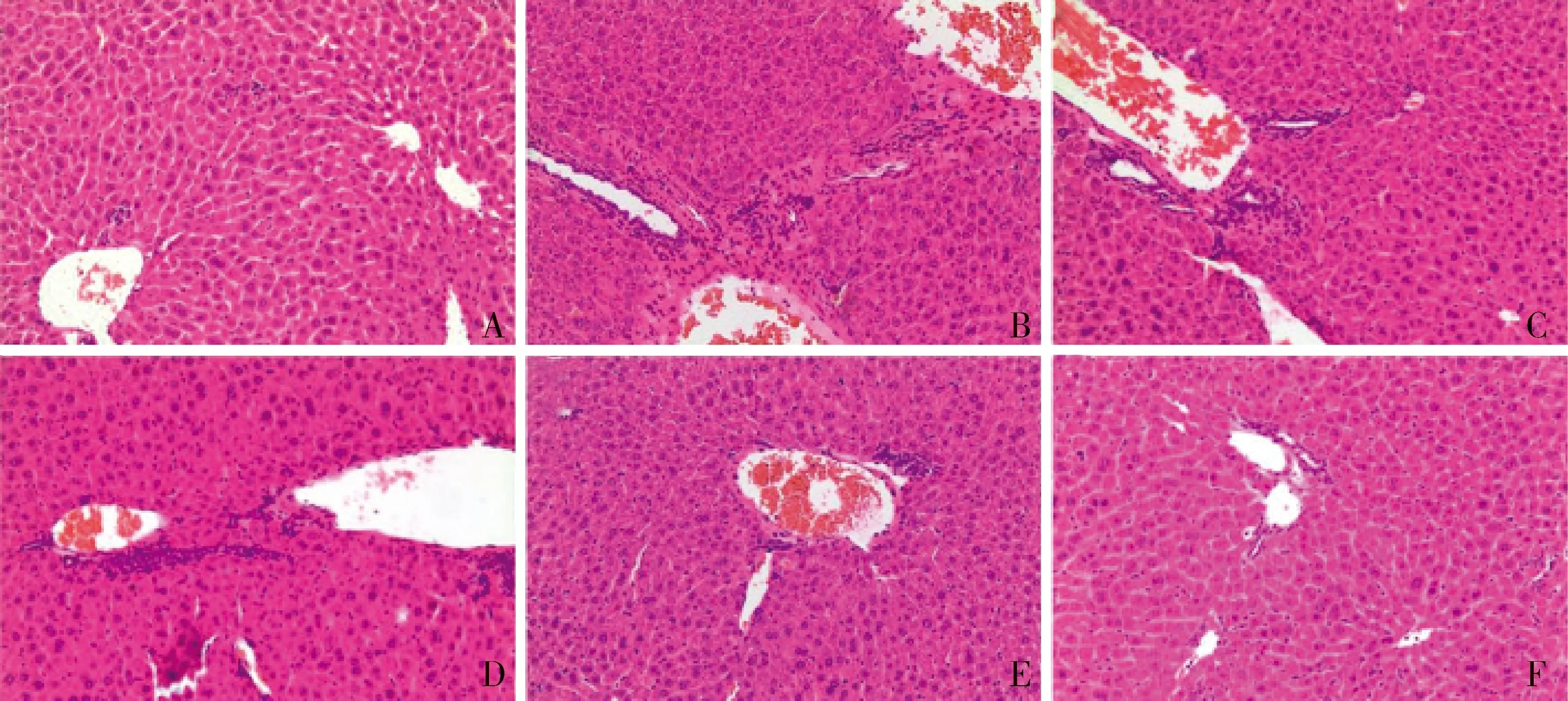
A.对照组;B.模型组;C.CA37.5 mg/kg组;D.CA75 mg/kg组;E.CA150 mg/kg组;F.水飞蓟宾组图2 绿原酸对胆总管结扎手术模型大鼠肝脏形态学的影响 (×100)Figure 2 Effects of chlorogenic acid(CA) on liver histological changes of bile duct ligation-induced rats (×100)
2.3 肝纤维化评价
对照组大鼠肝脏无明显纤维化结构;模型组大鼠具有明显的纤维化桥接,大量的胶原沉积物环绕在汇管区,纤维化区域蔓延连接并将肝脏分为大量单独的假小叶;随着绿原酸剂量的增加,纤维化程度明显改善(见图3)。
2.4 肝组织中纤维化相关因子表达分析
肝纤维化相关因子Ⅰ型和Ⅲ型胶原、TGF-β1及VEGF基因在正常大鼠肝组织中处于低表达水平,而胆总管结扎模型大鼠各因子基因均明显上调;而各治疗组纤维化相关因子均出现不同程度下调,尤其以150 mg/kg绿原酸组降低最为显著(P<0.05, 见图2)。
2.5 肝组织中α-SMA表达分析
正常大鼠肝组织中α-SMA蛋白处于低表达水平,而胆总管结扎模型大鼠肝组织α-SMA表达显著增加(P<0.001);各治疗组大鼠肝组织α-SMA表达均不同程度降低,绿原酸可剂量依赖性降低其表达,尤其以高剂量(150 mg/kg)降低最为显著(P<0.01,见图5)。
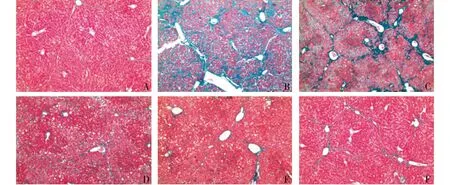
A.对照组;B.模型组;C.CA 37.5 mg/kg组;D.CA 75 mg/kg组;E.CA 150 mg/kg组;F. 水飞蓟宾组图3 绿原酸对胆总管结扎手术模型大鼠肝纤维化的影响 (×100)Figure 3 Effects of chlorogenic acid(CA) on liver fibrosis of bile duct ligation-induced rats (×100)
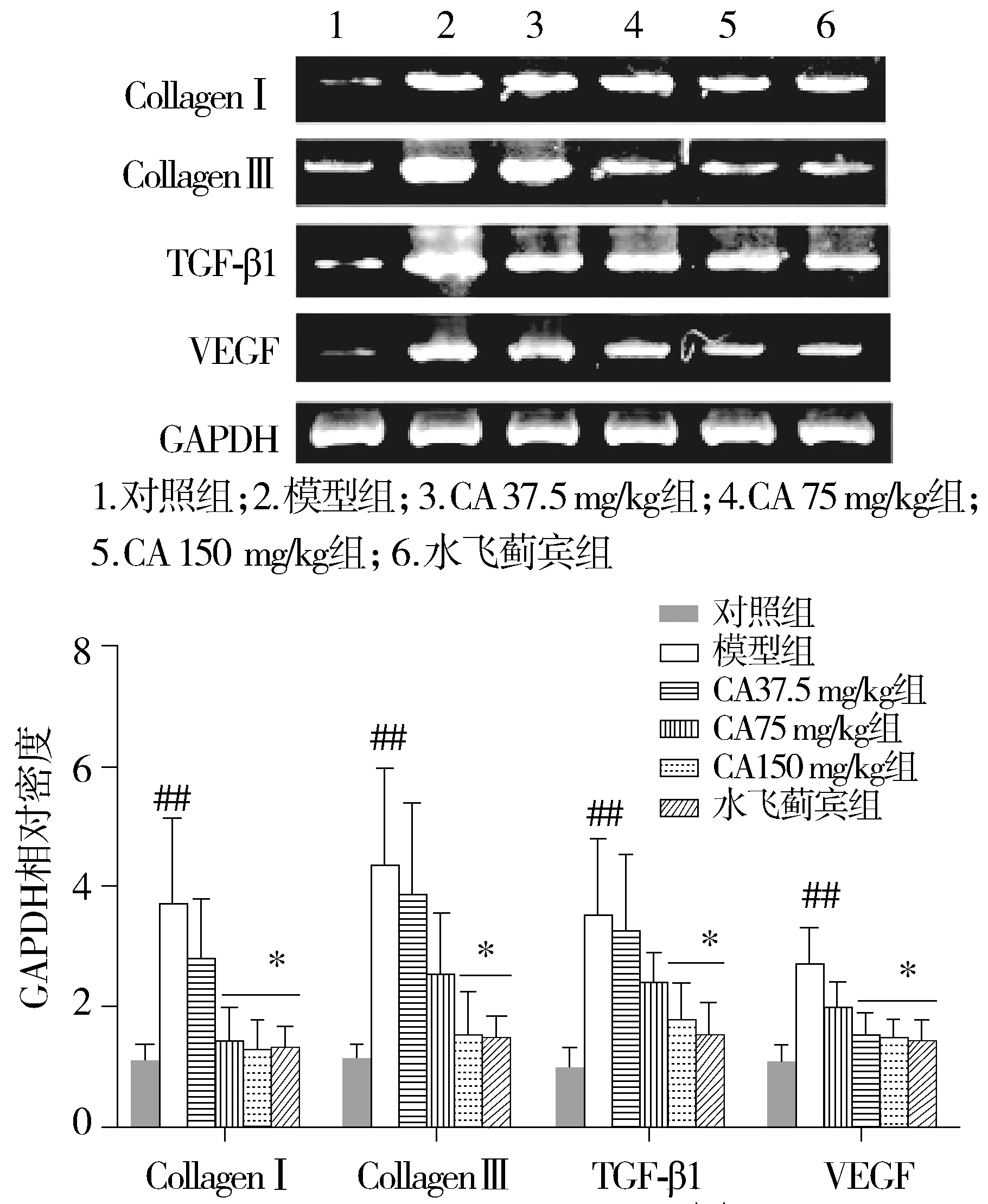
与对照组比较,##P<0.01;与模型组比较,*P<0.05图4 绿原酸对胆总管结扎模型大鼠肝脏Ⅰ和Ⅲ型胶原、TGF-β1及VEGF基因表达影响Figure 4 Effects of chlorogenic acid(CA) on collagen Ⅰ,collagen Ⅲ,TGF-β1, and VEGF mRNA in the liver of BDL rats
3 讨论
本研究表明绿原酸能对胆总管结扎导致的肝纤
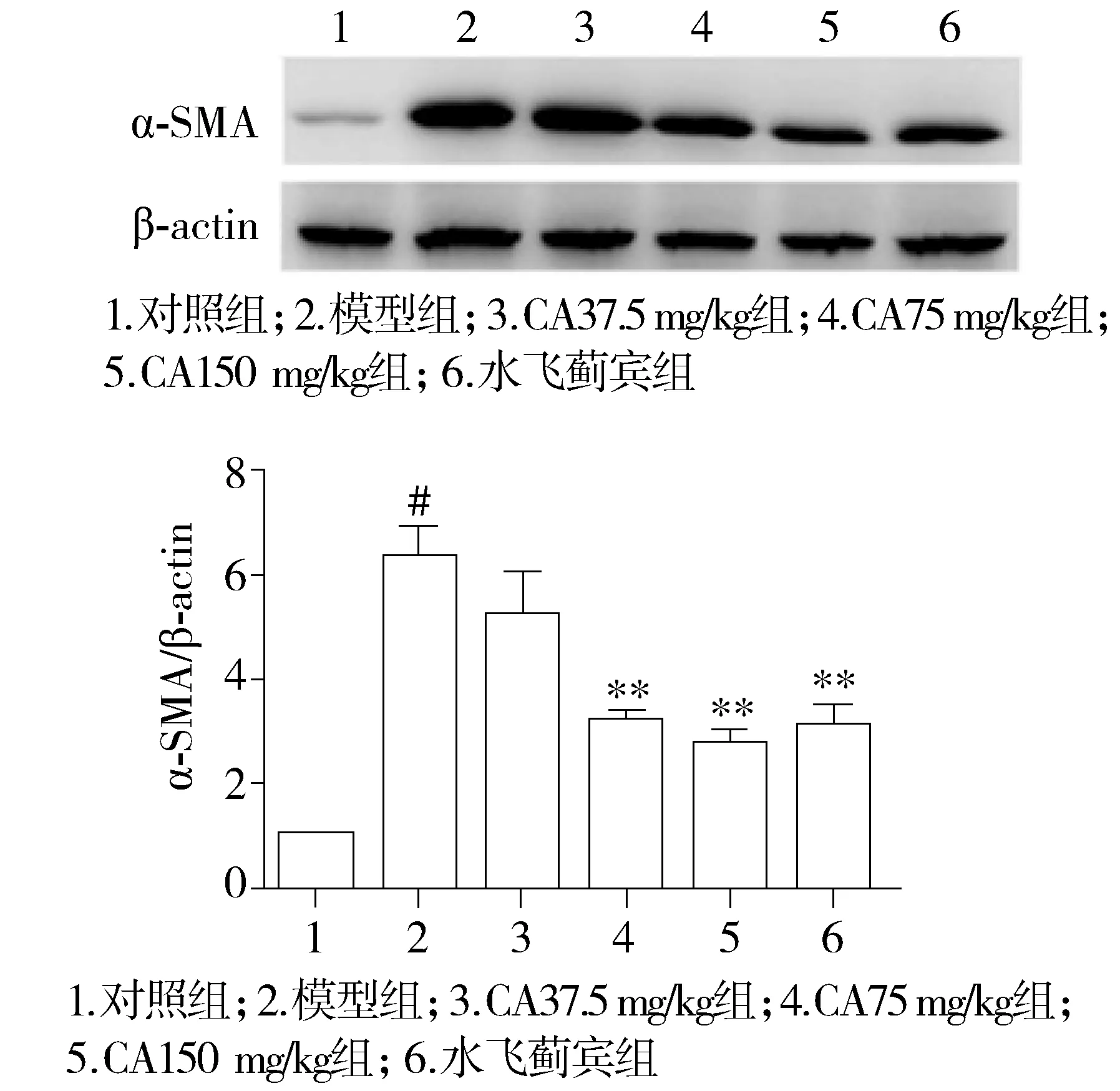
与对照组比较,#P<0.001;与模型组比较,**P<0.01图5 绿原酸对胆总管结扎模型大鼠肝脏α-SMA蛋白表达的影响Figure 5 Effects of chlorogenic acid(CA) on α-SMA protein expression in the liver of BDL rats
维化大鼠模型具有保护作用。中剂量和高剂量绿原酸可显著降低大鼠肝脏指数,提示绿原酸可缓解胆总管结扎导致引发的肝肿大。HE染色和Masson染色病理结果显示,绿原酸可显著抑制肝脏内炎症反应和纤维化程度。低剂量的绿原酸(37.5 mg/kg)对治疗肝纤维化效果不明显,而高剂量的绿原酸(75-150 mg/kg剂量范围)可显著改善肝纤维化程度。这与高剂量的绿原酸(70-140 mg/kg剂量范围)对四氯化碳(CCl4)导致的肝纤维化有明显的抑制作用相一致[8]。此外,本研究表明高剂量绿原酸能导致α-SMA蛋白表达降低。α-SMA蛋白的表达是HSC激活的标志,活化的HSC高表达α-SMA与其自身获得收缩能力有关[9]。抑制α-SMA蛋白的表达可直接或间接抑制HSC的激活或诱导其凋亡,进而抑制肝纤维化发展[10]。已有文献报道,活化的HSC细胞凋亡与肝纤维化的缓解有关[11]。肝损伤后能激活枯否细胞(Kupffer cell,KC)分泌TGF-β等细胞因子,活化HSC细胞,使HSC细胞增殖,转变为肌成纤维细胞,并且合成大量的Ⅰ型胶原、Ⅲ型胶原和纤维连接蛋白等细胞外基质(ECM)成分,导致肝纤维化[12,13]。1998年Schuppan等[14]曾报道,TGF-β抗体静脉注射治疗结扎胆总管造成的大鼠肝纤维化获得较好的效果。TGF-β被众多的研究认为是最主要的致肝纤维化介质,TGF-β能刺激Ⅰ、Ⅲ型胶原纤维连接蛋白的合成[15,16]。在本实验中,绿原酸治疗组的Collagen Ⅰ、Collagen Ⅲ、TGF-β1、VEGF基因的表达低于模型组,表明绿原酸能够改善肝纤维化程度,其作用机制可能与绿原酸能够抑制肝纤维化相关因子表达有关。
绿原酸可以促进HSC细胞的凋亡,抑制纤维化肝组织胶原的产生与沉积减轻肝纤维化,降低肝脏损伤程度。促进活化的HSC细胞的凋亡一直被认为是治疗肝纤维化的有效措施[17]。细胞凋亡的发生是由基因调控的,Bax和Bcl-2以及Bcl-xl和Bcl-xs是两对能促进和抑制细胞凋亡的代表基因[18]。Novo等[19]的研究认为肝组织中Bax/Bcl-2比值决定着 HSC凋亡的调控方向,当Bax/Bcl-2 比值较高(>23/29)时,诱导HSC凋亡;比值较低(<23/29)时,HSC的凋亡受到抑制。因此,下一步应探究在阻塞性黄疸大鼠中,绿原酸是否影响这些基因的表达从而影响HSC细胞的凋亡。
本研究结果表明绿原酸能抑制总胆管结扎引起的肝损伤,尽管尚未完全明确其作用机制,但该研究表明绿原酸能通过抑制TGF-β1、VEGF和α-SMA的表达从而改善肝纤维化。因此,绿原酸可作为治疗肝纤维化的潜在药物。
[1] Chen Y,Zong C,Guo Y,etal.Hydrogen-rich saline may be an effective and specific novel treatment for osteoradionecrosis of the jaw[J].Ther Clin Risk Manag,2015,11:1581-1585.
[2] Ghatak S,Biswas A,Dhali GK,etal.Oxidative stress and hepatic stellate cell activation are key events in arsenic induced liver fibrosis in mice[J].Toxicol Appl Pharmacol,2011,251(1):59-69.
[3] Lu HT,Jiang Y,Chen F.Application of preparative high-speed counter-current chromatography for separation of chlorogenic acid from Flos Lonicerae[J].J Chromatogr A,2004,1026(1/2):185-190.
[4] 戚晓渊,史秀灵,高银辉,等.绿原酸抗肝纤维化作用的研究[J].中国实验方剂学杂志,2011,17(15):139-143.
[5] 黄伟炜,陈一明,宫晓光,等.绿原酸对阻塞性黄疸大鼠肝纤维化的治疗作用及其机制[J].环球中医药,2012,5(8):561-565.
[6] Xu Y,Chen J,Yu X,etal.Protective effects of chlorogenic acid on acute hepatotoxicity induced by lipopolysaccharide in mice[J].Inflamm Res,2010,59(10):871-877.
[7] Zheng Z,Sheng Y,Lu B,etal.The therapeutic detoxification of chlorogenic acid against acetaminophen-induced liver injury by ameliorating hepatic inflammation[J].Chem Biol Interact,2015,238:93-101.
[8] 叶霖财,肖智勇,周文霞,等.四氯化碳致肝纤维化动物模型实验条件的优化[J].军事医学科学院院刊,2010,34(4):340-344.
[9] Friedman SL.Hepatic stellate cells:protean,multifunctional,and enigmatic cells of the liver[J].Physiol Rev,2008,88(1):125-172.
[10] Ramirez AM,Wongtrakool C,Welch T,etal.Vitamin D inhibition of pro-fibrotic effects of transforming growth factor β1 in lung fibroblasts and epithelial cells[J].J Steroid Biochem Mol Biol,2010,118(3):142-150.
[11] Iredale JP.Hepatic stellate cell behavior during resolution of liver injury[J].Semin liver Dis,2001,21(3):427-436.
[12] 黄艳,黄成,李俊.肝纤维化病程中Kupffer细胞分泌的细胞因子对肝星状细胞活化增殖,凋亡的调控[J].中国药理学通报,2010,26(1):9-13.
[13] Issa R,Zhou X,Constandinou CM,etal.Spontaneous recovery from micronodular cirrhosis:evidence for incomplete resolution associated with matrix cross-linking[J].Gastroenterology,2004,126(7):1795-1808.
[14] Schuppan D,Strobel D,Hahn EG.Hepatic fibrosis-therapeutic strategies[J].Digestion,1998,59(4):385-390.
[15] Dooley S,Delvoux B,Lahme B,etal.Modulation of transforming growth factor b response and signaling during transdifferentiation of rat hepatic stellate cells to myofibroblasts[J].Hepatology,2000,31(5):1094-1106.
[16] Seong J,Kim SH,Chung EJ,etal.Early alteration in TGF-β mRNA expression in irradiated rat liver[J].Int J Radiat Oncol Biol Phys,2000,46(3):639-643.
[17] Li D,Friedman SL.Liver fibrogenesis and the role of hepatic stellate cells:new insights and prospects for therapy[J].J Gastroenterol Hepatol,1999,14(7):618-633.
[18] Bataller R,Brenner DA.Hepatic stellate cells as a target for the treatment of liver fibrosis[J].Semin Liver Dis,2001,21(3):437-451.
[19] Novo E,Marra F,Zamara E,etal.Overexpression of Bcl-2 by activated human hepatic stellate cells:resistance to apoptosis as a mechanism of progressive hepatic fibrogenesis in humans[J].Gut,2006,55(8):1174-1182.
Effects of chlorogenic acid on hepatic fibrosis in the rats with obstructive jaundice
WU Duohu, BAO Chuanyu, LI Longhe, ZOU Yongping, YUAN Wei, WANG Desen, XIE Jinyuan, GONG Xiaoguang*
(DepartmentofEmergency,HainanGeneralHospital,Haikou570311,China;*Correspondingauthor,E-mail:wdhhx@126.com)
ObjectiveTo explore the protective effects of chlorogenic acid(CA) on hepatic fibrosis in rats with obstructive jaundice.MethodsA total of 66 rats were randomly divided into sham group, model group, silibinin group, low, moderate and high CA groups. The hepatic fibrosis models were established by bile duct ligation(BDL). The rats in silibinin group were treated with 50 mg/kg silibinin and the rats in CA groups were treated with 37.5, 75 mg/kg and 150 mg/kg CA for 4 weeks, respectively. In order to assess the effect of CA on liver damage and fibrosis, the liver index, HE and Masson staining were observed. Moreover, the mRNA levels of collagen Ⅰ, Ⅲ, VEGF and TGF-β1 were detected by RT-PCR, and the level of α-SMA was detected by Western blot.ResultsThe liver index in model group increased highly compared to sham group(P<0.001), and there was obvious pathological changes in liver tissues and hepatic fibrosis. The liver index in moderate and high dose groups significantly deceased compared to model group(P<0.01), and the inflammatory cell infiltration and the damage of lobuli hepatic was reduced. The expression of collagen Ⅰ, collagen Ⅲ, VEGF and TGF-β1 mRNA, and α-SMA protein were decreased in high dose group(P<0.01).ConclusionThe results suggest that CA may exhibit a therapeutic potential for liver fibrosis by inhibiting the production of TGF-β1, VEGF and α-SMA.
chlorogenic acid; hepatic fibrosis; collagen Ⅰ
2014年海南省应用技术研发与示范推广专项(ZDXM2014066)
吴多虎,男,1972-12生,本科,副主任医师
2016-07-06
R575
A
1007-6611(2016)11-0963-05
10.13753/j.issn.1007-6611.2016.11.001

