结直肠癌中AQP3的表达及其与临床预后的关系
雷 星, 陈 硕, 单 涛*
(1延安大学附属医院普外科,延安 716000; 2西安交通大学第二附属医院普通外科; *通讯作者,E-mail:shantao820304@163.com)
结直肠癌中AQP3的表达及其与临床预后的关系
雷 星1, 陈 硕2, 单 涛2*
(1延安大学附属医院普外科,延安 716000;2西安交通大学第二附属医院普通外科;*通讯作者,E-mail:shantao820304@163.com)
目的 探讨水通道蛋白-3(AQP3)的表达与结直肠癌临床病理及预后关系。 方法 收集术前未予化疗治疗的临床病例资料齐全的原发性结直肠癌病例,取癌组织、癌旁组织、正常组织各40例,采用免疫组化法检测AQP3的表达。比较AQP3表达与年龄、肿瘤大小、临床分期、肿瘤部位、淋巴结转移、病理类型之间的关系,并结合随访资料分析AQP3表达与否和预后的关系。 结果 40个肿瘤标本中,11例(27.5%)AQP3高表达,28例(70.0%)中度表达,1例(2.5%)无AQP3染色。癌旁和正常组织中AQP3阳性表达分别为4例(10.0%)和2例(5.0%)。AQP3的表达还与TNM分期(P=0.007)、淋巴结转移(P=0.009)、远处转移(P=0.000)成正相关。在不同年龄、性别、组织学分级和肿瘤大小中AQP3表达没有显著性差异(P>0.05)。除此之外,AQP3阴性组比阳性组明显具有生存优势。 结论 AQP3可能是预测结直肠癌预后的良好指标。
结直肠癌; 水通道蛋白3(AQP3); 预后; 免疫组化
结肠癌是常见的恶性肿瘤之一,近年来由于诊治技术的提高,使得结肠癌的早期诊断治疗有了显著的提高,尽管在诊断和治疗中取得一定进展,但结直肠癌仍严重影响生命健康[2]。因此,寻找干预治疗的新靶向非常重要。
近年来,越来越多的研究表明,肿瘤的生长、进展、侵袭和转移依赖于肿瘤微环境和肿瘤代谢[3]。水分子在肿瘤的进展中发挥显著的作用,这一认识对于制定抗肿瘤治疗方案非常重要[4]。水通道蛋白是具有分泌和吸收功能的上皮细胞运输水的一类水膜通道,某些亚型也参与其他分子的运输,如甘油和尿素。目前,在哺乳动物中有13种AQP成员,其中,AQP0、AQP1、AQP2、AQP4、AQP5、AQP6、AQP8主要是水选择性,而AQP3、AQP7、AQP9、AQP10、AQP11、AQP12也可以输送甘油和其他小分子溶质[5]。AQPs基于其特定的组织定位在几种类型肿瘤中表达有所不同,AQP1的表达通常与脑肿瘤相关[6]。王璐等[7]研究发现AQP3表达与皮肤鳞状细胞癌的分化程度相关,在AQP3敲除小鼠的研究中,AQP3基因缺失延缓致癌物诱导皮肤肿瘤形成。通过AQP3进行的甘油转运有助于细胞增殖和肿瘤发生中ATP(adenosine triphosphate)的生成[8]。AQP5可能参与细胞增殖而广泛过表达于胰腺癌中[9]。
AQP3在结肠癌组织中的表达与肿瘤转移有关,这表明,AQP3过表达在肿瘤进展中发挥一定作用。然而,AQP3在结直肠癌中的表达和临床意义尚未完全阐明。为了评估AQP3作为结直肠癌的一种新型预后标志物的潜力,我们使用免疫组织化学检测结直肠癌临床样本中AQP3的表达,进一步分析AQP3的表达与结直肠癌临床病理特征及预后的关系。
1 材料与方法
1.1 材料
选取延安大学附属医院普外科2014-08~2016-05的40例结直肠癌患者(结肠20例,直肠20例)的肿瘤组织,40 ml/L的福尔马林固定。其中,男性20例,女性20例,手术时的年龄范围35-74岁(中位年龄为56.4岁)。样本的组织学类型均为结直肠腺癌,肿瘤分期和组织学分级均根据国际抗癌协会的分类记录。40例标本中,Ⅰ期3例、Ⅱ期11例、Ⅲ期22例、Ⅳ期4例。病理分级如下:5例Ⅰ级、20例Ⅱ级、15例Ⅲ级。对所有的患者进行随访,随访中位时间为14个月(3-36个月)。所有的研究均由延安大学人体试验委员会批准,受试人员均签署由中国延安大学人体试验委员会伦理审查委员会批准的知情同意书。
1.2 免疫组化
检测AQP3蛋白的免疫组化采用标准化的链霉亲和过氧化物酶的方法,组织切片(4 μm)在适当浓度的一抗中孵育过夜,次日,切片在生物素标记的羊抗兔IgG中孵育30 min,随后在过氧化酶标记的链霉亲和素室温孵育20 min。用0.02%的3,3′-二氨基联苯胺在50 mmol/L Tris-HCl缓冲液(pH7.6)中染色5-7 min,经苏木精复染、水冲洗、脱水、清除,封片。免疫染色的阴性对照用非免疫山羊或兔血清替代一抗,显微镜观察,抗AQP3和β-actin抗体购自美国Santa Cruz生物公司。
1.3 结果判断标准
使用DA KO Hercept Test 评分方法:(-),无细胞染色或少于30%的肿瘤细胞细胞膜(浆)较弱染色;(+),大于30%的肿瘤细胞细胞膜(浆)部分较弱染色;(++),大于30%的肿瘤细胞细胞膜(浆)完全较弱到中等染色;(+++)大于30%的肿瘤细胞细胞膜完全强染色。(-)和(+)的判为AQP3表达阴性,而评分为(++)和(+++)的判为AQP3表达阳性。
1.4 统计学分析
采用χ2检验或双侧Fisher精确检验分析方法。采用Kaplan-Meier计算生存率、Log-rank检验进行差异性检验。选择有显著性差异的因素逐步建立Cox多元比例风险模型,以确定其预后价值。P<0.05认为差异有统计学意义,所有的统计学分析采用SPSS13(SPSS,Chicago)软件。
2 结果
2.1 结直肠癌中AQP3蛋白的表达
为确定AQP3在结直肠癌中的表达状态,首先用免疫组化评估结直肠癌患者的肿瘤标本、癌旁组织和正常组织。研究结果显示AQP3在病例组中11例(27.5%)强表达,28例(70.0%)中度表达,仅偶尔在癌旁组织[4(10.0%)]和正常组织[1(5.0%)]中检测到(见图1)。
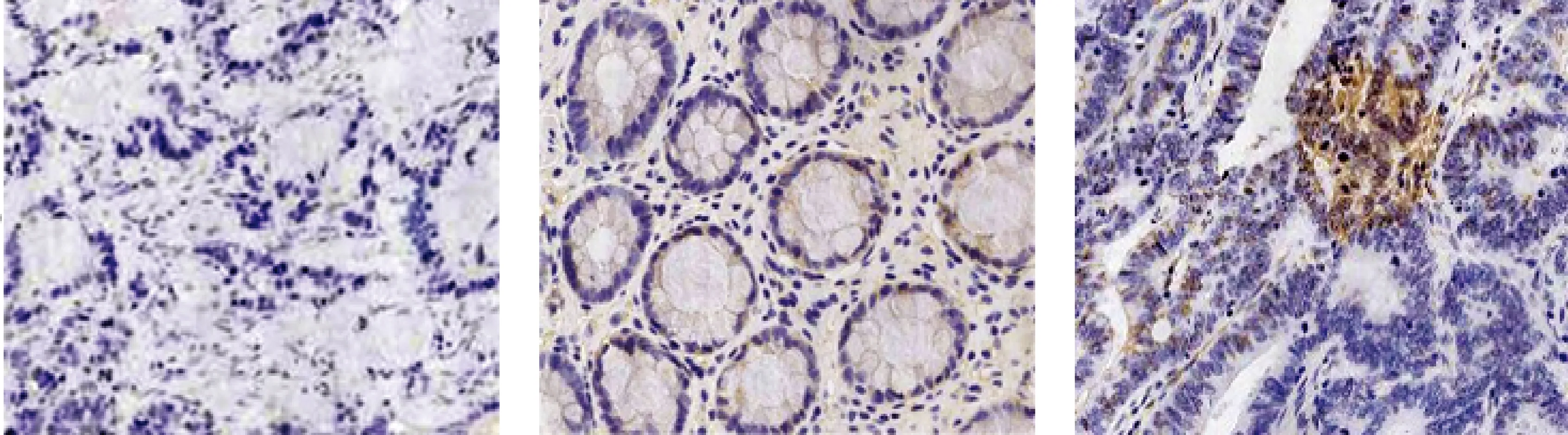
A.正常结直肠组织 B.癌旁组织 C.结直肠癌组织图1 结直肠癌、癌旁和正常组织间质中AQP3的表达水平 (×400) Figure 1 AQP3 expression in colorectal cancer by immunohistochemistry staining (×400)
2.2 AQP3表达与临床病理特征之间的关系
AQP3在Ⅰ-Ⅱ期病例中的表达水平显著低于在Ⅲ期和Ⅳ期中的表达水平(P=0.007);在有无淋巴结转移(P=0.009)和有无远处转移(P=0.000)间AQP3表达差异有统计学意义;AQP3表达在不同年龄(P=0.900)、不同性别(P=0.830)、不同组织学分级(P=0.954)和不同肿瘤大小(P=0.161)间差异无统计学意义(见表1)。
表1 结直肠癌组织中AQP3表达与临床病理因素关系 例(%)
Table 1 Association between AQP3 protein expression and clinicopathological factors in pancreatic cancers cases(%)
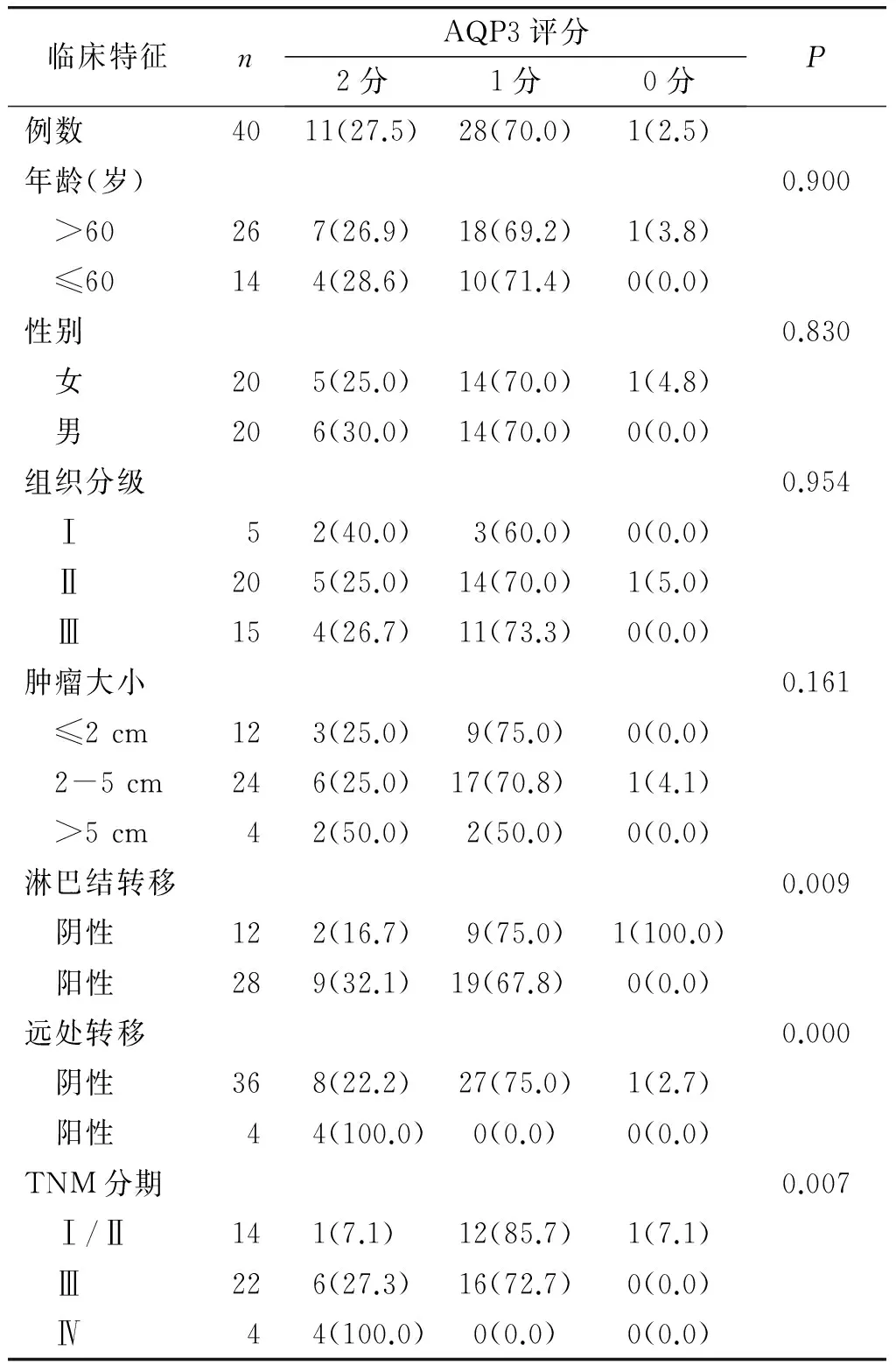
临床特征nAQP3评分2分1分0分P例数4011(27.5)28(70.0)1(2.5)年龄(岁)0.900 >60267(26.9)18(69.2)1(3.8) ≤60144(28.6)10(71.4)0(0.0)性别0.830 女205(25.0)14(70.0)1(4.8) 男206(30.0)14(70.0)0(0.0)组织分级0.954 Ⅰ52(40.0)3(60.0)0(0.0) Ⅱ205(25.0)14(70.0)1(5.0) Ⅲ154(26.7)11(73.3)0(0.0)肿瘤大小0.161 ≤2cm123(25.0)9(75.0)0(0.0) 2-5cm246(25.0)17(70.8) 1(4.1) >5cm42(50.0)2(50.0)0(0.0)淋巴结转移0.009 阴性122(16.7)9(75.0)1(100.0) 阳性289(32.1)19(67.8) 0(0.0)远处转移0.000 阴性368(22.2)27(75.0)1(2.7) 阳性44(100.0)0(0.0)0(0.0)TNM分期0.007 Ⅰ/Ⅱ141(7.1) 12(85.7)1(7.1) Ⅲ226(27.3)16(72.7)0(0.0) Ⅳ44(100.0)0(0.0)0(0.0)
2.3 AQP3与结直肠癌预后的关系
为了确定AQP3与结直肠癌预后关系,对基于AQP3表达状态的患者累积生存率进行了分析,将AQP3弱染色和无染色定为阴性,强染色定位阳性。AQP3阴性患者(n=29)1年累积生存率为100.0%(中位时间,30.2个月),而AQP3阳性患者(n=11)的累积生存率为78.6%(中位时间,20.0个月),二者间有显著性差异(P=0.011,见图2)。
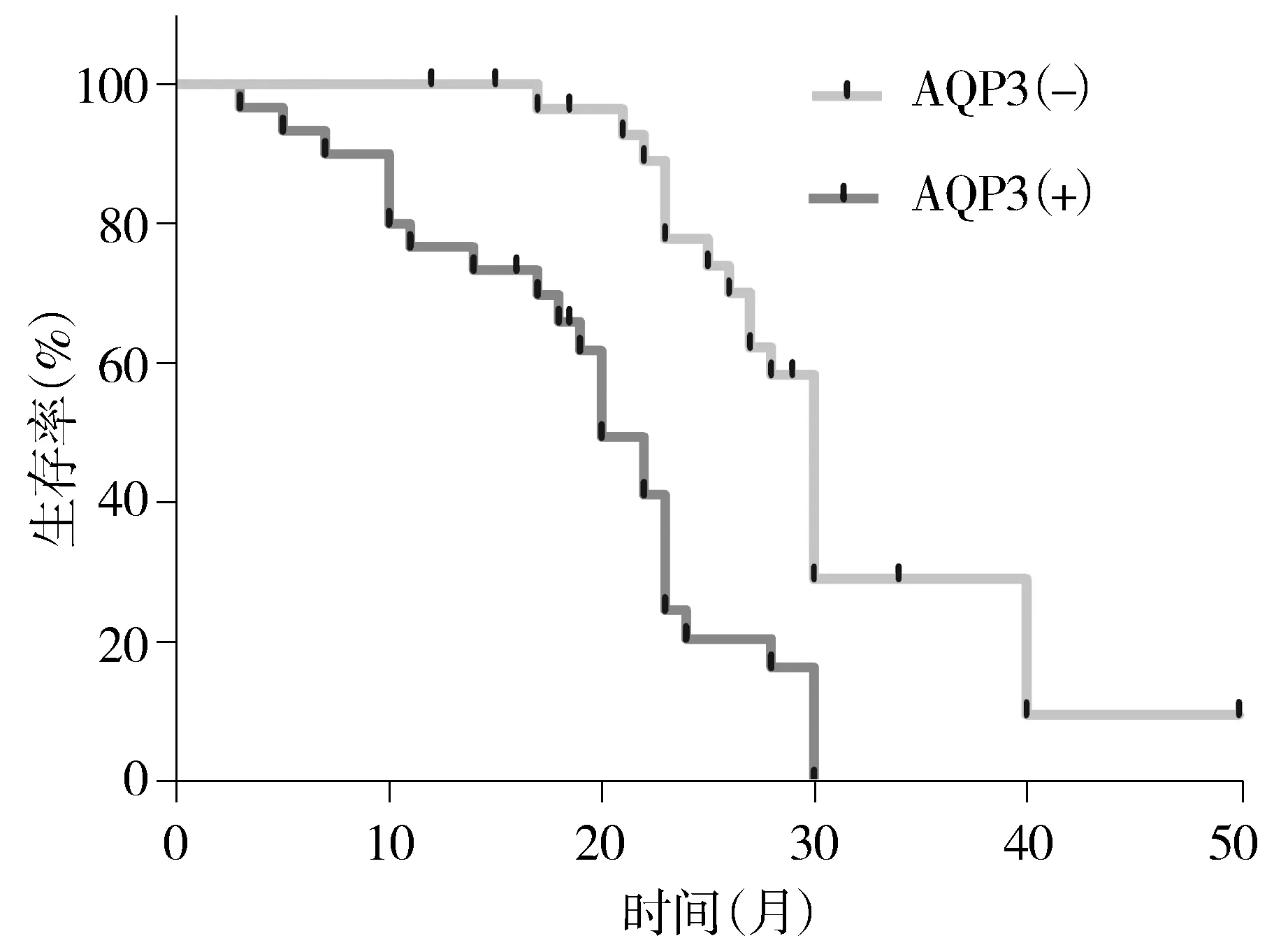
图2 两组患者结直肠癌组织中AQP3表达阳性组和阴性组生存曲线图 Figure 2 Kaplan-Meier analysis of the overall postoperative survival curves in colorectal cancer patients with positive or negative AQP3 protein expression
多因素分析显示,淋巴结转移(P=0.009)和TNM分期(P=0.007)是结直肠癌患者总生存期的独立预后因素;肿瘤大小等其他临床参数不是独立的预后因素(见表2)。
表2 Cox多元比例风险预后模型
Table 2 Prognostic factors in Cox multivariate analysis
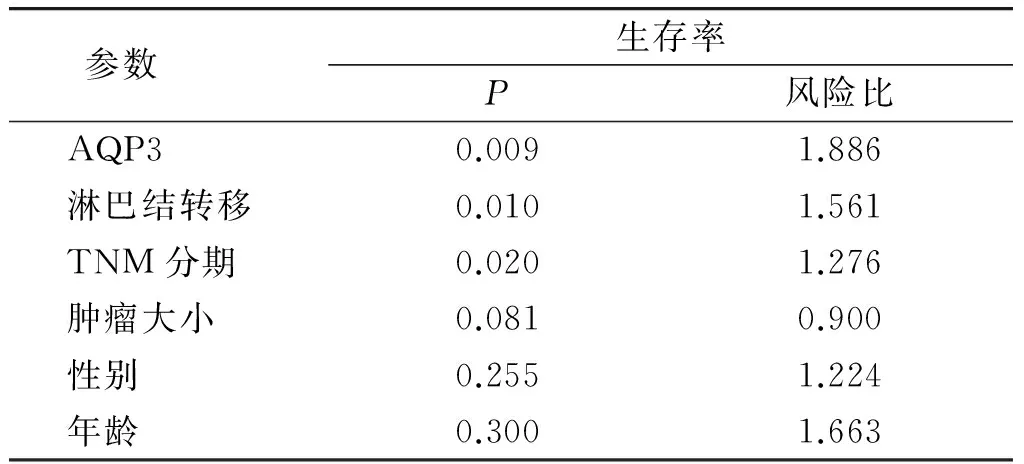
参数 生存率P风险比AQP30.0091.886淋巴结转移0.0101.561TNM分期0.0201.276肿瘤大小0.0810.900性别0.2551.224年龄0.3001.663
3 讨论
水通道蛋白(aquaporin,AQPs)是广泛存在于原核和真核生物细胞膜、高效选择性转运水分子的特异通道[6]。肿瘤是机体在各种致瘤因素的作用下,细胞在基因水平上失去其生长的正常调控,导致新生物生成的过程。细胞所依赖的各种代谢都需要水分子的参与,而水通道蛋白可以快速特异地转运水分子。
AQP3,最初认为生理条件下表达在皮肤角质细胞中[11],AQP3敲除小鼠会因为角质细胞中缺少甘油及水分而出现皮肤弹性及屏障功能受损[10],与光化性角化病、Bowen病和浸润性皮肤鳞状细胞癌的发生有密切联系[12]。AQP3在结直肠癌、宫颈癌、肾癌、皮肤肿瘤、食道癌、肝癌等多种肿瘤中也具有高表达[10]。但AQP3在肿瘤进展具体作用机制还不完全明确。在胃癌细胞系中AQP3可通过Wnt/GSK-3beta/beta-catenin信号通路促进肿瘤细胞迁移[13],还可以通过PI3K/Akt信号通路减少肿瘤细胞水和能量代谢[14]。在乳腺癌细胞中,AQP3通过调控CXCL12/CXCR4依赖的H2O2转运影响乳腺癌细胞的迁移能力[15]。在前列腺癌中,AQP3可介导ERK1/2激活、提高MMP3表达,从而促进肿瘤细胞的运动和浸润能力[16]。
然而,AQP3在结直肠癌中的表达和临床意义尚未完全阐明。本研究中检测到的结直肠组织中AQP3表达与以前研究结果[17]相一致。此外,我们分析了AQP3与结直肠癌临床病理特征的相关性,结果表明,AQP3与患者的年龄、性别无显著性相关,而与肿瘤TNM分期、淋巴结转移和远处转移相关。本研究初步证实了AQP3在结直肠癌中可能的作用地位,具体AQP3通过何种机制影响结直肠癌进展,有必要在细胞分子生物学及动物实验中进一步探讨研究,这也是课题组下一步的方向。
总之,本阶段研究提示AQP3蛋白在结直肠癌中表达上调,与高TNM分期、淋巴结转移和不良预后紧密相关。因此,AQP3可作为结直肠癌侵袭和转移的新的生物标志物。
[1] Torre LA,Bray F,Siegel RL,etal.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(5):87-108.
[2] Chen W,Zheng R,Baade PD,etal.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[3] Aronld M,Sierra MS,Laversanne M,etal.Global patterns and trends in colorectal cancer incidence and mortality[J].Gut,2016:Epub ahead of print.
[4] Koontongkaew S.The tumor microenvironment contribution to development,growth,invasion and metastasis of head and neck squamous cell carcinomas[J].J Cancer,2013,4:66-83.
[5] Ribatti D,Ranieri G,Annese T,etal.Aquaporins in cancer[J].Biochim Biophys Acta,2014,1840:1550-1553.
[6] Ishibashi K,Hara S,Kondo S.Aquaporin water channels in mammals[J].Clin Exp Nephrol,2009,13:107-117.
[7] 王璐,朱莹,袁耀东,等,皮肤鳞状细胞癌组织中埃兹蛋白和水通道蛋白3的表达[J].郑州大学学报,2012,47(1):23-26.
[8] 李白翎,金磊,钟铿,等.水通道蛋白3在非小细胞肺癌中的表达及与临床病理相关性的研究[J].中国肺癌杂志,2012,15(7):404-408.
[9] 毛春蓉,仲建新,练云,等.水通道蛋白在卵巢上皮癌中的表达及意义[J].江苏医药,2012,38(4):412-415.
[10] Papadopoulos MC,Saadoun S.Key roles of aquaporins in tumor biology[J].Biochim Biophys Acta,2015,1848:2576-2583.
[11] 郭晓强.水甘油通道3介导的甘油运输与皮肤功能[J].第二军医大学学报,2009,30(12):1416-1419.
[12] 王小勇,陶承军,任金平,等.水通道蛋白在光化性角化病、Bowen病和浸润性鳞状细胞癌中的表达及其意义[J].温州医科大学学报,2015,875-878.
[13] Zhou Y,Wang Y,Wen J,etal.Aquaporin 3 promotes the stem-like properties of gastric cancer cells via Wnt/GSK-3beta/beta-catenin pathway[J].Oncotarget,2016,7:16529-16541.
[14] Li Z,Li B,Zhang L,etal.The proliferation impairment induced by AQP3 deficiency is the result of glycerol uptake and metabolism inhibition in gastric cancer cells[J].Tumour Biol,2016,37:9169-9179.
[15] Satooka H,Hara-Chikuma M.Aquaporin-3 controls breast cancer cell migration by regulating hydrogen peroxide transport and its downstream cell signaling[J].Mol Cell Biol,2016,36:1206-1218.
[16] Chen J,Wang Z,Xu D,etal.Aquaporin 3 promotes prostate cancer cell motility and invasion via extracellular signal-regulated kinase 1/2-mediated matrix metalloproteinase-3 secretion[J].Mol Med Rep,2015,11:2882-2888.
[17] Li A,Lu D,Zhang Y,etal.Critical role of aquaporin-3 in epidermal growth factor-induced migration of colorectal carcinoma cells and its clinical significance[J].Oncol Rep,2013,29:535-540.
AQP3 expression in colorectal carcinoma and its relationship with clinical prognosis
LEI Xing1,CHEN Shuo2,SHAN Tao2*
(1DepartmentofGeneralSurgery,AffiliatedHospitalofMedicalCollege,Yan’anUniversity,Yan’an716000,China;2DepartmentofGeneralSurgery,SecondAffiliatedHospitalofMedicalCollege,Xi’anJiaotongUniversity;*Correspondingauthor,E-mail:shantao820304@163.com)
ObjectiveTo investigate AQP3 expression in colorectal carcinoma and its relationship with clinical prognosis.MethodsClinical data and followed-up data from 40 colorectal cancer patients without chemotherapy before surgery were collected. The expression of AQP3 was measured in 40 cases of colorectal cancer tissues, 40 cases of para-neoplastic tissues and 40 cases of normal tissues by immunohistochemistry(IHC). Then the correlation between AQP3 expression and clinicopathological parameters and prognosis was analyzed.ResultsOf 40 tumor specimens, 11(27.5%) had high expression of AQP3, 28(64.4%) exhibited moderate(intermediate) staining, and 1(2.5%) showed no AQP3 expression. AQP3 was only occasionally detected in para-neoplastic tissues[4(10.0%)] and normal tissues[2(5.0%)]. AQP3 overexpression was associated with TNM stage(P=0.007), lymph node metastasis(P=0.009), and distant metastasis(P=0.000). The relationships between age, gender, histological grade and tumor size and expression of AQP3 were not significant(P>0.05). In addition, patients with negative AQP3 expression had a superior cumulative survival rate compared to patients with positive AQP3 expression.ConclusionAQP3 may be used as a novel biomarker for predicting colorectal cancer prognosis.
colorectal cancer; aquaporin 3; prognosis; immunohistochemistry
国家自然科学基金资助项目(81402583);陕西省自然科学基金资助项目(2014JQ4165);西安交通大学校基金资助项目(xjj2014077)
雷星,男,1979-03生,硕士,副主任医师,E-mail:leisaner@163.com
2016-08-27
R735.35
A
1007-6611(2016)11-1008-04
10.13753/j.issn.1007-6611.2016.11.012

