大黄散质量标准研究
王晓剑 , 张 悠,王晓红
(1首都医科大学附属北京友谊医院药剂科, 北京 100050; 2北京市丰盛中医骨伤专科医院内科; 3江苏省第二中医院内分泌科; *通讯作者,E-mail:wxjhxj2006@163.com)
大黄散质量标准研究
王晓剑1*, 张 悠2,王晓红3
(1首都医科大学附属北京友谊医院药剂科, 北京 100050;2北京市丰盛中医骨伤专科医院内科;3江苏省第二中医院内分泌科;*通讯作者,E-mail:wxjhxj2006@163.com)
目的 建立大黄散的质量标准。 方法 采用薄层色谱法(TLC)法对大黄散中黄连进行定性鉴别,采用HPLC法检测大黄素和大黄酚的含量。色谱柱:Kromasil ODS C18(200 mm×4.6 mm,5 μm),流速:1.0 ml/min,流动相:甲醇-0.1%磷酸溶液(70 ∶30),pH 2.3,检测波长为256 nm。 结果 薄层色谱中,黄连斑点清晰可见,分离度符合要求,阴性无干扰;大黄素和大黄酚含量分别在36.4-182.0 ng,70.3-351.5 ng范围内线性关系良好,平均加样回收率分别为104.9%(RSD=3.3%,n=6)、99.3%(RSD=2.4%,n=6),精密度RSD均为0.9%。 结论 本文构建的TLC法定性鉴别黄连及HPLC法检测大黄素和大黄酚含量的方法结果准确,重复性好,可作为大黄散的质量控制方法。
大黄散; 薄层色谱法; 高效液相色谱法; 大黄素; 大黄酚
大黄散是由大黄、黄连和黄芩三味药组成的复方制剂,收载于《外台秘要》,主治黄疸。该方目前尚无相关质量控制方法,影响了其进一步开发利用,为加强对本品的质量控制,本文采用薄层色谱法(TLC)法对黄连进行了定性鉴别,并采用高效液相色谱法(HPLC)法对大黄中大黄素、大黄酚的含量进行了测定。
1 仪器、试剂与试药
1.1 仪器
高效液相色谱仪(依利特P200Ⅱ);可见紫外分光光度计(日本岛津UV-2450型)。
1.2 试剂与试药
甲醇-色谱纯,水-纯化水,其余试剂均为分析纯,大黄素(含量测定用,批号:110756-200110)和大黄酚对照品(含量测定用,批号:110796-201319)、黄连对照药材(批号:120913-201109)、小檗碱对照品(鉴别用,批号:110713-200910),均购于中国药品生物制品检定所。
2 方法与结果
2.1 黄连的薄层色谱鉴别
2.1.1 溶液制备 供试品溶液制备:取大黄散6 g,甲醇加热回流 1 h,放冷,滤过,取滤液,即得。
对照药材溶液制备:取黄连对照药材,甲醇加热回流1 h,放冷,滤过,取滤液,即得。
对照品溶液制备:取盐酸小檗碱对照品,制成0.5 mg/ml甲醇溶液。
阴性对照品溶液制备:取黄连和黄芩,按供试品溶液的制备方法制成。
薄层色谱(附录ⅥB)试验:吸取上述供试品溶液、对照药材溶液、对照品溶液及阴性对照品溶液四种溶液各5 μl,点于同一硅胶G薄层板上,以甲苯-乙酸乙酯-甲醇-浓氨试液(9 ∶6 ∶3 ∶1)为展开剂,预饱和后展开,取出,晾干后紫外光灯365 nm下检视。
2.1.2 色谱结果 薄层色谱中,供试品与对照品相应位置显相同的1个黄色荧光斑点;在与黄连对照药材对应位置显相同颜色3个黄色荧光斑点(见图1)。

1.大黄散(批号:161001);2.大黄散(批号:161002);3.大黄散(批号:161003);4.缺黄连阴性样品;5.黄连对照药材;6.盐酸小檗碱图1 黄连薄层色谱鉴别Figure1 Thin layer chromatogram of rhizoma coptidis
2.2 大黄素和大黄酚的含量测定
2.2.1 溶液的制备 供试溶液的制备:精密称取大黄散3 g,置锥形瓶中,量取乙醇25 ml,称定重量,加热回流1 h,冷却后用乙醇补足重量,滤过。取续滤液,精密量取10 ml,挥干溶剂,以15 ml 30%乙醇-盐酸(10 ∶1)溶液为溶剂加热回流1 h,冷却,分别用三氯甲烷振摇提取4次,合并提取液,回收溶剂,残渣用无水乙醇-乙酸乙酯(2 ∶1)混合溶液溶解,移至25 ml的量瓶中,稀释至刻度,摇匀,滤过,取续滤液,备用。
对照品溶液的制备:分别精密称取大黄素和大黄酚对照品适量,加无水乙醇-乙酸乙酯(2 ∶1)混合溶液,制成大黄素8 μg/ml和大黄酚15 μg/ml的混合溶液,即得。
空白溶液的制备:取处方除大黄的药味,按成品工艺及供试品溶液的制备方法制备空白对照品溶液。
2.2.2 色谱条件及系统适用性试验 色谱柱:采用迪马Kromasil ODS C18(200 mm×4.6 mm,5 μm),大黄素和大黄酚色谱峰可基线分离;紫外全程扫描确定大黄素在256 nm处有最大吸收,故选择256 nm作为检测波长;以甲醇-0.1%磷酸溶液(70 ∶30)作为流动相,色谱图显示大黄素和大黄酚色谱峰保留时间适宜,与其他色谱峰分离度大于1.5,理论塔板数按大黄素计不得少于3 000。
2.2.3 专属性试验 取方中除大黄的药味黄连和黄芩,按大黄散制备工艺及供试品溶液制备方法制备阴性对照溶液,按正文2.2项下色谱条件进行测定,结果本品阴性对照溶液在大黄素和大黄酚色谱峰所在位置无干扰(见图2),证明本文建立的方法专属性强。
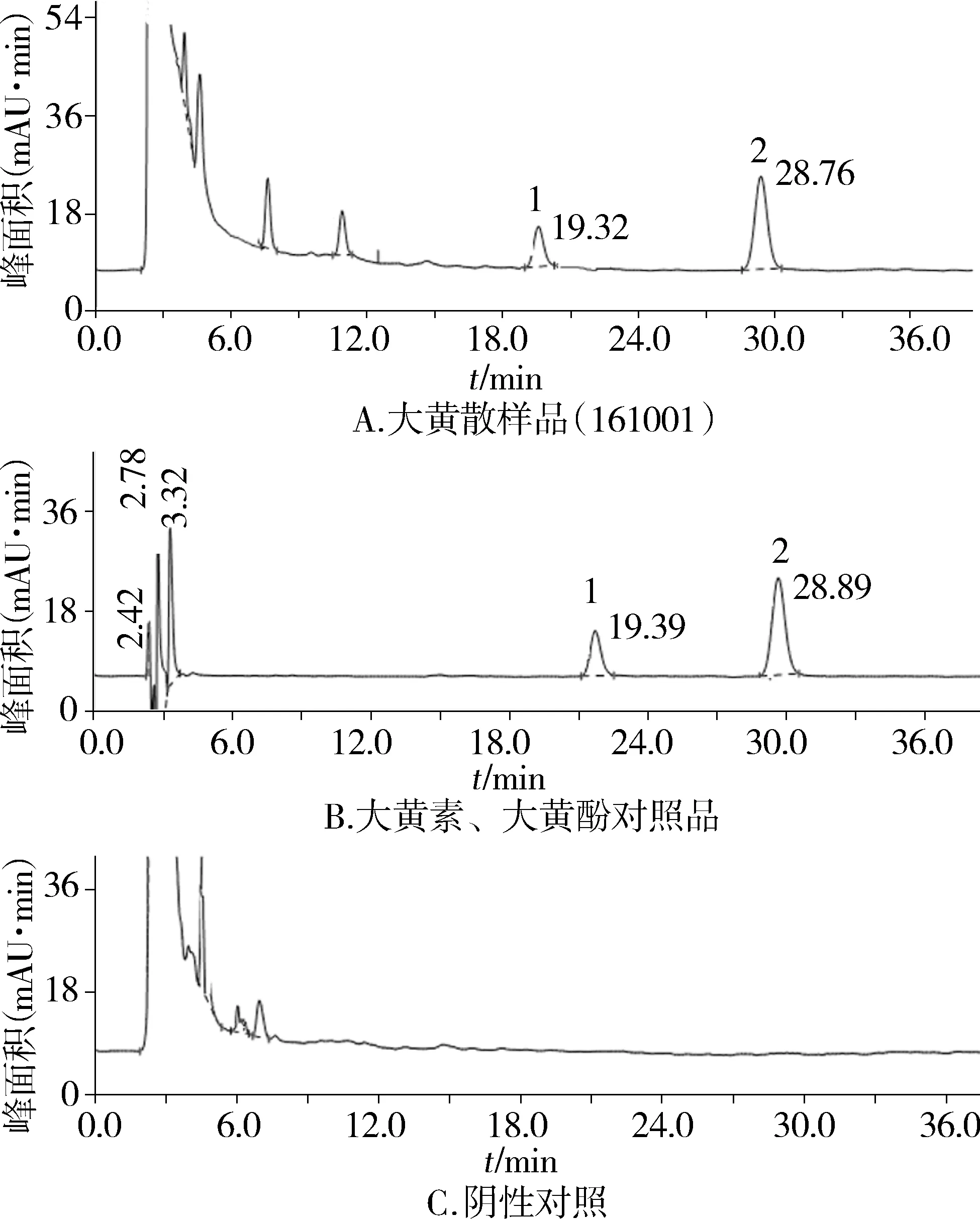
1.大黄素;2.大黄酚图2 大黄素、大黄酚HPLC图Figure 2 High performance liquid chromatogram of emodin and chrysaphanol
2.2.4 线性范围考察 分别精密称取大黄素和大黄酚对照品适量,加无水乙醇-乙酸乙酯(2 ∶1)制成含大黄素72.8 mg/L和含大黄酚140.6 mg/L的对照品溶液,分别量取 0.5,1,1.5,2,2.5 ml至10 ml量瓶中,用无水乙醇-乙酸乙酯(2 ∶1)稀释至刻度,分别进样10 μl,测定。大黄素和大黄酚进样量(ng)对峰面积作图,得直线,其大黄素回归方程为y=69.321+46.530x,r=0.999 9;大黄酚回归方程为y=189.43+135.9x,r=0.999 9;结果表明,大黄素和大黄酚分别在36.4-182.0 ng和70.3-351.5 ng范围内进样量与峰面积之间呈良好线性关系。
2.2.5 精密度考察 精密吸取同一份供试品溶液20 μl(批号:161001),在上述色谱条件下重复进样5次,结果大黄素、大黄酚峰面积RSD分别为0.9%和0.9%,表明仪器精密度良好。
2.2.6 稳定性考察 取同一份供试品溶液(批号:161001),分别在制备后0,2,6,12,24 h后依法测定大黄素和大黄酚的峰面积,结果大黄素、大黄酚峰面积RSD分别为0.8%和0.9%,表明供试品溶液在24 h内基本稳定。
2.2.7 重复性试验 取同批样品(批号:161001),依法平行测定6份,分别计算大黄素和大黄酚的总量,结果平均含量为0.534 mg/g,RSD值为2.8%,表明该方法的重复性良好。
2.2.8 回收率试验 采用加样回收方法,精密称取已知含量的样品(批号:161001)适量,分别加入一定量的大黄素和大黄酚对照品,参照2.1项下方法制备供试品溶液,依法测定,计算回收率,结果表明该法具有良好的回收率,大黄素和大黄酚平均加样回收率分别为104.9%(RSD=3.3%,n=6)和99.3%(RSD=2.4%,n=6),见表1。
表1 大黄素、大黄酚回收率试验结果 (n=6)
Table 1 Results of recovery test of emodin and chrysaphanol in Dahuang powders (n=6)
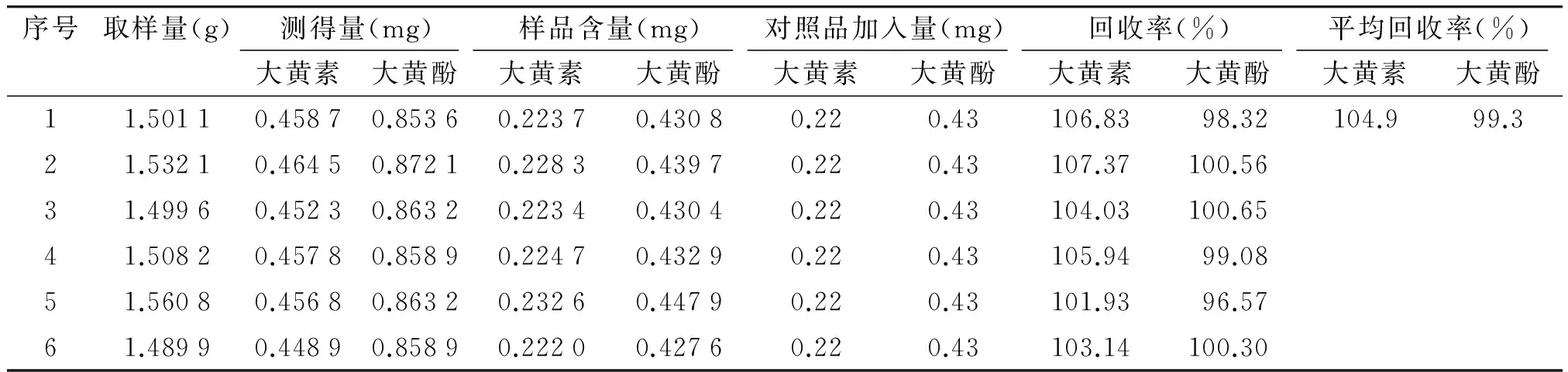
序号取样量(g)测得量(mg)样品含量(mg)对照品加入量(mg)回收率(%)平均回收率(%)大黄素大黄酚大黄素大黄酚大黄素大黄酚大黄素大黄酚大黄素大黄酚11.50110.45870.85360.22370.43080.220.43106.8398.32104.999.321.53210.46450.87210.22830.43970.220.43107.37100.5631.49960.45230.86320.22340.43040.220.43104.03100.6541.50820.45780.85890.22470.43290.220.43105.9499.0851.56080.45680.86320.23260.44790.220.43101.9396.5761.48990.44890.85890.22200.42760.220.43103.14100.30
2.2.9 大黄药材的含量测定 精密称取大黄药材0.15 g,置锥形瓶中,加乙醇25 ml,称定重量,加热回流1 h,放冷,乙醇补足减失重量,滤过,精密量取续滤液10 ml,水浴蒸干,加30%乙醇-盐酸(10 ∶1)溶液15 ml,加热回流1 h,立即冷却,三氯甲烷振摇提取4次,每次15 ml,合并三氯甲烷液,回收溶剂,残渣用无水乙醇-乙酸乙酯(2 ∶1)混合溶液溶解,移置25 ml量瓶中,并稀释至刻度,摇匀,滤过,取续滤液,即得。
按正文中的供试品含测条件进行实验,结果见表2。
表2 大黄药材含量测定结果 (n=6)
Table 2 Determination of emodin and chrysophanol in Rhubarb (n=6)
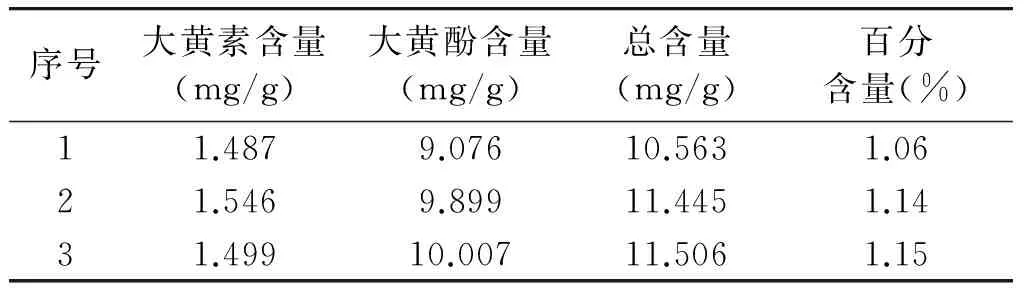
序号大黄素含量(mg/g)大黄酚含量(mg/g)总含量(mg/g)百分含量(%)11.4879.07610.5631.0621.5469.89911.4451.1431.49910.00711.5061.15
2.2.10 样品测定 按正文拟定含量测定方法,分别对10批样品进行测定,结果见表3。
表3 大黄散中大黄素、大黄酚含量测定结果 (mg/g,n=3)
Table 3 Determination of emodin and chrysophanol in Dahuang powders (mg/g,n=3)
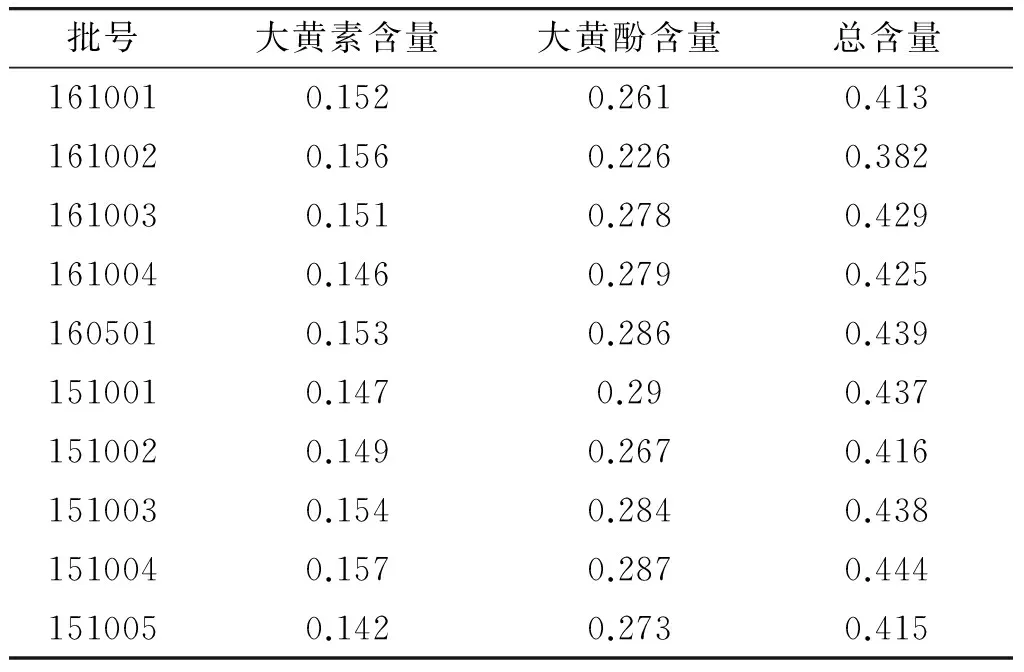
批号大黄素含量大黄酚含量总含量1610010.1520.2610.4131610020.1560.2260.3821610030.1510.2780.4291610040.1460.2790.4251605010.1530.2860.4391510010.1470.290.4371510020.1490.2670.4161510030.1540.2840.4381510040.1570.2870.4441510050.1420.2730.415
结果显示,本文所测10批大黄散中大黄素和大黄酚的平均含量为0.424 mg/g。在保证产品质量的前提下,综合考虑药材成分转移率等因素,建议本品每克含大黄以大黄素和大黄酚含量总和计不得少于0.3 mg。
3 讨论
大黄散是由大黄、黄连和黄芩三味药组成的复方制剂,收载于《外台秘要》。方中以大黄之苦寒泻热通便,泻下焦之火;黄连之苦寒泻火坚阴,泻中焦之火;黄芩之苦寒,清热除烦,泻上焦之火,又可清解少阳腑中之热。其中大黄为君药,其主要有效成分为大黄素和大黄酚等蒽醌类成分。研究表明大黄具有多种药理活性,包括调整胃肠运动、改善血液循环、清洁肠道、减少毒素吸收、保护肠屏障、调整免疫、保护器官等。现代药理学也证实大黄具有抗菌作用,且抗菌谱广、作用强。以大黄为主要药味的国家标准复方中成药品种达八百多种,且大黄已作为一个世界性药物载入多个国家的药典。
本文采用薄层色谱法对大黄散中黄连进行定性鉴别[1,2],并以方中君药大黄为研究对象,参考《中国药典》(2015年版)及文献建立了高效液相色谱法测定大黄中大黄素和大黄酚的含量[3-6],同时加入黄连的定性鉴别,可有效控制大黄散的质量。在监控药品制剂质量的同时,对投料药材的质量进行同步监控,可保证从源头控制产品质量。鉴于中药复方所含化学成分类型多样,选择以对照品和对照药材同时作为对照,可以准确检测药材,有利于提高专属性,加强中药复方质量控制。
本文构建的采用薄层色谱法定性鉴别方中黄连、采用高效液相色谱法测定大黄素和大黄酚的含量的方法结果准确,重复性好,可作为大黄散的质量控制方法,为保证其临床应用奠定基础,为进一步开发研究提供依据。
[1] 李文玮,刘东文.黄连泻心颗粒的薄层色谱鉴别研究[J].国际卫生医药导报,2008,14(16):84-85.
[2] 刘晓琳.黄连上清胶囊的薄层色谱鉴别研究[J].安徽医药,2003,7(4):303-304.
[3] 韩桂茹,赵志军,许红辉,等.多种药材与制剂中大黄酚与大黄素含量测定改进方法[J].药物分析杂志,2008,12(3):461-465.
[4] 戴作波,张建霞.HPLC法测定自制降脂胶囊中大黄蒽醌衍生物的含量[J].临床合理用药杂志,2016,9(4):23-26.
[5] 杨月娥,胡文帅,庞婕,等.道地产区大黄中5种蒽醌类化合物含量测定[J].安徽农业科学,2011,39(11):6378-6379.
[6] 高晓燕,卢建秋.HPLC-DAD法同时测定大黄中7个蒽醌类化合物的含量[J].药物分析杂志,2010,28(9):1636-1641.
Study on quality standard of Dahuang powder
WANG Xiaojian1*, ZHANG You2, WANG Xiaohong3
(1DepartmentofPharmacy,BeijingFriendshipHospital,CapitalMedicalUniversity,Beijing100050,China;2DepartmentofInternalMedicine,BeijingFengshengSpecialHospitalofTraditionalMedicalTraumatologyandOrthopaedics;3DepartmentofEndocrinology,JiangsuProvinceSecondHospitalofTCM;*Correspondingauthor,E-mail:wxjhxj2006@163.com)
ObjectiveTo establish the quality standard of Dahuang powder.MethodsRhizoma coptidis was identified by thin layer chromatography(TLC), and the contents of emodin and chrysophanol in Dahuang powder were both determined by high performance liquid chromatography(HPLC). The separation was performed on Kromasil ODS column with methanol-0.1% phosphoric acid(70 ∶30) as mobile phase and pH=2.3,and the UV detector was set at 256 nm.ResultsThe calibration curves of emodin and chrysophanol were linear in the range of 36.4-182 ng and 70.3-351.5 ng respectively. The average recoveries of emodin and chrysophanol were 104.9%(RSD=3.3%,n=6) and 99.3%(RSD=2.4%,n=6),respectively, and the RSD of precision was both 0.9%.ConclusionThe method is accurate, reliable, and can be used for the quality control of the preparation of Dahuang powder.
Dahuang powder; thin layer chromatography; high performance liquid chromatography; emodin; chrysophanol
王晓剑,男,1983-10生,硕士,药师,E-mail:wxjhxj2006@163.com
2016-05-06
R927.1
A
1007-6611(2016)11-0988-04
10.13753/j.issn.1007-6611.2016.11.006

