丹红注射液对自体脂肪颗粒移植存活率的影响
贾 垚, 王 鹏,2, 陈曦航,2, 武承兴
(1山西医科大学第一医院整形科,太原 030001; 2山西医科大学第一临床医学院; 3山西大医院整形科;*通讯作者,E-mail: 591292983@qq.com)
丹红注射液对自体脂肪颗粒移植存活率的影响
贾 垚1, 王 鹏1,2, 陈曦航1,2, 武承兴3*
(1山西医科大学第一医院整形科,太原 030001;2山西医科大学第一临床医学院;3山西大医院整形科;*通讯作者,E-mail: 591292983@qq.com)
目的 观察中药制剂丹红注射液对自体脂肪颗粒移植成活率的影响。 方法 建立SD大鼠自体脂肪颗粒移植动物模型,分为低剂量组,高剂量组和模型组。实验组分别持续肌肉注射不同剂量的丹红注射液,模型组不做处理,术后不同时间检测血液中VEGF含量。术后90 d采集脂肪移植体样本,与术前记录数据进行对比得到移植存活率;HE染色后镜下观察脂肪移植组织细胞形态和血管密度;血管内皮细胞Ⅷ因子免疫组化法观察新生血管生长情况及密度。 结果 自体脂肪颗粒移植术后90 d,实验组脂肪存活率均明显高于模型组(P<0.05)。ELISA结果显示,低剂量组和高剂量组SD大鼠血清VEGF表达各时段水平明均显高于模型组(P<0.05)。HE染色显示低剂量组和高剂量组在脂肪细胞数量、形态、脂肪移植体纤维化程度优于模型组,血管内皮细胞Ⅷ因子免疫组织化学染色示新生毛细血管密度高于模型组。 结论 丹红注射液能显著提高SD大鼠自体脂肪颗粒移植的存活率。
自体脂肪移植; 丹红注射液; 血管内皮细胞生长因子; 血管新生; 大鼠; 存活率
近年来,由于软组织缺损而造成的先天性或后天性畸形的发病率呈逐年上升趋势,最重要的缺损是皮下脂肪组织的缺损[1]。目前治疗方案中自体脂肪组织填充最为常用[2]。但自体脂肪注射进行缺损修复时,注射颗粒脂肪存在着吸收率较高的问题,严重影响了自体脂肪移植的效果[3]。这个问题也得到了国内外许多学者的关注和研究。这些研究主要集中于两个方面,一方面是提高自体移植脂肪组织内脂肪细胞的增殖能力,或者促进前脂肪细胞及脂肪干细胞(adipose derived stem cells,ADSCs)向成熟的脂肪细胞分化;另一方面通过改善自体脂肪移植组织的受区环境,促进血管内皮细胞增殖,诱导新生血管形成,尽快重建游离脂肪的血运,增加自体移植脂肪组织的血液供应来提高脂肪移植的存活率[4]。
能否找寻一种经济、方便、有效的方法,一方面延缓或抑制移植的脂肪细胞凋亡,促进前脂肪细胞的分化,另一方面改善脂肪移植组织的性状及供受区组织的环境,促进血管内皮细胞增殖,诱导新生血管形成,从而提高移植脂肪颗粒存活率,以便在临床上能够得到更为广泛的应用呢?
近些年来,中药对人体疾病的治疗越来越受到了中外学者的重视,中药的研究开展得越来越深入,许多中药的药理功效得到了较广泛的认同。研究发现丹红对心血管系统、血液循环系统、物质代谢、肝肾功能及肿瘤治疗等均可发挥良好的作用,丹红能够扩张冠状动脉,改善心脏功能,可使减少的血细胞数恢复正常,可以增加机体抗缺氧能力,可以保护细胞,延长细胞寿命[5]。鉴于国内外鲜有学者在中药对自体脂肪移植存活率进行基础及临床应用研究,我们应用肌肉注射中药丹红注射液到自体脂肪移植的SD大鼠中,探讨中药丹红对自体脂肪移植术后脂肪移植存活率的影响并分析可能的机制。
1 材料与方法
1.1 实验动物及主要试剂、仪器
SD大鼠(10周龄,雄鼠),体重(265±5)g,购自山西医科大学实验动物中心;丹红注射液(国药准字:Z20026866)(Danhong Injection),菏泽步长制药有限公司生产,产品规格:10 ml/支。VEGF的ELISA试剂盒(美国R&D公司);鼠多克隆Ⅷ因子抗体(Rat Polycloal to Factor Ⅷ,英国Biorbyt公司);鼠兔通用免疫组化二抗(丹麦Dako公司);免疫组化抗体稀释液(丹麦Dako公司);盐酸氯胺酮注射液(2 ml ∶0.1 mg),福建古田药业有限公司;陆眠宁Ⅱ注射液(1.5 ml ∶30 mg),吉林省华牧动物保健品有限公司。图像分析系统(IMAGE PROPLUS 6.0,美国);CO2培养箱(THERMO FORMA3111,美国);荧光光学显微镜(LEICA DM6000M,德国);倒置相差显微镜(Nikon TS-100,日本);酶标仪(Bio-Tek Synergy HT,美国)。
1.2 大鼠分组与处理
模型组 12只单纯行自体脂肪颗粒移植;低剂量组24只行自体脂肪颗粒移植+肌肉注射丹红注射液4 ml/(kg·d)(持续用药2周);高剂量组24只行自体脂肪颗粒移植+肌肉注射丹红注射液8 ml/(kg·d)(持续用药2周)。术后90 d进行脂肪移植体标本取材,称量后置入4%多聚甲醛溶液中固定。术后1周、2周、4周、6周、8周分别尾静脉取血,每只取血1 ml,取血后置入离心管中以1 500 r/min离心5 min,留取上层血清,-80 ℃保存,ELISA试剂盒检测VEGF浓度。
1.3 大鼠自体脂肪移植存活率检测
以自体移植脂肪组织术后与术前质量比计算存活率,完整取下脂肪移植体后分离修去周围多余组织及包膜,精密天平准确测量其质量,与术前记录数据进行对比得到移植存活率。
1.4 大鼠的血清VEGF表达水平检测
首先配置冲洗缓冲液,底物溶液,扩增液,稀释度标准品。移去96孔板中的多余板条,在剩余的96孔板中的每一孔中分别加入50 μl的稀释剂。在第一列的孔中加入200 μl已准备好的标准品。其余的孔中分别加入200 μl待检测的血清。4 ℃环境下孵育过夜。在96孔板的每孔中分别加入200 μl的VEGF,在室温下避光孵育2 h。再次用洗板仪清洗96孔板4次。每孔中分别加入50 μl的底物溶液,放置于室温下避光孵育45 min。每孔中分别加入50 μl的扩增溶液,室温下避光孵育45 min。每孔中分别加入50 μl的中止液,吹打混匀。利用酶标仪在30 min内于450 nm下读取吸光值,绘制标准曲线,得到VEGF含量。
1.5 移植脂肪组织的苏木精-伊红(HE)染色和血管内皮细胞Ⅷ因子的免疫组化染色
将标本置于4%多聚甲醛溶液中固定24 h,流水冲洗过夜。乙醇梯度脱水后,将标本置于透明二甲苯中浸泡,浸蜡后,进行包埋,切片机切片后用载玻片每个标本捞片5张。其中,2张用于苏木精-伊红染色,3张用于血管内皮细胞Ⅷ因子的免疫组化染色。苏木精-伊红(HE)染色,将切片烤干后,二甲苯脱蜡,梯度酒精脱水,苏木精染色约8 min,盐酸酒精分化,流水冲洗20 min。分化后镜检。伊红染色:0.1%-0.5%伊红染液染色1-2 min,70%乙醇5 s。 梯度酒精脱水,二甲苯透明1-2 min。 封片后贴标签,编号,倒置显微镜观察。血管内皮细胞Ⅷ因子的免疫组化染色 将石蜡切片烤干后,脱蜡、水化,用封闭通透液浸润切片30 min(室温避光)后,0.01 mol/L柠檬酸钠缓冲溶液(pH 6.0)进行抗原修复暴露抗原决定簇,用山羊血清封闭非特异性蛋白 ,加一抗(1∶500)约50 μl,放入湿盒中置于4 ℃冰箱过夜。加二抗孵育和显色 ,切片复染、脱水、透明、封片后倒置显微镜观察。
1.6 SD大鼠自体脂肪移植组织内毛细血管密度计算
在100倍光镜下观察脂肪组织移植体血管内皮细胞Ⅷ因子免疫组化染色切片,在每张切片中分别随机选取6个视野,周边区及中心区各3个视野,统计每个视野中的毛细血管断面数目(条),计算血管断面密度(均数±标准差,条/视野)。凡是免疫组化染色成棕黄色的单个内皮细胞或者内皮细胞团均作为一个微血管计算在内。
1.7 统计学分析
所有数据使用 SPSS13.0 软件进行处理,计量资料以 表示,数据采用t检验或单因素方差分析进行检验,存活率比较采用卡方检验,双侧检验水准为α=0.05,P<0.05为差异有统计学意义。
2 结果
2.1 大鼠自体脂肪移植组织块观察
脊椎皮下可见丘状隆起的脂肪移植体,移植的脂肪组织无移位及扩散,在脂肪移植体部位触及移植体,于其外周1 cm处切开皮肤,邻近皮肤、皮下组织均未见明显炎症反应、组织坏死、空腔或脓肿形成,脂肪移植体均表现为质地略柔软、边界清晰、活动度良好的组织团块,脂肪移植体呈暗黄色,外部被一层纤维组织包膜所覆盖,界线比较明显。
2.2 大鼠自体脂肪颗粒移植各实验组间脂肪移植体存活率比较
结果表明,自体脂肪颗粒移植术后90 d,模型组脂肪移植存活率为(40.6±6.5)%,低剂量组脂肪移植存活率为(62.1±8.2)%,高剂量组脂肪移植存活率为(64.2±8.4)%。低剂量组和高剂量组脂肪移植存活率均明显高于模型组(P<0.05),低剂量组与高剂量组脂肪移植存活率无明显差异(P>0.05)。
2.3 大鼠自体脂肪颗粒移植各实验组间血清VEGF表达比较
结果表明:SD大鼠自体脂肪颗粒移植低剂量组和高剂量组血清VEGF表达水平在脂肪移植术后1,2,4,6周时,与模型组比较均有明显增高(P<0.05),在术后 2 周时达到高峰,低剂量组和高剂量组血清 VEGF 表达水平无显著差异(P>0.05,见图1)。
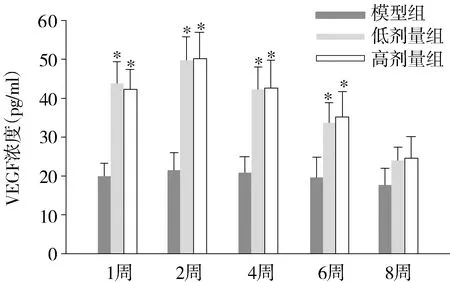
与模型组比较,*P<0.05图1 大鼠自体脂肪颗粒移植各实验组间血清VEGF表达比较Figure 1 Expression of VEGF in serum at different time after fat particle transplantation
2.4 大鼠自体脂肪移植组织HE染色
结果显示:低剂量组和高剂量组自体脂肪移植90 d后均可见脂肪细胞增生,移植脂肪组织纤维间隔不多,脂肪小叶以及脂肪小叶间纤维组织保持较好,周围血管较丰富,无论在脂肪移植体周边区还是在中央区均可见到大量的前脂肪细胞和脂肪细胞,形态规则,脂肪细胞排列比较整齐,形态相近。实验模型组移植脂肪组织中有较多的脂肪细胞坏死融合,形成了数量较多的大小不等的空泡,存活脂肪细胞大小不规则,分布不均匀,脂肪组织间纤维结缔组织较多,并有分隔倾向,偶可见部分前脂肪细胞与大小不一的脂肪细胞夹杂在一起,血运不丰富,新生血管不明显(见图2)。
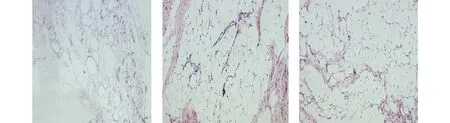
A.模型组 B.低剂量组 C.高剂量组图2 自体脂肪颗粒移植90 d后自体移植脂肪组织的HE染色 (×100) Figure 2 Morphology of autotransplanted fat tissues at 90 d after fat particle transplantation by HE (×100)
2.5 SD大鼠自体脂肪移植组织血管内皮细胞Ⅷ因子免疫组织化学染色
血管内皮细胞Ⅷ因子免疫组化染色后,血管呈现棕黄色,低剂量组和高剂量组自体脂肪移植90 d后移脂肪组织周边区和中心区血管均较丰富,但差别不明显。模型组移植脂肪组织中血运不丰富,新生血管不明显(见图3)。
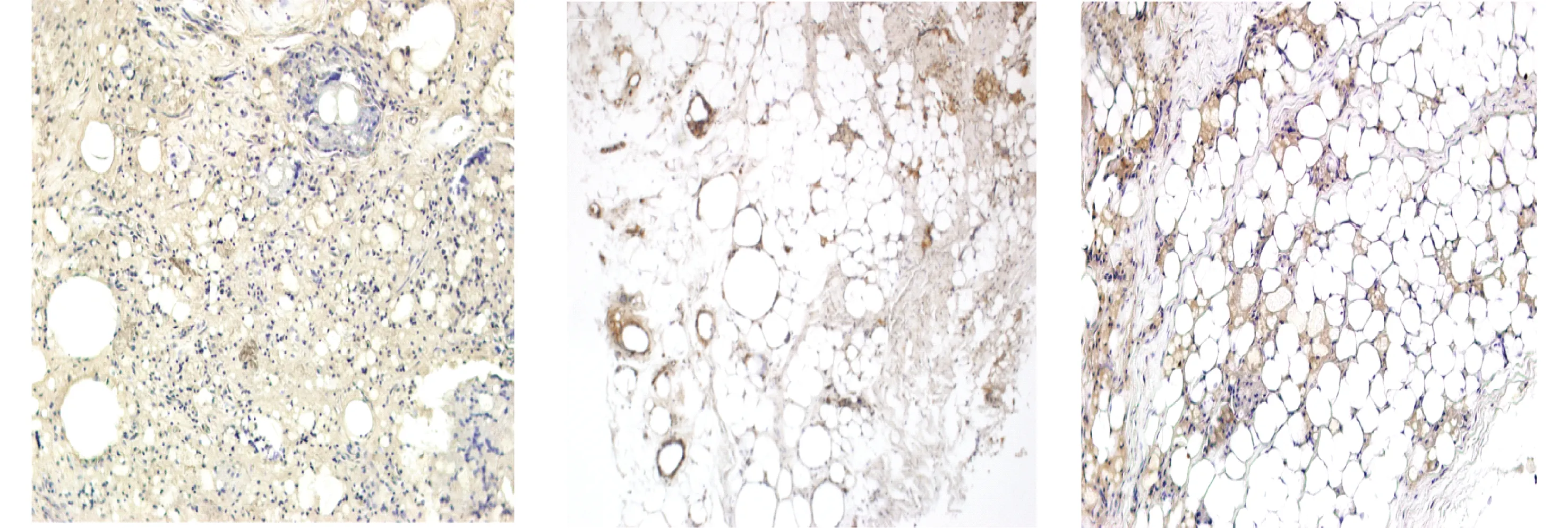
A.模型组 B.低剂量组 C.高剂量组图3 SD大鼠自体脂肪颗粒移植90 d后自体移植脂肪组织的血管内皮细胞Ⅷ因子免疫组化染色结果 (×100) Figure 3 Immunohistochemical staining of vascular endothelial cells factor Ⅷ in autotransplanted fat tissues 90 d after fat particle transplantation (×100)
2.6 SD大鼠自体脂肪移植组织的毛细血管密度评估
通过光镜下观察,计算毛细血管数量,模型组移植脂肪组织的毛细血管密度为(14.10±2.83)条/HP,低剂量组移植脂肪组织的毛细血管密度为(24.85±3.27)条/HP,高剂量组移植脂肪组织的毛细血管密度为(25.76±3.42)条/HP。低剂量组和高剂量组毛细血管密度明显高于模型组(P<0.05),但低剂量组与高剂量组的毛细血管密度无明显差异(P>0.05)。
3 讨论
3.1 自体脂肪组织移植修复的相关实验研究
自体脂肪组织移植修复软组织缺损畸形距今已有上百年的历史,与其他种类的人工合成充填材料、异体脂肪或异种脂肪相比较,自体脂肪组织具有来源丰富、取材简便、操作简单、充盈外观好、无排异反应、组织相容性好、无明显过敏反应等优势[6,7],更加易于被患者所接受,从而倍受整形美容外科医生的重视,可广泛用于充填各种先天性软组织缺损或后天性软组织缺损,自体脂肪移植技术在整复外科领域治疗软组织缺损沿用已久[8]。但自体脂肪移植的存活率较低长久以来一直是自体脂肪移植的最大障碍,也一直是自体脂肪移植研究讨论的重点和难点[9],长期困扰着临床医师,并且极大地限制了自体颗粒脂肪移植在临床上的广泛及大面积应用。
较多国内外学者认识到加快脂肪移植组织的血供重建是提高脂肪颗粒移植存活率的关键因素。如果可以找到能够显著加速脂肪移植组织血供重建的一些药物或细胞因子,在脂肪组织移植的过程中,使脂肪组织移植体的血供加快,脂肪组织内的缺血、缺氧、营养不足期缩短,成熟的脂肪细胞缺血坏死减少;同时又减少或延缓脂肪细胞的凋亡,促进前脂肪细胞吸收并合成脂质,促进前脂肪细胞反分化成为成熟的脂肪细胞,从而可以代偿被吸收的脂肪组织,便可以明显提高自体脂肪组织移植的成活率[10]。Langer等[11]利用活体免疫荧光显微镜进行观察,结果发现脂肪组织移植后的血供主要依赖周围的血管长入。国内学者杜学亮等[12]通过免疫组化方法研究脂肪组织内微血管的分布,应用免疫组化方法显示微血管,对不同的时期脂肪组织移植块按中央区和周边区划分,进行了微血管的定量统计研究,发现脂肪组织移植体周边区的血管密度在移植后的14 d达到高峰;中央区的血管密度呈逐渐增高趋势,在同一时期脂肪组织移植体周边区的血管密度要高于中央区的血管密度,脂肪组织移植块周边区的血管密度明显高于中央区的血管密度。证明了新生血管在脂肪移植组织的血运重建过程中,作为供血的主要渠道,其生长的快慢程度以及数量对脂肪移植体显得尤为重要。移植体与受床建立良好的血运是脂肪移植组织存活的关键。血运的建立一方面依靠从受床向移植体长入新生血管,另一方面通过新生血管与原有血管吻合沟通。可见,改善血液循环是提高移植脂肪存活率的有效途径。由于血管新生是由细胞因子启动的调控过程,目前最常用的方法是将促血管生长因子应用到局部。血管内皮生长因子(VEGF)在血管形成的过程中发挥着最重要的作用,血管内皮生长因子是最早被发现的能够促进血管生长的生长因子,也是目前发现的效果最强的促血管生成因子。CM-Dil标记的血管内皮前体细胞复合游离脂肪移植,显示了较高的脂肪存活率和新生毛细血管密度[13,14],局部的血管内皮生长因子能提高游离移植脂肪的存活率和质量[15]。Lei等[16]在SD大鼠自体颗粒脂肪移植的部位注射含有编码重组人血管内皮生长因子(recombinant human vascular endothelial growth factor,rhVEGF)DNA的脂质体质粒,分别在术后3,7,15,30 d取出移植物,测量质量并对移植物进行组织学评价以及微血管计数。结果显示,术后15 d和30 d,rhVEGF试验组的微血管计数均远远高于模型组,脂肪移植体吸收率较低。所以本次实验通过检测药物作用和非药物作用的模型鼠血液中VEGF的表达,移植脂肪组织中血管密度,来对药物作用进行判断。结果显示低剂量组和高剂量组血管密度均高于模型组,而且VEGF表达也明显高于模型组。
3.2 SD大鼠自体脂肪颗粒移植动物模型
脂肪颗粒移植动物模型多采用SD大鼠或裸鼠[17-19]。即通过手术切取大鼠自体脂肪组织,然后通过脂肪颗粒注射技术将自体脂肪颗粒移植于大鼠背部皮下;或者通过脂肪抽吸技术获得人的脂肪颗粒,然后采用脂肪注射技术将脂肪颗粒移植在裸鼠背部皮下。大鼠自体脂肪组织取材的部位多以腹股沟区域脂肪垫为常见[20]。在自体脂肪移植术后取材的时间选择上,多数实验研究将时间选择在3-6个月之间。在脂肪移植术后的3个月内,脂肪组织的吸收一般比较严重,而移植脂肪组织的量通常在脂肪移植术后3个月后保持稳定。因此,本次实验选择在自体脂肪移植术后的90 d进行取材,这样可以更加准确地反映移植脂肪组织真实的吸收率、存活率,贴近临床应用,与临床实际观察结果保持一致。
3.3 丹红对自体脂肪颗粒移植的影响
近些年来,中药对人体疾病的治疗越来越受到了中外学者的重视,中药的研究开展得越来越深入,许多中药的药理功效得到了较广泛的认同。临床治疗气虚血瘀的病证,常配伍使用丹红,通过益气而达活血之效。现代药理学研究证明,丹红对心血管系统、血液循环系统、物质代谢、肝肾功能及肿瘤治疗等均可发挥良好的作用,丹红能够扩张冠状动脉,改善心脏功能,可使减少的血细胞数恢复正常,可以增加机体抗缺氧能力,可以保护细胞,延长细胞寿命[20]。
基于丹红较为明确的药理机制和药物效果,本研究将丹红应用在提高自体脂肪颗粒移植存活率的研究中,结果显示丹红注射液能显著提高SD大鼠自体脂肪颗粒移植的存活率。本实验仅对丹红注射液提高自体脂肪移植存活率做了定性研究,丹红在自体脂肪移植术后的最佳给药方式、最佳剂量范围以及最佳用药频率、持续时间等定量结果尚不清楚,在本实验的基础上,丹红是否还能够更好地提高自体脂肪组织移植的存活率?丹红与其他中药如当归等的配伍方能否更加有利于提高自体脂肪移植组织的存活率?这些问题均有待于今后更进一步的研究探讨,使该方法能够更好地应用于临床,增加脂肪移植组织的存活率,提高自体脂肪移植修复技术的成功率。
[1] Katz AJ,Llull R,Hedrick MH,etal.Emerging approaches to the tissue engineering of fat[J].Clin Plast Surg,1999,26(4):587-603.
[2] Zuk PA,Zhu M,Mizuno H,etal.Multilineage cells from human adipose tissue:implications for cell-based therapies[J].Tissue Engineering,2001,7(2):211-228.
[3] Har-Shai Y,Lindenbaum ES,Gamliel-Lazarovich A,etal.An integrated approach for increasing the survival of autologous fat grafts in the treatment of contour defects[J].Plast Reconstr Surg,1999,104(4):945-954.
[4] Nishimura T,Hashimoto H,Nakanishi I,etal.Microvascular angiogenesis and apoptosis in the survival of free fat grafts[J].Laryngoscope,2000,110(8):1333-1338.
[5] 王硕,何俗非,翟静波,等.丹红注射液药理作用及临床应用研究进展[J].中国中医药信息杂志,2014,21(3):128-131.
[6] Tang W,Zeve D,Suh JM,etal.White fat progenitor cells reside in the adipose vasculature[J].Science,2008,322(5901):583-586.
[7] Hamed S,Egozi D,Kruchevsky D,etal.Erythropoietin improves the survival of fat tissue after its transplantation in nude mice[J].PLoS One,2010,5(11):e13986.
[8] Rietjens M,De Lorenzi F,Rossetto F,etal.Safety of fat grafting in secondary breast reconstruction after cancer[J].J Plast Reconstr Aesthet Surg,2011,64(4):477-483.
[9] Yoshimura K,Shigeura T,Matsumoto D,etal.Characterization of freshly isolated and cultured cells derived from the fatty and fluid portions of liposuction aspirates[J].J Cell Physiol,2006,208(1):64-76.
[10] 彭青和.脂肪移植的基础研究与临床应用进展[J].医学综述,2010,16(10):1526-1529.
[11] Langer S,Sinitsina I,Biberthaler P,etal.Revascularization of transplanted adipose tissue:a study in the dorsal skinfold chamber of hamsters[J].Ann Plastic Surg,2002,48(1):53-59.
[12] 杜学亮,罗少军.免疫组化法对不同时期脂肪移植体内微血管的定量研究[J].中华整形烧伤外科杂志,1998,14(5):352-354.
[13] Yi C,Pan Y,Zhen Y,etal.Enhancement of viability of fat grafts in nude mice by endothelial progenitor cells[J].Dermatol Surg,2006,32(12):1437-1443.
[14] 易成刚,郭树忠,张琳西,等.血管内皮细胞生长因子基因转染血管内皮祖细胞移植提高移植脂肪存活率的实验研究[J].中华外科杂志,2005,43(11):730.
[15] Yi CG,Xia W,Zhang LX,etal.VEGF gene therapy for the survival of transplanted fat tissue in nude mice[J].J Plast Reconstr Aesthet Surg,2007,60(3):272-278.
[16] Lei M,Liu SQ,Peng H,etal.Effect of rhVEGF gene transfection on survival of grafts after autologular transplantation in rats[J].Chin J Traumatol,2008,11(1):49-53.
[17] Lu F,Li J,Gao J,etal.Improvement of the survival of human autologous fat transplantation by using VEGF-transfected adipose-derived stem cells[J].Plast Reconstr Surg,2009,124(5):1437-1446.[18] Chang L,Wang J,Zheng D,etal.Improvement of the survival of autologous free-fat transplants in rats using vascular endothelial growth factor 165-transfected bone mesenchymal stem cells[J].Ann Plast Surg,2014,72(3):355-362.
[19] Hamed S,Ben-Nun O,Egozi D,etal.Treating fat grafts with human endothelial progenitor cells promotes their vascularization and improves their survival in diabetes mellitus[J].Plast Reconstr Surg,2012,130(4):801-811.
[20] McFarland JE.The free autogenous fat graft a comparison of the fat“pearl”and fat“cell” graft in an animal model[J].Ophthal Plast Reconstr Surg,1988,4(1):41-48.
Influence of Danhong injection on the survival rate of fat particle auto-transplantation in rats
JIA Yao1, WANG Peng1,2, CHEN Xihang1,2, WU Chengxing3*
(1DepartmentofPlasticSurgery,FirstHospitalofShanxiMedicalUniversity,Taiyuan030001,China;2FirstClinicalMedicalCollegeofShanxiMedicalUniversity;3PlasticSurgery,ShanxiDayiHospital;*Correspondingauthor,E-mail:591292983@qq.com)
ObjectiveTo investigate the influence of Danhong injection on the survival rate of fat particle auto-transplantation.MethodsAutologous fat particle transplantation rat model was established,and then divided into three groups:model group, low dose group and high dose group. The rat were given different doses of astragalus membranaceus injection by intramuscular injection in experiment groups and nothing in control group. The expression level of VEGF in blood serum was detected. Fat grafts were collected 90 d after the autologous fat transplantation to calculate the survival rate. The adipocyte morphology and density of blood vessels of the fat transplant were observed by HE staining. Immunohistochemical staining of vascular endothelial cells factor Ⅷ was used to observe the capillary growth and density.ResultsAt 90 d after the fat particle transplantation, the survival rates of fat transplant in experiment groups were higher than that in control group(P<0.05). ELISA showed the levels of VEGF expression in experimental groups were higher than that in control group(P<0.05). HE staining showed the number, the shape, the degree of fat transplant fibrosis were better in experimental groups than that in control group. Immunohistochemical staining of vascular endothelial cells factor Ⅷshowed newborn microvessel densities in experimental groups were higher than in control group.ConclusionDanhong injection can significantly promote the survival rate of autologous fat particle transplant in SD rats.
autologous fat transplantation; Danhong injection; vascular endothelial growth factor; angiogenesis; survival rate; rats
山西医科大学第一医院院青年基金资助项目(YQ1313);山西医科大学校青年基金资助项目(02201311)
贾垚,女,1983-01生,硕士,主治医师,E-mail:591292983@qq.com
2016-08-12
R622.9
A
1007-6611(2016)11-0982-06
10.13753/j.issn.1007-6611.2016.11.005

