戊二醛交联对盐酸青藤碱微胶囊性能的影响及体外细胞毒性研究*
王昌萌,张 凤,张 雯,李镟颖,张 华,李 伟, 高 敏
(天津工业大学 材料科学与工程学院,天津市先进纤维与储能技术重点实验室,天津 300387)
戊二醛交联对盐酸青藤碱微胶囊性能的影响及体外细胞毒性研究*
王昌萌,张 凤,张 雯,李镟颖,张 华,李 伟, 高 敏
(天津工业大学 材料科学与工程学院,天津市先进纤维与储能技术重点实验室,天津 300387)
采用W/O/W复乳界面聚合法以戊二醛作为交联剂,制备盐酸青藤碱聚乙烯醇(SM-PVA)微胶囊。扫描电镜和傅里叶红外光谱分析戊二醛用量对SM-PVA微胶囊结构的影响,动态膜透析法研究微胶囊体外药物释放行为,MTT法评价微胶囊体外细胞毒性。结果表明SM-PVA微胶囊表面光滑、分散性良好;随着戊二醛用量增加,微胶囊囊壁增厚,结构紧实;体外药物释放结果显示戊二醛用量及释放介质pH值对药物释放均有影响;且体外细胞毒性结果表明微胶囊对L929细胞无细胞毒性。SM-PVA微胶囊具有缓释性能和良好的生物相容性,可进一步研制成为新型中药给药制剂。
盐酸青藤碱;聚乙烯醇;戊二醛;药物缓释;细胞毒性
0 引 言
盐酸青藤碱(Sinomenine hydrochloride,SM)是从防已科植物青风藤中提取的青藤碱的盐酸盐[1-2]。青藤碱具有免疫抑制、清除活性自由基、改善血管循环等作用,并且对类风湿性关节炎、心律失常等疾病疗效显著[3-5]。但其生物半衰期较短,临床治疗一般需长期大剂量给药,频繁给药容易引起血药浓度的大幅度波动、胃肠道不适和过敏反应等副作用[6-7],因此有必要进行药剂学研究以弥补上述缺陷。
新型给药系统(Drug delivery system, DDS)应用已成为中药药剂学研究的热点,随之出现了很多类型的药物传递体系[8-11],其中,微胶囊化技术制备的药物微胶囊为中药传统制剂的改进提供新方法。针对水溶性药物,最常用的承载方式是双乳液法,即W/O/W乳液法,可有效提高水溶性药物载药量低的问题。药物载体材料的性能对药物微胶囊至关重要,其中聚乙烯醇(Polyvinyl alcohol,PVA)被广泛应用。PVA因其具有对人体无毒、无刺激性、生物可降解性等优势,可用于制备止血纤维、人工皮肤、药膜、代血浆及药物微球等[12-15]。
本实验以SM为模型药物,PVA为微胶囊壁材,采用W/O/W双乳液法制备SM-PVA缓释微胶囊,实现了水溶性药物成分SM的微胶囊化,考察戊二醛用量对SM-PVA微胶囊结构和体外药物释放性能的影响。而戊二醛具有一定的生物毒性,作为交联剂过量添加可能会引起药物微胶囊制剂的安全性,为此,本研究进一步考察微胶囊的细胞相容性,为研制SM的新型中药制剂奠定基础,此类研究未见文献报道。
1 实 验
1.1 主要试剂
盐酸青藤碱(纯度>99%),西安飞达生物技术有限公司;聚乙烯醇(PVA,平均聚合度为1750±50)和失水山梨糖醇脂肪酸(Span-80),天津市光复精细化工研究所;其余试剂均为分析纯;MTT、RPMI 1640 培养基和胎牛血清,Gibco公司;胰蛋白酶、青霉素和链霉素,Solarbio公司;小鼠成纤维细胞(L929),天津医科大学。
1.2 SM-PVA微胶囊的制备及表征
1.2.1 SM-PVA微胶囊的制备
精密称取一定量SM和PVA,分别制成溶液备用。采用W/O/W双液乳法,SM溶液中加入一定量戊二醛和盐酸溶液制成内水相;将内水相滴加入溶有span-80的环己烷油相,乳化30 mins,形成稳定的W/O初乳液。在高速搅拌下将初乳液分散到配制好的PVA水溶液中,形成W/O/W复乳体系,反应1 h,抽滤,洗涤样品,真空干燥即得SM-PVA微胶囊。空白PVA微胶囊制备过程中,在内水相中不添加SM,其余方法相同。
1.2.2 SM-PVA微胶囊的表征
SM-PVA微胶囊的红外光谱(FT-IR)采用KBr压片法,德国Bruker公司TENSOR37型傅里叶变换红外光谱仪进行测定,分辨率为4 cm-1,测试范围为400~ 4 000 cm-1。取少量分散均匀的SM-PVA微胶囊置于贴有导电胶的样品台上,喷金,采用日本岛津公司SS-50型场发射扫描电子显微镜(SEM)观察微胶囊表面形貌。
1.3 SM-PVA微胶囊体外药物释放性能研究
1.3.1 标准曲线及回归方程
精密称取SM标准药物适量,分别用pH值6.8、7.4的PBS和0.1 mol/L盐酸稀释,得到10,20,40,60,80和100 mol/L的一系列SM溶液,采用日本Shimadzu公司UV-260型紫外分光光度计,在波长265 nm处测试溶液吸光度,以吸光度A对浓度C进行线性回归,分别得到SM在pH值6.8、7.4的PBS和0.1 mol/L盐酸溶液中的回归方程。
2.3.2 SM-PVA微胶囊的载药量及包封率
精密称取0.1 g盐酸青藤碱药物微胶囊,用玛瑙研钵研磨30 min后加入5 mL N-甲基吡咯烷酮溶解,再用PBS稀释定容至50 mL,超声30 min,离心后取上清液,在265 nm波长处测定其吸光度,根据标准曲线计算盐酸青藤碱的含量。再根据以下公式计算载药量(DL)和包封率(EE)。
载药量=(微胶囊中盐酸青藤碱的含量/微胶囊的总重量)×100%
包封率=(微胶囊中盐酸青藤碱的含量/投药量)×100%
1.3.3 SM-PVA微胶囊体外药物释放性能研究
采用动态膜透析法考察SM-PVA微胶囊的体外药物释放性能。精密称取真空干燥后的SM-PVA微胶囊0.1 g,加入经超纯水浸泡煮沸处理过的透析袋中,紧密封口后使其悬浮于200 mL 一定pH 值的PBS中,在(37±0.5) ℃恒温水浴中以100 r/min的速度磁力搅拌,在不同时间间隔取外液5 mL,同时补充pH值的等量同温度的PBS。采用紫外分光光度计测定所取溶液的吸光度,计算释放介质中SM的量,并按下式计算累积释药百分率,分别研究戊二醛浓度及释放介质pH值对SM-PVA微胶囊释药性能的影响。
累计释放率=(透析外液盐酸青藤碱累计量/微胶囊中盐酸青藤碱总量)×100%
1.4 SM-PVA微胶囊的体外细胞毒性研究
1.4.1 细胞培养及分组
小鼠成纤维细胞(L929)接种在含10% (体积分数)胎牛血清、100 U/mL 青霉素和100 μg/mL链霉素的RPMI-1640培养基的培养瓶中,在37 ℃、5% CO2及饱和湿度条件下培养箱中常规培养,细胞呈单层贴壁生长。
实验分组:空白对照组(无血清、无细胞)、阴性对照组(加细胞,不加微胶囊)、PVA微胶囊组、不同质量浓度SM-PVA微胶囊组。实验组微胶囊制备过程中,戊二醛浓度均为45%,考察戊二醛添加量对细胞相容性的影响。细胞毒性实验前,将干燥恒重的PVA微胶囊和SM-PVA微胶囊紫外灭菌3 h,以无血清RPMI 1640培养液配制成不同质量浓度的悬液。
1.4.2 MTT法检测细胞毒性
取处于对数生长期、生长状态良好的L929细胞,用2.5 g/L胰蛋白酶的PBS溶液消化细胞后,重新分散,配成细胞密度为1×104cell/mL单个细胞悬液,接种于96孔板,每组设6个复孔。培养24 h 后,倒置显微镜镜下观察确认细胞贴壁良好。实验组加系列稀释的高、中、低剂量SM-PVA悬液,使终浓度依次为5.0,1.0和0.2 mg/mL,各组分别记为SM-PVA-5.0、SM-PVA-1.0和SM-PVA-0.2。各组分别培养24,48和72 h,结束培养前4 h,每孔加 5 mg/mL MTT溶液,继续培养4 h后小心吸去上清,每孔加150 μL DMSO,在微量振荡器上振荡混匀10 min,使甲瓒溶解。酶标仪检测波长490 nm的每孔光密度值(OD值),平行测试3次取平均值,计算细胞相对增殖率。
细胞相对增殖率(RGR,%)= (样品组吸光度/对照组吸光度)×100%。
1.5 统计学分析

2 结果与讨论
2.1 SM-PVA微胶囊的红外光谱分析

图1 SM, PVA和SM-PVA微胶囊的红外光谱
Fig 1 FT-IR spectra of SM, PVA and SM-PVA microcapsules
2.2 SM-PVA微胶囊表面形貌
图2(a)为SM-PVA微胶囊的SEM照片,微胶囊呈球形,表面光滑且致密,无粘连现象。戊二醛作为交联剂,随着其含量增加,微胶囊的壁厚及致密度增大。图2(b)和(c)为研磨后微胶囊的放大照片,当戊二醛用量较低时,图2(b)中可以观察到破损的微胶囊呈明显地空心结构,胶囊囊壁厚度约为1 μm;而戊二醛用量较高时,由于囊壁交联程度较高,囊壁更为致密,图2(c)中未见有破损的胶囊出现。

图2 SM-PVA微胶囊的SEM照片
Fig 2 SEM photograph of SM-PVA microcapsules
2.3 标准曲线方程建立及SM-PVA微胶囊载药量和包封率
SM在0.1 mol/L盐酸溶液中的回归方程为A=0.01452C+0.0376,相关系数为0.99631;在pH值为6.8的PBS中的回归方程为A=0.01482C-0.0204,相关系数为0.99939;在pH值为7.4的PBS中的回归方程为A=0.01472C-0.0123,相关系数为0.99942,结果表明SM溶液质量浓度在10~100 μg/mL范围内与A呈现良好的线性关系,满足实验要求。实验所制备的SM-PVA微胶囊的载药量为6.5%,包封率为87%。
2.4 SM-PVA微胶囊体外药物释放性能研究
2.4.1 戊二醛浓度对SM-PVA微胶囊释药性能的影响
PVA需要在硫酸、盐酸、乙酸、甲醇等催化剂存在条件下才能与甲醛或戊二醛发生交联反应[16]。本实验中采用盐酸作为催化剂,催化PVA与戊二醛发生交联反应,形成网状结构构成微胶囊的囊壁。随着戊二醛用量加大,联网密度增大,增大PVA链段移动的束缚,制得的微胶囊囊壁增厚,且致密度增加。如图3所示,当戊二醛浓度为45%时,SM-PVA微胶囊的药物释放速率明显减慢,40 h 药物累积释放率仅为46%;而戊二醛浓度为25%时药物累积释放率为57%。
Fig 3 The releasing curves of SM-PVA microcapsules with various contents of glutaraldehyde
这与SEM观察到SM-PVA微胶囊形态的实验结果相符,从而验证了戊二醛的用量对微胶囊结构具有一定的影响。
2.4.2 pH值对SM-PVA微胶囊释药性能的影响
图4为不同pH(1.5、6.8、7.4)值的释放介质中SM-PVA微胶囊的释药性能。由图可以看出其药物释放有一定的pH依赖性,在pH值为1.5和6.8时SM-PVA的药物释放速率较快,原因是PVA分子链中含有大量的羟基,在pH值=2~7 时,PVA分子链中的—OH能部分质子化而带正电荷,使分子链间相互排斥,易于伸展,表现出较高的溶胀性,药物更容易渗透出来。当pH值大于7时,溶剂中存在的—OH使得PVA分子链中的羟基去质子化,使得分子链的伸展受限,所以药物释放速率明显低于酸性条件下。文献[8,17]结果也证实了这一规律,在不同pH值条件下,微胶囊壁材中的基团间静电相互作用的强弱不同,导致药物释放速率不同。
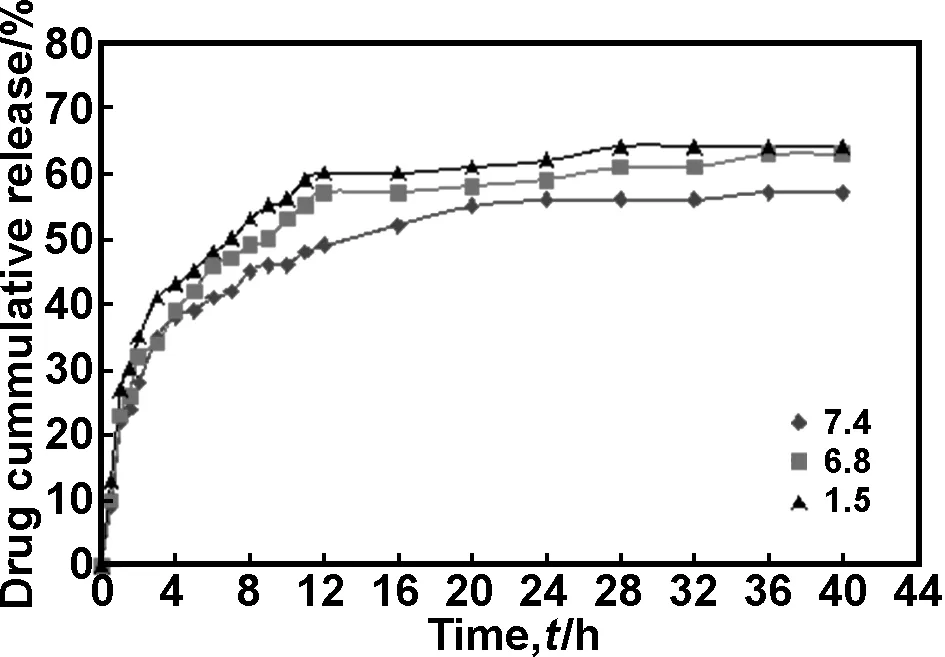
图4 不同pH值的SM-PVA微胶囊释药曲线
Fig 4 The releasing curves of SM-PVA microcapsules with various pH value
2.5 MTT检测体外细胞毒性
1983年,Mosmann[18]建立的四甲基偶氮唑盐(MTT)比色法,由于其操作简单、快速且无放射性污染等特点,已成为细胞生物学及相关研究领域一种分析细胞活性、生长增殖的常用方法。细胞毒性试验是目前用于毒性评价、生物材料检测和环境材料接触检测的主要方法。
图5给出了不同浓度的SM-PVA微胶囊和无载药的纯PVA微胶囊对L929细胞相对增殖率的影响。在细胞培养24 h时,不同浓度的SM-PVA和PVA微胶囊对L929细胞的细胞相对增殖率的影响无明显的差别;在细胞培养48和72 h时,随着SM-PVA微胶囊浓度的增大,L929细胞的细胞相对增殖率呈明显的下降趋势;纯PVA微胶囊对L929细胞相对增殖率影响不大。由图5可知,在同一时间点(如72 h),细胞相对增殖率随着SM-PVA微胶囊浓度的增大而减少;在同一浓度(如SM-PVA微胶囊浓度为5.0 mg/mL)条件时,细胞相对增殖率随着作用时间的延长而降低。

图5 不同微胶囊对L929细胞的细胞毒性
Fig 5 In vitro cytotoxicity of various microcapsules to L929 cell
统计学分析可知,在24 h,各组间比较,P>0.05,无明显统计学差异,说明在24 h 以内,当SM-PVA微胶囊的浓度≤ 5.0 mg/mL 时,对细胞增殖的影响不大;在细胞培养48和72 h,SM-PVA微胶囊的浓度为5.0 mg/mL 组与其它各组比较,P<0.05,有统计学差异,说明在细胞培养48 h以上时,当SM-PVA微胶囊的浓度大于5.0 mg/mL时,对细胞增殖有较大影响。
3 结 论
综上所述,W/O/W双乳液法制备的SM-PVA微胶囊表面光滑、致密、无粘连现象,微胶囊整体形貌较好,呈明显的核壳结构。随着戊二醛用量增加,SM-PVA微胶囊壁厚及致密度增加;体外药物释放实验表明其缓释性能明显增强,进一步证实戊二醛浓度对SM-PVA微胶囊结构的影响。此外,释放介质pH值对SM-PVA微胶囊的释药性能也存在一定的影响,在模拟胃液(pH值为1.5)的磷酸盐缓冲液中的药物释放较快。体外细胞毒性实验结果表明,本实验方法制备的SM-PVA微胶囊无细胞毒性,具有良好的生物相容性,为研制口服药物制剂奠定基础。
[1] Liu L, Eberhard B, Dennis B, et al. Amelioration of rat experimental arthritis by treatment with the Sinomenine [J]. International journal of immunopharmacology, 1996, 18(10): 529-534.
[2] Huang Zhuyan, Zhang Yuanhu, Zhou Lan, et al. Study on the chemical constituents of sinomenium acutum [J]. Chinese Traditional and Herbal Drugs, 2009, 40(2): 193-196.
黄筑艳, 张援虎, 周 岚, 等. 青风藤化学成分的研究 [J]. 中草药, 2009, 40(2): 193-196.
[3] Vieregge B, Resch K, Kaever V. Synergistic effects of the alkaloid sinomenine in combination with the immunosuppressive drugs tacrolimus and mycophenolic acid [J]. Planta Medica, 1999, 65: 80-82.
[4] Liu Z Q, Jiang Z H, Chan K, et al. Pharmaco kinetic interaction of paeoniflorin and sinomenine: pharmacokinetic parameters and tissue distribution characteristics in rats and protein binding ability in vitro [J]. Journal of Pharmacological Sciences, 2005, 99(4): 381-391.
[5] Kok T W, Yue P Y, Mak N K, et al. The anti-angiogenic effect of sinomenine [J]. Angiogenesis, 2005, 8: 3-12.
[6] Wang Yan, Zhou Liling, Li Rui. Study progress in sinomenium acutum (Thunb.) Rehd.et Wils [J]. Journal of Chinese Medicinal Materials, 2002, 25(3): 209-211.
王 岩, 周莉玲, 李 锐. 青风藤的研究进展[J]. 中药材, 2002, 25(3): 209-211.
[7] Zhu Shilong, Chen Dizhao, Li Yong, et al. Progress in the study of Sinomenine [J]. Journal of Jishou University (Natural Science Edition), 2011, 32(5): 95-100.
朱士龙, 陈迪钊, 李 勇, 等. 青藤碱最新研究进展[J]. 吉首大学学报(自然科学版), 2011, 32(5): 95-100.
[8] Shao Wenyao, He Caiyun, Feng Yanling, et al. Make microspheres through emulsion-solvent evaporation method [J]. Journal of Functional Materials, 2015, 46(3): 3121-3126.
邵文尧,何彩云,冯艳玲,等. 乳化-溶剂挥发法制备聚乳酸载药微球 [J]. 功能材料,2015,46(3): 3121-3126.
[9] Gong Ming,Xu Qiangqiang,Chu Jia,et al. Preparation and controlled release properties of cell outer Membrane mimetic structures of chitosan nanoparticles [J]. Journal of Functional Materials, 2014, 45(4): 4039-4042.
宫铭,徐强强,褚佳,等. 仿细胞外层膜结构壳聚糖纳米颗粒的制备及其控释性能研究[J].功能材料, 2014, 45(4): 4039-4042.
[10] Li G Y, Qi M Y, Yu N N, et al. Hybrid vesicles co-assembled from anionic graft copolymer and metal ions for controlled drug release [J]. Chemical Engineering Journal, 2015, 262: 710-715.
[11] Zhang W, Zhang H, Zhang X X. Preparation, characterization, and in-vitro evaluation of caulis sinomenii-loaded PLA microspheres for controlled drug delivery system [J]. Journal of Controlled Release, 2013, 172(1): e74.
[12] Li J K, Wang N, Wu X S. Poly(vinyl alcohol) nanoparticles prepared by freezing-thawing process for protein/peptide drug delivery [J]. Journal of Controlled Release, 1998, 56(1-3): 117-126.
[13] Yun J, Kim H I. Control of release characteristics in pH-sensitive poly(vinyl alcohol)/poly(acrylic acid) microcapsules containing chemically treated alumina core [J]. Journal of Applied Polymer Science, 2010, 115(3): 1853-1858.
[14] Zhang Zhengguo,Gao Baojiao,Lei Qingjuan, et al. Graft polymerization of methacrylicacidon crosslinked polyvinyl alcohol microspheres and adsorption property of grafted microspheres towards N-containing metabolite and drug molecules[J]. Journal of Functional Materials, 2012, 43(12): 1564-1568.
张正国,高保娇,雷青娟,等. 在交联聚乙烯醇微球表面接枝聚合甲基丙烯酸及接枝微球对含氮代谢及药物分子吸附特性的初探[J]. 功能材料,2012,43(12): 1564-1568.
[15] Wang X Q, Yucel T, Lu Q, et al. Silk nanospheres and microspheres from silk/PVA blend films for drug delivery [J]. Biomaterials, 2010, 31(6): 1025-1035.
[16] Gao Xiping, Liu Jie, Zheng Xuejing, et al. Influence of crosslinking of formaldehyde on structure and properties of gelatin/PVA blend films [J]. Journal of Functional Materials, 2014, 45(5): 5001-5005.
高喜平,刘 捷,郑学晶,等. 甲醛交联对明胶/PVA膜结构及性能的影响 [J].功能材料,2014,45(5): 5001-5005.
[17] Li Zhihui,Liu Wentao,Cui Haitao, et al. Study on swelling and drug release properties of biocompatible chitosan/montmorillonite composite microspheres[J]. Journal of Functional Materials, 2013, 44(2): 197-201.
李智慧, 刘文涛, 崔海涛, 等. 生物相容壳聚糖/蒙脱土复合微球的溶胀与药物缓释性能研究[J].功能材料, 2013, 44(2): 197-201.
[18] Mosmann T. Rapid colorimetric assay for cellular growth and survival:application to roliferation and cytotoxicity assays[J]. Journal of Immunological Methods,1983, 65(1-2): 55-63.
Study on the effect of crosslinking of glutaraldehyde on properties of polyvinyl alcohol microcapsules with sinomenine hydrochloride and in vitro cytotoxicity
WANG Changmeng, ZHANG Feng, ZHANG Wen, LI Xuanying,ZHANG Hua, LI Wei, GAO Min
(Tianjin Municipal Key Laboratory of Advanced Fiber and Energy Storage,
School of Materials Science and Engineering, Tianjin Polytechnic University, Tianjin 300387, China)
Polyvinyl alcohol (PVA) microcapsules carrying Sinomenine hydrochloride (SM) were prepared by W/O/W double emulsion interfacial polymerization technique with glutaraldehyde as a cross linker. The effects of content of cross linker on structure of SM-PVA microcapsules were studied by SEM and FT-IR.In vitro release and cytotoxicity were studied by dynamic membrane dialysis and MTT method respectively. The results showed that SM-PVA microcapsules were approximate to spheres, smooth with almost homogeneous structure. The thickness of capsule wall was increased with increasing the content of glutaraldehyde. The in vitro release results demonstrated glutaraldehyde dosage and pH value had a significant effect on drug release. The cell experiments showed that SM-PVA microcapsules have no cytotoxicity to L929 cell. The research indicates that SM-PVA microcapsules have good controlled release characteristics and biological activity, which can be used as a potential delivery system.
sinomenine hydrochloride; polyvinyl alcohol; glutaraldehyde; drug sustained release;cytotoxicity
1001-9731(2016)11-11115-05
国家自然科学基金资助项目(51203113);天津市高等学校科技发展基金计划资助项目(20140305);国家级大学生创新创业训练计划资助项目(201410058012)
2015-09-25
2015-12-25 通讯作者:张 雯,E-mail: zhangwen2050@hotmail.com
王昌萌 (1993-),男,成都人,在读本科,师承张雯讲师,从事生物医用材料研究。
R283.6
A
10.3969/j.issn.1001-9731.2016.06.023

