α亚麻酸对体外成熟人卵母细胞线粒体DNA拷贝数的影响
胡继君,孙丽君,管一春,郝大勇,马晓娟,齐若凡,董孝贞
α亚麻酸对体外成熟人卵母细胞线粒体DNA拷贝数的影响
胡继君,孙丽君,管一春,郝大勇,马晓娟,齐若凡,董孝贞
目的:探讨α亚麻酸(ALA)对人未成熟卵母细胞体外成熟的影响及对卵母细胞线粒体DNA拷贝数的影响。方法:收集2014年10月—2015年10月因男方因素行胞浆内单精子注射(ICSI)的273例患者的未成熟卵母细胞441枚,其中MⅠ期179枚,GⅤ期262枚。将MⅠ期和GⅤ期卵母细胞按相同的构成比随机分为5组,分别放入含不同浓度[0(对照组),10 μmol/L,50 μmol/L,100 μmol/L,200 μmol/L]ALA的培养液中,培养24 h后观察卵母细胞的成熟情况,实时荧光定量聚合酶链反应(real-time PCR)测定各组卵母细胞的线粒体DNA(mtDNA)拷贝数。结果:①各组未成熟卵母细胞体外成熟培养(IVM)后总成熟率以ALA 50 μmol/L组(70.1%)最高,明显高于对照组(42.1%)及ALA 200 μmol/L组(34.1%),差异有统计学意义(P<0.05);②5组GⅤ期卵母细胞成熟率以ALA 50 μmol/L组(64.4%)最高,明显高于对照组(28.9%)及ALA 200 μmol/L组(18.2%),差异有统计学意义(P<0.05);③ALA 50 μmol/L组成熟卵母细胞mtDNA拷贝数(3.64×107±1.85×106)大于对照组(3.42×106±1.95×105),差异有统计学意义(P<0.05)。结论:50 μmol/L ALA在体外实验中可增加卵母细胞mtDNA拷贝数,有促进人未成熟卵母细胞体外成熟的作用。
α亚麻酸;卵母细胞;细胞培养技术;DNA,线粒体
(J Int Reprod Health/Fam Plan,2016,35:454-458)
未成熟卵母细胞在GⅤ期被抑制,在体内外对促性腺激素(Gn)刺激做出反应后继续进行减数分裂形成MⅡ期卵母细胞,这个过程被称为卵母细胞核成熟。调控卵母细胞成熟的分子机制复杂,许多通路参与此调控过程,包括环磷酸腺苷(cAMP)和cAMP依赖的蛋白激酶途径。卵母细胞继续减数分裂成熟和Gn刺激后的生殖泡破裂(germinal vesicle breakdown,GVBD),主要是通过增加细胞内cAMP浓度介导的。未成熟卵母细胞体外成熟培养(in vitro maturation,IVM)技术是指从卵巢中取得的未成熟卵母细胞,在体外合适条件下进行培养,使卵母细胞成熟且具有受精能力的一项技术。有报道称在正常的体外受精/胞浆内单精子注射-胚胎移植(invitro fertilization/intracytoplasmic sperm injectionembryo transfer,IVF/ICSI-ET)周期中,约有15%的卵母细胞未成熟,这些卵母细胞因无法受精而被废弃[1]。IVM的出现无疑为充分利用这些未成熟卵母细胞奠定了基础。α亚麻酸(alpha-linolenic acid,ALA)为全顺式9、12、15十八碳三烯酸,属n-3系列多不饱和脂肪酸(poly unsaturated fatty acids,PUFAs),体内可以转化为二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(dehydroacetic acid,DHA)。对哺乳动物的研究发现,ALA不仅可以通过膳食改善哺乳动物的繁殖能力,而且还能通过IVM提高卵母细胞的体外成熟率和发育至囊胚阶段的能力[2]。然而ALA作用于卵母细胞的机制仍不明确,且尚少见ALA对人未成熟卵母细胞体外成熟和发育潜能影响的报道。本研究初步探讨不同浓度ALA对人未成熟卵母细胞体外成熟中对卵母细胞线粒体DNA(mtDNA)拷贝数的影响,以期寻找ALA在人未成熟卵母细胞IVM中的适宜浓度,作为优化IVM方案的参考。
1 对象与方法
1.1研究对象未成熟卵母细胞均来自2014年10月—2015年10月于郑州大学第三附属医院生殖医学中心因男方因素行ICSI-ET的273例患者,平均年龄(30.6±4.0)岁,收集441枚未成熟卵母细胞,其中MⅠ期卵母细胞179枚,GⅤ期卵母细胞262枚。将MⅠ期和GⅤ期卵母细胞按相同的构成比随机分为5组,各组患者的年龄、不孕时间、体质量指数(BMI)、基础内分泌水平[基础卵泡刺激素(bFSH)、基础雌二醇(bE2)、基础黄体生成激素(bLH)]比较,差异均无统计学意义(P>0.05),具有可比性,见表1。所有患者无长期吸烟、吸毒或酗酒等不良嗜好,均采用标准长方案促排卵。本研究已获郑州大学第三附属医院伦理委员会批准,所有患者均知情同意并签署知情同意书。
1.2制备IVM培养液将ALA(美国Sigma公司)溶于二甲基亚砜(DMSO,美国Sigma公司)中,配制10 mmol/L储备液。①基础IVM培养液:IVF受精液中加入75 IU/L FSH、75 IU/L LH和1%双抗;②ALA 0 μmol/L组(对照组)IVM培养液:基础IVM培养液中添加同等浓度的DMSO;③ALA 10 μmol/L组IVM培养液:基础IVM培养液中含10 μmol/L的ALA;④ALA 50 μmol/L组IVM培养液:基础IVM培养液中含50 μmol/L的ALA;⑤ALA 100 μmol/L组IVM培养液:基础IVM培养液中含100 μmol/L的ALA;⑥ALA 200 μmol/L组IVM培养液:基础IVM培养液中含200 μmol/L的ALA。各组培养液均于37℃5%体积分数CO2培养箱中过夜平衡后使用。
1.3未成熟卵母细胞的收集因男方因素行ICSI的不孕症患者采用常规促排卵方案。当最大卵泡直径达18 mm时注射人绒毛膜促性腺激素(hCG),34~36 h后超声引导经阴道穿刺取卵。取卵后4 h将卵丘复合物置于含80 U/mL透明质酸酶0.2 mL的四孔板中,拆除卵母细胞周围的大部分颗粒细胞,经倒置显微镜观察卵母细胞的成熟程度,生殖泡仍存在即生殖泡期(GⅤ期)卵母细胞,生殖泡破裂但尚未排出第一极体即MⅠ期卵母细胞,GⅤ期或MⅠ期卵母细胞供本研究使用。
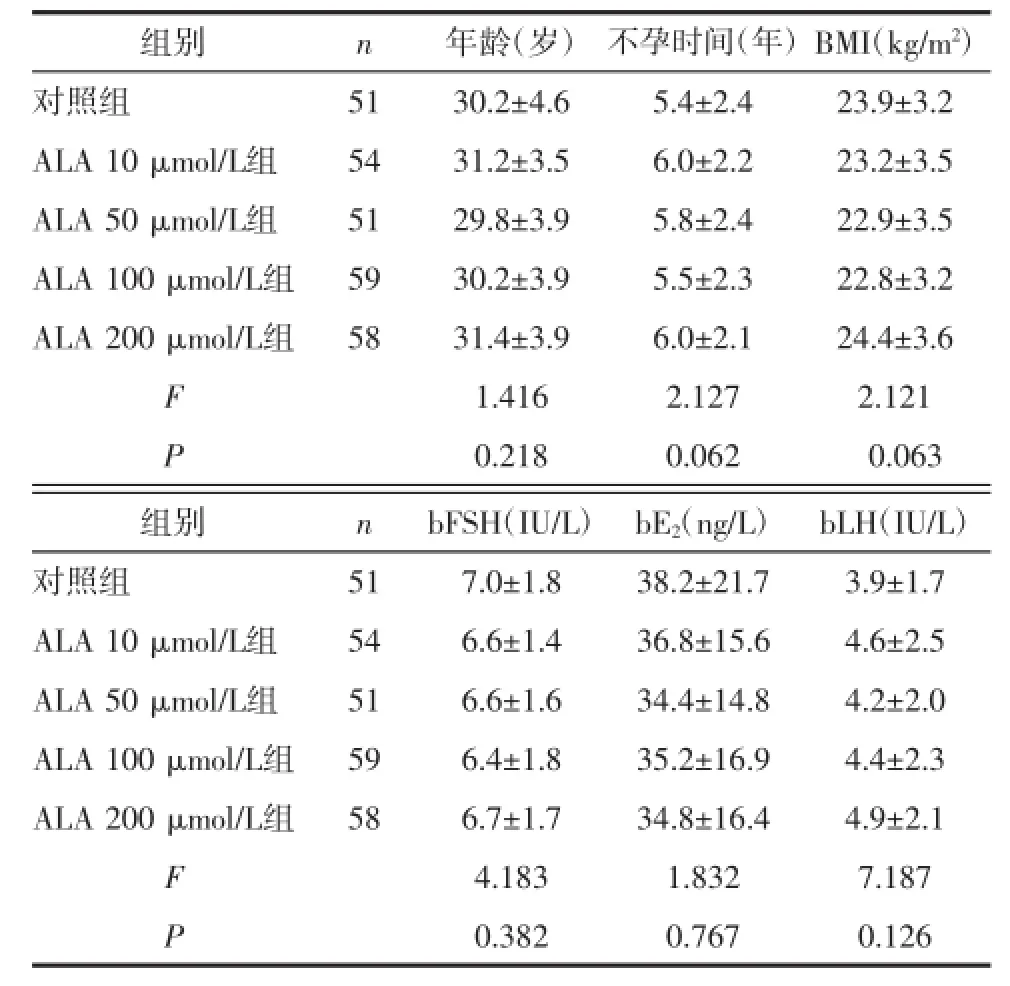
表1 各组患者一般情况比较(x±s)
1.4未成熟卵母细胞的体外培养采用微滴培养,50 μL/滴,1枚/滴。各组配制培养液滴在使用前于37℃、5%CO2孵箱(Galaxy 48 R,Eppendorf有限公司)中平衡至少6 h,将收集的MⅠ期卵母细胞和GⅤ期卵母细胞按相同的构成比随机分为5组,采用随机数字表将未成熟卵母细胞编号后随机分配到各组,分别放入含不同浓度(0 μmol/L,10 μmol/L,50 μmol/L,100 μmol/L,200 μmol/L)ALA培养液中。于37℃5%CO2培养箱中培养24 h后于倒置显微镜(IX70,Olympus公司)下观察卵母细胞的成熟情况,以第一极体排出为卵母细胞成熟的标志。
1.5体外成熟卵母细胞的保存将对照组和ALA 50 μmol/L组成熟卵母细胞以磷酸盐缓冲液(PBS)洗涤3次,单个卵母细胞移入装有10 μL细胞裂解液[50 mmol/L Tris-HCl+0.1mmol/L乙二胺四乙酸(EDTA),体积分数0.5%Tween-20+200 mg/mL蛋白酶K,pH值8.5]的0.2 mL薄壁聚合酶链反应(PCR)管中,使细胞裂解释放DNA备用。
1.6引物设计查阅相关文献,根据引物设计原则,应用生物信息学方法和Primer生物软件结合生物信息学方法,由上海生物工程有限公司合成本研究所需引物,设计引物序列:上游为5′-CGAAAGGACAAGAGAAATAAGG-3′;下游为5′-CTGTAAAGTTTTAAGTTTTATGCG-3′,Tm 60,产物片段158 bp。将合成的固体引物离心到管底,轻轻加入灭菌双蒸水,配制100 μmol/L的贮存液,-20℃保存。
1.7体外成熟卵母细胞mtDNA的测定
1.7.1卵母细胞中mtDNA拷贝数定量标准品的制备以检测标本中有无卵母细胞mtDNA存在的PCR扩增产物的反应体系和反应条件进行目的产物的扩增,按DNA快速纯化/回收试剂盒[宝生物工程(大连)有限公司]说明书要求进行目的产物的分离、纯化,测定分离纯化的DNA浓度,按1 ng 158 bp的PCR产物含5.8×109双链DNA分子,计算出分离纯化的DNA样品即标准品的拷贝数;将标准品按照1∶10的比例进行等倍比稀释而形成标准品梯度浓度。
1.7.2实时荧光定量PCR反应检测卵母细胞中mtDNA拷贝数使用SYBT Premix Ex TaqTM试剂盒[宝生物工程(大连)有限公司],在ABI PRISM7900HT实时荧光定量PCR扩增仪(德国Eppendorf公司)上检测mtDNA拷贝数。根据试剂盒说明书制备10 μL PCR反应体系:1 μL模板,5 μL SYBR Premix Ex TaqTM,0.2 μL ROX Reference Dye,D41、D56引物各0.2 μL,PCR水补齐至10 μL。反应条件为:95℃预变性2 min;95℃变性15 s,60℃退火15 s,72℃延伸20 s,40个循环并收集荧光曲线。然后将样品加热到95℃15 s,马上降低到60℃保持15 s,按照0.5℃/s梯度递增到95℃,在升温中收集荧光信号。设定溶解曲线,检测PCR反应特异性。每次反应的标准曲线通过已知拷贝数的标准品确定,每个样品的起始mtDNA拷贝数通过此标准曲线来确定。
实验第1部分发现,ALA浓度在50 μmol/L时对卵母细胞体外成熟作用更明显,在此基础上,实验第2部分将ALA 50 μmol/L组和对照组的成熟卵母细胞的线粒体DNA进行比较。55℃加热含卵母细胞PCR管2 h,95℃10 min灭活蛋白酶K,然后进行PCR扩增。按Real-time PCR试剂盒说明书[宝生物工程(大连)有限公司]进行操作,-70℃保存。以洗涤过卵母细胞的磷酸盐缓冲液PBS作阴性对照。
1.8统计学方法数据处理采用SPSS17.0统计学软件包。定量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用Bonferroni法。定性资料采用例数(百分比)表示,组间比较采用卡方检验。检验水准为α=0.05。组间多重比较时,按比较次数(k)适当调整检验水准,α′=0.05/k。
2 结果
2.1各组培养液对未成熟卵母细胞体外成熟的影响不同浓度(0 μmol/L,10 μmol/L,50 μmol/L,100 μmol/L,200 μmol/L)ALA体外培养MⅠ期卵母细胞,24 h成熟率差异无统计学意义(P>0.05);而各组的GⅤ期卵母细胞24 h成熟率及卵母细胞24 h总成熟率比较,差异有统计学意义(均P<0.05),且ALA 50 μmol/L组显著高于对照组及ALA 200 μmol/L组,差异有统计学意义(P<0.05)。见表2。
2.2对照组和ALA50 μmol/L组成熟卵母细胞mtDNA拷贝数比较ALA50 μmol/L组卵母细胞线粒体拷贝数高于对照组,差异有统计学意义(P<0.001)。见表3。
3 讨论
在卵母细胞的IVM体系中添加某些特定物质(如血清、特定的激素、抗氧化剂等)可以提高培养体系的效率。虽然不同物质作用机制不同,但是在一定程度上可以改善卵母细胞IVM体系,提高卵母细胞成熟率和胚胎发育潜能。本实验探讨不同浓度ALA对人未成熟卵母细胞体外成熟和卵母细胞线粒体DNA拷贝数的影响,有望以此提高患者卵母细胞的利用率和发育潜能。
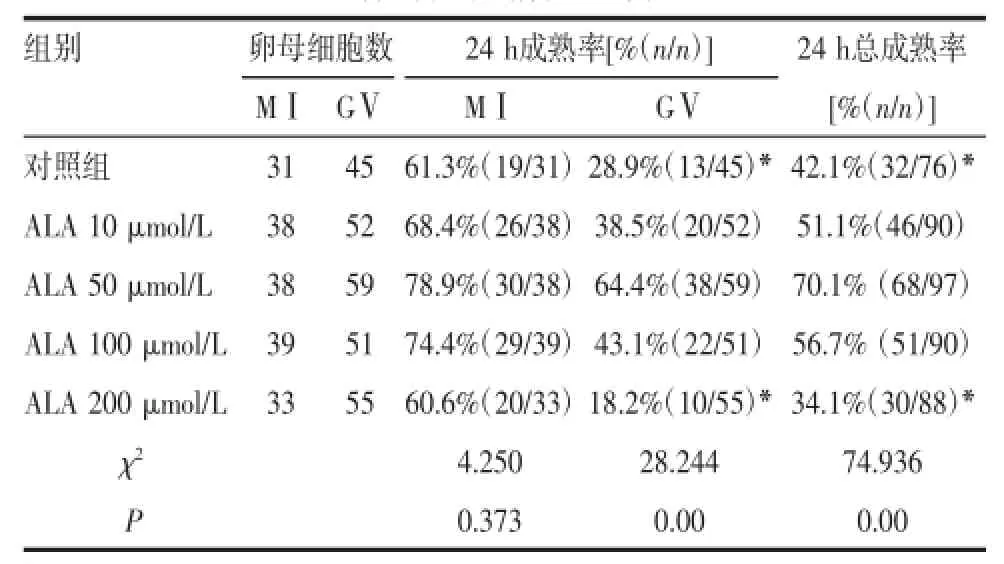
表2 不同浓度ALA对人类MⅠ/GⅤ期卵母细胞体外成熟情况比较
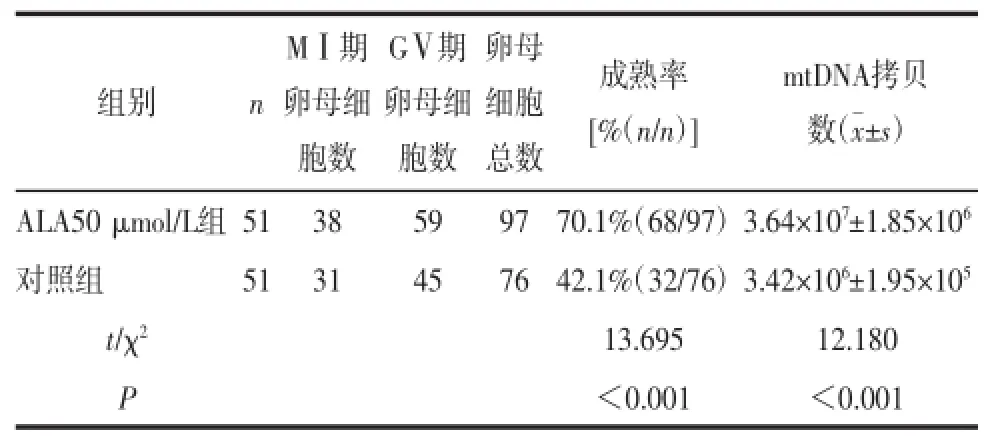
表3 对照组和ALA50 μmol/L组成熟卵母细胞mtDNA拷贝数比较
ALA可充当前列腺素(PGs)合成的前体物质,而前列腺素E2(PGE2)被认为是卵母细胞成熟的关键介质。PGE2通过卵丘细胞上的自分泌/旁分泌途径介导的G蛋白偶联受体(G-protein-coupled receptors,PTGERs)通路起作用,作为第二信使刺激细胞内cAMP增加。IVM培养液中添加ALA可增加卵母细胞内cAMP含量,高浓度的cAMP介导ALA对卵母细胞的核成熟。同时,有丝分裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)也是卵母细胞成熟的必需物。增加MAPK活性可加速减数分裂的恢复和生殖泡破裂(germinal vesicle breakdown,GVBD),从而提高卵母细胞的核成熟率。Marei等[2]的研究推测,一方面ALA通过增加PGE2促进卵母细胞成熟,另一方面ALA依赖于MAPK途径(或通过增加胞内cAMP水平)加速GVBD从而促进GⅤ期卵母细胞成熟。
据报道ALA在山羊窦状卵泡中的浓度范围是64.6~100.6 μmol/L,在牛血浆中的浓度是53.9~143.66 μmol/L,在卵泡液中的浓度是35.9~71.8 μmol/L[3-4],在子宫内膜组织中的浓度是71.8 mmol/L。据此,本研究选用浓度范围0~200 μmol/L的ALA对人未成熟卵母细胞进行IVM,也能在一定程度上反映正常的生理状况。
本实验中ALA 50 μmol/L组的卵母细胞24 h成熟率最高,且与ALA 200 μmol/L组比较差异有统计学意义(P<0.05),这表明50 μmol/L ALA比高浓度(200 μmol/L)ALA更有利于人卵母细胞的体外成熟,且对GⅤ期卵母细胞的作用比对MⅠ期卵母细胞作用更明显。对牛、羊卵母细胞体外培养的研究结果表明,50 μmol/L ALA促进卵母细胞成熟,并提高卵母细胞的发育潜能,而更高浓度的ALA降低了卵母细胞成熟率[2,5-6]。
MⅠ期卵母细胞比GⅤ期卵母细胞体外培养成熟率高,成熟所需条件相对较低,本实验结果与此符合。但不同浓度ALA对GⅤ期卵母细胞的作用比对MⅠ期卵母细胞的作用明显,可能因为ALA能使卵母细胞内MAPK1和MAPK3磷酸化水平升高,MAPKs也是卵母细胞成熟的必需物,增加MAPK活性可加速减数分裂的恢复和GVBD,从而提高卵母细胞的核成熟率[7]。因此认为适宜浓度ALA对人GⅤ期卵母细胞体外成熟有积极作用,关于ALA对MⅠ期卵母细胞的影响机制有待研究。
卵母细胞体外成熟的难题之一就是核、质成熟同步性的问题。由于IVM得到的卵母细胞的核、质发育不同步,所以胚胎的发育潜能受到影响。本实验观察卵母细胞的成熟以第一极体的排出为标志,对胞质的成熟没有直接的测量指标,但是本实验研究组的相关研究显示,经ALA培养的卵母细胞卵裂率有所提高,且形成囊胚数增多。提示ALA对卵母细胞胞质成熟起了重要作用,一定程度上提高卵母细胞的发育潜能[8]。但是对ALA如何促进IVM卵母细胞核质成熟同步、改善卵母细胞质量,仍需进一步探索。
在卵母细胞成熟过程中,线粒体(数目、膜电位、形态和位置等)也发生明显的变化。mtDNA拷贝数是随之增加的[9]。已有研究表明卵母细胞中mtDNA的含量与受精结局和胚胎发育力密切相关[10-11]。由于mtDNA拷贝数可以表示卵母细胞中mtDNA的含量[12],所以保证受精后胚胎能完成发育的mtDNA拷贝数就是卵母细胞MⅡ期中线粒体的含量[13]。有研究认为体外培养环境中氧含量高于体内环境可导致体外成熟卵母细胞的mtDNA拷贝数、三磷酸腺苷(ATP)和活性氧簇(ROS)产量等都显著低于体内成熟卵母细胞,线粒体分布也不同于体内成熟卵母细胞[14]。但本实验发现来自ALA组的MⅡ期卵母细胞mtDNA拷贝数显著增多,表明ALA可增加卵母细胞mtDNA拷贝数。这可能与ALA在体外培养中作为一种潜在抗氧化剂,发挥抗氧化应激作用有关[15]。Marei等[6]分别用亚油酸(100 μmol/L)和ALA(50 μmol/L)体外培养牛未成熟卵母细胞,发现卵母细胞的核成熟率增加,亚油酸减少了细胞内ROS水平。Ge等[16]发现在小鼠卵母细胞体外成熟过程中,mtDNA拷贝数的减少也影响胚胎的发育潜能。本实验研究组发现在IVM培养液中添加ALA能够提高卵裂率,增加囊胚形成数[8]。这可能与本实验中ALA培养的卵母细胞mtDNA拷贝数增加有关。因为保证受精后胚胎能完成发育的mtDNA拷贝数就是卵母细胞MⅡ期中线粒体的含量[13]。当然也有观点认为在代谢原料减少等特殊情况下,细胞会反应性地增加mtDNA的拷贝数,试图产生更多的线粒体[17]。但是就本实验中卵母细胞mtDNA拷贝数的增加在一定程度上反映了ALA对卵母细胞成熟的影响。
在影响IVM结局的诸多因素中,IVM体系直接关系到卵母细胞成熟及其形成胚胎的质量。尽管目前将各种促成熟物质添加至体外培养液中的方法较常见,但仍然难以改善IVM治疗结局。因此还应扩大样本量进一步研究ALA的作用机制,为提高IVM结局及增加累积临床妊娠率提供新思路。
[1]Cha KY,Chian RC.Maturation in vitro of immature human oocytes for clinical use[J].Hum Reprod Update,1998,4(2):103-120.
[2]Marei WF,Wathes DC,Fouladi-Nashta AA.The effect of linolenic Acid on bovine oocyte maturation and development[J].Biol Reprod,2009,81(6):1064-1072.
[3]Childs S,Hennessy AA,Sreenan JM,et al.Effect of level of dietary n-3 polyunsaturated fatty acid supplementation on systemic and tissue fatty acid concentrations and on selected reproductive variables in cattle[J].Theriogenology,2008,70(4):595-611.
[4]Adamiak SJ,Powell K,Rooke JA,et al.Body composition,dietary carbohydratesandfattyacidsdeterminepost-fertilisation development of bovine oocytes in vitro[J].Reproduction,2006,131(2):247-258.
[5]Veshkini A,Khadem AA,Mohammadi-Sangcheshmeh A,et al. Linolenic acid improves oocyte developmental competence and decreases apoptosis of in vitro-produced blastocysts in goat[J]. Zygote,2016,24(4):537-548.
[6]Marei WF,Wathes DC,Fouladi-Nashta AA.Differential effects of linoleic and alpha-linolenic fatty acids on spatial and temporal mitochondrial distribution and activity in bovine oocytes[J].Reprod Fertil Dev,2012,24(5):679-690
[7]Fissore RA,He CL,Vande Woude GF.Potential role of mitogenactivated protein kinase during meiosis resumption in bovine oocytes[J].Biol Reprod,1996,55(6):1261-1270.
[8]孙丽君,胡继君,管一春,等.α亚麻酸对人未成熟卵母细胞体外成熟的影响[J].中国妇幼保健,2015,30(29):5002-5005.
[9]Bentov Y,Esfandiari N,Burstein E,et al.The use of mitochondrial nutrients to improve the outcome of infertility treatment in older patients[J].Fertil Steril,2010,93(1):272-275.
[10]Santos TA,El Shourbagy S,St John JC.Mitochondrial content reflects oocyte variability and fertilization outcome[J].Fertil Steril,2006,85(3):584-591.
[11]Chappel S.The role of mitochondria from mature oocyte to viable blastocyst[J].Obstet Gynecol Int,2013,2013:183024.
[12]Van Blerkom J.Mitochondrial function in the human oocyte and embryoandtheirroleindevelopmentalcompetence[J]. Mitochondrion,2011,11(5):797-813.
[13]Pikó L,Taylor KD.Amounts of mitochondrial DNA and abundance of some mitochondrial gene transcripts in early mouse embryos[J]. Dev Biol,1987,123(2):364-374.
[14]Bermejo-Alvarez P,Lonergan P,Rizos D,et al.Low oxygen tension during IVM improves bovine oocyte competence and enhances anaerobic glycolysis[J].Reprod Biomed Online,2010,20(3):341-349.
[15]Zavareh S,Karimi I,Salehnia M,et al.Effect of In Vitro Maturation Technique and Alpha Lipoic Acid Supplementation on Oocyte Maturation Rate:Focus on Oxidative Status of Oocytes[J].Int J Fertil Steril,2016,9(4):442-451.
[16]Ge H,Tollner TL,Hu Z,et al.The importance of mitochondrial metabolic activity and mitochondrial DNA replication during oocyte maturation in vitro on oocyte quality and subsequent embryo developmental competence[J].Mol Reprod Dev,2012,79(6):392-401.
[17]曹亚男,郝建秀,张雯珂,等.线粒体DNA与早期胚胎发育的研究进展[J].国际生殖健康/计划生育杂志,2016,35(4):313-316.
[本文编辑王昕]
Effect of Linolenic Acid on Mitochondrial DNA Copy Numbers of Human Oocyte Derived from in Vitro Maturation
HU Ji-jun,SUN Li-jun,GUAN Yi-chun,HAO Da-yong,MA Xiao-juan,QI Ruo-Fan,DONG Xiao-zhen.
Reproductive Medicine Center,the Third Affiliated Hospital of Zhengzhou University,Zhengzhou 450052,China
Correspondirng author:SUN Li-jun,E-mail:docslj@sina.com
Objective:To explore the effect of alpha-linolenic acid(ALA)on human oocytes maturation and the mitochondrial DNA(mtDNA)copy numbers of oocyte.Methods:A total of 441 morphologically normal immature oocytes were recruited from 273 infertile women underwent ICSI in our Center from October 2014 to October 2015.There were 179 oocytes at MⅠstage and 262 oocytes at GⅤstage.Oocytes with the same proportion of MⅠand GⅤwere randomly divided into 5 groups,and in vitro cultured for 24 hours in the medium with ALA at different level[0(as control),10 μmol/L,50 μmol/L,100 μmol/L,200 μmol/L].The oocyte maturation was observed,and the mtDNA copy numbers in the ALA 0 μmol/L(as control)group and the ALA 50 μmol/L group were determined by real-time PCR.Results:①The total maturation rate of the ALA 50 μmol/L group(70.1%)was significantly higher than that of the control group(42.1%)and the ALA 200 μmol/L group(34.1%,both P<0.05).②The total maturation rate of GⅤin the ALA 50 μmol/L group(64.4%)was significantly higher than that in the control group(28.9%)and the ALA 200 μmol/L group(18.2%,both P<0.05).③The mtDNA copy number of in vitro matured oocytes in the ALA 50 μmol/L group(3.64×107±1.85×106)was significantly higher than that in the ALA 0 μmol/L group(3.42×106±1.95×105,P<0.05).Conclusions:50 μmol/L ALA can increase the mtDNA copy number of the in vitro matured human oocyte,suggesting that ALA can promote the in vitro maturation of human oocyte.
Alpha-linolenic acid;Oocytes;Cell culture techniques;DNA,mitochondrial
2014年度河南省医学科技攻关计划普通项目(201403109)
450052郑州大学第三附属医院生殖医学中心
孙丽君,E-mail:docslj@sina.com
(2016-08-11)

