PM2.5对HTR8-SVneo细胞的毒性作用
秦喆,侯海燕,徐忠伟,张利文,韩斌,吴思雨,陈亚琼
·论著·
PM2.5对HTR8-SVneo细胞的毒性作用
秦喆,侯海燕,徐忠伟,张利文,韩斌,吴思雨,陈亚琼
目的:探讨大气中的PM2.5对HTR8-SVneo细胞的毒性作用。方法:采用0,30,60,120和200 μg/mL 5个浓度的PM2.5对HTR8-SVneo细胞染毒24 h,以0 μg/mL浓度为对照组,其余浓度为不同剂量PM2.5染毒组,通过CCK-8细胞增殖毒性检测试剂盒测定细胞存活率;激光全息细胞分析及成像系统观察细胞3D形态及动态监测24 h内各组细胞数量变化;流式细胞仪检测细胞生长周期;彗星试验检测细胞DNA损伤水平;活性氧簇(ROS)检测试剂盒测定细胞内ROS水平。结果:60,120和200 μg/mL浓度组细胞存活率及增殖能力低于对照组(P<0.05或P<0.01);PM2.5可使HTR8-SVneo细胞的生长周期阻滞在G2/M期(P<0.05或P<0.01);不同浓度PM2.5染毒组彗尾DNA百分比均高于对照组(P<0.01),且呈剂量依赖性。各浓度染毒组细胞中ROS的产生均高于对照组(P<0.05或P<0.01)。结论:PM2.5对HTR8-SVneo细胞有一定毒性作用,造成DNA的损伤,阻碍细胞生长周期,这种毒性作用可能与氧自由基的产生增多有关。
空气污染物;滋养细胞;细胞毒性
(J Int Reprod Health/Fam Plan,2016,35:449-453)
PM2.5(particulate matter 2.5)是空气动力学直径≤2.5 μm的大气固态与液态颗粒物质的总称,粒径小,比表面积大,弥散距离远,可携带多种有毒物质进入人体肺泡沉积,并穿过肺泡气血屏障进入血液。PM2.5与多种疾病发病机制有关,危害人类健康,成为目前医学领域的研究热点。许多学者通过体内、体外实验聚焦于PM2.5对呼吸系统、心血管系统的损伤作用及其相关机制,其对生殖系统的影响却大多集中于流行病学调查层面。流行病学研究发现,PM2.5与不良妊娠结局有关,如造成胚胎停育、胎盘早剥、低出生体质量儿等[1-4],其具体机制却鲜有提及。HTR8-SVneo细胞是永生化的人类早孕胎盘绒毛膜外滋养细胞,HTR8-SVneo细胞的正常增殖与分化是胎盘形成及发挥生理功能的重要保证,由于其无限传代的特性常被用于药物或毒物与妊娠关系的研究。本文以HTR8-SVneo细胞为研究对象,探讨PM2.5对其细胞毒性作用,以探讨PM2.5致不良妊娠结局的具体机制。
1 材料与方法
1.1材料
1.1.1实验细胞人绒毛膜外滋养细胞HTR8-SVneo细胞系由加拿大Graham教授惠赠。
1.1.2试剂与仪器①试剂:胎牛血清、RPMI 1640培养基(美国Gibco公司),胰蛋白酶(美国Hyclone公司),CCK-8(Cell Counting Kit-8)检测试剂盒(日本同仁化学研究所),流式细胞周期试剂盒(美国Biolegend公司),活性氧簇(reactive oxygen species,ROS)检测试剂盒(上海碧云天生物技术有限公司)。②仪器:TH-1000C型空气采样器(天虹仪器有限责任公司,武汉),CO2恒温三气细胞培养箱(美国Thermo Fisher公司),超净工作台(新加坡艺思高科技有限公司),倒置显微镜(日本Nikon公司),激光全息细胞分析及成像系统(瑞典Phiab公司),高速冷冻离心机(美国Beckman公司),全波长酶标仪(美国Molecular Devices公司),流式细胞仪(美国Beckman公司)。
1.2方法
1.2.1PM2.5悬浊液的配置中国环境科学院提供仪器和技术支持,利用玻璃纤维滤膜,使用TH-1000C型空气采样器采集2015年11月天津医科大学周围大气中的PM2.5颗粒物,吸气流量约为1.2 m3/min,一次连续采样24 h。将吸附有PM2.5的石英滤膜剪成1 cm×1 cm的方块,置于250 mL的广口玻璃瓶中,加入100 mL超纯水,将盛有剪好的滤膜和超纯水的广口瓶置于超声波清洗仪中,4℃恒温,超声清洗60 min后用8层纱布过滤,将滤液4℃,12 000 r/min,30 min离心弃上清,沉淀真空冷冻干燥24 h,冻干后PM2.5呈灰黑色絮状物,紫外线照射0.5 h后用无菌磷酸盐缓冲液(PBS)配置成20 mg/mL的染毒母液。
1.2.2细胞培养HTR8-SVneo细胞用含有10%胎牛血清(fetal bovine serum,FBS),1%谷氨酰胺,1%丙酮酸钠,1%青-链霉素,1%4-羟乙基哌嗪乙磺酸(Hepes)的RPMI(Roswell Park Memorial Institute)1640培养基,37℃,10%O2,5%CO2的培养箱中培养。
1.2.3CCK-8细胞增殖毒性检测常规培养消化细胞,以3×103/孔密度接种细胞于96孔板中常规培养24 h后,1 500 r/min,5 min离心,弃上清,实验组每孔加入不同浓度染毒溶液(10,20,40,60,80,100,120,160和200 μg/mL PM2.5)培养24 h,实验设立阴性对照组(含有培养基加细胞,无PM2.5染毒液)和空白对照组(仅有培养基),每孔加入20 μL CCK-8,孵育3 h后,酶标仪读取A450吸光度值。存活率=(实验组-空白对照)/(阴性对照-空白对照)×100%。
1.2.4全息细胞仪观察细胞3D形态及动态监测HTR8-SVneo细胞数的变化常规培养消化细胞,以2×105/孔密度接种细胞于六孔板常规培养24 h后,每孔加入不同浓度染毒溶液(0,30,60,120和200 μg/mL PM2.5)后,用激光全息细胞分析及成像系统每隔20 min进行一次细胞计数,监测24 h内的细胞增殖情况。
1.2.5流式细胞仪检测PM2.5对HTR8-SVneo细胞周期的影响常规培养消化细胞,以105/孔密度接种细胞于六孔板常规培养24 h后收集各孔细胞至1.5 mL环氧树脂(Epoxy epoxide,EP)管中,吸净管中PBS后逐滴加入预先配制好的预冷的75%乙醇,滴加的同时轻柔震荡,-20℃固定。PBS洗固定后的细胞2次,各管加入500 μL含0.2%聚乙二醇辛基苯基醚(Triton-X 100),100 μg/mL核糖核酸酶A、50 μg/mL碘化丙啶的PBS,避光孵育0.5 h后上机。实验独立重复3次。
1.2.6单细胞凝胶电泳实验(彗星实验)检测PM2.5对HTR8-SVneo细胞的DNA损伤作用常规消化细胞,制备单细胞悬液。取100 μL于45℃水浴中保温的0.5%正常熔点琼脂糖,铺于磨沙载玻片上,形成底胶,盖玻片推匀,不能有气泡,4℃凝固5~8 min。水平取下盖片,取100 μL于37℃水浴中保温的1%低熔点琼脂糖与100 μL细胞悬液(约400个细胞)混匀,立即铺片,加上盖玻片,4℃凝固5~8 min。将制备好的胶板去掉盖玻片后,浸于4℃预冷的细胞裂解液中,在4℃下裂解1~3 h。取出胶板,用双蒸水浸没漂洗后放入电泳槽中,浸泡在4℃预冷的电泳液中解旋30 min~1 h。玻片水平放置阳极端附近,4℃电泳20~25 min(25 V,300 mA)。可在电泳槽周围加冰块以保持低温。电泳结束后将胶板浸泡于中和液中,每次10min,中和3次,每次要更换中和液。最后晾干。取出胶板,碘化丙啶(5 mg/mL)染色,暗处染色5~10 min。蒸馏水漂洗2次,每次5 min。稍晾干,滤纸吸去多余水分,尽快在荧光显微镜下观察,利用彗星分析软件(CometAssaySoftwareProject,CASP)分析图像。实验独立重复3次。
1.2.7HTR8-SVneo细胞氧化指标的检测各组细胞ROS含量的检测严格按照试剂盒说明书进行。按照1∶1 000用无血清培养液稀释荧光探针2′,7′-二氯荧光黄双乙酸盐(DCFHDA),使终浓度为10 μmol/L。收集消化后的细胞,悬浮于稀释好的DCFH-DA中,细胞浓度为106个/mL,37℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。使用荧光酶标仪检测。实验独立重复3次。
1.3统计学方法采用SPSS21.0软件分析数据,定量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析,组间两两比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1各组细胞3D形态HTR8-SVneo细胞正常形态为梭形,且轮廓清晰。随着PM2.5染毒剂量的增加,细胞形态发生改变,轮廓逐渐模糊。见图1(见封三)。
2.2CCK-8细胞增殖毒性检测结果不同浓度染毒组的细胞存活率比较,差异有统计学意义(F=21.74,P<0.05);与对照组(0 μg/mL)相比,120 μg/mL和200 μg/mL PM2.5染毒组的细胞存活率降低,差异有统计学意义(P<0.05或P<0.01)。见图2。
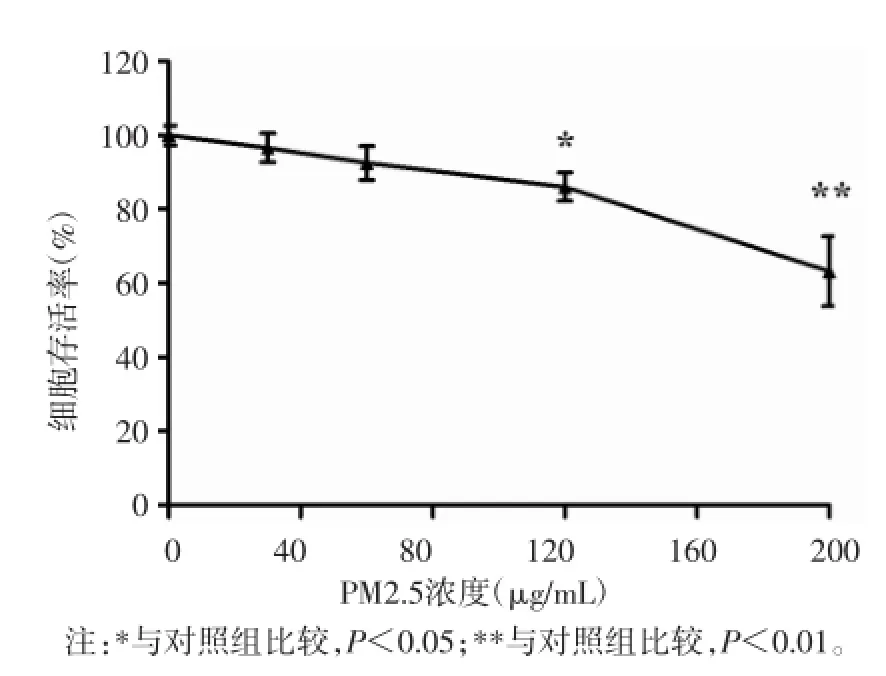
图2 各组HTR8-SVneo细胞存活率比较
2.324h内细胞增殖情况各组细胞增殖力比较差异有统计学意义(F=108.8,P<0.01),其中与对照组(0 μg/mL)相比,30 μg/mL PM2.5染毒组细胞增殖能力变化差异无统计学意义(P>0.05),随着染毒浓度的增加,60、120和200 μg/mL PM2.5染毒组的细胞增殖能力逐渐减弱,差异有统计学意义(均P<0.01)。见图3(见封三)。
2.4PM2.5对HTR8-SVneo细胞周期的影响随着PM2.5浓度增加,G2/M期细胞数逐渐增多,各组G2/ M期细胞数分别为(20.84±2.61)个、(49.10±6.14)个、(53.72±6.72)个、(61.37±7.67)个和(61.96±7.75)个,差异有统计学意义(F=20.42,P<0.01)。与对照组(0 μg/mL)相比,不同浓度PM2.5染毒组的G2/M期细胞数均升高(P<0.05或P<0.01)。见图4(见封三)。
2.5PM2.5对HTR8-SVneo细胞DNA的损伤作用不同浓度组的细胞彗尾DNA百分比比较,差异有统计学意义(F=156.5,P<0.01),其中60,120和200 μg/mL PM2.5染毒组的细胞彗尾DNA百分比大于对照组,且呈剂量依赖性,差异有统计学意义(P<0.01)。见图5(见封三)。
2.6HTR8-SVneo细胞内ROS含量的测定不同浓度组细胞内ROS含量比较,差异有统计学意义(F= 39.87,P<0.01)。60,120和200 μg/mL PM2.5染毒组细胞内ROS含量高于对照组,差异有统计学意义(P<0.05或P<0.01)。见图6。
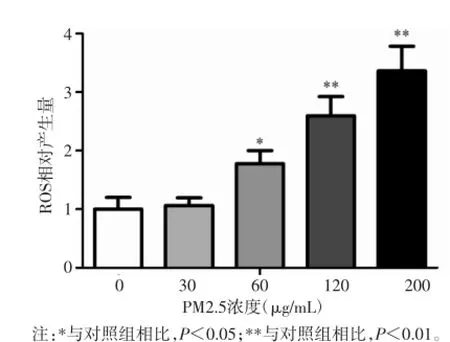
图6 PM2.5对HTR8-SVneo细胞内ROS含量的影响
3 讨论
滋养细胞来源于胚胎外胚层,是构成胎盘的主要细胞,在妊娠早期适度侵入子宫蜕膜和血管,促进胎盘着床及子宫螺旋动脉的重塑,确保胚胎正常植入以及胎儿足够的血液供应。因此,滋养细胞正常的增殖能力与生物学功能是妊娠成功的先决条件。以HTR8-SVneo细胞为研究对象,探讨PM2.5对滋养细胞的毒性作用对于了解PM2.5致不良妊娠结局的具体机制具有重大意义。
3.1PM2.5降低HTR8-SVneo细胞的增殖能力
HTR8-SVneo是永生化的人绒毛膜外滋养细胞,具有和原代滋养细胞相同的生物性状。本研究发现,不同浓度PM2.5对HTR8-SVneo细胞增殖均有一定影响,CCK-8细胞毒性检测与激光全息细胞分析及成像系统均显示PM2.5影响细胞的正常增殖且存在剂量依赖效应。研究已证实PM2.5对细胞增殖的抑制作用,例如,人类肺成纤维细胞经100~200 μg/mL的PM2.5染毒24 h后存活率降为81%~91%[5]。烹调油烟中的细颗粒物PM2.5对胎鼠AECⅡ细胞增殖具有明显的抑制作用,且呈时间-反应关系和剂量-反应关系,其中200 μg/mL PM2.5造成AECⅡ细胞存活率约为50%[6]。本研究通过全息细胞仪观察染毒24 h后各组细胞形态发现,随着染毒浓度增加,细胞轮廓逐渐模糊,说明HTR8-SVneo细胞经PM2.5染毒后细胞膜完整性受损,与同类研究结果类似[7]。
3.2PM2.5使HTR8-SVneo细胞周期发生阻滞一个完整的细胞周期包括4个阶段,分别为G1期、S期、G2期和M期,G1期是从有丝分裂到DNA复制前的一段时期,主要是RNA和蛋白质的合成,为S期细胞质和DNA的合成与复制做准备。S期为DNA合成期,在此期除了合成DNA外,同时还要合成组蛋白。G2期DNA合成结束,M期即细胞进入有丝分裂。细胞停留在G1或G2期过久则说明发生了阻滞,细胞周期阻滞受到一系列分子机制的调控,使得细胞DNA在S期复制或M期分裂时免受损害,避免错误的遗传信息进入子代细胞,保持细胞遗传特性的稳定性。细胞周期阻滞是细胞对外界刺激的一种保护效应,G1期阻滞可以提供充足的时间诱导受损DNA的修复。细胞经过G2/M这一调控点即进入有丝分裂阶段,G2/M期则确保细胞精准地完成有丝分裂过程。若一些损伤的DNA未经修复直接进入下一个细胞周期阶段,这种损伤将会导致遗传的不稳定性[8]。研究表明,PM2.5可影响多种细胞的生长周期。Deng等[9]用源于沙尘暴的PM2.5以及正常来源PM2.5处理人类肺纤维细胞,发现G2/M期细胞数显著增多。另有研究发现PM2.5在抑制原发性胎儿肺泡Ⅱ型上皮细胞ACEⅡ增殖的同时使ACEⅡ细胞生长周期阻滞在sub-G1与G1期,并且由细胞周期蛋白/细胞周期蛋白依赖性激酶(cyclin/CDK)复合物严格调控,验证了PM2.5对细胞增殖的抑制作用与细胞周期进程有关的猜想[8]。本研究发现,随着PM2.5染毒剂量的增加,G2/M期细胞数量逐渐增加,PM2.5可以影响多种细胞的有丝分裂周期,例如PM2.5通过氧化应激ROS增多激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)和胞外信号调节激酶(extracellular signal-regulated kinase,ERK)通路,造成大鼠胚胎细胞G1/S期阻滞[10]。Longhin等[11]发现PM2.5激活了P53-Chk2通路造成BEAS-2B细胞G2/M期阻滞。Abbas等[12]发现PM2.5通过TP53-RB通路造成L132细胞G2期阻滞。由此可见,PM2.5对细胞周期的影响依赖于细胞种类的不同,并且涉及不同的通路,笔者认为PM2.5对细胞增殖能力的抑制作用与其对细胞周期进程的影响关系密切,PM2.5使HTR8-SVneo细胞发生G2/M期阻滞,而具体分子机制有待探讨。有学者发现杀虫剂苯菌灵降低HTR8-SVneo细胞在G0/G1期的比例,使细胞停留在G2/M期,因为苯菌灵可以结合纺锤体微管蛋白破坏其装配,在有丝分裂期间影响细胞周期进程[13],因此笔者推测,PM2.5可能同样影响HTR8-SVneo细胞内纺锤体的装配从而改变细胞生长进程。
3.3PM2.5通过氧化应激造成HTR8-SVneo细胞DNA损伤已知PM2.5诱导细胞发生氧化应激是其细胞毒性的主要分子机制[14]。本课题组前期研究发现,多环芳烃类污染物苯并芘(BaP)可以刺激HTR8-SVneo细胞发生氧化应激,而BaP又是PM2.5的组成成分[15]。本研究发现,HTR8-SVneo细胞经不同浓度PM2.5染毒后ROS产生量亦增多,验证了本课题组对PM2.5诱发HTR8-SVneo细胞氧化应激的猜想。既往研究表明,PM2.5诱导ROS的产生与丝裂原活化蛋白激酶(MAPK)家族成员,以及缺氧诱导因子1α(HIF-1α)、核因子κB(NF-κB)等转录因子的激活关系密切,同时ROS作为一个信号分子开启Nrf-2防御机制,通过磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(AKT)通路的激活抵御氧化应激[14]。有研究发现肺泡上皮细胞A549经PM2.5染毒后,在G2/M期产生的ROS最多,考虑为G2/M期的细胞中线粒体含量高所致[16-17]。结合本研究结果,笔者认为PM2.5造成HTR8-SVneo细胞产生ROS增多与其造成细胞G2/M期阻滞有关,但是否涉及其他通路有待进一步研究。
氧化应激造成的DNA损伤包括8-羟基脱氧鸟苷(8-OHdG)的形成和DNA链断裂。彗星实验是一种通过检测DNA链损伤来判别遗传毒性的技术,当各种内源性和外源性DNA损伤因子诱发细胞DNA链断裂时,在碱性电解质的作用下,DNA发生解螺旋,损伤的DNA断链及片段被释放出来。由于这些DNA的分子质量小且碱变性为单链,所以在电泳过程中带负电荷的DNA会离开核DNA向正极迁移形成“彗星”状图像,而未受损伤的DNA部分保持球形。DNA受损越严重,产生的断链和断片越多,长度也越大,在相同的电泳条件下迁移的DNA量就愈多,迁移的距离就愈长。本研究发现,随着PM2.5浓度的增加,彗尾DNA含量增多,即证实了PM2.5对HTR8-SVneo细胞DNA的损伤作用,与许多同类研究结果类似[18-20]。因此可以确定的是,PM2.5诱导HTR8-SVneo细胞发生氧化应激后进一步损伤细胞DNA造成遗传毒性。
综上所述,PM2.5可以影响HTR8-SVneo细胞的生长周期从而抑制其增殖过程,同时诱导细胞发生氧化应激造成DNA的损伤。PM2.5对于HTR8-SVneo细胞的毒性作用可能是其造成不良妊娠结局的潜在机制。
[1]Sun X,Luo X,Zhao C,et al.The associations between birth weight and exposure to fine particulate matter(PM2.5)and its chemical constituents during pregnancy:A meta-analysis[J].Environ Pollut,2016,211:38-47.
[2]Arroyo V,Díaz J,Carmona R,et al.Impact of air pollution and temperature on adverse birth outcomes:Madrid,2001-2009[J]. Environ Pollut,2016,218:1154-1161.
[3]Pereira G,Evans KA,Rich DQ,et al.Fine Particulates,Preterm Birth,and Membrane Rupture in Rochester,NY[J].Epidemiology,2016,27(1):66-73.
[4]Yang L,Wang Y,Lin Z,et al.Mitochondrial OGG1 protects against PM2.5-induced oxidative DNA damage in BEAS-2B cells[J].Exp Mol Pathol,2015,99(2):365-373.
[5]贾玉巧,赵晓红,郭新彪,等.大气颗粒物PM10和PM2.5对人肺成纤维细胞及其炎性因子分泌的影响[J].环境与健康杂志,2011,28(3):206-208.
[6]汪磊,王勇,操基玉,等.烹调油烟中细颗粒物对胎鼠肺泡Ⅱ型上皮细胞的遗传毒性[J].中国工业医学杂志,2012,35(3):210-212.
[7]王伟,程硕,谈明光,等.上海市吴淞地区大气PM2.5两种提取成分的细胞毒性研究[J].环境与职业医学,2005,22(4):299-302.
[8]Liu Y,Chen YY,Cao JY,et al.Oxidative stress,apoptosis,and cell cycle arrest are induced in primary fetal alveolar type II epithelial cells exposed to fine particulate matter from cooking oil fumes[J]. Environ Sci Pollut Res Int,2015,22(13):9728-9741.
[9]Deng F,Guo X,Liu H,et al.Effects of dust storm PM2.5 on cell proliferation and cell cycle in human lung fibroblasts[J].Toxicol In Vitro,2007,21(4):632-638.
[10]Yuan X,Wang Y,Li L,et al.PM2.5 induces embryonic growth retardation:Potential involvement of ROS-MAPKs-apoptosis and G0/G1 arrest pathways[J].Environ Toxicol,2015 Oct 15.[Epub ahead of print]
[11]Longhin E,Holme JA,Gutzkow KB,et al.Cell cycle alterations inducedbyurbanPM2.5inbronchialepithelialcells: characterization of the process and possible mechanisms involved [J].Part Fibre Toxicol,2013,10:63.
[12]Abbas I,Verdin A,Escande F,et al.In vitro short-term exposure to air pollution PM2.5-0.3 induced cell cycle alterations and genetic instability in a human lung cell coculture model[J].Environ Res,2016,147:146-158.
[13]Zhou J,Xiong K,Yang Y,et al.Deleterious effects of benomyl and carbendazim on human placental trophoblast cells[J].Reprod Toxicol,2015,51:64-71.
[14]Deng X,Rui W,Zhang F,et al.PM2.5 induces Nrf2-mediated defense mechanisms against oxidative stress by activating PIK3/ AKT signaling pathway in human lung alveolar epithelial A549 cells[J].Cell Biol Toxicol,2013,29(3):143-157.
[15]章艳燕,侯海燕,陈晓,等.五味子乙素对苯并芘致HTR8-SVneo细胞氧化损伤的保护作用[J].国际生殖健康/计划生育杂志,2015,34(3):181-183.
[16]Vattanasit U,Navasumrit P,Khadka MB,et al.Oxidative DNA damage and inflammatory responses in cultured human cells and in humans exposed to traffic-related particles[J].Int J Hyg Environ Health,2014,217(1):23-33.
[17]Yamamori T,Yasui H,Yamazumi M,et al.Ionizing radiation inducesmitochondrialreactiveoxygenspeciesproduction accompanied by upregulation of mitochondrial electron transport chain function and mitochondrial content under control of the cell cycle checkpoint[J].Free Radic Biol Med,2012,53(2):260-270.
[18]Gao ZX,Song XL,Li SS,et al.Assessment of DNA Damage and Cell Senescence in Corneal Epithelial Cells Exposed to Airborne Particulate Matter(PM2.5)Collected in Guangzhou,China[J]. Invest Ophthalmol Vis Sci,2016,57(7):3093-3102.
[19]Bocchi C,Bazzini C,Fontana F,et al.Characterization of urban aerosol:seasonal variation of mutagenicity and genotoxicity of PM2.5,PM1 and semi-volatile organic compounds[J].Mutat Res,2016,809:16-23.
[20]YangL,WangWC,LungSC,etal.Polycyclicaromatic hydrocarbons are associated with increased risk of chronic obstructive pulmonary disease during haze events in China[J].Sci Total Environ,2017,574:1649-1658.
[本文编辑秦娟]
Cytotoxicity of PM2.5 on HTR8-SVneo Cells
QIN Zhe,HOU Hai-yan,XU Zhong-wei,ZHANG Li-wen,HAN Bin,WU Si-yu,CHEN Ya-qiong.
Department of Obstetrics and Gynecology,Affiliated Hospital of Logistics University of Chinese People′s Armed Police Forces,Tianjin 300162,China(QIN Zhe,HOU Hai-yan,WU Siyu,CHEN Ya-qiong);Central Laboratory,Logistics University of Chinese People′s Armed Police Forces,Tianjin 300162,China(QIN Zhe,XU Zhong-wei);Peking Union Medical College Hospital,China Academy of Sciences,Beijing 100730,China(HOU Hai-yan);School of Public Health,Tianjin Medical University,Tianjin 300070,China(ZHANG Li-wen);State Key Laboratory of Environmental Criteria and Risk Assessment,Chinese Research Academy of Environmental Sciences,Beijing 100012,China(HAN Bin)
CHEN Ya-qiong,E-mail:chenyq82@hotmail.com
Objective:To investigate the cytotoxicity of atmospheric PM2.5 on HTR8-SVneo cells. Methods:The in vitro cultured HTR8-SVneo cells were exposed to PM2.5 at the concentrations of 0,30,60,120 and 200 μg/mL for 24 h.The cells treated with 0 μg/mL PM 2.5 were used as the control group.The cell survival rate was analyzed by the CCK-8 cell proliferation and cytotoxicity test kits.The 3D morphology was observed by the Laser holographic cell analysis and imaging system.The change in the number of cells was also dynamically monitored.The cell cycle was detected by flow cytometry.The level of DNA damage was detected by comet assay. The level of intracellular reactive oxygen species(ROS)was measured by the ROS kits.Results:The survival rate and proliferation ability in three groups treated with 60,120 and 200 μg/mL PM2.5 were significantly lower than those in the control group(P<0.05 or P<0.01).PM2.5 treatment made the growth cycle arrest in G2/M phase(P<0.05 or P<0.01).The percentage of tail DNA in the PM2.5 exposure groups was higher than that in the control group(P<0.01),with a dose-dependent manner.The level of ROS in the PM2.5 exposed groups was higher than that in the control group(P<0.05 or P<0.01).Conclusions:PM2.5 has a certain cytotoxicity on HTR8-SVneo cells via the DNA damage and the cell cycle arrest which is related to the increased oxygen free radicals.
Air pollutants;Trophoblast cell;Cytotoxicity
国家自然科学基金(81402691);天津市应用基础与前沿技术研究计划重点项目(15JCZDJC36000)
300162天津,中国人民武装警察部队后勤学院附属医院妇产科(秦喆,侯海燕,吴思雨,陈亚琼);中国人民武装警察部队后勤学院中心实验室(秦喆,徐忠伟);中国医学科学院北京协和医学院(侯海燕);天津医科大学公共卫生学院(张利文);环境基准与风险评估国家重点实验室,中国环境科学研究院(韩斌)
陈亚琼,E-mail:chenyq82@hotmail.com
(2016-09-10)

