转基因抗病玉米饲喂Wistar大鼠食用安全性评价
刘 明,李宝健,仇玉兰,裴秋玲,王景雪
(1 山西大学生命科学学院,太原 030006;2 中山大学生命科学学院,广州 510275;3山西医科大学公共卫生学院,太原 030001)
转基因抗病玉米饲喂Wistar大鼠食用安全性评价
刘 明1,李宝健2,仇玉兰3,裴秋玲3,王景雪1
(1山西大学生命科学学院,太原 030006;2中山大学生命科学学院,广州 510275;3山西医科大学公共卫生学院,太原 030001)
目的:利用不同剂量的转几丁质酶和β-1,3葡聚糖酶基因的转基因抗病玉米粉饲喂Wistar大鼠28d,之后继续用相同剂量未转基因的对照玉米饲喂1w。检测实验期和恢复期Wistar大鼠食用转基因玉米的食用安全性。方法:将Wistar大鼠按体重随机分为1个对照组和饲喂转基因玉米低、中、高剂量组等4个组,每组雌雄各半,经口28d摄入转基因玉米。饲喂期间对大鼠的一般生活状况、体重增长进行观察;大鼠饲喂期和停止饲喂后1w,统计其食物利用率;连续喂饲4w末和停止喂养后1w,对大鼠血清生化学指标进行检查,同时进行解剖学检查。结果:大鼠饲喂转基因玉米后,与对照组比较,一般生活状况无明显差异,无任何中毒症状出现,全部动物健康存活;与对照组同期同性别的大鼠相比,体重增长未见统计学差异(P>0.05);大鼠喂饲4w末和停止喂饲后1w食物利用率未见统计学差异(P>0.05);饲喂转基因玉米期间,大鼠血清谷草转氨酶(AST)/谷丙转氨酶(ALT)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、天冬氨酸氨基转移酶(AST)等指标与同期对照组比较未见显著差异(P>0.05);大体解剖肉眼观察,各脏器颜色形态未见异常,脏器系数未见异常。结论:实验周期内转几丁质酶和β-1,3葡聚糖酶的转基因抗病玉米对Wistar大鼠生长发育无明显不良影响,转几丁质酶和β-1,3葡聚糖酶的转基因抗病玉米及其亲本玉米对大鼠具有同等的食用安全性。
转基因玉米;几丁质酶;β-1,3-葡聚糖酶;食用安全性;剂量
我国是世界玉米生产第二大国,但我国每年因病虫害造成的玉米产量损失约5%~15%,局部地区病害严重时产量损失可达到50%~70%以上[1]。转基因技术在提高作物抗病、虫害能力、抗非生物逆境等方面都取得非常大的进展,已研发出的转基因抗虫、抗除草剂玉米表现出了良好的增产性能。然而,关于转基因植物的食用安全性一直是科学界、政府和广大消费者关心的焦点问题,许多国家都投入了大量的人力物力,对转基因植物的生物安全性进行研究[2-4]。有关国际组织对此也制定了相关规定,我国也制定了一系列的政策措施开展对转基因作物的安全管理和监督[5-10]。
根据转基因生物安全性评价的原则,已经有一些研究者对转基因玉米进行了个案评价,如朱亚熙等[11]对转G2-aroA基因耐草甘膦玉米和非转基因玉米营养成分进行了比较分析,结果显示两者之间没有明显的差异。Han et al.[12]用转Cry1Ah和G2-aroA基因的抗虫、耐草甘膦玉米饲喂SD大鼠90d,结果显示,转基因玉米和非转基因玉米在对SD大鼠的食用安全性上没有显著差别[12]。朱晗等[13]用转基因玉米Bt-799饲喂Wistar大鼠14w,证明Bt-799玉米对Wistar大鼠生长发育无明显不良影响。Appenzeller et al.[14]用转有Cry1F、PAT、Cry34Ab1/Cry35Ab1 和PAT等4种基因的抗虫玉米饲喂SD大鼠92d,结果显示,该转基因玉米与非转基因玉米对大鼠的营养性能上没有明显差异。本研究以转几丁质酶基因和β-1,3葡聚糖酶基因玉米为实验材料,以Wistar大鼠为实验动物,将不同比例的转基因玉米添加到动物饲料中,饲喂大鼠28d,对其食用安全性进行研究,以期为该转基因玉米的食用安全性评价提供参考依据。
1 材料与方法
本试验在山西医科大学毒理学教研室完成。
1.1 材料
1.1.1 实验动物 体重180~200g左右的幼龄SPF级健康Wistar大鼠,动检号:070101,雌雄各半,由山西医科大学实验动物中心提供。饲养环境为标准的SPF级动物室,饲养条件参照相关标准[15]。
1.1.2 转基因玉米及其亲本对照玉米 受试转基因玉米为玉米自交系海9-21转入几丁质酶和β-1,3葡聚糖酶基因,经分子检测和田间抗病实验,证明是转基因并且具有抗玉米丝黑穗病特性的玉米材料。以亲本玉米自交系海9-21作为对照,该玉米自交系为山西、重庆、山东等地推广种植的多个高产杂交种,如晋单36、太单30、金泰99和登海3337的亲本,已被证实可安全食用[16]。转基因玉米和未转基因的亲本自交系海9-21均由山西省农业科学院生物技术研究中心提供。
1.1.3 饲料配制 动物标准饲料由中国放射防护研究院动物中心按试验动物标准饲料配方制成。
(1)饲料基本配方为:68%标准饲料+32%的玉米粉,其中玉米粉为转基因或未转基因的玉米粉。按照饲料中转基因玉米的加入量将实验分为:对照组、高剂量组、中剂量组和低剂量组等4组,其中对照组为68%标准饲料+32%玉米自交系海9-21玉米粉;低剂量组为68%标准饲料+8%转基因玉米粉+24%玉米自交系海9-21玉米粉;中剂量组为68%标准饲料+16%转基因玉米粉+16%玉米自交系海9-21玉米粉;高剂量组为68%标准饲料+32%转基因玉米粉。(2)饲料配制方法:标准饲料和玉米粉均匀混合用水和成小块状,干燥箱自然烘干,大鼠自由经口摄入,大鼠的饮水方式为自由饮水。各实验处理饲喂剂量保持一致。
1.2 实验方法
1.2.1 动物分组及管理 将受试大鼠按体重随机分成4个实验组,每组20只,雌雄各半,以每笼饲养2只同性大鼠进行管理,分别饲喂低剂量、中剂量、高剂量和对照组饲料。动物自由饮食,各实验组大鼠分别连续饲喂4w(实验期)相应剂量的饲料,之后各实验组组随机取10只大鼠,进行眼眶采血以及常规病理解剖取材,进行相应的生理生化分析。剩余10只全部改为饲喂对照饲料,1w(恢复期)后进行相同处理和分析。对照组则一直饲喂对照组饲料。在饲喂大鼠的同时每天观察大鼠经口长期摄入转几丁质酶和β-1,3葡聚糖酶基因玉米后机体产生的异常反应和反应的可逆程度。
1.2.2 一般状况 每日观察大鼠的外观、精神、行为、活动、被毛、粪便和饮水等情况。
1.2.3 体重 每周称量并记录每只大鼠的体重。
1.2.4 摄入量 每周称1次体重,记录食物摄入量,计算每周及总的食物利用率如(1)式。
食物利用率=平均体重增长/平均进食量
(1)
1.2.5 血清生化学检查 连续喂饲4w末,每个试验组随机选取10只大鼠,禁食16h后采血,每只大鼠眼眶采血约1mL。停止喂养后1w对剩余10只大鼠采血,处理同前。取样后,对血液样品进行抗凝处理,分别对2次采取的血液样品分离血清,并使用日本日立公司生产的7060型自动生化分析仪和北京中生生物工程高技术公司生产的生化检验试剂盒进行血清生化学检查,检测项目包括:谷草转氨酶(AST)/谷丙转氨酶(ALT)、总蛋白(TP)、白蛋白(ALB)、尿素氮(BUN)、天冬氨酸氨基转移酶(AST)等指标。
1.2.6 大体解剖和脏器称重 麻醉处死大鼠,肉眼逐一观察各组织器官,仔细分离并称量心脏、肝脏、脾脏、肺、肾脏、胃和脑重量,并与体重进行比较,按照(2)式计算脏器系数。
脏器系数=脏器重量/体重
(2)
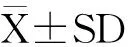
2 结果与分析
2.1 一般状况
通过观察大鼠饲喂转基因玉米后其外观、精神、行为、活动、被毛、粪便和饮水等方面的微小变化,各实验组动物活动正常,与对照组比较,无明显差异,也无任何中毒症状出现,全部动物健康存活。
2.2 体重增长
各实验组和对照组的大鼠在实验期间体重增加比较稳定,雄性大鼠体重增幅略高于雌性。对于雄性大鼠,只有在第2w时,各雄性实验组与雄性对照组相比差异具有统计学意义(P<0.05),其余各实验组和对照组同期相比,大鼠体重增长未见统计学差异(P>0.05)(图1)。对于雌性大鼠,各实验组与对照组同期相比,大鼠体重增长均未见统计学差异(P>0.05)(图2)。

图1 雄性大鼠体重变化

图2 雌性大鼠体重变化
2.3 食物利用率
大鼠连续喂饲4w末和停止喂养1w后,同期同性别的各实验组与其对照组相比,总食物利用率差异均无统计学意义(P>0.05)(表1)。
2.4 血清生化学检查
连续喂饲4w末和停止喂养后1w,同时期各实验组分别与对照组相比,血清生化学检查的相应指标也未见显著差异(P>0.05)(表2)。
2.5 大体解剖肉眼观
连续喂饲4w末和停止喂养后1w对实验组大鼠进行解剖,仔细观察心、肝、脾等脏器,颜色形态未见异常。
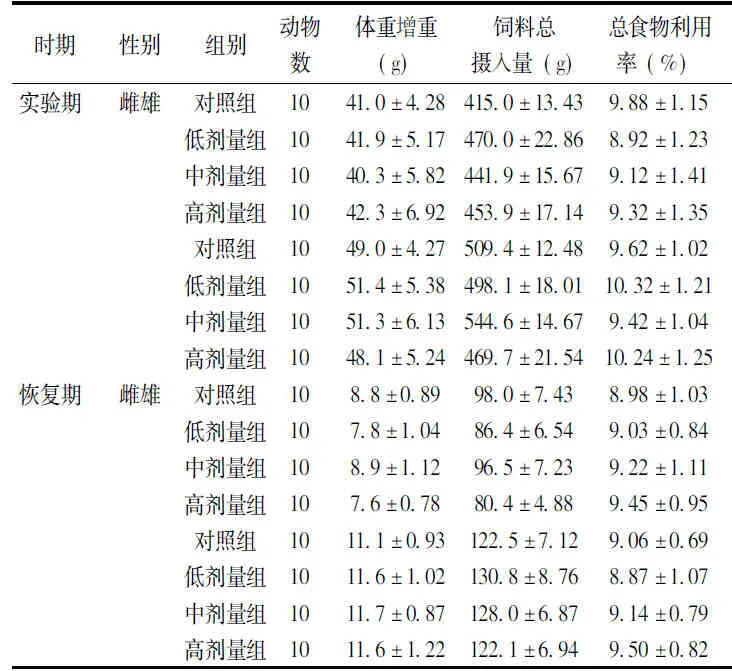
表1 大鼠食物利用率的比较
2.6 脏器重量
连续喂饲4w末和停止喂养1w后对实验组和对照组大鼠进行解剖,称量喂饲前后的心脏、肝脏、脾脏、肺、肾脏、胃和脑的重量,与体重进行比较。各实验组与同期对照组相比,各脏器系数无统计学上差异(P>0.05),脏体比较未见异常(表3)。

表2 大鼠血清生化学分析

表3 大鼠脏器观察结果的比较
3 讨论
转基因食品安全性评价包括营养学及抗营养素安全评价、致敏性研究、毒理学安全评价等[17,18]。本研究所用转基因玉米中转有几丁质酶和β-1,3葡聚糖酶基因。几丁质和葡聚糖是真菌细胞壁的主要成分,几丁质酶和β-1,3葡聚糖酶能特异地催化水解真菌细胞壁中的几丁质和葡聚糖,阻止真菌对植物的入侵,从而起到抗真菌性病害的作用。
研究证实,本研究所用的转基因玉米对真菌引起的玉米丝黑穗病具有良好的抗性。虽然转几丁质酶和β-1,3葡聚糖酶可以提高植物抗真菌病害的能力已经是一个不争的事实[19-21],但关于转几丁质酶和β-1,3葡聚糖酶的转基因植物的食品安全性却鲜有报道[22]。本研究利用转基因玉米对大鼠进行了连续28d喂养,在饲喂期和停喂1w后,分别对实验组和对照组大鼠的一般生长状况、体重增长、食物利用率以及血清生化学指标等进行了分析。结果表明,转基因组与非转基因的对照组、以及不同剂量组与对照组之间均没有明显差异。说明在实验条件下,转基因玉米以占饲料8%、16%、32%的比例饲喂大鼠28d,在饲喂期间和停喂1w后,转基因玉米对大鼠未产生毒害作用,表明转几丁质酶和β-1,3葡聚糖酶基因玉米与亲本海9-21对Wistar大鼠具有同等食用安全性。
目前,用转基因植物或食品直接喂养实验动物,以观察转基因植物或食品的食用安全性,有很多的研究。由于实验设计依据不同,转基因饲料在整个饲料中所占比例差别很大,从5%~90%以上,各不相同[23-25],本实验转基因饲料设置了3个不同的剂量组,8%、16%、32%对大鼠进行实验,未发现有毒害作用。今后,可以加大转基因玉米在饲料中比例,进行进一步的实验,也可以将几丁质酶和β-1,3葡聚糖酶蛋白提取出来,直接以高出正常摄入量数十倍或数百倍的量直接饲喂,进行毒性实验。如Nicola et al.的研究[26]。
鉴于本文所研究的转基因玉米的食用安全性,仅仅是饲喂28d所得的结果,还需要进行更长时间的喂养以进行进一步的验证。◇
[1]杨春会.谈玉米病害发生的种类及症状[J].科技制富向导,2013,17:337.
[2]Domingo J L,Bordonaba J G.A literature review on the safety assessment of genetically modified plants[J].Environment International,2011,37:734-742.
[3]Li Y.,et al.Biosafety management and commercial use of genetically modified crops in China[J].Plant Cell Rep,2014,33:565-573.
[4]Goodman R E,et al.Evaluation of endogenous allergens for the safety evaluation of genetically engineered food crops:review of potential risks,test methods,examples and relevance[J].J Agric Food Chem,2013,61:8317-8332.
[5]Alink G,et al.Safety and nutritional assessment of GM plants and derived food and feed:the role of animal feeding trials[J].Food Chem Toxicol,2008,46:S2-S70.
[6]黄昆仑,许文涛.转基因食品安全评价与检测技术[M].北京:科学出版社,2009.
[7]沈平,黄昆仑.国际转基因生物食用安全检测及其标准化[M].北京:中国物质出版社,2010.
[8]中华人民共和国农业部.转基因植物及其产品食用安全检测:大鼠90d 喂养试验[S].中华人民共和国农业行业标准:NY/T1102-2006,2006:1-6.
[9]Alimentarius C.Guideline for the conduct of food safety assessment of foods derived from recombinant-DNA plants[J].CAC/GL,2003,45:1-18.
[10]Kuiper H A,et al.Assessment of the food safety issues related to genetically modified foods[J].Plant J.,2001,27(6):503-528.
[11]朱亚熙,贺晓云,马丽艳,等.转G2-aroA基因耐草甘膦玉米和非转基因玉米营养成分的比较分析[J].中国食物与营养,2012,18(9):65-69.
[12]Han S,Zou S,He X,et al.Potential subchronic food safety of the stacked trait transgenic maize GH5112E-117C in Sprague-Dawley rats[J].Transgenic Research,2016,DOI 10.1007/s11248-016-9944-6
[13]朱晗,等.Bt-799玉米对 Wistar 大鼠食用安全性评价研究[J].中国食物与营养,2014,20(9):63-67.
[14]Appenzeller L M,et al.Subchronic feeding study with genetically modified stacked trait lepidopteran and coleopteran resistant(DAS-φ15φ7-1xDAS-59122-7)maize grain in Sprague-Dawley rats[J].Food Chem Toxicol,2009,47:1512-1520.
[15]胡建华,姚明,崔淑芳.实验动物学教程[M].上海:上海科学技术出版社,2009.
[16]石平,苏书文,白琪林,等.玉米自交系海-21的选育与应用[J].作物杂志,2011,3:123-124.
[17]WHO.Application of the principles of substantial equivalence to the safety evaluation of food components from plants derived by modern biotechnology[R].Report of a WHO Workshop,Geneva:WHO,1995.
[18]OECD.Safety evaluation of foods derived by modern biotechnology-concepts and principles[R].OECD Publishing,Paris,1993.
[19]Vesselina S A,et al.Intercellular proteins and β-1,3-glucanase activity associated with leaf rust resistance in wheat[J].Physiol Plantarum.1999,106:393-401.
[20]Anguelova-Merhar V S,et al.β-1,3-Glucanase and chitinase activities and the resistance response of wheat to leaf rust[J].Journal of Phytopathology,2001,149:381-384.
[21]冯道荣,许新萍,范钦,等.获得抗稻瘟病和纹枯病的转多基因水稻[J].作物学报,2001,27(3):293-300.
[22]姚春馨,等.转几丁质酶—葡聚糖酶双价基因水稻稻米毒理试验[J].中国粮油学报,2007,22(4):18-23.
[23]Fonseca C,Planchon S,Renaut J,et al.Characterization of maize allergens- MON810 vs.its non-transgenic counterpart[J].Jouranl of Proteomics,2012,75(7):2027-2037.
[24]Hammond B,et al.Toxicological evaluation of proteins introduced into food crops[J].Critical Reviews in Toxicology,2013,43:25-42.
[25]Liu P,et al.A 90-day subchronic feeding study of genetically modified maize expressing Cryl Ac-M protein in Sprague-Dawley rats[J].Food Chem Toxicol,2012,50(9):3215-3221.
[26]Nicola J S,et al.Acute and 28-day repeated dose toxicology studies in mice with aryloxyalkanoate dioxygenase(AAD-1)protein expressed in 2,4-D tolerant DAS-40278-9 maize[J].Regul Toxicol Pharm,2012,62(2):363.
(责任编辑 李婷婷)
Food Safety Evaluation on Transgenic Corn Fed Wistar Rats
LIU Ming1,LI Bao-jian2,QIU Yu-lan3,PEI Qiu-ling3,WANG Jing-xue1
(1School of Life Science,Shanxi University,Taiyuan 030006,China;2School of Life Science,Sun Yat-sen University,Guangzhou 510275,China;3School of Public Health,Shanxi Medical University,Taiyuan 030001,China)
【Objective】 Wistar rats were fed by transgenic corn expressing chitinase and β-1,3-glucanase gene to study if the transgenic corn possesses potential toxic or adverse effects for rats.The gene type of wild type corn was the inbred line,Hai 9-21.【Method】 Wistar rats were randomly divided into four groups with applied 32% wild type corn flour added 68% normal food(control group),8% transgenic corn flour added 24% wild type corn flour and added 68% normal food(low dose group),16% transgenic corn flour added 16% wild type corn flour and added 68% normal food(middle dose group),32% transgenic corn flour added 68% normal food(high dose group).They were fed for 28 d with low/ middle/ high dose group food and control group food,respectively,in experimental stage.All of the Wistar Rats were fed for 7 d with the control group food in recover stage.During experimental stage and recover stage,the rats’ general living status,body weight and average food utilization rate were observed.At the end of experimental stage and recover stage,the rats’ serum biochemistry index were examined,then the rats were carried on anatomical examination.【Result】Compared with the control group,there were no significant differences between low/ middle/ high dose group and control group about general living status,and without any toxic symptom appears in low/ middle/ high dose group.All of rats were health survival during experimental stage and recover stage .Compared with the control group during the same period of same sex rats,there was no significant difference(P>0.05)about body weight growth in low/ middle/ high dose group.At the end of experimental stage and recover stage,the rats’ food utilization rate had no statistical difference(P>0.05)between low/ middle/ high dose group and control group.During the period of rats fed transgenic corn,compared with the control group,there were no significant differences on amount of AST/ALT,TP,ALB,BUN,AST(P>0.05).With gross anatomy observation,each organ’s color,morphology and weight were normal in all of rats.【Conclusion】Transgenic corn had no adverse effects on rats,and the transgenic corn was same safe as wild type corn at the experiment period.
transgenic maize;chitinase;β-1,3glucanase;food safety;dosage
山西省人事厅人才引进与开发专项资金项目(2007);太原市科技攻关项目(2007)。
刘明(1988— ),男,硕士研究生,研究方向:转基因植物生物安全性评价。
王景雪(1961— ),女,博士,教授,硕士生导师,研究方向:作物基因工程。

