长期耐力运动对大鼠右心室MMP-2和TIMP-2的影响
王世强常芸饶志坚马晓雯
1国家体育总局体育科学研究所(北京 100061)2湖南工业大学体育学院(株洲 412008)
长期耐力运动对大鼠右心室MMP-2和TIMP-2的影响
王世强1,2常芸1饶志坚1马晓雯1
1国家体育总局体育科学研究所(北京 100061)2湖南工业大学体育学院(株洲 412008)
目的:通过建立长期大强度运动模型,研究长期不同强度耐力运动对大鼠右心室心功能和羟脯氨酸的含量影响以及基质金属蛋白酶2(matrix metalloproteinase-2,MMP-2)和金属蛋白酶抑制剂2(tissue inhibitor of metalloproteinase-2,TIMP-2)的调节作用,为运动性心肌纤维化和心律失常的发生机制提供实验依据。方法:24只健康成年雄性SD大鼠随机分为安静对照组、中强度运动组和大强度运动组,每组8只。中强度组和大强度组进行16周的运动,每周训练5天,休息2天,每次1 h。16周后采用小动物超声心动仪检测大鼠右心室心功能。随后,立刻麻醉处死大鼠,摘取心脏,分离出右心室。采用样本碱水解法检测羟脯氨酸的含量;荧光定量PCR检测MMP-2和TIMP-2 mRNA的相对表达。Western Blot检测MMP-2和TIMP-2蛋白的表达。结果:(1)与安静组相比,中强度组右室射血分数(RVEF)和右室缩短分数(RVFS)增加,但无显著性差异。大强度组RVEF显著低于安静组和中强度组(P<0.05),大强度组RVFS均低于安静组和中强度组,但无显著性差异。(2)中强度组羟脯氨酸的含量高于安静对照组,但无显著性差异;而大强度组羟脯氨酸的含量显著高于安静组和中强度组(P<0.01)。(3)与安静组相比,中强度组MMP-2 mRNA和蛋白的表达具有增加趋势,但无显著性差异。大强度组MMP-2 mRNA的表达显著高于安静组(P<0.05),大强度组MMP-2蛋白的表达显著高于安静组和中强度组(P<0.01);与安静组比较,中强度组和大强度组TIMP-2 mRNA的表达均无显著性差异;通过计算发现,三组间MMP-2/TIMP-2 mRNA的比值无明显差异,大强度组MMP-2/TIMP-2蛋白的比值显著高于安静组和中强度组(P<0.01)。结论:长期大强度运动造成大鼠右心室羟脯氨酸含量显著增加,心肌MMP-2的表达增加,MMP-2/TIMP-2比例失调可能是右心室心功能异常和运动性心肌纤维化的发生机制之一。
运动;大鼠;右心室;羟脯氨酸;基质金属蛋白酶2
运动性心律失常一直是运动医学和体育科学备受关注的问题。常芸等针对我国优秀运动员潜在的心脏隐患的调研也证实了长期从事大强度运动的优秀运动员存在较高的心律失常风险。部分运动性心律失常的发生与长期反复大强度运动对心脏的病理性损伤有关[1,2]。近期,人体和动物研究均证实,长期大强度运动导致心肌纤维化,可能是运动性心律失常的主要病理改变[3-6]。Chang最新研究结果也证实,4周反复力竭运动会导致大鼠心脏传导系统纤维化的发生[7]。
心肌纤维化是指心肌中的胶原纤维异常增加的现象。过度增加的胶原纤维影响心肌细胞间的电信号传导,促进心律失常的发生与维持[8]。我们前期研究也发现,16周的大强度运动导致大鼠右心室胶原纤维过度增加、发生纤维化,而左心室未发现纤维化存在[9]。La等发现,高强度耐力导致运动员右心室射血功能降低,而左心室功能正常[10]。最近的人体实验研究表明,受过长期训练的耐力运动员运动后促炎因子显著增加,右心室心功能降低[11]。
MMP-2能够降解心肌间质中胶原蛋白,是心肌间质重塑的重要调节因子。TIMP-2是MMP-2的特异性抑制剂,能与MMP-2特异性结合,抑制MMP-2的活性。MMP-2/TIMP-2的比例失调是造成心肌胶原蛋白重塑、心肌纤维化和心肌功能下降的重要原因[12]。以往研究证实,在容量负荷过载[13]、心肌梗死[14]和高血压[15]等因素诱导的心肌肥厚发病过程中,均发现MMP-2/ TIMP-2的比例失调。而长期不同强度耐力运动对心室MMP-2/TIMP-2的影响如何,是否参与了长期大强度运动,尚不清楚。因此,本研究拟通过观察不同强度运动对大鼠右心室MMP-2和TIMP-2的影响,探讨运动性心肌纤维化的发生机制,为筛选安全有效的预防和治疗运动性心律失常的有效治疗靶点和干预措施提供科学依据。
1 材料与方法
1.1 实验对象
8周龄SPF级健康雄性SD大鼠24只,体重为(220±8 g),购自北京维通利华实验动物技术有限公司,许可证号为SCXX(京)2012-0001。所有大鼠均以啮齿类动物普通饲料喂养,在国家体育总局体育科学研究所ABSL-3级动物房饲养,室温为22±2℃,空气湿度为45%~55%,每天光照12小时。
1.2 分组和运动方案
适应性喂养3天后,所有大鼠进行一周适应性跑台训,每天训练15 min,跑台速度为15 m/min,跑台坡度为0°。随机分为安静对照组、中等强度训练组和大强度训练组,每组8只。运动方案参照Bedford研究[16],中强度组跑台速度为15.2 m/min,坡度为5°(最大摄氧量约58.4±1.7 VO2max),大强度组跑台速度为28 m/min,坡度为10°(最大摄氧量81.00%±3.5 VO2max)。大强度组先以15 m/min速度跑5 min,随后在5 min内逐渐增至28 m/min,维持直至16周训练结束。
1.3 大鼠右心室心功能指标检测
取材前,采用10%水合氯醛将大鼠麻醉后,胸部去毛,用小动物心功能分析(加拿大ULTRASONIX)探头置于大鼠胸前。测量大鼠右心室舒张末期容积和收缩末期容积,并计算右室射血分数(RVEF);测量右心室舒张末期短轴距离和收缩末期短轴距离,并计算右室缩短分数(RVFS)。
1.4 取材
大鼠运动16周后进行取材。迅速取出心脏,切取
右心室,每块组织分为2份,一份用于羟脯氨酸含量的测定,一份用于基因和蛋白的测定。
1.5 羟脯氨酸含量的检测(样本碱水解法)
羟脯氨酸(hydroxyproline,Hyp)在氧化剂的作用下所产生的氧化产物与二甲氨基苯甲醛作用呈现紫色,根据其呈色的深浅可推算其含量。称量组织放入试管中,加入水解液,混匀,加盖后95℃或者沸水浴水解20 min。调PH值至6.0~6.8左右,加入双蒸水,混匀,加入适量活性炭,混匀。按表1添加完3种试剂后,60℃水浴15 min,冷却后3500转/分离心10 min,取上清在波长550 nm处测定各管吸光度值。试剂盒购于南京建成生物工程研究所(货号A030-2)。操作表如下:

1.6 RT-PCR检测MMP-2和TIMP-2 mRNA的含量
采用Trizol法(购于美国Life Technologies)提取总RNA,每个样本按照0.5 μg RNA作为初始模板,配置10 μl的总反应体系,应用cDNA合成试剂盒(RR370A,购于TaKaRa公司)在核酸扩增仪(Gene Amp PCR System 9700,美国ABI公司)进行反转录成cDNA,反应条件为37℃,15 min;85℃5 s;4℃保持。以合成的cDNA作为模板,以β-actin作为内参,配置20 μl反应体系,每个样本检测3个复孔,在实时荧光定量PCR系统(7300,美国ABI)进行扩增荧光定量,反应条件为:预变性95℃30 s,PCR反应95℃5 s,60℃31 s,40个循环。荧光定量试剂盒为TaKaRa公司的RR820A。根据收集的数据通过2-△△CT公式计算样本中mRNA的相对含量,其中△△CT=(CT实验组目的基因-CT实验组内参基因)-(CT对照组目的基因-CT对照组内参基因)。实验所需引物由上海生工生物合成。
1.7 Western Blot法检测MMP-2和TIMP-2蛋白的含量
提取总蛋白后用BCA法测定并调整蛋白浓度一致,加入上样缓冲液沸水中10 min使蛋白变性。120 V恒压SDS-PAGE电泳1 h后,200 mA恒流转膜1 h。5%脱脂奶粉(购于美国BD公司)封闭1 h,一抗(Anti-MMP-2和Anti-TIMP-2,内参为β-actin,均购于美国Abcam公司)置于摇床4℃过夜。TBST洗涤3次后,加HRP标记的二抗(1∶5000,购于美国Abcam公司),室温摇床孵育1 h。TBST洗膜3次,滴加ECL化学发光试剂(购于美国Millipore),室温2 min,滤纸吸干后置于保鲜膜内封存,置于暗匣内,X光片曝光约2 min,显影液中显影1 min,定影数十秒,条带用Quntity One软件进行图像分析。计算目的蛋白与内参蛋白条带的积分光密度(IOD)的相对值。

表2 Real-time PCR基因引物序列
1.8 统计学分析
所得数据用GraghPad Prism 6.0软件转换作图。所有数据均用SPSS18.0进行分析处理,结果采用平均数±标准差表示,采用单因素方差分析组间差异。
2 结果
2.1 心功能测定结果
结果(图1)显示,与安静组比,中强度组RVEF增加,但无显著性差异。高强度组RVEF显著低于安静组和中强度组(P<0.05);与安静组相比,中强度组RVFS增高,但无显著性差异。大强度组RVFS均低于安静组和中强度组,但无显著性差异。结果表明,长期中强度运动能增加右心室心肌功能,而长期大强度运动反而有损右心室心肌功能。

表1 Hyp含量测定操作表

图1 右心功能指标变化(n=5)
2.2 羟脯氨酸的含量变化
结果(图2)显示,中强度组羟脯氨酸的含量高于安静对照组,但无显著性差异;而大强度组羟脯氨酸的含量显著高于安静组和中强度组(P<0.01)。
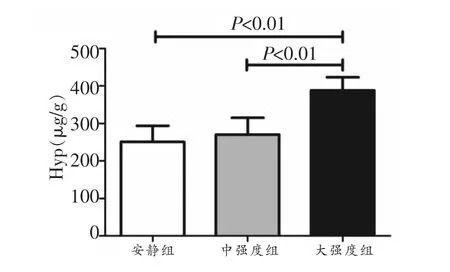
图2 心肌羟脯氨酸的含量变化
2.3 MMP-2 mRNA、TIMP-2 mRNA及其比值的变化
结果(图3)显示,与安静组相比,中强度组MMP-2 mRNA的表达具有增加趋势,但无显著性差异,大强度组MMP-2 mRNA的表达显著增加(P<0.05);与安静组比较,中强度组和大强度组TIMP-2 mRNA的表达均无显著性差异;通过计算发现,三组间MMP-2/TIMP-2的比值无明显差异。
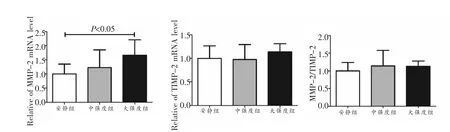
图3 MMP-2 mRNA、TIMP-2 mRNA及MMP-2/TIMP-2比值的变化(n=8)
2.4 MMP-2、TIMP-2蛋白及其比值的变化
图4显示,与安静组相比,中强度组MMP-2蛋白的表达略有增加,但无显著性差异。大强度组MMP-2蛋白的表达显著高于安静组和中等强度组(P<0.01);与安静组相比,中强度组TIMP-2蛋白表达降低,而高强度组升高,但均无显著性差异;通过计算MMP-2/ TIMP-2的比值,发现与安静组相比,中强度组MMP-2/ TIMP-2略有增加,但无明显差异。大强度组MMP-2/ TIMP-2显著高于安静组和中强度组(P<0.01)。

图4 MMP-2、TIMP-2蛋白及MMP-2/TIMP-2比值的变化(n=8)
3 讨论
3.1 长期大强度运动导致心肌纤维化和心功能降低
研究表明,长期适宜强度的运动能改善心脏功能,降低心血管疾病的发病率,延缓心脏衰老。然而,长期的大强度运动或过度运动则会导致心肌损伤乃至发生
纤维化,诱发心律失常,严重的心律失常甚至可能造成运动猝死。以往多数研究认为长期大强度运动造成的心肌炎症反应、自主神经系统发生变化和电解质紊乱是造成运动性心律失常的重要发生机制[17-19]。
近期,人体研究结果发现,长期大强度运动诱发心肌纤维化,可能是心律失常易感性增加的重要原因[20]。Breuckmann采用延迟钆增强-心脏核磁共振(late gadoliniumenhancement-cardiacmagneticresonance,LGE-CMR)技术检查了102名马拉松运动员是否存在心肌纤维化。结果发现,在被调查的102名健康的业余男性马拉松运动员中,12%的运动员存在心肌纤维化,而仅有4%的正常对照人群存在心肌纤维化[4]。同样使用LGE-CMR技术,Wilson等检测查了12名马拉松运动员(50-67岁)的心脏。结果发现,其中6名运动员(50%)存在心肌纤维化,而同年龄的对照人群和年轻运动员无心肌纤维化。同时,研究还发现耐力运动员心肌纤维化的发生率与年龄、身高、体重和体表面积等因素无关,而与运动年限和参加马拉松运动的次数紧密相关[6]。同样,La等研究了40名耐力运动员,发现5名运动员(13%)存在心肌纤维化,且发生部位都在右心室,同时发现右心室射血分数降低[10]。
动物研究也证实,长期大强度运动导致心肌纤维化。Benito等首次发现16周大强度运动诱导大鼠右心室而非左心室发生纤维化[3]。Guasch的研究也揭示,16周每天进行1小时大强度跑台训练大鼠心房纤颤的易感性较安静组显著增加(64%vs 15%)。同时,天狼星红染色发现心房纤维化程度增加了60%,显著高于对照组[21]。最近,Aschar-Sobbi的研究发现,6周力竭游泳运动诱导了心房纤维化的发生[20]。本研究通过测量心肌中的羟脯氨酸的含量反映胶原蛋白的含量,结果发现,大强度组羟脯氨酸的含量显著高于安静组合中强度组。笔者前期研究也发现,16周长期大强度运动造成大鼠右心室胶原分数(CVF)显著高于安静组和中强度组,表明具有心肌纤维化的发生[9]。过度增加的胶原纤维不仅会影响心肌细胞间的电信号传导,引起心律失常。另外,增生的胶原纤维还导致心肌的舒缩功能降低,心功能发生异常。本研究采用小动物超声心动仪检测了大鼠右心室舒张末期容积和收缩末期容积,并计算右室射血分数(RVEF)。测量右心室舒张末期短轴距离和收缩末期短轴距离,并计算右室缩短分数(RVFS)。结果显示,与安静组相比,中强度组RVEF增加,但无显著性差异。大强度组RVEF显著低于安静组和中强度组。研究表明,长期大强度导致大鼠右心室射血功能降低。与本研究一致,最近的人体实验研究也证实,受过长期训练的耐力运动员存在右心室功能障碍[11]。
3.2 长期大强度运动上调大鼠心肌MMP-2/TIMP-2的比值
MMP-2是心肌组织中活性最强的一种MMP,为内源性蛋白水解酶,几乎可以降解细胞外基质的所有组分,主要降解变性胶原、明胶和基膜的主要成分Ⅵ胶原。TIMP-2能特异性的与MMP-2结合,抑制其活性。正常生理状态下,心脏ECM的合成和降解维持动态平衡,其成分的过度生成或异常降解均会导致心肌的结构和力学性质发生改变,影响心脏的功能[22]。
MMP-2和TIMP-2异常表达,导致MMP-2/TIMP-2的比例失调,是引起心肌结构重塑和心功能衰退的重要原因[23]。Chen等研究发现,高血压大鼠心室MMP-2和TIMP-2的表达显著性增加,MMP-2的比值升高[15]。Morishita人体研究发现,急性心肌梗死后血液中MMP-2的表达变化与左心室射血分数的下降紧密相关[24]。Arumugam等研究通过异丙肾上腺素诱导建立心肌肥厚大鼠模型,心肌MMP-2高表达,而TIMP-2呈低表达,MMP-2/TIMP-2的比例显著升高[23]。临床研究和动物实验结果均显示,MMP-2的活性增高或MMP-2/TIMP-2比值升高可能是心肌缺血再灌注损伤的病理机制之一[25,26]。
本研究发现,与安静组相比,经过16周大强度运动后大鼠心肌MMP-2的基因和蛋白表达均显著增加,而TIMP-2无明显变化。经计算发现,MMP-2/TIMP-2的比值显著升高。前期研究表明,16周的大强度运动导致右心室纤维化,其可能与增高的MMP-2和MMP-2/ TIMP-2的比值升高有关[9]。研究表明,正常的胶原蛋白可以被升高的MMP-2降解,然后被缺乏连接结构的胶原纤维所取代,结果表现为MMP-2表达的增高伴随心肌纤维化程度的增加。MMP-2的表达受到转化生长因子β1(transforming growth factor-β1,TGF-β1)的调控[12]。前期研究发现,长期大强度运动可造成大鼠心肌TGF-β1的持续高表达[27]。据此,可以推测,长期大强度运动导致MMP-2的高表达,可能受到了TGF-β1的正向调节。
综上所述,长期大强度运动诱导右心室MMP-2的表达增加,MMP-2/TIMP-2的比例失调,导致心肌纤维化,心肌收缩和舒张功能下降,同时造成心电传导异常,可能是长期大强度运动后心功能异常和心律失常的病理机制。
4 结论
(1)中等强度运动对大鼠羟脯氨酸和右心室心功能的影响不显著。长期大强度运动导造成大鼠右心室羟脯氨酸含量显著增加,导致右心室心功能异常。
(2)长期大强度运动诱导大鼠心肌MMP-2的表达
显著增加,对TIMP-2的影响不显著,MMP-2/TIMP-2的比值显著增加,可能是造成右心室心功能异常和运动性心肌纤维化的机制之一。
[1]常芸.运动性心律失常研究现状与展望[J].中国运动医学杂志,2015,34(1):59-68.
[2]常芸.运动员心脏的医务监督[M].北京:北京体育大学出版社,2011:85-110.
[3]Benito B,Gay-Jordi G,Serrano-Mollar A,et al.Cardiac arrhythmogenic remodeling in a rat model of long-term intensive exercise training[J].Circulation,2011,123(1):13-22.
[4]BreuckmannF,MohlenkampS,NassensteinK,etal. Myocardial late gadolinium enhancement:prevalence,pattern,and prognostic relevance in marathon runners[J].Radiology,2009,251(1):50-57.
[5]PousselM,DjaballahK,LaroppeJ,etal.Leftventricle fibrosis associated with nonsustained ventricular tachycardia in an elite athlete:is exercise responsible?A case report[J].J Athl Train,2012,47(2):224-227.
[6]Wilson M,O'Hanlon R,Prasad S,et al.Diverse patterns of myocardial fibrosis in lifelong,veteran endurance athletes[J].J Appl Physiol(1985),2011,110(6):1622-1626.
[7]Chang Y,Yu T,Yang H,et al.Exhaustive Exercise-Induced Cardiac Conduction System Injury and Changes of cTnT and Cx43[J].Int J Sports Med,2015,36(1):1-8.
[8]JalifeJ,KaurK.Atrialremodeling,fibrosis,andatrial fibrillation[J].Trends Cardiovasc Med,2015,25(6):475-484.
[9]王世强,常芸,马晓雯,等.不同强度耐力运动对大鼠心肌胶原蛋白的影响及MMP-1/TIMP-1的调节作用[J].中国体育科技,2015,51(5):60-66.
[10]La Gerche A,Burns AT,Mooney DJ,et al.Exercise-induced right ventricular dysfunction and structural remodelling in endurance athletes[J].Eur Heart J,2012,33(8):998-1006.
[11]LaGercheA,InderWJ,RobertsTJ,etal.Relationship between Inflammatory Cytokines and Indices of Cardiac Dysfunction following Intense Endurance Exercise[J].PLoS One,2015,10(6):e0130031.
[12]Serban AI,Stanca L,Geicu OI,et al.Extracellular matrix is modulated in advanced glycation end products milieu via a RAGE receptor dependent pathway boosted by transforming growth factor-beta1 RAGE[J].J Diabetes,2015,7(1):114-124.
[13]Voloshenyuk TG,Gardner JD.Estrogen improves TIMP-MMP balance and collagen distribution in volume-overloaded hearts of ovariectomized females[J].Am J Physiol Regul Integr Comp Physiol,2010,299(2):R683-693.
[14]Liu W,Zhang X,Zhao M,et al.Activation in M1 but not M2 MacrophagesContributestoCardiacRemodelingafter Myocardial Infarction in Rats:a Critical Role of the Calcium Sensing Receptor/NRLP3 Inflammasome[J].Cell Physiol Biochem,2015,35(6):2483-2500.
[15]Chen Q,Pang L,Huang S,et al.Effects of emodin and irbesartan on ventricular fibrosis in Goldblatt hypertensive rats[J].Pharmazie,2014,69(5):374-378.
[16]Bedford TG,Tipton CM,Wilson NC,et al.Maximum oxygen consumption of rats and its changes with various experimental procedures[J].J Appl Physiol Respir Environ Exerc Physiol,1979,47(6):1278-1283.
[17]Redpath CJ,Backx PH.Atrial fibrillation and the athletic heart[J].Curr Opin Cardiol,2015,30(1):17-23.
[18]Turagam MK,Velagapudi PKocheril AG.Atrial fibrillation in athletes[J].Am J Cardiol,2012,109(2):296-302.
[19]Wilhelm M,Roten L,Tanner H,et al.Atrial remodeling,autonomictone,andlifetimetraininghoursinnonelite athletes[J].Am J Cardiol,2011,108(4):580-585.
[20]Aschar-Sobbi R,Izaddoustdar F,Korogyi AS,et al.Increased atrial arrhythmia susceptibility induced by intense endurance exercise in mice requires TNFalpha[J].Nat Commun,2015,6:6018.
[21]Guasch E,Benito B,Qi X,et al.Atrial fibrillation promotion byenduranceexercise:demonstrationandmechanistic exploration in an animal model[J].J Am Coll Cardiol,2013,62(1):68-77.
[22]DeCoux A,Lindsey ML,Villarreal F,et al.Myocardial matrix metalloproteinase-2:inside out and upside down[J].J Mol Cell Cardiol,2014,77:64-72.
[23]Parthasarathy A,Gopi V,Devi KMS,et al.Aminoguanidine inhibitsventricularfibrosisandremodelingprocessin isoproterenol-induced hypertrophied rat hearts by suppressing ROS and MMPs[J].Life Sci,2014,118(1):15-26.
[24]Morishita T,Uzui H,Mitsuke Y,et al.Predictive utility of the changes in matrix metalloproteinase-2 in the early phase for left ventricular reverse remodeling after an acute myocardial infarction[J].J Am Heart Assoc,2015,4(1):e001359.
[25]SariahmetogluM,Skrzypiec-SpringM,YoussefN,etal. Phosphorylationstatusofmatrixmetalloproteinase2in myocardial ischaemia-reperfusion injury[J].Heart,2012,98(8):656-662.
[26]Lu YZ,Wang J,Zhang CY,et al.[The cardioprotective effects ofischemicpostconditioningonmyocardialinterstitium following ischemic/reperfusion in rats][J].Zhongguo Ying Yong Sheng Li Xue Za Zhi,2014,30(5):431-435.
[27]王世强,常芸,马晓雯,等.不同强度耐力运动对大鼠心房TGF-β1/miR-21信号途径的影响[J].体育科学,2015,35(11):30-37+44.
Effects of Long-term Endurance Exercise on the Right Ventricular MMP-2 and TIMP-2 of Rats
Wang Shiqiang1,2,Chang Yun1,Rao Zhijian1,Ma Xiaowen1
1 China Institute of Sport Science,Beijing,China 100061 2 Intitute of Sports,Hunan University of Technology,Shanghai,China 412008 Corresponding Author:Chang Yun,Email:changyun2518@vip.sina.com
Objective To explore the effects of long-term exercise on the content of hydroxyproline and right ventricular function,and to investigate the role of matrix metalloproteinase-2(MMP-2)and matrix metalloproteinase tissue inhibitor-2(TIMP-2)during the exercise in order to provide experimental evidence for clarifying the mechanism of exercise-induced myocardial fibrosis and arrhythmia.Methods 24 SD rats were divided into control group(C),moderate intensity exercise group(M,15.2 m/min,5°slope)and high intensity exercise group(H,28 m/min,10°slope).Rats in groups M and H were conditioned to run 1 hour per day,5 days per week for a total of 16 weeks.The right ventricular function of the rats was measured by echocardiography.The rats were euthanized within 24 h after the last exercise,and their right ventricles were
exercise,rat,right ventricle,hydroxyproline,MMP-2
2015.12.07
国家体育总局体育科学研究所基本业务经费(15-37)
常芸,Email:changyun2518@vip.sina.com
collected.Ventricular hydroxyproline was measured by alkaline hydrolysis method.MMP-2 and TIMP-2 gene expression were evaluated by real-time PCR.MMP-2 and TIMP-2 proteins were quantified by Western Blot. Results(1)There was significant difference in ventricular ejection fraction(RVEF)between group H and groups C and M(P<0.05),and insignificant difference in RVEF and right ventricular fractional shortening(RVFS)between group C and group M,and in RVFS between group H and groups C and M.(2)There was significant difference in hydroxyproline content between group H and groups C and M(P<0.01),while insignificant difference between group C and group M.(3)There was significant difference in the expression of MMP-2 mRNA between group H and group C(P<0.05),and in the expression of MMP-2 protein between group C and group H(P<0.01),while insignificant difference between group H and group C.Though there was no significance in the MMP-2/TIMP-2 mRNA and MMP-2/TIMP-2 mRNA among the three group,while significant significance in the MMP-2/TIMP-2 mRNA between group H and groups C and M(P<0.01). Conclusion Long-term intensive exercise induce increase in hydroxyproline content in right ventricle of rats,resulting in right ventricular dysfunction,increased MMP-2,and disproportionality of MMP-2/TIMP-2,which probably is one of the factors that cause the exercise-induced cardiac dysfunction and arrhythmia.

