HNO自由基与O2反应机理的理论研究
胡威 陈淑勇 刘伯潭
(1天津大学化工学院,天津300072)
(2蚌埠玻璃工业设计研究院,浮法玻璃新技术国家重点实验室,蚌埠233000)
(3天津科技大学化工与材料科学学院,天津300457)
HNO自由基与O2反应机理的理论研究
胡威1陈淑勇2刘伯潭*,3
(1天津大学化工学院,天津300072)
(2蚌埠玻璃工业设计研究院,浮法玻璃新技术国家重点实验室,蚌埠233000)
(3天津科技大学化工与材料科学学院,天津300457)
采用密度泛函理论(DFT)和从头算方法,在B3LYP/6-311++G(d,p)水平上对反应HNO+O2做了理论计算研究。优化得到了反应物、中间体、过渡态和产物的几何构型以及相应的能量值、振动频率。通过分析反应路径的能量差异,以及异构化难易程度,发现HNO+O2反应有2种产物通道:HOONO和HNO3。其中过氧亚硝酸HOONO是主要产物,有3种稳定的构象。
密度泛函理论计算;反应机理;亚硝酰氢;氧气
氧气是与人类生活相关的重要物质之一,其与活泼自由基的反应一直是关注的热点[1-16]。据文献报道,HNO自由基是含氮化合物在氧气存在的条件下光解的重要中间体之一[16-17]。HNO自由基是一种活泼的自由基,人们对它作了大量的研究[16,18-43],如红外光谱和紫外光谱、发射光谱等检测[18-32],结构的确定[33]及与一些自由基、小分子(臭氧、一氧化氮、氧原子和氢原子等)反应的动力学和机理考察等[16,34-42]。
Bryukov等[16]测定了HNO和O2的反应速率,而自由基反应的反应机理难以用实验方法确定。目前对HNO与O2的反应机理和动力学研究还很少。对该反应的反应动力学进行研究,提出其化学反应微观机理,有利于从反应本质上揭示其相互作用的反应机理,对该反应的研究工作具有很重要的意义。
量子化学是目前计算分子的能量和几何结构最精确的理论方法之一[43],该方法是在量子力学的理论条件下用计算机模拟化学反应的过程。其对于化学反应研究、过渡态的探索等非常重要,对化学反应机理的研究有重要的指导意义。本文的理论研究工作可以弥补实验研究的不足,采用量子化学计算的方法对HNO自由基和O2的反应路径和产物通道进行了详细研究,得到了反应物分子进攻的方式和加成物异构化分解生成产物的过程,为该反应的研究工作提供了理论依据。
1 计算方法
本文采用密度泛函理论(DFT),计算工作均在B3LYP/6-311++G(d,p)水平上进行,优化得到了各反应路径上所有驻点的几何结构,包括反应物R、过渡态TS、中间体IM和产物P,并在相同水平上采用内禀反应坐标(IRC)计算方法确认了中间体和过渡态之间的联系,得到了HNO+O2在单重态势能面上的能级示意图,见图2。计算工作由Gaussian 09程序A.02版完成[44]。
2 计算结果和讨论
图1为计算得到的各驻点的几何构型。图2为各反应路径在势能面上的能级示意图。符号TSa/b表示连接中间体IMa与IMb的过渡态。对计算结果的分析表明:反应物、中间体和产物的力学常数矩阵本征值都为正,而过渡态有且仅有一个虚频。表1为在B3LYP/6-311++G(d,p)水平上计算所得的各驻点的总能量、零点振动能(ZPE)和相对能量,并且在QCISD/6-311++G(d,p)水平上做了单点能计算,校正了总能量。其中相对能量是以反应物HNO+O2的能量为基准,包含零点能校正值的单点能。
2.1 反应路径的描述
从图2观察可以知道,反应物经过加成、配合物异构化和分解过程,最终得到2种产物,分别为P1(HOONO)和P2(HNO3),其中P1t-p、P1c-p、P1c-c是P1(HOONO)的3种稳定构象。形成这些产物的路径如下:

2.1.1 反应第一步HNO自
由基由N原子进攻氧气分子的一个氧原子,生成具有平面结构的IM1A(cis-ON(H)OO)或IM1B(trans-ON(H)OO)。为了便于后文介绍,当H和O3原子处于N-O2键的同侧时,即中间体IM1A,称其顺式异构体,当H和O3原子处于N-O2键的异侧时,即中间体IM1B,称其反式异构体。H-N-O1夹角由HNO自由基中的108.9°增大到了IM1A的126.3°(IM1B中为125.6°),O2-O3键由O2分子中的0.1205nm增大到了IM1A的0.1348nm(IM1B中为0.1314nm);N原子带电量由HNO中的-0.144变为到了IM1A中的-0.177(IM1B中为-0.231),IM1A中O2原子带电量为0.293(IM1B中为0.264)。在B3LYP/6-311++G(d,p)水平上对该IM1A的N-O2键进行了势能面扫描,未发现相应过渡态的存在,所以认为该过程是无势能配位,反应物加成得到IM1A放出热量12.2kJ·mol-1,生成IM1B放出热量9.2kJ·mol-1。2.1.2反应物到产物P1(HOONO)从反应物到产物P1(HOONO)共有6条路径,分别为路径(1)、(4)、(5)、(7)、(8)、(9),下面对各路径进行详细描述。路径(1):前文对IM1A的形成进行了详细描述,所以此处不再重复。接下来,IM1A的H原子从N原
子迁移到O3原子得到产物过氧亚硝酸P1t-p (HOON
O),如图1,其N-O2键旋转180°得到P1c-p;P1c-p的O2-O3键旋转可以得到具有平面结构的P1c-c,该过程需要克服4.5 kJ·mol-1的能垒。P1t-p、P1c-p和P1c-c是HOONO的3种稳定构象,可以看成是OH自由基与NO2
的弱键加合物[46-48]。
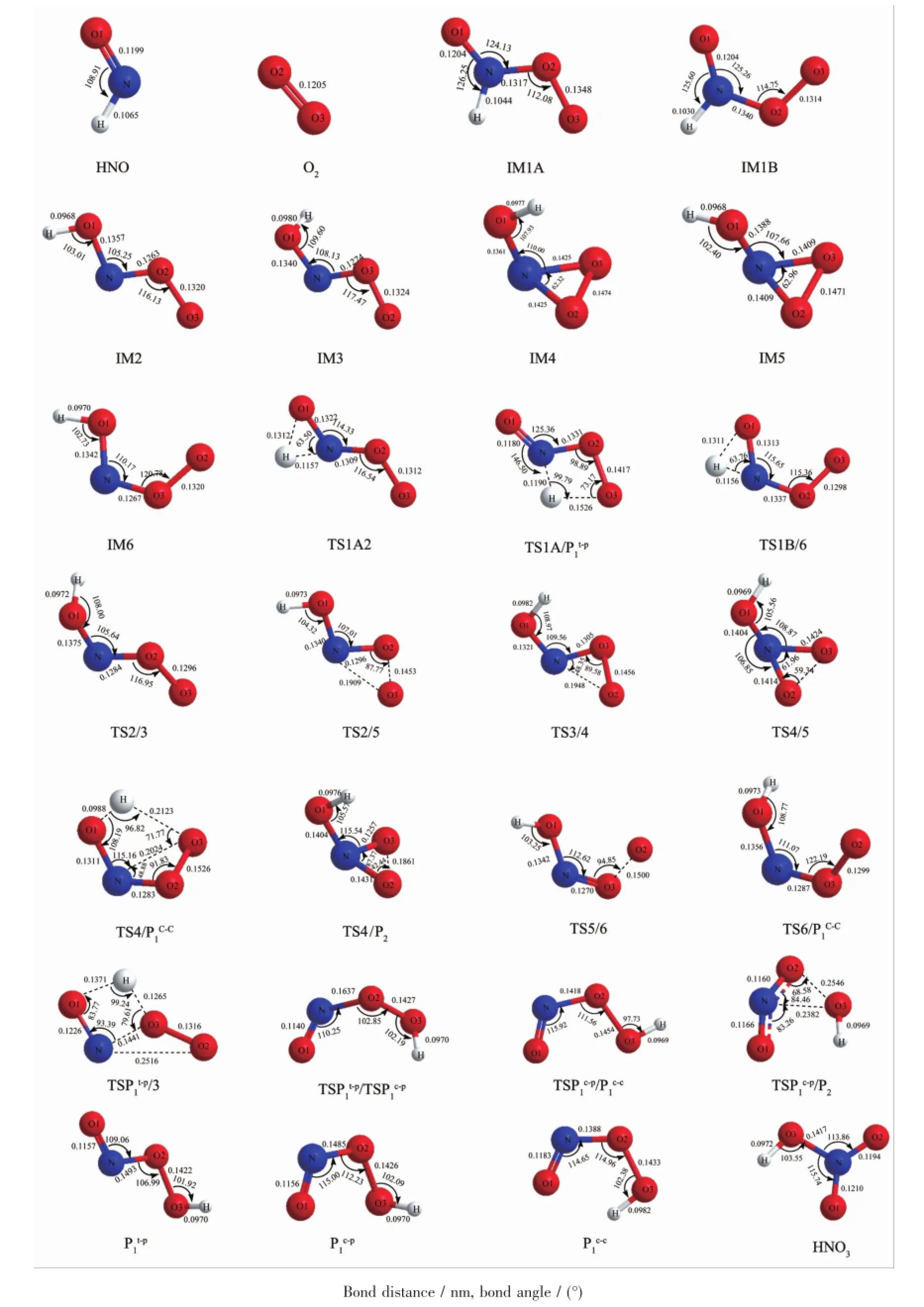
图1 各驻点的几何构型Fig.1 Geometric structures of stationary points
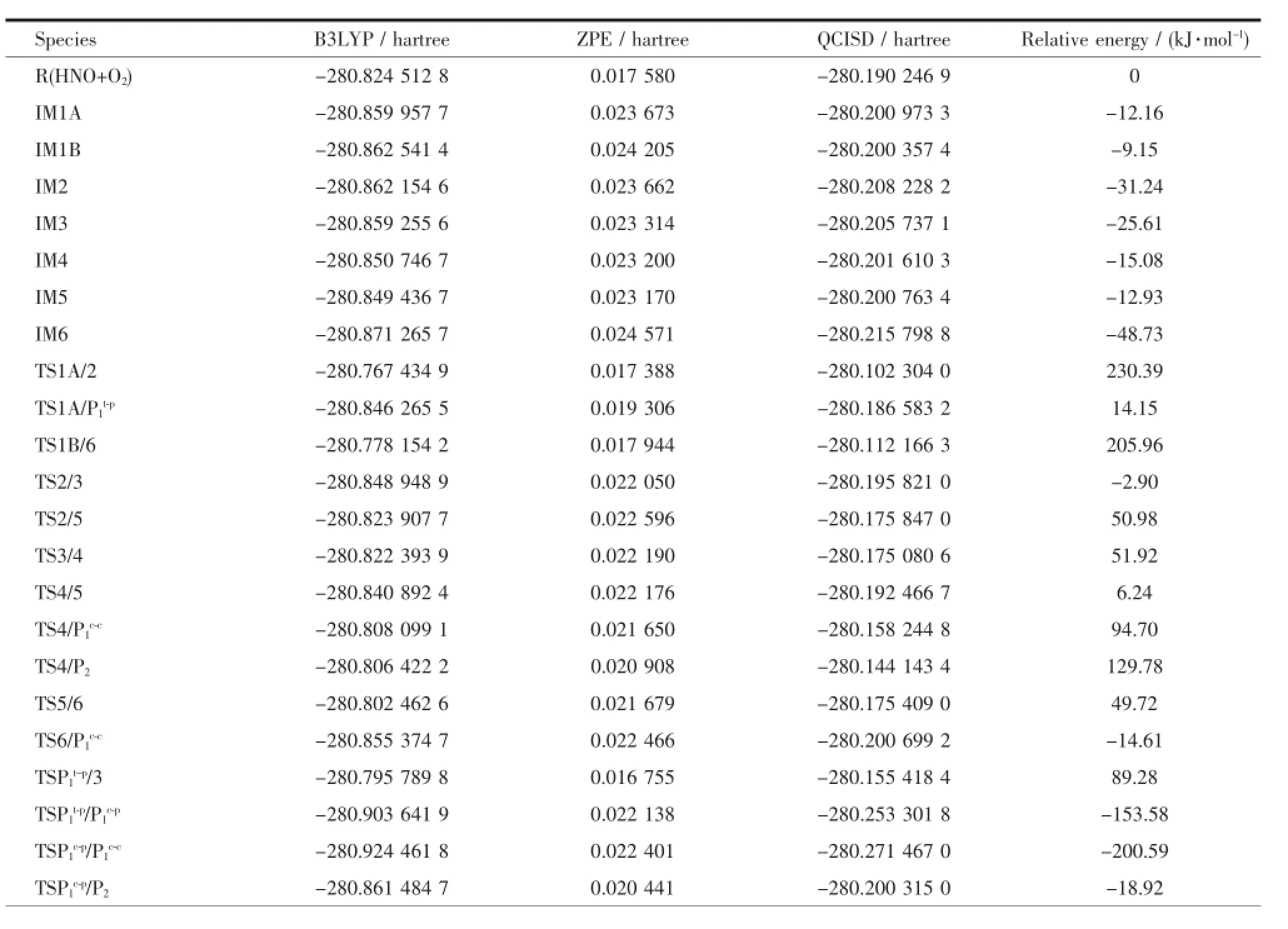
表1 各驻点的能量值Table 1 Energies of stationary points
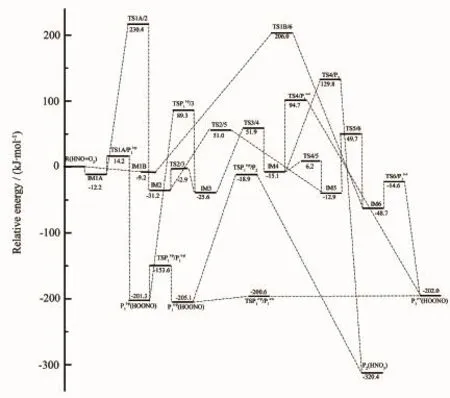
图2 单重态势能面上的能级示意图Fig.2 Schematic energy surface at singlet state
路径(4):P1t-p的N-O2键断裂,O3原子与N原子靠近成键,并且H原子由O3原子迁移到O1原子,形成具有平面结构的IM3。接下来中间体IM3的O2原子向N原子靠近,形成具有N-O2-O3三元环结构的IM4(Cs对称,对称面为H-O1-N所在平面)。然后IM4的N-O3键断裂,并且H原子由O1原子迁移到O3原子生成P1c-c(HOONO)。
路径(5):IM4的N-O1键旋转180°得到IM5,然后N-O2键断裂生成具有平面结构的IM6,然后H原子由O1原子迁移到O2原子得到P1c-c(HOONO),其中O2、O3原子的位置与路径(1)、(4)中得到的P1c-c不同,为方便叙述,图例中标号不做变更。
路径(7)、路径(8)中IM1A的H原子从N原子迁移到O1原子,得到平面结构的中间体IM2,然后NO1键旋转180°得到IM3。两条路径的后续异构化过程分别与路径(4)、路径(5)相同。
路径(9):IM1B的H原子由N原子迁移到O1原子得到IM6,接下来异构化过程和路径(5)相同。2.1.3反应物到产物P2(HNO3)
从反应物到产物P2(HNO3)共有3条路径,分别为路径(2)、(3)、(6)。
路径(2):P1c-p(HOONO)的O3原子由O2原子迁移至N原子,生成平面结构的硝酸P2(HNO3),此过程需要克服186.2 kJ·mol-1的能垒,放出115.3 kJ· mol-1。
路径(3):IM4的O2-O3键断裂,并且N-O1键旋转得到P2(HNO3),此过程需要克服144.9 kJ·mol-1的能垒,放出305.3 kJ·mol-1的热量。
路径(6):路径(3)与路径(8)的重叠部分即组成路径(6),所以不再重复描述。
2.2 能量分析
下面通过对势能面图的能量进行比较,确定最主要的产物通道。
首先,通过比较产物各路径中处于最高位的过渡态能量和异构化的复杂程度,找出生成P1(HOONO)和P2(HNO3)的最具竞争力的路径。产物P1(HOONO)可由路径(1)、(4)、(5)、(7)、(8)、(9)生成。观察势能面图可以发现路径(1)相对于其他路径更容易发生,因为路径(1)的最高位过渡态能量比其他路径低很多,且异构化步骤简单。产物P2(HNO3)的生成路径为(2)、(3)、(6),通过同样的分析可以得出路径(2)是产物P2(HNO3)的最可行路径。
接下来对比各产物最优路径找出该反应的主要产物。由上述可知路径(1)是产物P1(HOONO)形成的最具竞争力的路径,产物P2(HNO3)的最可行路径是通道(2)。因为路径(1)从反应物到P1t-p均包含在路径(2)中,并且路径(2)的最后一步异构化(P1c-p→TSP1c-p/ P2→P2)需要克服较高能垒(186.2 kJ·mol-1),所以路径(1)比路径(2)容易发生。综合上述讨论,P1(HOONO)是HNO+O2反应的主要产物。
3 结论
通过B3LYP/6-311++G(d,p)水平的量子化学计算发现:HNO+O2反应的第一步是HNO的N原子进攻氧气的O原子,经过加成、异构化和分解等过程形成了一系列的中间体、过渡态和产物,其几何构型见图1,同时得到了该反应在单重态势能面上的势能图(图2)。
通过分析反应路径的能量差异,以及异构化难易程度,发现反应有2种产物:P1(HOONO)和P2(HNO3),其中过氧亚硝酸HOONO是主要产物,有3种稳定的构象:P1t-p、P1c-p、P1c-c[46](图1),硝酸HNO3在动力学上为次要产物。
[1]Chowdhury P K.Bull.Chem.Soc.Jpn.,1993,66(12):3571-
3575
[2]Dombrowsky C,Hwang SM,Röhrig M,et al.Ber.Bunsen-Ges.Phys.Chem.,1992,96(2):194-198
[3]Carl S A,Sun Q,Peeters J.J.Chem.Phys.,2001,114(23): 10332-10341
[4]Suma K,Sumiyoshi Y,Endo Y,etal.J.Phys.Chem.A,2004, 108(39):8096-8099
[5]Bose D,Cand ler G V.J.Chem.Phys.,1997,107(16):6136-6145
[6]Campuzano Jost P,Croce A E,Hippler H,et al.J.Chem. Phys.1994,102(13):5317-5326
[7]Ellermann T,Sehested J,Nielsen O J,et al.Int.J.Chem. Kinet.,1994,218(4):287-294
[8]Hack W,Horie O,Wagner H G.J.Chem.Phys.,1982,86 (5):765-771
[9]Leforestier C,Miller W H.J.Chem.Phys.,1994,100:733-735
[10]Xiang T,Liu K,Shi C,et al.Chem.Phys.Lett.,2007,437 (1):8-13
[11]Meryem T,Picard S D L,AndréC,et al.Phys.Chem. Chem.Phys.,2010,12(39):12702-12710
[12]Huang M B,Chen B Z,Wang Z X.J.Phys.Chem.,2002, 106(22):5490-5497
[13]Alexander S,Masanori U,Nozomu K,et al.J.Phys.Chem. A,2007,111(29):6622-6627
[14]Kaiser E W,Wallington T J,Hurley M D.Int.J.Chem. Kinet.,1995,27(27):205-218
[15]Stickel R E,Chin M,Daykin E P,et al.J.Phys.Chem., 1993,97(51):13653-13661
[16]Bryukov M G,Kachanov A A,Timonnen R,et al.Chem. Phys.Lett.,1993,208(5/6):392-398
[17]Cheskis S G,Sarkisov O M.Chem.Phys.Lett.,1979,62(1): 72-76
[18]Callear A B,Wood PM.Trans.Faraday Soc.,1971,67:3399-3406
[19]Bancroft JL,Hollas JM,Ramsay D A.Can.J.Phys.,2011, 40(3):322
[20]Dixon R N,Jones K B,Noble M,et al.Mol.Phys.1981,42 (2):455-473
[21]Dixon R N,Rosser C A.J.Mol.Spectrosc.,1985,110(2): 262-276
[22]Pearson J,Orr-Ewing A J,Ashfold M N R,et al.J.Chem. Phys.,1997,106(14):5850-5873
[23]Robinson GW,Mccarty M.J.Chem.Phys.,1958,28(2):350-350
[24]Ellis H B,Ellison G B.J.Chem.Phys.,1983,78(11):6541-6558
[25]Clough PN,Thrush B A,Ramsay D A,et al.Chem.Phys. Lett.,1973,23(2):155-156
[26]Johns JW C,Mckellar A R W,Weinberger E.Can.J. Phys.,1983,61(61):1106-1119
[27]Petersen JC,Vervloet M.Chem.Phys.Lett.,1987,141(6): 499-502
[28]Johns JW C,Mckellar A RW.J.Chem.Phys.,1977,66(3): 1217-1224
[29]Dixon R N,Noble M,Taylor C A,et al.Faraday Discuss. Chem.Soc.,1981,71:125-142
[30]Obi K,Matsumi Y,Takeda Y,et al.Chem.Phys.Lett., 1983,95(6):520-524
[31]Petersen JC,Amano T,Ramsay D A.Can.J.Phys.,2011, 62(12):5449-5452
[32]Sastry K,Helminger P,Plummer G M,et al.Astrophys.J. Suppl.Ser.,1984,55(4):563-570
[33]Dalby FW.Can.J.Phys.1958,36(10):1336-1339
[34]Inomata S,WashidaN.J.Phys.Chem.A,1999,103(26):5023-5031
[35]Xu S C,Lin M C.Int.J.Chem.Kinet.,2009,41(11):667-677
[36]Nguyen H M T,Zhang S,Peeters J,etal.Chem.Phys.Lett., 2004,388(1):94-99
[37]Tsang W,Herron JT.J.Phys.Chem.Ref.Data 1991,20(4): 609-663
[38]Diau E W,Halbgewachs M J,Smith A R,et al.Int.J. Chem.Kinet.,1995,27(9):867-881
[39]Xu Z F,Lin M C.Chem.Phys.Lett.,2007,440(1/2/3):12-18 [40]Choi Y M,Lin M C.Int.J.Chem.Kinet.,2005,37(5):261-274
[41]Du B,Zhang W,Feng C,et al.J.Mol.Struct.:Theochem, 2004,712(1/2/3):101-107
[42]Takagi K,Saito S,Kakimoto M,et al.J.Chem.Phys., 1980,73(6):2570-2574
[43]LIU Jing(刘晶),ZHENG Chu-Guang(郑楚光),XU Ming-Hou(徐明厚),et al.J.Combust.Sci.Technol.(燃烧科学与技术),2005,11(2):155-158
[44]Frisch M J,Trucks G W,Schlegel H B.et al.Gaussian 09,Revision A.02.Gaussian,Inc,Pittsburgh,PA,2009.
[45]In NIST Chemistry WebBook,NIST Standard Reference database Number 69,March 2008 Release(vibrational frequency data compiled by Jacox M E)
[46]PEIKe-Mei(裴克梅),LIYi-Min(李益民),KAN Rui-Feng (阚瑞峰),et al.Acta Phys.-Chim.Sinica(物理化学学报),2003,19(1):55-59
[47]Bing M C,Lee LW,Yuan P L.J.Phys.Chem.,1991,95(7): 2814-2817
[48]Mcgrath M P,Rowland F S.J.Phys.Chem.,1994,98(4): 1061-1067
Theoretical Mechanism Study of the HNO+O2Reaction
HUWei CHEN Shu-Yong LIU Bo-Tan
(1School of Chemical Engineering and Technology,Tianjin University,Tianjin 300072,China)
(2State Key Laboratory for Advanced Technology of FloatGlass,Bengbu Design&Research Institute for Glass Industry, Bengbu,Anhui233000,China)
(3College of Chemical Engineering&Material Science,Tianjin University of Science&Technology,Tianjin 300457,China)
In order to figure out the reaction mechanisms of HNO radicalwith O2,a detailed theoretical study was performed.Reveal the microscopic reaction mechanism and provide theoretical support for the protection of the air.The geometry configurations of reactants,intermediates,transition states and products were optimized so that their harmonic vibration frequencies and energies were obtained at the B3LYP/6-311++G(d,p)level.Intrinsic reaction coordinate calculations at the same level were computed to ensure the connections between transition states and intermediates.The energieswere confirmed by single-point calculated at the QCISD/6-311++G(d,p),and all the total energieswere corrected by the zero-pointenergy.Through analyzing the energy and isomerization of the reaction paths,it is found that HNO+O2possesses two products:HOONO and HNO3.HOONO is themain product,and it has three isomers.
density functional calculations;reactionmechanisms;HNO;O2
O641
A
4861(2016)10-1757-06
10.11862/CJIC.2016.236
2016-03-30。收修改稿日期:2016-09-06。
低成本低能耗CO2捕集技术开发与示范(No.2015BAC04B01)教育部资助项目。
*通信联系人。E-mail:liubotan@tju.edu.cn