复心汤对乳鼠心肌细胞GATA4、PKA、ERK表达的影响*
薛一涛焦华琛刘 江高翔宇
(1.山东中医药大学附属医院,山东 济南 250011;2.山东省章丘市中医医院,山东 济南 250014)
·综 述·
复心汤对乳鼠心肌细胞GATA4、PKA、ERK表达的影响*
薛一涛1焦华琛1刘 江1高翔宇2△
(1.山东中医药大学附属医院,山东 济南 250011;2.山东省章丘市中医医院,山东 济南 250014)
目的 为明确复心汤治疗心衰的作用靶点,以心肌细胞信号转导分子GATA4、PKA、ERK作为观察对象,观察复心汤对GATA4、PKA、ERK表达的影响。方法 健康成年的雄性Wistar大鼠75只,随机分为复心汤低剂量组、复心汤中剂量组、复心汤高剂量组、缬沙坦组、生理盐水组,制备含药血清,原代乳鼠心肌细胞的培养,加入相应含药血清干预24 h,Western blot法测各组乳鼠心肌细胞中GATA4、PKA、ERK表达。结果 复心汤3组及缬沙坦组乳鼠心肌细胞中GATA4、PKA、ERK表达量明显低于生理盐水组(P<0.01),复心汤中剂量组抑制GATA4、PKA、ERK表达方面较复心汤低、高剂量组及缬沙坦组更明显(P<0.01)。结论 复心汤通过抑制心肌细胞GATA4、PKA、ERK表达,抑制心室肥厚,改善心衰。
慢性心力衰竭 心室重构 心肌肥厚 复心汤 GATA4
复心汤是治疗慢性心力衰竭有效方药,经过多年临床应用,效果显著。本研究通过探讨复心汤对导致心衰心肌肥厚的GATA4、PKA、ERK等信号转录因子的影响,来确定复心汤治疗心衰与各信号转录因子的关系,明确复心汤抗心衰的作用靶点及机制。现报告如下。
1 材料与方法
1.1 实验动物 SPF级健康成年的雄性Wistar大鼠75只,180~220 g;SPF级健康雄性Wister1-3 d乳鼠6只,5~7 g,购买自山东大学实验动物中心,许可证号Scxk(鲁)20150009。经医学实验动物管理委员会批准。
1.2 试药与仪器 缬沙坦(规格:80 mg胶囊,批准文号:国药准字H20040217):北京诺华制药有限公司;0.9%氯化钠注射液(规格:500 mL/瓶,批准文号:国药准字H37021260):山东洁晶药业有限公司。山羊血清封闭液(c-0005),购自北京博奥森生物技术有限公司;GAPDH(ab181603)购自abcam公司,-20℃保存,Rabbit来源,1∶10000稀释;山羊抗兔IgG(ZB-2301)购自北京中杉金桥生物技术有限公司,1∶5000稀释;复心汤药物组成:炙附子30 g,淫羊藿30 g,葶苈子30 g,泽泻20 g,当归15 g,黄柏30 g。由山东省中医院中药制剂室浓缩提纯,每毫升含生药7.1 g,密封装瓶,置4℃保存备用。高速低温离心机(MICROMAX RF,Thermo IEC美国)ND-1000分光光度计 (JCS0112,Gene Company美国)移液器(10~1000μl,GLISON法国)超低温冰箱(725,Thermo Forma美国)Minishaker(MSI,IKA广州)超净工作台(SW-CJ-1F,苏州安泰技术有限公司)化学发光图像分析仪(LAS-4000mini2200,富士 日本)二氧化碳培养箱(bb506uv,NUAIR德国)倒置显微镜(Axiovert 40C,OLYMPUS公司日本)。
1.3 含药血清制备 75只Wister大鼠随机分为复心汤高、中、低剂量组、缬沙坦组、生理盐水组。复心汤低剂量组给予低剂量复心汤1 mL/d(每毫升约含生药1.90 g)灌胃,复心汤中剂量组给予中剂量复心汤1 mL/d(每毫升约含生药3.79 g)灌胃,复心汤高剂量组给予高剂量复心汤1 mL/d(每毫升约含生药7.58 g)灌胃,缬沙坦组给予缬沙坦水溶液1 mL/d(3.6 mg/mL),生理盐水组给予0.9%氯化钠注射液1 mL/d灌胃,每日1次,共10 d。末次灌胃2 h后下腔静脉收集血液后处死动物并离心血液取得血清,将血清灭活、滤菌后与DMEM培养基以15%浓度混合;将各组分离的血清标记后放于-80℃冷冻保存。
1.4 原代心肌细胞分离、纯化与培养 1)取新生1~3 d Wister大鼠乳鼠,75%酒精消毒后是用眼科剪与眼科镊开胸取出心脏,将心室部分剪下放入D-Hank′s液中冲洗大约3次左右。2)将心肌组织置于50 mL离心管中,用眼科剪剪成碎块,约1 mm3,吸取0.05%Ⅱ型胶原酶和0.06%胰蛋白酶按1∶1比例混合3 mL加入已剪碎的心肌组织中,吸管吹打,置于CO2培养箱(37℃,5%CO2~95%空气)中静置5 min,自然沉淀,弃第一次消化上清。3)再次加入消化酶3 mL,37℃条件下分离成单细胞悬液,每消化5 min后吸出上层细胞悬液,加入少量含血清培养基以中止消化。4)再向组织中加入消化酶混合液3 mL进行消化,重复多次,直到组织碎块肉眼不可见。5)将收集上清液经200目孔径不锈钢网过滤,离心机离心后,取得心肌细胞,用含15%胎牛血清培养基混悬,接种于培养瓶中,然后置于CO2培养箱(5%CO2~95%空气,37℃)中,差速贴壁1 h。6)取差速贴壁后细胞悬液台盼蓝染色计算细胞存活率,后再次接种于培养瓶,置CO2培养箱(37℃,5% CO2~95%空气)中继续培养,48 h后更换培养液,继续培养观测待细胞铺满后可用于实验检测。
1.5 药物干预及观察项目 将培养状态良好的心肌细胞随机分组去胎牛血清并分别加入相应含药血清进行干预,继续培养。24 h后处理标本,应用Western blot法检测心肌细胞中GATA4、PKA、ERK的表达[1]。
1.6 统计学处理 应用SPSS17.0统计软件分析。所有数据以(±s)表示,多组间比较采用完全随机设计的单因素方差分析,组间两两比较采用SNK检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组乳鼠心肌细胞中GATA4、PKA、ERK表达结果 见表1,图1。用LAS-4000 mini化学发光图像分析仪进行灰度值定量测定,并定量分析后显示:与生理盐水组相比,复心汤低剂量组、复心汤中剂量组、复心汤高剂量组、缬沙坦组大鼠心肌细胞中GATA4、PKA、ERK1/2表达量明显降低(P<0.01);与复心汤中剂量组比较,复心汤低剂量组、复心汤高剂量组、缬沙坦组大鼠心肌细胞中GATA4、PKA、ERK1/2表达量明显增高(P<0.01);与缬沙坦组相比复心汤低剂量组、复心汤高剂量组大鼠心肌细胞中GATA4、PKA、ERK1/2表达量明显增高(P<0.01)。
表1 各组大鼠心肌细胞中GATA4、PKA、ERK1/2、P-ERK1/2相对表达量比较(±s)
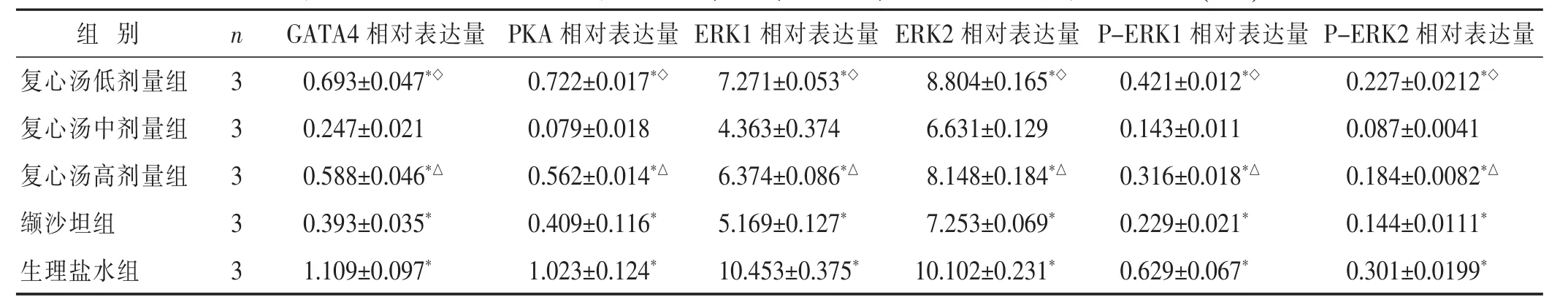
表1 各组大鼠心肌细胞中GATA4、PKA、ERK1/2、P-ERK1/2相对表达量比较(±s)
与复心汤中剂量组比较,*P<0.01;与缬沙坦组比较,◇P<0.01。与低剂量组比较,△P<0.01。
?
3 讨 论
心衰属中医学 “心悸”“怔忡”“喘证”等病证的范畴。病位在心,病机以气虚血瘀贯穿始终,与肺脾肾关系密切。目前认为[2]心力衰竭的中医病机主要为本虚标实,其中以心肾阳虚、血瘀水停者为最常见。复心汤以制附子作为主药,回阳救逆,补火助阳,散寒止痛,为回阳第一品。臣以淫羊藿、葶苈子两药,一补一泻,虚实兼顾,辅助君药温补肾阳、利水消肿。佐以泽泻、当归、黄柏三味,兼顾气分、血分和水分,与君臣药共同起到益气温阳、活血利水的作用。
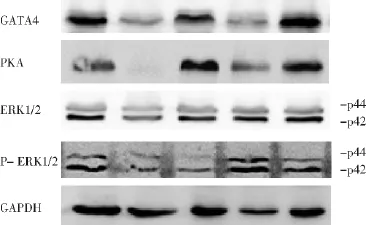
图1 Western blot法分析乳鼠心肌细胞中GATA4、PKA、ERK的表达
GATA基因家族属锌指蛋白家族,因其能识别“GATA”DNA序列,故此命名[3]。GATA-4/5/6与心脏发育密切相关[4],在心肌特化和分化过程中是大量心脏特异基因的直接调控者,其中GATA4是心脏信号转导通路的下游效应因子,相比其他亚型,GATA4在心肌肥厚中的作用尤为重要。GATA-4与心脏发育密切相关[5],在心肌特化和分化过程中是大量心脏特异基因的直接调控者,是心脏信号转导通路的下游效应因子,在心肌肥厚中作用尤为重要。已知研究结果表明,GATA-4与DNA的结合及转录与其变异与否密切相关,同时GATA-4在不同细胞亚核斑点间的选择性蓄积也受其变异作用[6]。已知成年鼠实验中,证实α-MHC、心钠素(ANF)、脑钠素(BNP)、钠/钙离子交换通道,A1腺苷受体、m2毒蕈碱型乙酰胆碱受体和AngII1a受体多种影响心脏结构基因均受GATA-4调控[7]。
GATA-4分子结构上Ser105和Ser261是两个重要磷酸化位点。肥厚心肌细胞中GATA-4与ET-1结合可被ERK抑制剂阻断。ET-1表达增强的同时也对GATA-4进行正反馈调控。相关动物模型的压力超负荷实验中,GATA4与BNP基因序列的结合被ET-1受体激动剂完全抑制,证实了GATA-4的DNA结合活性受ET-1影响[8]。其中p38-MAPK信号通路参与这一过程。研究证实,肥厚刺激条件p38激酶可激活BNP基因与GATA-4结合使BNP基因蛋白质表达量的提高。此外也有研究表明PKA可直接磷酸化GATA-4Ser 261增强其转录活性[9]。乙酰化、亚细胞定位及与辅因子相互作用等多种调节方式亦可影响GATA-4基因转录活性。目前研究证实,GATA-4是多种刺激和信号通路的下游效应因子。ERK、PKA均为GATA4上游转录因子,已知ERK、PKA所在信号转导通路与心衰的发生有密切关系。因此,此研究对于揭示复心汤治疗心衰的作用靶点及作用机制,有重要意义。
薛一涛等通过动物与临床实验研究复心汤 (炙附子、仙灵脾、泽泻、葶苈子、黄柏、当归)抗心衰机制,研究表明,应用复心汤,抑制心衰大鼠Raf/MEK/ERK通路的蛋白激活[10];抑制心衰大鼠PI3K-Akt-GSK3β途径的蛋白激活[11];提高心衰大鼠Caspase-8,Bcl-2蛋白转录[12],多种阻断细胞凋亡途径[13];降低心衰大鼠血清TNF-α及BNP水平以延缓心衰[14],心衰患者外周血淋巴细胞β1-AR mRNA的表达增高[15],明显消除CHF患者症状[16]。
本实验观察到,复心汤3组及缬沙坦组乳鼠心肌细胞中GATA4、PKA、ERK表达量明显低于生理盐水组,具有显著统计学差异,说明复心汤和缬沙坦是通过抑制GATA4、PKA、ERK的表达及其所在信号通路过度激活状态,来发挥抗心力衰竭的作用,其中复心汤中剂量组抑制GATA4、PKA、ERK表达方面较低剂量组、高剂量组更明显,存在统计学差异,提示在一定剂量范围内,复心汤在抑制GATA4、PKA、ERK的表达方面呈现剂量依赖性,剂量越高疗效越好,超过一定剂量则效应降低。复心汤中剂量组与缬沙坦组在抑制GATA4、PKA、ERK表达方面存在明显统计学差异,提示复心汤中剂量在改善心衰,抑制心室肥厚,改善心衰心室重构的某些方面较缬沙坦更有效。
综上,GATA4、PKA、ERK等信号转录因子与心衰的形成与进展密不可分;复心汤可通过抑制GATA4、PKA、ERK等信号转录因子的表达达到抑制心室重构的目的;中剂量复心汤对乳鼠心肌细胞的作用效果明显优于高剂量复心汤低剂量复心汤以及缬沙坦试验组。
[1] 李春陵,顾广福,罗建华,等.益气温阳活血方对慢性心力衰竭心室重塑大鼠GATA4表达的影响[J].中华中医药杂志,2014,29(9):2967-2968.
[2] 何怀阳,黄春林.心衰中医病机探讨[J].辽宁中医杂志,2007,34(4):413-415.
[3] 李昕,贾勇圣,郑建全.GATA4在心肌肥厚中的作用[J].医学与哲学,2008,29(1):48-49
[4] Patient RK,McGhee JD.The GATA family(vertebrates and invertebrates)[J].Curr Opin Genet Dev,2002,12:416-422.
[5] 姜升阳,徐明,张幼怡.GATA结合蛋白4在心脏发育及心肌重塑中的作用[J].生理科学进展,2008,39(4):302-306.
[6] AS Philips,JC Kwok,BH Chong.Analysis of the signals and mechanisms mediating nuclear trafficking of GATA-4[J]. Journal of Biological Chemistry,2007,282 (34):24915-24927.
[7] Suzuki YJ,Evans T.Regulation of cardiacmyocyte apoptosis by the GATA-4 transcription factor[J].Life Sci,2004,74(15):1829-1838.
[8] Kobayashi S,Mao K,Zheng H,et al.Diminished GATA4 protein levels contribute to hypergly cemia-induced cardiomyocyte injury[J].Journal of Biological Chemistry,2007,282∶21945-21952.
[9] Tremblay JJ,Viger RS.Transcription factor GATA-4 is activated by phosphorylation of serine 261 via the cAMP/ protein kinase a signaling pathway in gonadal cells[J].J Biol Chem,2003,278(24):22128-22135.
[10]薛一涛,焦华琛,苏文革,等.复心合剂对心衰大鼠信号通路Raf/MEK/ERK的影响[J].中华中医药学刊,2015,33(4): 791-794.
[11]薛一涛,焦华琛,陈炜,等.复心汤对心力衰竭大鼠PI3KAkt-GSK3β通路的影响[J].上海中医药杂志,2015,49(8): 74-78.
[12]薛一涛,焦华琛,林鑫,等.复心汤对心衰大鼠心肌细胞凋亡信号转导分子Bcl-2表达的影响[J].中华中医药学刊,2013,31(12):128-131.
[13]林鑫.复心合剂对心衰大鼠模型TNF-α及心肌细胞凋亡的影响[D].济南:山东中医药大学,2012:34-38.
[14]薛一涛,林鑫,高扬,等.复心汤对心衰大鼠模型TNF-α及BNP的影响[J].中西医结合心血管病杂志,2013,11(7): 833-834.
[15]薛一涛,焦华琛,刘秀娟,等.复心合剂对慢性充血性心力衰竭患者淋巴细胞β1-AR mRNA表达的影响及临床观察[J].中华中医药学刊,2015,33(3):533-536.
[16]高扬.复心汤对抗心力衰竭机制及临床疗效研究[D].济南:山东中医药大学,2012:31-33.
Influence of Fu Xin Decoction′s on the Expression of GATA4、PKA、ERK in Myocardial Cell of Rats
XUE Yitao,JIAO Huachen,LIU Jiang,et al. Affiliated Hospital of Shandong University of Traditional Chinese Medicine,ShanDong JiNan 250011,China.
Objective:In myocardial cell signal transduction molecules GATA4,PKA,ERK as research object,This research through observation Fu Xin Decoction for the effect of GATA4、PKA、ERK expression,For the clear Fu Xin Decoction′s targets for the treatment of heart failure.Methods:75 healthy adult male Wistar rats were randomly divided into low dose group,median dose group and high dose group of Fu Xin Decoction,valsartan group,normal saline group.Medicated serum were prepared.The cultivation of the myocardial cells and processing,join the drug-containing serum levels of processing for 24 hours.The expression of myocardial cells GATA4,PKA,ERK were detected with the method of Western blot.Results:Compared with normal saline group,low dose group,median dose group and high dose group of Fu Xin Decoction,valsartan group,GATA4,PKA,ERK in rat myocardial cells,expression quantity to decrease,with statistically significant difference(P<0.01);Compared with median dose group after low dose group,high dose group of Fu Xin Decoction,valsartan GATA4,PKA,ERK in rat myocardial cells,expression quantity increased obviously had a statistically significant difference(P<0.01).Conclusion:Fu Xin Decoction can by adjusting the rat myocardial cells GATA4、PKA、ERK to achieve the goal of treatment for heart failure.
Chronic heart failure;Ventricular remodeling;Myocardial hypertrophy;After heart soup;GATA4
R285.5
A
1004-745X(2016)10-1907-04
10.3969/j.issn.1004-745X.2016.10.024
国家自然科学基金资助项目(81273703)
△(电子邮箱:gaoxiangyuv@163.com)
(2016-05-11)

