MnSOD-SIRT3在佐剂性关节炎大鼠肝组织中的表达和意义
苏会萍,张俊强,曹 威,储海峰,俞 晨,4,李 简,杨 睿,宋先兵,陈晓宇
MnSOD-SIRT3在佐剂性关节炎大鼠肝组织中的表达和意义
苏会萍1,2,张俊强1,曹 威1,储海峰3,俞 晨1,4,李 简3,杨 睿3,宋先兵5,陈晓宇1
目的 探讨肝脏锰超氧化物歧化酶(MnSOD)、去乙酰化酶3(SIRT3)的改变与佐剂性关节炎(AA)大鼠的关系。方法 弗氏完全佐剂(FCA)足趾皮下注射诱导SD大鼠AA,造模后12、19、26 d,分批处死大鼠,计算肝脏指数,检测血清谷草转氨酶(AST);谷丙转氨酶(ALT);肝匀浆检测丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)的变化;肝组织免疫组化和Western blot法检测MnSOD、SIRT3蛋白表达变化。结果 与正常组大鼠比较,AA大鼠造模12 d后,肝脏指数升高,血清转氨酶升高,肝匀浆中MDA升高,GSH-Px、SOD活性下降(P<0.05,P<0.01),肝组织中MnSOD、SIRT3蛋白表达下降。结论 AA模型组大鼠存在肝损伤,肝匀浆中氧化应激指标升高,其机制与肝脏中MnSOD和SIRT3表达有一定的关联。
佐剂性关节炎;锰超氧化物歧化酶;去乙酰化酶3;大鼠
氧化应激性反应是导致类风湿关节炎(rheumatoid arthritis,RA)的一个重要因素,长期治疗、生活方式的改变、关节疼痛和功能受限等使RA患者处于应激状态[1],机体出现脂质过氧化反应,氧自由基(oxygen free radical,ROS)的生成增加,而清除ROS的能力下降[2]。佐剂性关节炎(adjuvant arthritis,AA)大鼠模型由于和RA在形态学上相似,且造模简单,是目前较为常用的RA动物模型,常用于RA药物筛选模型[3]。真核细胞线粒体中含有锰超氧化物歧化酶(manganese superoxide dismutase,Mn-SOD),属于金属抗氧化酶,能够特异性地将超氧阴离子自由基(O-·)2转化为H2O2和O2。MnSOD主要存在于线粒体,而线粒体是细胞内氧化代谢和产生能量、自由基的重要场所,故其在抗氧化损伤中作用显著[4]。去乙酰化酶(sirtuins,SIRTs)家族中的SIRT3主要位于线粒体,是具有去乙酰化酶活性的SIRTs,具有调节线粒体的能量代谢和抗氧化应激的作用[5]。肝脏是机体重要的物质代谢场所,肝细胞中线粒体含量丰富。近年来,有文献[6]报道AA大鼠存在氧化应激性肝损伤,为进一步了解其肝损伤原因,该研究探讨AA大鼠机体氧化应激情况以及与肝功能损伤、肝脏中MnSOD和SIRT3表达的联系,旨在进一步阐明AA大鼠的氧化应激机制。
1 材料与方法
1.1 实验动物与试剂
1.1.1 动物 40只雄性SD大鼠,清洁级,(180± 20)g,购置并饲养于安徽省实验动物中心,每天光照周期12 h∶12 h,自由饮食水。
1.1.2 试剂 弗氏完全佐剂(FCA)购自美国Sigma公司;羊抗鼠MnSOD、SIRT3多克隆抗体购自美国Abcam公司;兔抗羊生物素-链霉卵白素免疫组化检测试剂盒(SP-9000)、DAB显色试剂盒购自北京诺博莱德科技有限公司,HE染色试剂盒、ECL化学发光试剂盒购自江苏碧云天公司;谷草转氨酶(aspartate transaminase,AST)(货号:C010-3)、谷丙转氨酶(glutamic-pyruvic transaminase,ALT)(货号:C009-2)、超氧化物歧化酶(superoxide dismutase,SOD)(货号:A001)、谷胱甘肽过氧化物酶(glutathion peroxidase,GSH-Px)(货号:A005)、丙二醛(malondialdehyde,MDA)(货号:A003)检测试剂盒购自南京建成生物工程研究所;BCA蛋白测定试剂盒购自美国Amersham Life Sciences公司。
1.1.3 主要仪器与设备 大鼠足跖容积测量仪YLS-TA(山东医学科学研究所);电子天平(德国Sartorius公司);IX51倒置显微镜(日本Olympus公司);SW-CJ-IF型超净工作台(江苏苏净集团);玻璃匀浆器、AM-1 ACE破碎乳化机(日本Nissel精机制作所);荧光显微镜、RM2235切片机(德国Leica公司);7020全自动生化分析仪(日立中国公司Hitachi Europe Ltd.)等。
1.2 方法
1.2.1 实验动物分组和标本收集 随机将大鼠分为两组:正常组(10只)、模型组(30只)。模型组于每鼠右后足趾皮内注射0.1 ml FCA致炎,建立AA大鼠模型。将AA模型组随机均分为3组,分别于致炎后12、19、26 d腹腔注射50 mg/kg戊巴比妥钠溶液麻醉SD大鼠,剖开腹腔,暴露腹主动脉,抽取约5 ml动脉血置于EP管中,8 000~10 000 r/min离心10 min分离血清,储存于-20℃冰箱待测AST、ALT活力。破腹后取出肝脏,称取肝脏湿重,计算肝脏指数,肝脏指数(%)=肝脏湿重/大鼠体重× 100%。留取相同部位肝脏,迅速转移至液氮中做Western blot法检测;另取相同部位肝脏置10%福尔马林溶液中固定。
1.2.2 血清AST、ALT检测 按照底物法测定AST、ALT试剂盒说明书进行操作,检测前应用新鲜配置的质控液对生化分析仪进行开机校准,保证测试结果在质控范围内,进行血清样本AST、ALT活力的检测。质控品标号:YZB/皖0213-2012。AST、ALT活力的单位为IU/L。
1.2.3 肝匀浆分光光度计检测抗氧化指标 取相同新鲜部位的肝组织,以预冷的生理盐水为匀浆介质,肝组织 ∶生理盐水按1∶9的比例进行匀浆,匀浆液3 500~4 000 r/min离心10 min,留取上清液,即10%的肝组织匀浆液,置于-20℃冰箱中保存待测。严格按照操作程序说明书进行,硫代巴比妥酸(thiobarbituric acid,TBA)法检测MDA含量;羟胺法检测SOD活性和比色法测定GSH-Px活性。
1.2.4 免疫组化法检测肝脏MnSOD、SIRT3蛋白表达 制备SD大鼠肝脏组织切片,石蜡包埋,5 μm厚切片,脱蜡至水,微波中火抗原修复(0.01 mol/L柠檬酸盐缓冲液),3%H2O2、37℃孵育10 min消除内源性过氧化物酶,正常山羊血清封闭液,滴加羊抗鼠MnSOD、SIRT3多克隆抗体(一抗),4℃孵育过夜,滴加辣根过氧化物酶标记的兔抗羊IgG/HRF二抗,37℃温箱中孵育30 min,DAB显色,苏木精复染,脱水、透明、封片,光学显微镜观察 MnSOD、SIRT3蛋白表达情况。
1.2.5 Western blot法检测肝组织中MnSOD、SIRT3蛋白表达 液氮中冻存的肝脏组织取样,并将组织样品于研钵中研磨成匀浆,按照试剂盒说明书配置组织细胞裂解液,将肝组织裂解研磨成匀浆,提取组织蛋白。根据BCA试剂盒测定总蛋白含量,-80℃冰箱储存备用。各组取30 μg等量的组织蛋白,煮沸变性,SDS-PAGE进行蛋白分离,将蛋白质电转至硝酸纤维素膜,10%脱脂奶粉封闭,加入羊抗鼠Mn-SOD、SIRT3多克隆抗体一抗(1∶1 000),4℃过夜。次日用Tris缓冲液(TBST)洗膜后,加入兔抗羊辣根过氧化物酶标记的二抗(1∶2 000),37℃孵育1 h。采用ECL化学发光法进行显色,以β-actin为内参照,灰度分析软件Image J作半定量分析。
1.3 统计学处理 应用SPSS 16.0软件进行分析,计量资料采用表示,组间比较应用单因素方差分析,经过方差齐性检验后采用t检验,率的比较采用χ2检验。
2 结果
2.1 各组大鼠肝指数变化 与正常组比较,模型组大鼠活动减少、体重减轻,肝脏指数明显增加(F= 2.707,P<0.05),且随着造模时间的延长,模型组大鼠炎症的加重,表现为原发侧足趾肿胀进行性加重,且出现渐进性的继发性足肿胀和前足肿胀,逐渐行动不便、站立不稳,肝脏指数逐渐增加,但12、19、26 d模型各组间差异无统计学意义(F=1.097,P>0.05)。见图1。
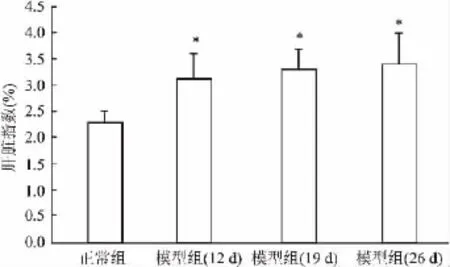
图1 AA大鼠的肝脏指数(,n=10)
2.2 大鼠血清AST、ALT的变化 与正常组比较,各模型组大鼠血清AST、ALT含量明显升高,差异有统计学意义(F=3.261,P<0.01);但12、19、26 d模型各组间差异无统计学意义(F=1.326,P>0.05)。见图2。
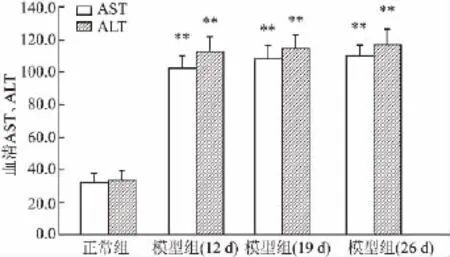
图2 AA大鼠的血清AST、ALT的变化(,n=10)
2.3 各组大鼠肝匀浆MDA含量和SOD、GSH-Px活性的影响 与正常组比较,AA模型组大鼠肝匀浆中MDA含量明显升高(P<0.01),SOD活性和GSH-Px酶活力单位显著降低(P<0.01)。见表2。模型组12、19、26 d间MDA含量、SOD活性和GSHPx酶活力单位比较差异无统计学意义(F=1.602,P >0.05)。见图3。
2.4 免疫组化法检测大鼠肝脏中MnSOD、SIRT3蛋白表达情况 正常组大鼠肝脏中MnSOD蛋白表达明显,主要表达于肝细胞胞质和肝血窦内皮细胞上,各模型组大鼠肝脏中MnSOD蛋白表达明显减弱,阳性主要位于肝血窦内皮细胞上,而肝细胞胞质中减弱,见图3。肝脏中SIRT3蛋白表达情况类似于MnSOD蛋白表达,正常组大鼠SIRT3蛋白表达明显,主要表达于肝血窦内皮细胞上,模型组大鼠肝脏中SIRT3蛋白表达明显减弱,阳性结果主要表达于肝血窦内皮细胞,而肝细胞胞质中表达明显减弱,见图4。
表2 大鼠肝匀浆中MDA含量和SOD、GSH-Px活性的影响(,n=10)

表2 大鼠肝匀浆中MDA含量和SOD、GSH-Px活性的影响(,n=10)
与正常组比较:**P<0.01
组别 MDA(μmol/L) SOD(U/ml) GSH-Px(μmol/L)正常 4.36±0.43 212.62±5.04 183.16±6.27模型(12 d) 11.03±0.96** 138.24±9.73** 144.82±9.83**模型(19 d) 11.91±1.24** 130.08±8.85** 138.87±9.15**模型(26 d) 12.35±1.27** 127.61±9.35** 136.82±9.04**
2.5 Western blot法检测大鼠肝脏中MnSOD、SIRT3蛋白表达情况 与免疫组化检测大鼠肝脏中MnSOD、SIRT3蛋白表达结果相似,Western blot结果显示,正常组大鼠肝脏中MnSOD、SIRT3蛋白高表达,模型组12 d时肝脏组织中有MnSOD、SIRT3阳性表达,19 d、26 d表达呈降低趋势;通过Image J软件,利用灰度比值半定量分析表明,AA模型组大鼠肝脏组织中MnSOD/GAPDH、SIRT3/GAPDH与正常组比较差异有统计学意义(F=4.217,P<0.01);各模型组间表达差异无统计学意义。见图4。
3 讨论

图3 大鼠肝脏中蛋白表达情况 免疫组化 ×400

图4 AA大鼠肝脏组织MnSOD、SIRT3蛋白表达
目前,最常用于动物实验的佐剂为FCA,制备中先将抗原水溶液 ∶油剂(石蜡油)按1∶1混合,然后加入乳化剂(羊毛脂等)构成油包水抗原乳剂,制备成不完全弗氏佐剂,最后在其中加入灭活分枝杆菌的卡介苗,形成FCA[7]。在本研究中,SD大鼠在注射FCA的3 d表现为急性炎症表现,原发注射侧足趾红肿,关节处于注射1周内表现明显的肿胀,1周后继发侧表现关节肿胀,14 d关节肿胀进一步发展,严重者不能负重,随着时间的推移,继发性炎症进一步发展,说明AA造模成功。肝脏指数检测结果表明,各模型组之间差异并不明显。正常组肝脏呈棕褐色、质柔软,肝脏指数正常,而模型组肝脏体积增大、肝被膜紧张、色泽苍白混浊,肝脏指数相对于正常组有显著的增加,表明肝脏受到一定程度的损伤。AST和ALT是反映肝细胞膜损伤的敏感性指标,肝细胞膜损伤后,导致转氨酶大量进入血液中,引起血清中AST和ALT升高。本研究中,正常组大鼠血清AST、ALT含量均在正常范围内,各模型组大鼠血清AST、ALT含量明显升高,与正常组比较差异有统计学意义;但12、19、26 d模型各组间差异无统计学意义。因此,说明足趾注射FCA,引起佐剂性肝损伤。
生物膜脂质过氧化产物MDA的浓度高低可反映出组织细胞受自由基攻击后氧化损伤的程度,GSH-Px和SOD是广泛存在于机体的抗氧自由基损伤的重要酶类,GSH-Px能特异性催化还原型谷胱甘肽(GSH)对H2O2的还原过氧化的脂质,因此具有保护细胞膜结构和功能完整性的作用。本研究表明,12、19、26 d模型各组间差异无统计学意义,相对于正常组,AA模型组大鼠肝脏组织匀浆中GSH-Px 和SOD活性显著升高,而MDA的浓度下降,说明AA模型组大鼠肝脏组织中存在氧化应激作用。过量的氧自由基造成肝细胞膜脂质的过氧化,损伤抗氧化酶,引起GSH-Px和SOD的催化作用降低甚至失活。
MnSOD是机体重要的氧自由基清除剂,是位于线粒体中的酶,有催化超氧阴离子发生歧化反应的作用。线粒体是细胞内氧化还原反应和产生能量的重要场所,同时也是产生自由基的场所,故MnSOD抗氧化损伤的作用显著[4]。SIRT3是一种去乙酰化酶,有高度保守特性,依赖于烟酰胺腺嘌呤二核苷酸发挥功能,能对线粒体内相关的乙酰化蛋白脱乙酰基,加强ROS清除氧自由基,稳定线粒体,抑制线粒体内ROS的蓄积[5]。SIRT3在线粒体内通过对组蛋白/非组蛋白的去乙酰化作用,调节线粒体内的能量代谢,提高细胞内的ATP含量,可保护细胞,发挥抗氧化应激作用[8]。研究[9]表明,SIRT3通过引起MnSOD 122位赖氨酸残基脱乙酰化,进而活化Mn-SOD,减少线粒体生成ROS,参与抗衰老等作用。文献[10]报道,SIRT3作为能量感受器及ROS清除的介导者可能在RA的发病机制中发挥着重要作用。本实验肝脏组织的免疫组织化学法检测结果表明,正常组大鼠肝脏中MnSOD蛋白表达明显,主要表达于肝细胞胞质和肝血窦内皮细胞上,各模型组大鼠肝脏中MnSOD蛋白表达明显减弱,SIRT3蛋白在肝组织中表达情况类似于MnSOD蛋白表达,表明肝小叶中存在MnSOD-SIRT3相关抗氧化作用。本研究进一步采用Western blot法检测肝匀浆中Mn-SOD、SIRT3蛋白表达情况,结果与免疫组化法检测结果相似,正常组大鼠肝脏中MnSOD、SIRT3蛋白高表达,模型组12 d时肝脏组织中有少量MnSOD、SIRT3阳性表达,19、26 d表达呈降低趋势;灰度比值半定量分析表明,AA模型组大鼠肝脏组织中Mn-SOD/GAPDH、SIRT3/GAPDH明显较正常组降低,说明肝组织中有MnSOD-SIRT3相关抗氧化作用。
综上所述,AA模型组大鼠存在肝损伤、血清转氨酶升高、肝匀浆中氧化应激指标升高,其机制与肝脏中MnSOD和SIRT3表达有一定的联系。
[1] Hirao M,Yamasaki N,Oze H,et al.Serum level of oxidative stress marker is dramatically low in patients with rheumatoid arthritis treated with tocilizumab[J].Rheumatol Int,2012,32(12):4041-5.
[2] Kundu S,Ghosh P,Datta S,et al.Oxidative stress as a potential biomarker fordetermining disease activity in patients with rheumatoid arthritis[J].Free Radic Res,2012,46(12):1482-9.
[3] 卢锦森,马中飞,纵何香,等.白藜芦醇对佐剂性关节炎大鼠血管内皮因子表达的影响[J].安徽医科大学学报,2015,50(7):969-73.
[4] Brandauer J,Andersen M A,Kellezi H,et al.AMP-activated protein kinasecontrols exercise training-and AICAR-induced increases in SIRT3 and MnSOD[J].Front Physiol,2015,6:85.
[5] Lo Gullo A,Mandraffino G,Sardo M A,et al.Circulating progenitor cells in rheumatoid arthritis:association with inflammation and oxidative stress[J].Scand J Rheumatol,2014,43(3):184-93.
[6] Comar J F,Babeto de Sá-Nakanishi A,de Oliveira A L,et al.Oxidative state of the liver of rats with adjuvant-induced arthritis[J]. Free Radic Biol Med,2013,58:144-53.
[7] Ahmed Y M,Messiha B A,Abo-Saif A A.Protective effects of simvastatin and hesperidin against complete freund's adjuvant-induced rheumatoid arthritis in rats[J].Pharmacology,2015,96(5-6):217-25.
[8] Chen C J,Fu Y C,Yu W,et al.SIRT3 protects cardiomyocytes from oxidative stress-mediated cell death by activating NF-κB[J]. Biochem Biophys Res Commun,2013,430(2):798-803.
[9] Chen I C,Chiang W F,Chen P F,et al.STRESS-responsive deacetylase SIRT3 is up-regulated by areca nut extract-induced oxidative stress in human oral keratinocytes[J].J Cell Biochem,2014,115(2):328-39.
[10]Cheung K G,Cole L K,Xiang B,et al.Sirtuin-3(SIRT3)protein attenuates doxorubicin-induced oxidative stress and improves mitochondrial respiration in h9c2 cardiomyocytes[J].J Biol Chem,2015,290(17):10981-93.
Expression and significance of MnSOD-SIRT3 in adjuvant arthritis of rat liver tissue
Su Huiping1,2,Zhang Junqiang1,Cao Wei1,et al
(1Dept of Histology and Embryology,Anhui Medical University,Hefei 230032;
2Dept of Rehabilitation,Anqing Medical College,Anqing 246052)
Objective To investigate the relationship between the changes of manganese superoxide dismutase(Mn-SOD),sirtuin 3(SIRT3)with adjuvant arthritis(AA)rats.Methods Complete Freund's adjuvant(FCA)of subcutaneous injection of SD rats induced by AA,the AA rats were put to death on the day 12,19 and 26,calculate the liver index,serum aspartate transaminase(AST),alanineaminotransferase(ALT)were detected,methane dicarboxylic aldehyde(MDA),glutathione peroxidase(GSH-Px)and superoxide dismutase(SOD)in liver homogenate were also detected,and MnSOD,SIRT3 protein expression changes were detected in the liver tissue by immunohistochemistry and Western blot.Results Compared with the normal rats,AA rats on the day 12,the liver index,serum transaminase eleations,liver homogenate MDA increased,GSH-Px,SOD activity decreased(P<0.05,P<0.01).The expressions of MnSOD and SIRT3 protein decreased in liver tissue.Conclusion There is liver damage in AA model grouprats,oxidative stress index increases in liver homogenate.The mechanism is related to the expression of MnSOD and SIRT3 in the liver.
adjuvant arthritis;manganese superoxide dismutase;sirtuin 3;rat
R 322.72
A
1000-1492(2016)09-1268-05
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.016.html
2016-05-30接收
国家自然科学基金面上项目(编号:81373421);安徽高校 自然科学研究项目(编号:KJ2015A350);安徽医科大学“早期接触科研”训练计划项目(编号:2015-ZQKY-01)
1安徽医科大学组织胚胎学教研室,合肥 2300322安庆医药高等专科学校康复保健教研室,安庆 2460523安徽医科大学14级“5+3”临床医学系,合肥 2300324皖西卫生职业学院护理系,六安 2370005安徽省医学高等专科学校,合肥230601
苏会萍,女,硕士研究生; 陈晓宇,男,博士,教授,硕士生导师,责任作者,E-mail:chenxy@163.com

