犬牙槽骨干细胞与髂骨骨髓干细胞体外成骨能力的比较
郑文龙,吴 涛,邹多宏,陈乔尔
犬牙槽骨干细胞与髂骨骨髓干细胞体外成骨能力的比较
郑文龙1,2,3,吴 涛1,2,3,邹多宏1,2,3,陈乔尔1,2,3
目的 比较犬牙槽骨来源干细胞(ABSC)和骨髓间充质干细胞(BMSC)的体外成骨能力,为骨组织工程的种子细胞选择提供新思路。方法 取同一只犬的牙槽骨骨组织和髂骨骨髓作为ABSC和BMSC的来源。取第3代细胞进行一系列体外检测:MTT法检测两种细胞的增殖能力;成骨诱导和常规培养条件下,不同时间点进行茜素红和碱性磷酸酶染色,观察钙盐沉积和碱性磷酸酶合成能力,同时对细胞内碱性磷酸酶活力进行半定量检测;成骨诱导后7、14、21 d利用RT-PCR法检测关键性成骨因子[Ⅰ型胶原(COL-1)、碱性磷酸酶(ALP)、骨钙素(OCN)]的表达情况。结果 相较BMSC,ABSC增殖能力略高,钙结节和碱性磷酸酶的表达能力更强。COL-1早期在ABSC中的表达高于BMSC,并随着时间呈下降趋势。ALP在ABSC中的表达始终高于BMSC,且在14 d达到最高峰。OCN总体呈上升趋势,14 d和21 d有明显表达,且ABSC高于BMSC。结论 犬ABSC的成骨能力与BMSC差别不大,提示犬ABSC可以成为骨组织工程优先选择的种子细胞之一。
骨髓干细胞;牙槽骨干细胞;成骨分化
研究[1]表明,颌骨组织修复颌面部的骨缺损比使用中轴骨或四肢骨拥有更加稳定的成骨效果,远期的骨吸收更少。胚胎学证实,颌骨起源于神经嵴,又称为外胚间叶组织,而躯干四肢骨起源于中胚层[2]。研究[3]显示,牙槽骨来源干细胞(alveolar bone-derived stem cells,ABSC)和骨髓间充质干细胞(bone marrow mesenchymal stromal cells,BMSC)在胚胎和骨骼系统发育相关基因的表达上存在较大差异。近年来,Clausen et al[4]使用流式细胞术检测人的ABSC,证明其高表达干细胞表面标志 CD13、CD44、CD90、CD73,低表达CD31,并利用RT-PCR检测证明了成骨诱导后其成骨相关基因的高表达。Payer et al[5]证明ABSC在体外培养下具有成骨和成脂的潜能。研究[6]证明,颌骨BMSC比髂骨BMSC具有更高的神经向分化能力。以上结果说明,牙槽骨中具有多项分化潜能的干细胞,在组织工程中有巨大的潜力。该研究旨在比较ABSC和BMSC的体外成骨能力,为其将来更好地应用于组织工程提供更多的理论支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 拉布拉多犬,1.5岁,18~20 kg,雄性,饲养于安徽医科大学动物实验中心。
1.1.2 实验试剂 DMEM培养基、地塞米松、抗坏血酸、β-甘油磷酸钠、茜素红(美国Sigma公司);胎牛血清、BCI/PNBT碱性磷酸酯显色试剂盒、碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒(上海碧云天生物技术公司);逆转录试剂盒、qPCR反应试剂盒(大连TaKaRa公司)。
1.1.3 实验仪器 CO2细胞培养孵箱(美国Thermo公司);I型超净工作台(苏州净化设备厂);荧光倒置相差显微镜和照相系统(德国Leica公司);实时荧光定量PCR仪(美国Stratagene公司);低温高速离心机(德国eppendorf公司);自动细胞计数分析仪(北京京百卓显公司);全自动酶标仪(美国BioTek公司);生物安全柜(中国ESCO公司)。
1.2 方法
1.2.1 细胞培养 ABSC的培养:使用3%的戊巴比妥钠对拉布拉多犬进行静脉麻醉,然后固定于操作台,备皮、消毒,拔去犬的上颌前磨牙,从牙槽骨壁及其周围获得牙槽骨并送实验室培养。PBS冲洗3遍,去除血凝块,使用无菌器械将牙槽骨剪碎成大小约2 mm×2 mm×2 mm,加入含10%FBS的DMEM,于37℃、5%CO2的孵箱中进行培养。接种5~7 d后进行观察,换液。此后每隔3 d细胞全换液1次,倒置显微镜下观察细胞生长情况。BMSC的培养:对犬的髂骨进行穿刺获得5~8 ml骨髓,置入含肝素钠的离心管,送实验室采用全骨髓贴壁法培养细胞。5 d后小心吸取培养液和未贴壁细胞进行首次换液。当ABSC和BMSC细胞生长融合约80%~90%时,用0.25%胰酶消化传代。第3代细胞用于实验。
1.2.2 MTT法检测细胞增殖 取第3代两种细胞,分别以1×104/ml接种于96孔板,每孔200 μl完全培养基,每组5个复孔;使用MTT法,通过酶标仪测两者的吸光度(optical density,OD值),连续测9 d,绘制生长曲线。
1.2.3 成骨诱导分化后钙结节和ALP的染色 取第3代两种细胞,分别以5×104/ml的密度接种于24孔板培养,每孔0.5 ml,每组6个复孔。当细胞贴壁生长达90%汇合后,加入成骨诱导液(含10% FBS、10 mmol/L β-甘油磷酸钠、10-7mol/L地塞米松、50 mg/L维生素C)进行诱导培养。培养约7、14、21 d行茜素红和ALP染色,扫描并于倒置显微镜下观察。ABSC和BMSC的钙结节面积比较,则将染色后培养皿放在网格板上,平均分9个视野,取上、下、左、右和中间5个视野,拍照后,使用Image Pro Plus软件计算钙结节所占面积。
1.2.4 ALP相对活力的检测 取第3代两种细胞,分别以5×104/ml的密度接种于10 cm板,每板10 ml。当细胞贴壁生长达90%汇合后,加入成骨诱导培养液进行诱导培养。另设置对照组,不加入成骨诱导液,只加普通的培养基。每3 d换液1次。第7、14、21天提取蛋白,使用对硝基苯磷酸二钠法(pNPP法)对ALP的含量进行测定。
1.2.5 实时荧光定量PCR分析成骨相关基因的表达 取第3代两种细胞,分别以5×104/ml的密度接种于6孔板,每孔2 ml。成骨诱导7、14、21 d后,使用TRIzol试剂分别提取其总的RNA,对收集的RNA进行纯度与量的测定,逆转录合成cDNA,然后进行实时荧光定量PCR,反应体系为20 μl。扩增基因为I型胶原(collagen I,COL-1)、ALP、骨钙素(osteocalcin,OCN)及内参基因β-actin。实验重复3次。引物由上海生工生物工程公司进行设计(表1)。
1.3 统计学处理 采用SPSS 18.0软件进行分析,两组数据间的比较采用独立样本t检验,数据以表示。
2 结果
2.1 犬ABSC和BMSC的形态学观察 ABSC从骨组织边缘迁移出来,其大小形态等与BMSC相似,如单细胞核、成纤维样(图1)。原代细胞传代时使用细胞计数仪对其进行检测,两者的活力可达95%以上。在第3代至第7代细胞活力没有明显下降趋势。

表1 犬引物基因序列表
2.2 犬ABSC和BMSC生长曲线的比较 MTT结果显示ABSC在扩增的第1~3天,两组细胞增殖情况基本一致,第4天后ABSC增殖速度略高于BMSC,差异有统计学意义(P<0.05),9 d后,ABSC基本趋于稳定(图2)。

图1 倒置显微镜下观察原代培养BMSC和ABSC ×40
2.3 成骨诱导后钙结节和ALP的染色 茜素红染色:成骨诱导14 d时,茜素红染色可见ABSC中有局部散在的钙化结节且多余BMSC。21 d时,ABSC的矿化结节面积较大且稠密,明显多于BMSC。Image-Pro Plus 6.0软件分析表明,ABSC其钙结节面积百分比高于 BMSC,差异有统计学意义[14 d:(31.5±1.7)%vs(25.7±0.6)%,t=5.432,P<0.05;21 d:(59.5±1.4)%vs(35.6±0.5)%,t=27.304,P<0.05],见图3。ALP染色:成骨诱导7 d时,可见ABSC的皿底散在分布着蓝紫色的颗粒沉淀,而BMSC仅有皿底中央区域散在分布的着色点。随着诱导时间的增加,ALP越来越多。21 d时,可见ABSC的ALP表达明显高于BMSC(图4)。

图2 第3代ABSC和BMSC生长曲线比较
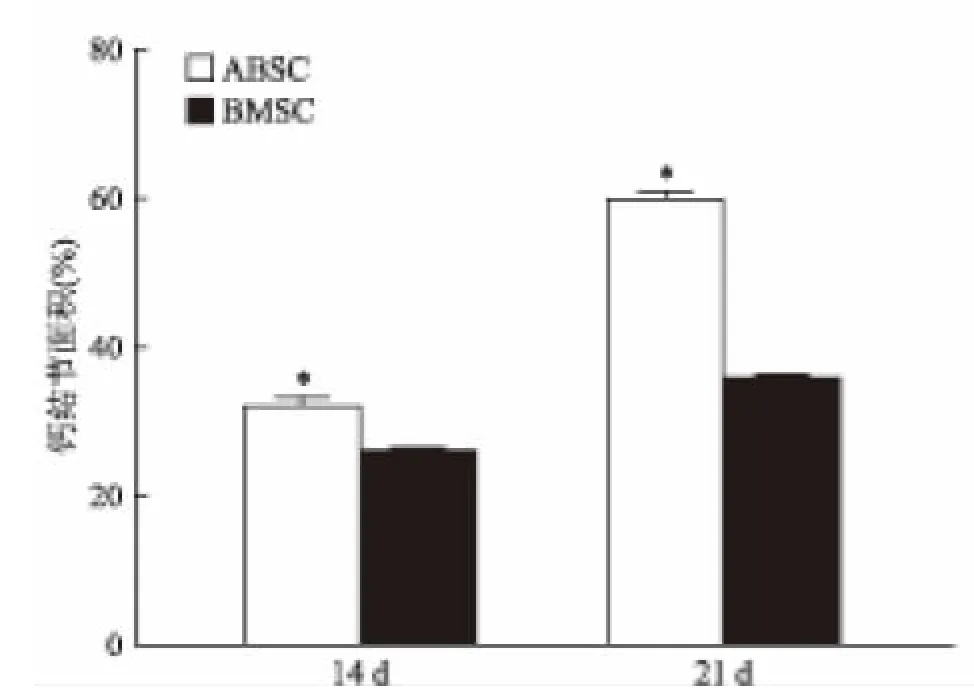
图3 ABSC和BMSC诱导14 d和21 d后茜素红染色扫描和镜下(×40)以及两者钙结节面积所占百分比
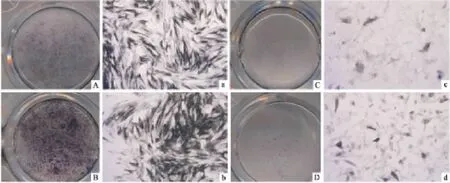
图4 ABSC和BMSC诱导7 d和21 d后ALP染色扫描和镜下 ×40
2.3 ALP活力相对定量检测 非诱导组中,ABSC 中ALP在14 d之后较为稳定,BMSC则一直较为稳定。成骨诱导后,ABSC中ALP增加趋势明显,BMSC中ALP在21 d才有明显增加,每个时间点ABSC 中ALP的活性均高于BMSC,差异有统计学意义(7 d:t=0.868,14 d:t=6.439,21 d:t=1.940,P<0.05),见图5。
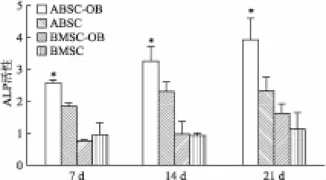
图5 ABSC和BMSC成骨诱导与常规培养ALP活力相对定量
2.4 成骨诱导后成骨相关基因的表达 RT-PCR结果显示,成骨诱导培养后,ABSC和BMSC的成骨相关基因COL-1、ALP、OCN都有差异表达。7、14 d,COL-1在 ABSC中的表达高于 BMSC(7 d:t= 37.283,14 d:t=14.900),且COL-1在两种细胞中的表达随着时间呈下降趋势。ALP在两组细胞的表达在14 d达到最高峰,且ABSC的ALP的表达始终高于BMSC(7 d:t=12.674,14 d:t=7.007,21 d:t =6.099)。OCN随着诱导时间在两种细胞中均呈上升趋势,14 d和21 d的OCN在ABSC的表达高于BMSC(14 d:t=36.908,21 d:t=23.938),以上差异有统计学意义(P<0.05)。见图6。
3 讨论
有关颌骨内干细胞的研究之前多是从颌骨中进行骨髓的抽取并进行相关的实验,而对于从颌骨骨松质中迁移出来的干细胞研究相对较少。研究[7]表明,从颌骨骨髓、骨松质或者两者混合物中生长出来的干细胞,三者在早期的细胞增殖速度上有所区别,但是在干细胞表面标志的表达上没有明显的区别。在30代内,三者没有致癌基因的异常表达,35代后才有核型异常的发生。Akintoye et al[8]报道,人类的颌骨中含有更少的造血干细胞,并显示较高的增殖能力和骨向分化能力。但是,在裸鼠皮下试验中,BMSC的成骨能力却又高于ABSC。研究[9]表明,不管是体外还是体内试验,大鼠的ABSC成骨能力均高于胫骨来源的间充质干细胞。Matsubara et al[10]报道人和犬的ABSC和BMSC具有相似的成骨能力,但是成软骨和成脂肪能力却有不同。Pekovits et al[11]报道,人类下颌骨骨松质与髂骨骨髓来源的干细胞的增殖能力没有明显差别。尽管这些研究结果之间存在着争议,但是多数研究[9-11]表明ABSC 和BMSC确实存在位点差异。出现这些争议有可能是因为实验对象(物种、年龄)、研究方法的不同导致。解剖位点的差异主要受以下因素影响:①血供区域的不同;②骨皮质和骨松质数量与结构的不同;③ 空间物理结构的不同;④ 基因表达的不同[12]。从胚胎发育来看,颌骨起源于外胚层的神经嵴,并经历骨膜内成骨过程。躯干四肢骨起源于中胚层的间叶细胞,并经历软骨成骨[2]。胚胎发生的不同对两者在骨骼系统发育相关基因的表达上会产生一定的影响,并影响着疾病的发生。如巨颌症、甲状旁腺亢进-颌骨肿瘤综合征等仅发生在颌骨。除此之外,颌面部的骨纤维异常增殖症在组织学和影像学上与中轴骨和四肢骨也有明显的不同。近期,有很多关于下颌骨长期使用抗吸收剂(二碳磷酸盐)导致骨坏死发生的病例。然而将二碳磷酸盐应用于中轴骨,仅仅导致轻微骨折而不是骨坏死[3]。

图6 ABSC和BMSC在成骨诱导后,骨相关基因的表达
本次研究所选择的干细胞已经被证实具有多向分化潜能,并具有较强的成骨特性[13]。为使干细胞更快的从骨松质中迁移出来,研究者使用胶原酶对骨组织进行了处理,这不可避免的对细胞的状态会产生一定的影响[8]。为了排除干扰,此次实验并未使用胶原酶。由于细胞增殖能力强,为保证在观察期内细胞不受接触抑制继续生长,MTT实验中的细胞浓度控制在1×104/ml。实验结果说明,ABSC的增殖能力高于BMSC,这与之前的研究[8]结果相一致。研究[3]显示,ABSC的同源异型盒基因家族的MSX基因相对BMSC高表达,而MSX作为核转录因子对细胞的增殖能力具有较强的控制能力。
ALP虽然是成骨分化的早期标志物,但是在骨细胞的形成期表达依然存在。因此本实验通过ALP半定量和ALP染色检测成骨诱导7、14、21 d的变化情况。钙结节是成骨分化的晚期标志物,因此选择检测的时间为14、21 d。为使细胞更快地增殖和汇集,进行骨诱导培养,实验中选择细胞浓度为5× 104/ml。镜下显示ALP和钙结节特别容易在皿底中央聚集,这可能是由于高密度状态更容易表现出骨向分化趋势。ALP是细胞成骨向分化的早期分泌产物,在ABSC中早期就有表达,说明ABSC的成骨分化趋势更加明显。镜下显示,不同细胞间着色程度不同,这可能是因为即使是同一批传代的细胞,每个细胞个体的分化潜能也存在着差异。此次研究培养的是混合型细胞群,并不是所有细胞均具有三系分化的潜能,能分化的干细胞只是其中一部分[11]。ALP半定量结果显示,ABSC的ALP活力高于BMSC,这与研究[8-9]结果一致。ABSC在诱导和非诱导情况下ALP活力的表达存在较大差异,说明ABSC更容易受到骨诱导的影响。
本实验采用COL-1、ALP、OCN 3种骨向分化相关基因作为RT-PCR的检测指标,COL-1、ALP基因是成骨分化的早期标志物,OCN是成骨分化的晚期标志物。RT-PCR的结果表明,COL-1、ALP在ABSC中的高表达,有利于其成骨早期分泌更多的矿化基质,这与ALP染色和ALP半定量结果相符。OCN的表达随着时间逐渐增加与细胞进入矿化期有关,有利于形成更多的钙结节,其在ABSC中的高表达与茜素红的染色结果一致。
以上结果说明:ABSC的成骨能力与BMSC差别不大,是骨组织工程中很有潜力的种子细胞,其深入机制还有待进一步研究。
[1] Kaigler D,Pagni G,Park C H,et al.Stem cell therapy for cranio-facial bone regeneration:a randomized,controlled feasibility trial [J].Cell Transplant,2013,22(5):767-77.
[2] Leucht P,Kim J B,Amasha R,et al.Embryonic origin and Hox status determine progenitor cell fate during adult bone regeneration [J].Development,2008,135(17):2845-54.
[3] Lee J T,Choi S Y,Kim H L,et al.Comparison of gene expression between mandibular and iliac bone-derived cells[J].Clin O-ral Investig,2015,19(6):1223-33.
[4] Clausen C,Hermund N U,Donatsky O,et al.Characterization of human bone cells derived from the maxillary alveolar ridge[J]. Clinical Oral Implants Res,2006,17(5):533-40.
[5] Payer M,Lohberger B,Stadelmeyer E,et al.Behaviour of multipotent maxillary bone-derived cells on beta-tricalcium phosphate and highly porous bovine bone mineral[J].Clin Oral Implants Res,2010,21(7):699-708.
[6] Shinagawa K,Mitsuhara T,Okazaki T,et al.The characteristics of human cranial bone marrow mesenchymal stem cells[J].Neurosci Lett,2015,606:161-6.
[7] Mason S,Tarle S A,Osibin W,et al.Standardization and safety of alveolar bone-derived stem cell isolation[J].J Dent Res,2014,93(1):55-61.
[8] Akintoye S O,Lam T,Shi S,et al.Skeletal site-specific characterization of orofacial and iliac crest human bone marrow stromal cells in same individuals[J].Bone,2006,38(6):758-68.
[9] Aghaloo T L,Chaichanasakul T,Bezouglaia O,et al.Osteogenic potential of mandibular vs.long-bone marrow stromal cells[J].J Dent Res,2010,89(11):1293-8.
[10]Matsubara T,Suardita K,Ishii M,et al.Alveolar bone marrow as a cell source for regenerative medicine:differences between alveolar and iliac bone marrow stromal cells[J].J Bone Miner Res,2005,20(3):399-409.
[11]Pekovits K,Kröpfl J M,Stelzer I,et al.Human mesenchymal progenitor cells derived from alveolar bone and human bone marrow stromal cells:a comparative study[J].Histochem Cell Biol,2013,140(6):611-21.
[12]Kasperk C,Helmboldt A,Börcsök I,et al.Skeletal site-dependent expression of the androgen receptor in human osteoblastic cell populations[J].Calcif Tissue Int,1997,61(6):464-73.
[13]Nishimura M,Takase K,Suehiro F,et al.Candidates cell sources to regenerate alveolar bone from oral tissue[J].Int J Dent,2012,2012:857192.
Canine alveolar bone-derived stem cells and bone marrow mesenchymal stromal cells:a comparative study of the osteogenic potential
Zheng Wenlong1,2,3,Wu Tao1,2,3,Zou Duohong1,2,3,et al
(1Stomatologic College of Anhui Medical University,2The Affiliated Stomatologic Hospital
of Anhui Medical University,3Key Lab of Oral Diseases Research of Anhui Province,Hefei 230032)
Objective To compare the osteogenic ability of two different canine stem cells in the application of bone tissue engineering in vitro,namely alveolar bone-derived stem cells(ABSC)and bone marrow mesenchymal stromal cells(BMSC).Methods ABSC and BMSC were prepared from the alveolar bone and bone marrow of a dog. The third generation of these cells were used for the following studies.Firstly,the proliferation of the two cells was detected by MTT assay.Secondly,after osteogenic induction,the osteogenic ability was detected by alizarin red staining and alkaline phosphatase staining.Thirdly,after osteogenic induction for 7,14 and 21 d,the activity of intracellular alkaline phosphatase was detected by the pNPP method.Fourthly,after osteogenic induction,the expression of collagenⅠ(COL-1),alkaline phosphatase(ALP)and osteocalcin(OCN)was analyzed by RT-PCR.Results ABSC showed higher proliferative ability.After osteogenic induction,ABSC produced more calcium nodules and alkaline phosphatase.The results showed that the expression of COL-1 in ABSC was higher than that in BMSC and both of them decreased gradually.The expression of ALP in them reached the highest peak at 14 d.OCN was significantly expressed in ABSC at 14 and 21 d,and was higher in BMSC.Conclusion The osteogenic abilities of ABSC are similar to that of BMSC,which is an ideal seed cell in the research of bone tissue engineering.
bone marrow mesenchymal stromal cells;alveolar bone-derived stem cells;osteogenic differentiation
R 78.02
A
1000-1492(2016)09-1252-06
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.010.html
2016-06-03接收
国家自然科学基金(编号:31370983)
1安徽医科大学口腔医学院、2安徽医科大学附属口腔医
院、3安徽省口腔疾病研究中心实验室,合肥 230032作者简介:郑文龙,男,硕士研究生;
陈乔尔,男,教授,硕士生导师,责任作者,E-mail:chqe0111 @163.com

