miR-210诱导犬BMSCs成血管及成骨向分化的体外实验研究
王默涵,邹多宏,周 咏,吴轶群,朱艳秋,何家才
miR-210诱导犬BMSCs成血管及成骨向分化的体外实验研究
王默涵1,邹多宏1,周 咏1,吴轶群2,朱艳秋1,何家才1
目的 体外检测miR-210基因诱导犬骨髓间充质干细胞(BMSCs)成骨和成血管方向分化的作用,探讨目的基因双重调控作用。方法 构建慢病毒载体Lenti-miR-210和Lenti-LacZ,并分别用Lenti-LacZ和Lenti-miR-210转染 BMSCs。分别在目的基因转染 BMSCs的第0、1、4、7、14、21天提取mRNA和蛋白,利用RT-PCR和Western blot检测关键性成血管和成骨因子[血管内皮生长因子(VEGF)和核心结合因子2(Runx2)]的表达。同时在目的基因转染的第21天通过碱性磷酸酶(ALP)和钙结节茜素红染色观察体外骨形成的情况。结果 慢病毒载体Lenti-miR-210和Lenti-LacZ能够成功转入BMSCs中,并在目的基因转染后,miR-210能够显著上调BMSCs关键性成骨和成血管因子VEGF和Runx2的表达(P<0.05);碱性磷酸酶和茜素红染色显示,相对于BMSCs组和Lenti-LacZ组,Lenti-miR-210组能够明显促进BMSCs的成骨向分化。结论 miR-210可以显著促进BMSCs向成骨和成血管方向分化,这为将来的体内实验奠定了基础。
miR-210;骨髓间充质干细胞;基因转染;血管生成;骨形成
目前临床上骨缺损的修复重建仍然面临挑战。除了自体骨移植,再生医学或组织工程骨的研究和临床应用也日益受到关注。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是再生医学或骨组织工程常用的种子细胞,其具有自我更新和多向分化的潜能。在骨的发育及再生中,血管生成与骨形成密不可分,并以耦合的形式存在[1]。组织工程骨的研究中,功能性血管网的建立是骨形成的关键因素[2]。因此,探索具有双重调控作用的生长因子已经成为骨组织工程研究领域的热点和难点。微小RNA(microRNAs,miRNAs)是由20~22个核苷酸组成的单链RNA,在细胞的基因调控中具有重要作用[3],研究[4-5]显示miRNAs在血管再生和骨修复过程中发挥重要作用,动物实验[5]表明miR-210有促进血管生成、抑制细胞凋亡的作用,而且其可通过抑制转化生长因子-β(TGF-β)/activin信号通路促进成骨细胞的分化。基于此,该研究运用基因转染技术,探讨miR-210诱导BMSCs成骨及成血管方向分化的双重调控作用。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取健康36周龄雄性拉布拉多犬(约15 kg),由安徽医科大学实验动物中心提供,在整个实验过程中对动物的处置均符合医学伦理学标准。
1.1.2 慢病毒载体的构建 慢病毒载体Lenti-LacZ 和Lenti-miR-210的构建由和元生物技术(上海)有限公司构建、鉴定和提供,病毒滴度为2.33×109TU/ml。病毒包装完成后,收集病毒原液,超速离心机浓缩,并进行病毒滴度测定,感染复数(multiplicity of infection,MOI)=加入病毒总数/细胞总数,本研究预实验分别采取MOI值为1、2、4、6、8、10、12、14、16、18、20、22转染细胞,病毒转染4~7 d后倒置荧光显微镜下观察细胞形态及绿色荧光蛋白(green fluorescent protein,GFP)表达情况,确定最佳MOI值。
1.1.3 主要试剂和仪器 DMEM培养基、胰蛋白酶、TRIzol RNA抽提试剂盒(Gibco公司,美国);胎牛血清(FBS)(浙江天杭生物科技有限公司,浙江);逆转录试剂盒、实时荧光定量PCR试剂盒(TaKaRa公司,日本);成骨及成血管因子[核心结合因子2 (Runt-related transcription factor 2,Runx2)和血管内皮生长因子(vascular endothelial growth factor,VEGF)]抗体(Abcam公司,英国);碱性磷酸酶(alkaline phosphatase,ALP)检测试剂盒、RIPA裂解液、蛋白浓度测定试剂盒(碧云天生物技术有限公司,上海);慢病毒载体 (和元生物有限公司,上海);茜素红(Sigma公司,美国);PVDF膜(Invitrogen公司,美国);Runx2和VEGF PCR引物[生工生物工程(上海)股份有限公司,上海]。
1.2 方法
1.2.1 犬BMSCs体外培养 用3%戊巴比妥钠(1 ml/kg)对拉布拉多犬进行静脉注射麻醉,一侧髂骨部位剃毛、消毒、铺巾。在无菌条件下抽取犬髂骨骨髓约5 ml,完全培养基(含10%FBS、100 U/ml青霉素、100 μg/ml链霉素的培养基)制成单细胞悬液,接种至培养皿中进行原代培养,待细胞融合达80% ~90%时,用0.25%胰蛋白酶消化传代,取生长状态良好的第2代细胞用于后续实验。
1.2.2 流式细胞术检测BMSCs表面标志物 收集第2代对数生长期细胞制成细胞悬液,调整细胞浓度为3×106个/ml分别加入CD34-PE、CD44-FITC、CD45-FITC、CD90-APC单克隆抗体各2 μl,室温避光孵育1 h,PBS洗2次,加入500 μl PBS重悬细胞,行流式细胞术分析。
1.2.3 犬BMSCs的转染和实验分组 根据预实验结果,当MOI=10时,转染效率最高,且BMSCs仍然保持增殖状态,说明该转染滴度对BMSCs扩增状态影响很小;实验分组为BMSCs组、Lenti-LacZ组和Lenti-miR-210组。取对数生长期的细胞按照每孔2 ×105个细胞接种于6孔板中,根据MOI值计算所需要的病毒量加入病毒浓缩液及总浓度为8 μg/ml的聚凝胺。12 h后对细胞进行换液,加入完全培养液,观察细胞形态及生长情况,并在转染后的第3~7天运用倒置荧光显微镜观察绿色荧光蛋白表达情况,确定病毒转染效率。
1.2.4 ALP和茜素红钙结节表达的检测 将状态良好的BMSCs按照每孔2×105个细胞接种于6孔板中,病毒转染及分组同1.2.3,完全培养基培养3周,PBS冲洗2次,每次3 min,4%多聚甲醛固定20 min后,PBS冲洗2次,每次3 min,在各自的6孔板中分别加入ALP显色试剂和2%茜素红染液染色40 min,双蒸水冲洗2次,扫描仪下扫描后置于倒置显微镜下观察钙结节形成情况,检测BMSCs向成骨细胞的分化。
1.2.5 RT-PCR测定成骨和成血管相关基因mRNA的表达 将状态良好的BMSCs按照每孔2×105个细胞接种于6孔板中,病毒转染同1.2.3,分别于转染后的第0、1、4、7、14、21天采用TRIzol法提取总RNA,逆转录成cDNA,并进行PCR扩增。为矫正标本RNA质量及逆转录效率的差异,将标本检测所得的CT值与相应的GAPDH基因CT值相减,进行标准化,实验重复3次。
1.2.6 Western blot检测成血管和成骨相关蛋白的表达 将状态良好的BMSCs按照每孔2×105个细胞接种于6孔板中,病毒转染同1.2.3,Western blot检测成血管和成骨相关蛋白的表达。具体方法:①分别于转染后第0、1、4、7、14、21天收集细胞,RIPA蛋白裂解液提取蛋白;②BCA法测定蛋白浓度后计算含有20~60 μg蛋白的溶液体积,每个样本以30 μg上样进行;③取出上样样品至200 μl EP管中,加入4×LDS上样缓冲液使终浓度为1×LDS,然后将样品置于95℃中水浴10 min,使蛋白变性;④10% SDS-聚丙烯酰氨凝胶电泳分离,常规转膜、一抗孵育、二抗行抗体杂交,ECL发光、显影、定影。
1.3 统计学处理 使用SPSS 13.0软件对数据进行t检验分析和方差分析,检测结果均以表示,P<0.05为差异有统计学意义。
2 结果
2.1 病毒转染BMSCs效率的结果 根据预实验结果,目的基因转染5 d后,基因转染效率达到最高,当MOI=10 pfu/细胞时,转染效率最高,且细胞形态为梭形,旋涡状生长,细胞仍维持增殖状态,表明该转染滴度对细胞的扩增影响很小。基因转染5 d后,荧光显微镜下观察其转染效率达90%以上。见图1。
2.2 流式细胞术对BMSCs表面标志物的鉴定结果
流式细胞术分析显示,BMSCs表面抗原CD44、CD90高度表达,阳性表达分别为97.2%和99.7%,造血干细胞表面抗原CD34和CD45表达阴性,阳性表达分别为0.288%和0.074%。见图2。
2.3 miR-210对成骨细胞分泌ALP和成骨细胞矿化功能的影响 转染后21 d,可见培养的BMSCs聚集生长,ALP染色Lenti-miR-210/BMSCs组可见较多的阳性表达,而BMSCs组和Lenti-LacZ/BMSCs组很少表达(图3A)。茜素红染色显示,在聚集生长中心可见点状染色阳性的钙化结节,细胞周围钙盐被染成橘红色。BMSCs组和Lenti-LacZ/BMSCs组仅有较少的钙结节形成,而Lenti-miR-210/BMSCs组可见较多细胞聚集形成结节(图3B)。

图1 目的基因转染结果 ×100
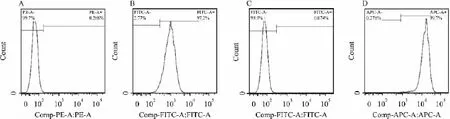
图2 犬BMSCs表面标志物阳性表达情况

图3 犬BMSCs培养21 d后ALP和茜素红钙结节染色观察
2.4 miR-210介导的BMSCs成血管及成骨相关因子mRNA的表达 RT-PCR结果显示,BMSCs组VEGF和Runx2 mRNA维持低水平少量表达,LentimiR-210/BMSCs组自目的基因转染后的第4天开始,VEGF和Runx2 mRNA表达显著增高,监测至第21天仍维持较高水平,与蛋白表达趋势几乎一致。转染后第4、7、14、21天,BMSCs组VEGF和Runx2 mRNA表达均低于 Lenti-miR-210/BMSCs组(P<0.05)。见图4。
2.5 miR-210介导的BMSCs成血管和成骨等标志分子检测 目的基因转染后的第4天VEGF蛋白过表达,随着时间延长,蛋白表达持续升高,BMSCs组的VEGF蛋白表达水平和Lenti-miR-210/BMSCs组相比有明显差异;Runx2蛋白在目的基因转染后,基因表达趋势几乎与VEGF蛋白表达一致。见图5。
3 讨论
本研究显示miR-210有促进BMSCs骨向和血管向分化的作用,该因子具有双重调控功能。因为在骨发育和再生过程中,血管生成与骨形成以耦合的形式存在,密不可分,所以在骨组织工程研究中,血管化问题的重要性日益彰显。当组织工程骨的厚度超过100~200 μm时,在体内构建能为细胞提供氧、营养及去除代谢废物的功能性血管会面临重大挑战[1]。因此,目前血管再生已被认为是骨组织工程继种子细胞、支架材料、细胞因子3大要素之后的第4大要素。
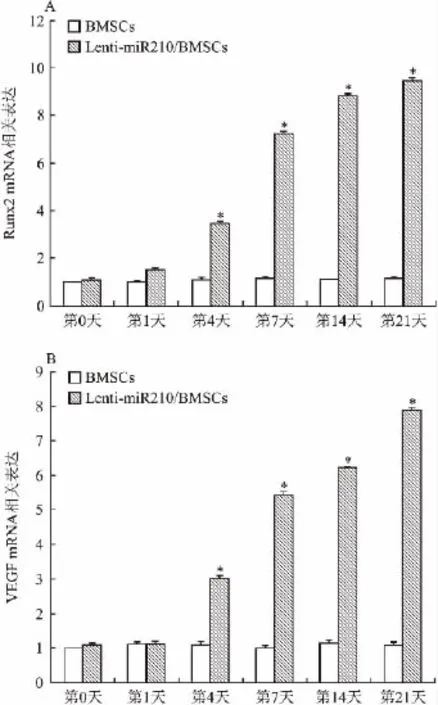
图4 RT-PCR检测目的基因转染BMSCs后成血管及成骨相关因子的表达
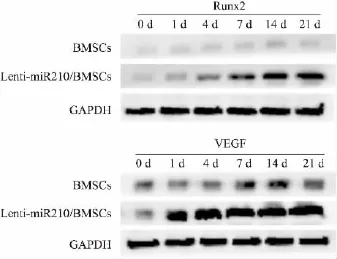
图5 Western blot检测相关蛋白表达
研究[6-7]表明miRNAs参与了细胞的凋亡、增殖、衰老、自噬及分化等过程,且能够通过上调或下调这些过程来调节细胞的生物学功能。miRNAs在血管发生及形成中起着关键作用。miR-210在细胞低氧时高表达,是低氧诱导因子1α(HIF-1α)的下游靶基因,HIF-1α驱动着miR-210的过表达和细胞过程(细胞周期调节、线粒体功能、凋亡和血管生成等)[8]。而且HIF-1α可以诱导VEGF的高表达,VEGF促进新血管形成后,新生血管为骨缺损区输送大量与骨形成相关的生长因子,生长因子成熟后可以演变为新骨[9-10]。研究[11-12]表明,在组织缺血时,miR-210对调控内皮细胞血管化有决定性作用;且miR-210过表达后,其通过抑制TGF-β/activin信号通路传导促进成骨细胞的分化[5]。因此,探索miR-210的双重调控作用(成骨和成血管)具有可靠的理论基础,该假说被本研究所证实。
由于慢病毒载体能高效的整合至靶细胞中长期稳定表达,且慢病毒载体不会产生特异性细胞反应[13],而在预实验的结果中表明,慢病毒的转染对细胞的增殖不会产生显著影响,因此,本研究利用慢病毒构建miR-210过表达载体,当MOI=10 pfu/时,转染效率最高,且细胞仍维持增殖状态,表明该转染滴度对细胞的扩增影响较小。流式细胞术检测结果表明本实验所用的BMSCs符合成体干细胞的特性(BMSCs表面标志物显示,间充质干细胞表面抗原的CD44和CD90表达为高度阳性,分别为97.2%和99.7%;造血干细胞表面抗原的CD34、CD45为高度阴性,分别为0.288%和0.074%)[14-15]。这为体内外细胞及动物实验提供了可靠的种子细胞来源。
RT-PCR和Western blot检测结果显示,目的基因转染BMSCs后的第4天,Lenti-miR-210/BMSCs组的Runx2和VEGF标志性成骨和成血管因子出现过表达,持续到第21天。相比BMSCs组及Lenti-LacZ组,目的基因组的成骨和成血管因子的过表达差异有统计学意义,说明外源性miR-210有促进BMSCs血管及骨向分化的双重调控作用。ALP是骨形成的功能性酶,是成骨细胞分化早期标志,并在成骨细胞的钙盐沉积中起关键作用[16]。为了进一步验证上述结果,在目的基因转染BMSCs的第21天,利用ALP和茜素红染色。结果显示,Lenti-miR-210/BMSCs在培养第21天时,ALP和茜素红染色及钙结节表达明显高于其它两组(BMSCs组和Lenti-LacZ/BMSCs组)。表明Lenti-miR-210能够促进BMSCs合成和分泌较多的成骨特异性蛋白及基质。本实验结果进一步证实我们的假说。
[1] Riddle R C,Khatri R,Schipani E,et al.Role of hypoxia-inducible factor-1α in angiogenic-osteogenic coupling[J].J Mol Med,2009,87(6):583-90.
[2] Zou D,Zhang Z,He J,et al.Blood vessel formation in the tissueengineered bone with the constitutively active form of HIF-1α mediated BMSCs[J].Biomaterials,2012,33(7):2097-108.
[3] van Rooij E,Olson E N.MicroRNA therapeutics for cardiovascular disease:opportunities and obstacles[J].Nat Rev Drug Discov,2012,11(11):860-72.
[4] Patella F,Rainaldi G.MicroRNAs mediate metabolic stresses and angiogenesis[J].Cell Mol Life Sci,2012,69(7):1049-65.
[5] Mizuno Y,Tokuzawa Y,Ninomiya Y,et al.miR-210 promotes osteoblastic differentiation through inhibition of AcvR1b[J].FEBS Lett,2009,583(13):2263-8.
[6] Liu K,Huang J,Xie M,et al.MIR34A regulates autophagy and apoptosis by targeting HMGB1 in the retinoblastoma cell[J].Autophagy,2014,10(3):442-52.
[7] Zhang F,Cui J,Liu X,et al.Roles of microRNA-34a targeting SIRT1 in mesenchymal stem cells[J].Stem Cell Res Ther,2015,6(1):1-13.
[8] Dang K,Myers K A.The Role of hypoxia-induced miR-210 in cancer progression[J].Int J Mol Sci,2015,16(3):6353-72.
[9] Voellenkle C,van Rooij J,Guffanti A,et al.Deep-sequencing of endothelial cells exposed to hypoxia reveals the complexity of known and novel microRNAs[J].Rna,2012,18(3):472-84.
[10]Zou D,He J,Zhang K,et al.The bone-forming effects of HIF-1alpha-transduced BMSCs promote osseointegration with dental implant in canine mandible[J].PLoS One,2012,7(3):e32355.
[11]Lou Y L,Guo F,Liu F,et al.miR-210 activates notch signaling pathway in angiogenesis induced by cerebral ischemia[J].Mol Cell Biochem,2012,370(1-2):45-51.
[12]Alaiti M A,Ishikawa M,Masuda H,et al.Up-regulation of miR-210 by vascular endothelial growth factor in exvivo expanded CD34+cells enhances cell-mediated angiogenesis[J].J Cell Mol Med,2012,16(10):2413-21.
[13]D'Costa J,Mansfield S G,Humeau L M.Lentiviral vectors in clinical trials:Current status[J].Curr Opin Mol Ther,2009,11 (5):554-64.
[14]Mödder U I,Roforth M M,Nicks K M,et al.Characterization of mesenchymal progenitor cells isolated from human bone marrow by negative selection[J].Bone,2012,50(3):804-10.
[15]Martins A A,Paiva A,Morgado J M,et al.Quantification and immunophenotypic characterization of bone marrow and umbilical cord blood mesenchymal stem cells by multicolor flow cytometry [C].Transplant Proc,2009,41(3):943-6.
[16]宁寅宽,李 强,蔡伟良,等.绿色荧光蛋白标记兔BMSCs体外成骨的定量能谱分析[J].安徽医科大学学报,2015,50 (4):415-8.
miR-210 gene in promoting the formation of bone and blood vessel by canine BMSCs in vitro
Wang Mohan,Zou Duohong,Zhou Yong,et al
(Stomatologic College of Anhui Medical University,The Affiliated Stomatological Hospital
of Anhui Medical University,Key Lab of Oral Diseases Research of Anhui Province,Hefei 230032)
Objective To explore the function of miR-210 gene in promoting the differentiation of BMSCs into bone and blood vessels in vitro.Methods The lentiviral vector carrying miR-210 or green fluorescent protein(GFP)gene (Lenti-miR-210 or Lenti-LacZ)was constructed and then transduced into the canine BMSCs.After transduced with targeted gene,expressions of relative osteogenic and angiogenic factors were detected by RT-PCR and Western blot on day 0,1,4,7,14 and 21.Alkaline phosphatase(ALP)and calcium nodules were detected by ALP staining and alizarin red staining(ARS)on day 21 of transduction.Results The BMSCs were successfully tranduced with miR-210 and GFP recombinant lentiviral vectors.After the targeted gene was transduced,expressions of VEGF and Runx2 at the mRNA and protein levels were significantly increased(P<0.05).Results of ALP and ARS staining showed that the targeted gene could induce the osteogenic differentiation of BMSCs more than Lenti-LacZ and BMSCs.Conclusion The miR-210 gene could promote the overexpressions of osteogenic and angiogenic factors,which could lay a foundation for the relative study in vivo in the future.
miR-210;bone marrow mesenchymal stem cells;gene transduction;osteogenesis differentiation;angiogenesis differentiation
Q 7;R 34
A
1000-1492(2016)09-1258-05
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.012.html
2016-04-14接收
国家自然科学基金(编号:31370983、81371114、81371190);安 徽 省 自 然 科 学 基 金 (编 号:1408085MKL29);安徽省杰出青年科学基金(编号:1508085J08);高校优秀青年人才支持计划重点项目(编号:gxyqZD2016058);安徽医科大学“青年拔尖人才支持计划”
1安徽医科大学口腔医学院,安徽医科大学附属口腔医院,安徽省口腔疾病研究中心实验室,合肥 2300322上海交通大学医学院附属第九人民医院口腔种植科,上海 200011
王默涵,男,硕士研究生;何家才,男,教授,主任医师,博士生导师,责任作者,E-mail:hejiacai@163.com

