褪黑素对大鼠肝纤维化的保护作用及其对TGF-β1表达的影响
汪玉荣,洪汝涛,谢园园
褪黑素对大鼠肝纤维化的保护作用及其对TGF-β1表达的影响
汪玉荣,洪汝涛,谢园园
目的 探讨褪黑素对大鼠肝纤维的保护作用及其对转化生长因子β1(TGF-β1)表达的影响。方法 选择60只雄性SD大鼠,随机分为正常组、模型组、褪黑素低剂量组及褪黑素高剂量组,每组15只。采用连续6周皮下注射CCl4方法制备肝纤维化大鼠模型。生化法测定大鼠血清谷丙转氨酶(ALT)、谷草转氨酶(AST)活性及白蛋白(ALB)含量。分光光度计法测定肝组织羟脯氨酸(Hyp)含量;HE染色及Van Gieson(VG)染色方法评价肝脏病理改变;免疫组化法测定肝组织中TGF-β1的表达。结果 与模型组相比,褪黑素处理组大鼠血清ALT、AST活性明显降低(P<0.01),褪黑素高剂量组大鼠血清ALB含量明显升高(P<0.05);褪黑素处理组大鼠肝组织Hyp含量较模型组明显降低(P<0.01);褪黑素高剂量组大鼠纤维病理评分明显低于模型组(P<0.05);TGF-β1在褪黑素处理组大鼠肝脏中的表达较模型组明显较少(P<0.01)。结论 褪黑素对大鼠肝纤维化有保护作用,其可能的作用机制为抑制TGF-β1的表达。
褪黑素;肝纤维化;转化生长因子β1
肝纤维化为慢性肝病的共同病理特征,最终可发展为肝硬化甚至原发性肝癌,严重威胁人类健康。研究[1]证明肝纤维化为一动态过程,可逆转。但是目前临床尚无治疗肝纤维化很有效的药物。褪黑素作为松果腺体分泌的一种重要激素,对肝纤维化具有保护作用,且机制与其强大的抗氧化作用有关[2]。但是褪黑素抗纤维化的作用机制尚不完全清楚。转化生长因子β1(transforming growth factor β1,TGF-β1)作为肝纤维化氧化应激过程产生的重要细胞因子,在肝纤维化的发生发展中起着重要作用,抑制TGF-β1的表达可改善肝纤维化[3]。该研究探讨褪黑素对CCl4致大鼠肝纤维化的保护作用及其对TGF-β1表达的影响。
1 材料与方法
1.1 实验动物 60只普通级SD雄性大鼠,180~220 g,购自安徽医科大学实验动物中心,标准环境适应性饲养1周,提供正常饮食。
1.2 主要试剂及仪器 褪黑素购于美国Sigma公司,溶解于酒精及0.9%生理盐水中(酒精含量≤1%);CCl4购于国药集团化学试剂合肥有限公司;Van Gieson(VG)染色试剂盒购于珠海贝索生物技术有限公司;组织蛋白及羟脯氨酸(hydroxyproline,Hyp)测定试剂盒购于南京建成生物工程研究所;兔多克隆抗体TGF-β1抗体购于美国Santa Cruz公司;山羊抗兔二抗试剂盒及DAB试剂盒购于北京中杉金桥生物技术有限公司;瑞士Roche Modular DPP全自动生化分析仪购于瑞士罗氏公司;752 N分光光度计购于上海绿宇生物科技有限公司;光学显微镜及倒置显微镜购于日本Olympus公司。
1.3 动物处理 SD大鼠被随机分为正常组、模型组、褪黑素低剂量组及褪黑素高剂量组,每组15只。将CCl4与精制花生油以2∶3的体积比制成40% CCl4。模型组及褪黑素处理组给予40%CCl43 ml/ kg,正常组给予等体积花生油,皮下注射,每周2次,连续6周。自皮下注射CCl4之日起,腹腔注射褪黑素:褪黑素低剂量组5.0 mg/kg,褪黑素高剂量组10.0 mg/kg,正常组及模型组给予等体积1%乙醇溶液(乙醇+生理盐水),每天1次,连续6周。每周称大鼠体重1次,根据体重调整用药剂量。6周末,所有动物禁食12 h后以10%水合氯醛麻醉处死,腹主动脉取血,4℃、5 000 r/min离心15 min,收集血清标本,并取新鲜肝脏同一部位用10%中性甲醛固定,以备石蜡包埋行病理及免疫组化检查,其余肝脏组织放入液氮中备用。
1.4 血清谷丙转氨酶(ALT)、谷草转氨酶(AST)及白蛋白(ALB)含量的测定 大鼠血清ALT、AST 及ALB水平采用瑞士Roche Modular DPP全自动生化分析仪进行测定。
1.5 肝组织Hyp含量测定 精确称取新鲜肝脏组织100 mg,严格按照试剂盒说明书步骤进行操作,采用分光光度计测定吸光度值,计算大鼠肝组织Hyp的含量。采用考马斯亮蓝法测定肝组织蛋白含量。
1.6 病理学检查 取同一部位肝脏组织行10%中性甲醛固定、石蜡包埋并5 μm连续切片。按常规步骤行HE染色,按试剂盒说明书步骤行VG染色,光学显微镜下观察病理结果。按Metavir半定量评分系统[4]进行肝纤维化病理评分,0:正常肝脏;1:汇管区纤维化,无纤维间隔;2:汇管区纤维化,少量纤维间隔;3:汇管区纤维化,纤维间隔很多,无肝硬化;4:肝硬化。
1.7 免疫组化法测定肝组织中TGF-β1表达 石蜡包埋组织块,5 μm连续切片,常规脱蜡至水,0.5%~1.0%过碘酸30 s灭活内源性过氧化物酶,放入微波炉中柠檬酸盐抗原修复(1次2 min,循环5次),予以正常山羊血清行抗原封闭,加入一抗TGF-β1(1∶450),4℃孵育过夜,按试剂盒说明书步骤加二抗,加DAB镜下显色,苏木精复染、脱水、透明、封片。每批实验均以PBS液代替一抗设置阴性对照。有明显黄色/棕黄色/褐色颗粒的细胞为阳性细胞。每张切片随机选取5个不连续的视野(×400),用O-lympus倒置显微镜摄片,Image-Pro Plus 6.0图像分析系统测定光密度(optical density,OD)值,计算平均OD值作为该切片的OD值。
1.8 统计学处理 采用 SPSS 17.0进行统计学分析。计量资料以表示,单因素方差分析进行组间比较,LSD法进行两组间比较。等级资料采用Ridit检验方法进行分析。P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肝功能测定结果 模型组大鼠死亡2只,其余3组大鼠均未见死亡。与正常组比较,模型组大鼠血清ALT、AST活性明显升高,ALB含量明显降低(P<0.01);与模型组比较,褪黑素低剂量组大鼠血清ALT、AST活性明显降低(P<0.01),血清ALB含量差异无统计学意义(P>0.05),褪黑素高剂量组大鼠血清ALT、AST活性明显降低(P<0.01),ALB含量明显升高(P<0.05)。见表1。
2.2 大鼠肝组织Hyp含量测定结果 与正常组比较,模型组大鼠肝组织Hyp含量明显升高(P<0.01);与模型组比较,褪黑素低剂量组及高剂量组大鼠肝组织Hyp含量明显降低(P<0.01)。见图1。
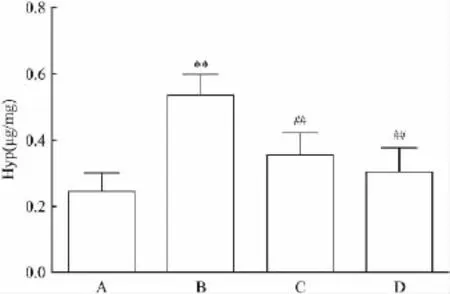
图1 各组大鼠肝组织Hyp的含量
2.3 大鼠肝脏病理检查结果 HE及VG染色结果显示:正常组大鼠肝小叶结构正常,几乎无胶原纤维沉积;模型组大鼠肝脏肝细胞肿大、脂肪变性及炎症细胞浸润明显,且肝小叶尤其汇管区胶原蛋白沉积明显,纤维间隔显著;褪黑素低剂量组及高剂量组大鼠肝小叶肝细胞脂肪变性明显,炎性细胞浸润及胶原纤维沉积程度较模型组明显减少。见图2、3。与正常组相比,模型组大鼠纤维化病理分级评分明显升高(U>2.58,P<0.01);与模型组比较,褪黑素高剂量组大鼠纤维化病理分级评分明显降低(U>1.96,P<0.05)。褪黑素低剂量组与模型组纤维化病理分级评分差异无统计学意义(U<1.96,P>0.05)。见表2。
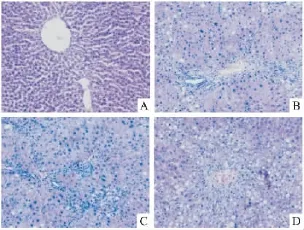
图2 各组大鼠肝脏病理HE染色 ×200
2.4 大鼠肝脏TGF-β1表达结果 TGF-β1主要表达于肝脏组织中肝星状细胞、窦内皮细胞及纤维化附近的炎症细胞胞质中。正常组大鼠肝脏组织中未见棕黄色、褐色阳性颗粒,TGF-β1几乎无
表1 褪黑素对CCl4肝纤维化大鼠肝功能的影响()
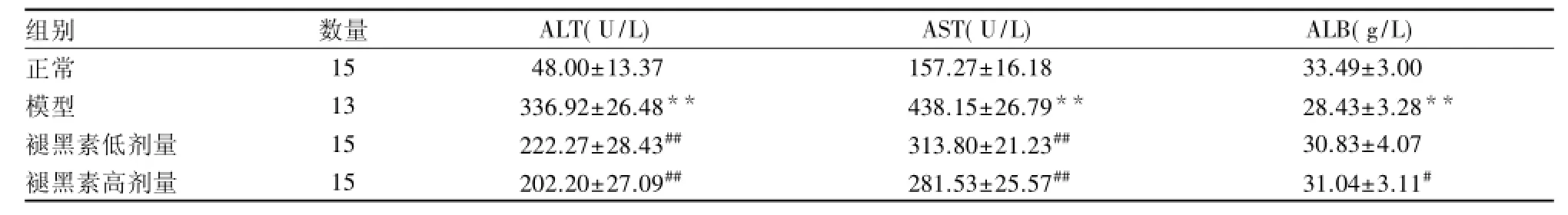
表1 褪黑素对CCl4肝纤维化大鼠肝功能的影响()
与正常组比较:**P<0.01;与模型组比较:#P<0.05,##P<0.01
组别 数量 ALT(U/L) AST(U/L) ALB(g/L)正常 15 48.00±13.37 157.27±16.18 33.49±3.00模型 13 336.92±26.48** 438.15±26.79** 28.43±3.28**褪黑素低剂量 15 222.27±28.43## 313.80±21.23## 30.83±4.07褪黑素高剂量 15 202.20±27.09## 281.53±25.57## 31.04±3.11#
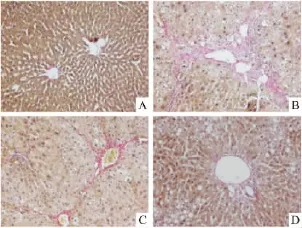
图3 各组大鼠肝脏病理VG染色 ×200
表2 褪黑素对大鼠肝组织肝纤维化病理分级评分的影响
模型组大鼠肝脏组织中可见明显的棕黄色及褐色颗粒,且主要位于汇管区纤维组织中,TGF-β1表达较正常组明显增加。褪黑素低剂量及高剂量组大鼠肝脏组织中可见棕黄色阳性颗粒,且主要位于汇管区,但是阳性颗粒较模型组明显减少,TGF-β1表达量较模型组明显减少。见图4。与正常组相比,模型组大鼠肝脏TGF-β1表达量明显增加(P<0.01);与模型组相比,褪黑素低剂量组及高剂量组大鼠肝脏TGF-β1表达量明显减少(P<0.01)。见图5。
3 讨论
肝纤维化是肝脏对各种致病因素持续或反复损伤的一种慢性修复反应,以细胞外基质及胶原纤维的过度沉积为特征[5]。Hyp主要存在于胶原蛋白中,其他蛋白中含量极少或不存在,故其含量的测定可用于反映纤维化严重程度[6]。本研究采用连续6周皮下注射CCl4制备大鼠肝纤维化模型。与正常组比较,模型组大鼠血清ALT、AST活性明显升高,血清ALB含量明显降低,肝组织Hyp含量明显增加,肝脏组织肝细胞变性坏死及炎症细胞浸润明显,汇管区纤维沉积及肝小叶纤维间隔明显增加,肝脏纤维化病理分级评分明显增加,说明CCl4诱导的肝纤维化模型制备成功。与模型组相比,褪黑素低剂量组及高剂量组大鼠肝功能明显改善,肝组织Hyp含量明显减少,且肝脏炎症坏死及纤维沉积程度均明显降低,可见褪黑素对CCl4诱导的大鼠肝纤维化具有明显的保护作用。
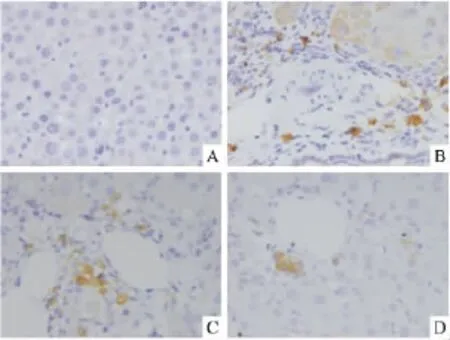
图4 各组大鼠肝组织TGF-β1表达情况 ×400
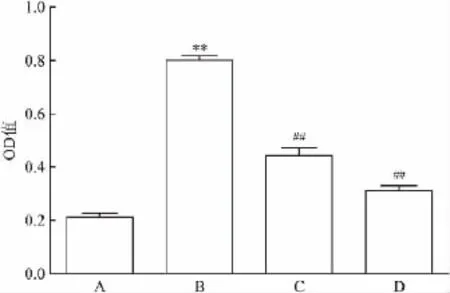
图5 各组大鼠肝组织TGF-β1的表达
褪黑素(N-乙酰-5-甲氧色氨酸)是松果腺体分泌的一种神经内分泌激素,有强大的自由基清除能力,是一种很强的抗氧化剂。褪黑素除清除自由基直接抗氧化作用外,还能提高机体抗氧化酶活性间接增强机体抗氧化功能[7]。研究[8-9]证明褪黑素能减轻多种原因导致的肝纤维化,且作用机制与抗氧化作用相关。
氧化应激促进肝纤维化发生发展过程中,大量细胞因子得以产生并释放,加速肝纤维化的发生发展,其中TGF-β1是最重要的促纤维化细胞因子[10]。TGF-β1主要通过活化肝星状细胞促进肝纤维化的形成:肝脏接受各种病理刺激时,肝内库普弗细胞、窦内皮细胞及血小板释放TGF-β1,激活静止状态的肝星状细胞,活化的肝星状细胞释放更多的TGF-β1并进一步促进自身的增殖及活化,活化的肝星状细胞合成大量的细胞外基质并沉积于肝脏内。TGF-β1除直接激活肝星状细胞合成细胞外基质外,其还能通过抑制组织金属蛋白酶并促进组织金属蛋白酶抑制剂而减少细胞外基质的降解,从而间接促进肝纤维化[11]。研究[12-13]表明减少 TGF-β1表达可抑制肝纤维化的发生发展。目前未见有关褪黑素对纤维化肝脏TGF-β1表达影响的报道。故本研究探讨褪黑素对肝纤维化大鼠的保护作用及其对TGF-β1表达的影响。
免疫组化方法结果显示:TGF-β1在正常组大鼠肝脏组织中几乎无表达;模型组大鼠肝脏组织TGF-β1表达量明显增加;褪黑素低剂量及高剂量组大鼠肝脏组织TGF-β1表达量明显低于模型组。结果说明褪黑素对CCl4诱导的肝纤维化大鼠肝脏TGF-β1的表达具有抑制作用。褪黑素对TGF-β1的抑制作用与其保护肝纤维化作用相一致,故考虑褪黑素抗纤维化作用机制可能与抑制肝脏TGF-β1的表达相关。
[1] Pellicoro A,Ramachandran P,Iredale J P.Reversibility of liver fibrosis[J].Fibrogenesis Tissue Repair,2012,5(Suppl 1):S26.
[2] Czechowska G,Celinski K,Korolczuk A,et al.Protective effects of melatonin against thioacetamide-induced liver fibrosis in rats [J].J Physiol Pharmacol,2015,66(4):567-79.
[3] Yao Q Y,Xu B L,Wang J Y,et al.Inhibition by curcumin of multiple sites of the transforming growth factor-beta1 signalling pathway ameliorates the progression of liver fibrosis induced by carbon tetrachloride in rats[J].BMC Complement Altern Med,2012,12:156.
[4] 洪汝涛,许建明,沈继龙,等.褪黑素对大鼠肝纤维化的影响及部分机制研究[J].中国药理学通报,2012,28(8):1141-5.
[5] 毛忠懿,吴雄健,陶立刚.ILK和TGF-β1在实验性大鼠肝纤维化中的表达和意义[J].安徽医药,2014,18(9):1630-3.
[6] Liu S Q,Yu J P,Chen H L,et al.Therapeutic effects and molecular mechanisms of Ginkgo biloba extract on liver fibrosis in rats [J].Am J Chin Med,2006,34(1):99-114.
[7] Tomás-Zapico C,Coto-Montes A.Melatonin as antioxidant under pathologicalprocesses[J].Recent Pat Endocr Metab Immune Drug Discov,2007,1(1):63-82.
[8] Wang H,Wei W,Wang N P,et al.Melatonin ameliorates carbon tetrachloride-induced hepatic fibrogenesis in rats via inhibition of oxidative stress[J].Life Sci,2005,77(15):1902-15.
[9] Tahan G,Akin H,Aydogan F,et al.Melatonin ameliorates liver fibrosis induced by bile-duct ligation in rats[J].Can J Surg,2010,53(5):313-8.
[10]吴雄健,毛忠懿.TGF-β1-Smad3-ILK信号转导通路与大鼠肝纤维化的相关性研究[J].中国当代医药,2013,20(36):14-21.
[11]田 甜,马国珍,廖志峰,等.TGF-β1、PDGF、CTGF与肝纤维化发病机制的相关性研究进展[J].甘肃医药,2014,33 (10):740-2.
[12]Chen B L,Peng J,Li Q F,et al.Exogenous bone morphogenetic protein-7reduces hepatic fibrosis in schistosoma japonicum-infected mice via transforming growth factor-β/Smad signaling[J].World J Gastroenterol,2013,19(9):1405-15.
[13]Lee J H,Eun J J,Hye L S,et al.Sauchinone attenuates liver fibrosis and hepatic stellate cell activation through TGF-β/Smad signaling pathway[J].Chem Biol Interact,2014,224:58-67.
Protective effects of melatonin on hepatic fibrosis in rats and its inhibitory effects on TGF-β1
Wang Yurong,Hong Rutao,Xie Yuanyuan
(Dept of Gastroenterology,The First Affiliated Hospital of Anhui Medical University,
Key Laboratory of Disease of Anhui Province,Hefei 230022)
Objective To investigate the protective effects of melatonin on hepaticfibrosis in rats and its effects on the expression of transforming growth factor β1(TGF-β1)in liver.Methods 60 male SD rats were divided randomly into the normal group,the model group and melatonin-treated groups(5.0 mg/kg,10.0 mg/kg;n=15respectively).The model of liver fibrosis was induced by carbon tetrachloride(CCl4)subcutaneously for 6 weeks continuously.The serum activities of aspartate aminotransferase(AST),alanine aminotransferase(ALT)and the levels of albumin(ALB)were detected by an autoanalyzer.The levels of hydroxyproline(Hyp)in liver were measured by spectrophotometry.Changes in liver pathology were examined by hematoxylin and eosin(HE)staining and Van Gieson(VG)staining.The expression of TGF-β1 in liver tissue was evaluated by immunohistochemistry.Results Compared with the model group,serumactivities of ALT and AST were decreased significantly in melatonintreated groups(P<0.01).The levels of serum ALB were increased significantly in melatonin-treated group(10.0 mg/kg)compared with the model group(P<0.05).In comparison with the model group,the levels of Hyp in liver were decreased significantly in melatonin-treated groups(P<0.01).Pathologic grading score of melatonin-treated group(10.0 mg/kg)was much lower than that of the model group(P<0.05).The expression of TGF-β1 in liver was decreased remarkably in melatonin-treated groups compared with the model group(P<0.01).Conclusion Melatonin protects liver fibrosis,one mechanism of which may be related to the inhibition of TGF-β1 expression in liver.
melatonin;liver fibrosis;transforming growth factor β1
R 575.2
A
1000-1492(2016)09-1248-05
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.008.html
2016-04-16接收
安徽高校省级科学研究项目(编号:KJ2013A155)
安徽医科大学第一附属医院消化内科,安徽省消化疾病重点实验室,合肥 230032
汪玉荣,女,硕士研究生;洪汝涛,男,主任医师,副教授,硕士生导师,责任作者,E-mail:hongrutao@163.com

