拉布拉多犬骨髓基质干细胞与牙周干膜细胞裸鼠皮下成骨能力的比较性研究
徐孟丹,周 咏,邹多宏
拉布拉多犬骨髓基质干细胞与牙周干膜细胞裸鼠皮下成骨能力的比较性研究
徐孟丹,周 咏,邹多宏
目的 观察比较拉布拉多犬骨髓基质干细胞(BMSCs)和拉布拉多犬牙周膜干细胞(PDLSCs)分别与支架材料β-磷酸三钙(β-TCP)复合后成骨能力的差异。方法 实验分为 3组:β-TCP组、犬 BMSCs/β-TCP复合体组、犬PDLSCs/β-TCP复合体组。体外培养犬 BMSCs和犬PDLSCs,扩增后取第3代细胞分别接种于厚2 mm、ø 6 mm的圆柱形β-TCP材料上,扫描电镜观察细胞与材料的黏附情况。裸鼠皮下植入各组细胞材料复合物。8周后取材,HE染色观察新骨形成,免疫组化检测成骨相关基因蛋白的表达。结果 扫描电镜结果可见犬BMSCs和犬PDLSCs均可在β-TCP支架材料上正常生长。裸鼠皮下实验中,犬BMSCs/β-TCP复合体组和犬PDLSCs/β-TCP复合体组都有骨样组织形成,犬BMSCs/β-TCP复合体组中骨钙素(OCN)和骨形态发生蛋白(BMP-2)表达量略高于犬PDLSCs/β-TCP复合体组。结论 两种细胞经体外诱导后都具有一定的成骨性能,其中BMSCs的成骨能力较PDLSCs的成骨能力强。
骨髓基质干细胞;牙周膜干细胞;β-磷酸三钙;裸鼠;异位成骨
外伤、肿瘤术后等原因可以造成口腔颌面部骨组织缺损,影响正常的美观和功能恢复。目前,自体骨移植是治疗骨缺损的“金标准”[1],但是存在来源有限、供区损伤和疼痛等缺点;异体骨移植也广泛应用于骨缺损的治疗,但免疫排斥反应和致病性等使其无法成为理想的修复手段[2]。近年来,通过骨组织工程技术复合骨诱导因子,再选取种子细胞及生物相容性良好的可降解性的支架材料治疗骨缺损成为研究的热点。骨髓基质干细胞(bone marrow stromal cells,BMSCs)来源充足,扩增迅速,具有多项分化潜能,被多数研究者认为是骨组织工程较合适的种子细胞之一。研究[3]表明BMSCs具有良好的成骨能力。但是,BMSCs的获取具有一定的风险和创伤性。牙周膜干细胞 (periodontal ligament stem cells,PDLSCs)易于获得,无额外的创伤,患者也很容易接受。研究[4-5]表明PDLSCs具有分化成牙槽骨细胞、牙周膜细胞和成牙骨质细胞的潜能,在生理条件下处于静息状态,参与维持牙周组织中细胞增殖与凋亡的平衡以及细胞功能稳态。近年来随着对其生物学研究的不断深入,基于PDLSCs的现代组织工程,细胞治疗和基因工程技术成为骨组织再生的新希望。该研究将拉布拉多犬BMSCs及PDLSCs分别与支架材料β-磷酸三钙(β-phosphate scaffold tricalcium,β-TCP)复合并植入裸鼠皮下,比较PDLSCs与BMSCs皮下成骨能力的差异。
1 材料与方法
1.1 主要材料
1.1.1 实验动物 2只拉布拉多犬,36周龄,约15 kg,购自上海新冈实验动物场饲养于安徽医科大学实验动物中心;6只BALB/c裸鼠,4周龄,18~20 g,购自上海斯莱克实验动物有限责任公司,饲养于中国科学技术大学实验动物中心。
1.1.2 主要试剂和仪器 DMEM培养基、β甘油磷酸钠、地塞米松、维生素C、戊巴比妥钠(美国Sigma公司);胰蛋白酶(美国Amresco公司);β-TCP(上海贝奥路生物材料有限公司);CO2恒温孵箱(美国Thermo Forma公司);s-3400扫描电镜(美国QUESTAR公司);骨钙素(osteocalcin,OCN)抗体、骨形态发生蛋白(bone morphogenetic protein 2,BMP-2)抗体(美国Abcam公司);羊抗兔二抗(北京中杉金桥生物技术有限公司);正置显微镜(德国Leica公司)。
1.2 方法
1.2.1 犬BMSCs的原代培养、扩增及成骨诱导 取成年拉布拉多犬,静脉注射3%的戊巴比妥钠(使用剂量为30~35 mg/kg),麻醉起效后,局部备皮消毒,使用骨髓穿刺针于髂后上棘穿刺抽取骨髓约10 ml,离心,弃上清液,接种于培养皿,加入含10%胎牛血清的DMEM培养基约10 ml,CO2恒温恒湿孵育箱内培养,细胞融合至80%时传代。取生长状态良好的第3代细胞,加入成骨诱导液(100 nmol/L地塞米松、0.05 mmol/L维生素C、10 mmol/L β甘油磷酸钠)培养7 d,每3 d更换培养液。
1.2.2 犬PDLSCs的原代培养、扩增及成骨诱导取成年拉布拉多犬,静脉注射3%的戊巴比妥钠(使用剂量为30~35 mg/kg),麻醉起效后,口内碘伏消毒后,无菌条件下拔取左下颌三颗下前牙,置入盛有无胎牛血清的DMEM培养瓶中,封瓶口后立即送往实验室。在超净工作台内用含双抗的PBS自根尖至牙冠反复冲洗,用锐利剪刀片充分刮除牙颈部牙龈组织,含双抗的PBS反复冲洗,无菌条件下用锐利手术刀片刮取牙根中部1/3的牙周膜组织,在DMEM培养液浸润下,剪成1 mm×1 mm×1 mm的碎块,以5 mm间隔均匀铺于6 cm培养皿底部,加入1 ml含10%胎牛血清、100 U/ml青霉素和100 U/ml链霉素的DMEM培养液,置于孵箱内,4 h后待组织块贴壁完全,加入3 ml上述DMEM培养液,从第4天开始,每3~5 d换液1次,7~15 d左右当细胞从组织块周围游出并达70%~80%融合时,0.25%胰酶消化传代。取生长状态良好的第3代细胞,加入成骨诱导液继续培养7 d,每3 d更换培养液。
1.2.3 种子细胞与骨架材料复合体制备 取18块厚2 mm、直径为6 mm的圆形β-TCP,高温高压消毒后浸泡在不含胎牛血清的DMEM中24 h。取诱导7 d后的第三代犬BMSCs、犬PDLSCs各3皿,消化离心弃去上清液,用3 ml的DMEM稀释混匀,计数,并稀释成1×107个/ml浓度的细胞悬液,滴加在 β-TCP材料中,置于孵箱内培养3 d。
1.2.4 扫描电镜观察 取出体外培养3 d的犬BMSCs/β-TCP、犬PDLSCs/β-TCP复合物,弃培养液,PBS冲洗3次,加入2.5%戊二醛,4℃固定30 min,PBS洗3次,乙醇系列梯度脱水,临界点干燥,喷金后扫描电镜观察材料表面细胞的形态。
1.2.5 裸鼠皮下实验 实验分为单纯β-TCP对照组、犬BMSCs/β-TCP复合体组、犬PDLSCs/β-TCP复合体组。用10%水合氯醛(使用剂量为0.35 mg/ g)麻醉裸鼠后,碘伏消毒手术区,剪开其背部的皮肤,依次植入三组材料,缝合并标记。术后常规饲养,观察裸鼠背后伤口的愈合情况。植入8周后,处死裸鼠,取材,4%多聚甲醛固定后EDTA脱钙,经梯度酒精脱水,石蜡包埋切片,HE染色,免疫组化染色,光学显微镜下观察。
2 结果
2.1 种子细胞体外培养形态观察 牙周膜原代培养4 d后可见有部分细胞从组织块中爬出,成放射状分布,细胞呈长梭形。培养7 d可见有大量细胞从组织块中爬出,快速增殖。8~10 d后可进行第1次传代。BMSCs原代培养5 d后换液,待细胞融合至90%时传代,每隔2 d更换新鲜培养液。BMSCs呈长梭形。见图1。

图1BMSCs、PDLSCs体外培养 ×10
2.2 种子细胞与β-TCP结合情况观察 扫描电镜可见两种细胞均以较高的细胞密度生长于β-TCP表面及孔隙中,细胞呈长梭形或多角形层叠生长,细胞间拉伸成网状,相互交错,两组间未见明显差异,见图2。

图2 BMSCs、PDLSCs与β-TCP扫描电镜图 ×1 050
2.2 种子细胞与β-TCP复合后对成骨相关基因及蛋白表达的影响 HE染色结果显示,BMSCs/β-TCP组和PDLSCs/β-TCP组内均有明显的骨样组织形成。其中BMSCs/β-TCP组的骨样组织形成略多于PDLSCs/β-TCP组。单纯材料对照组内未见明显骨样组织形成(图3A)。免疫组织化学染色结果显示,BMSCs/β-TCP组和PDLSCs/β-TCP组内均可见OCN和BMP-2蛋白阳性表达。BMSCs/β-TCP组的OCN和BMP-2蛋白阳性表达略多于 PDLSCs/β-TCP组。单纯材料对照组内未见明显OCN和BMP-2蛋白阳性表达。
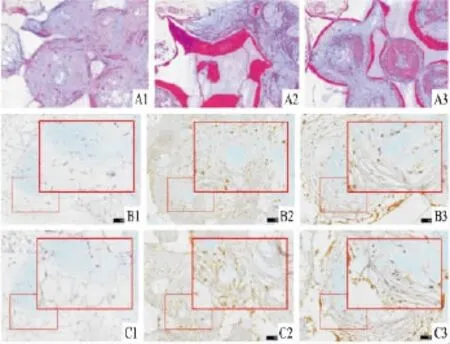
图3 种子细胞与β-TCP复合后对成骨相关基因及蛋白表达的影响
3 讨论
自体骨移植一直被认为是治疗口腔颌面部骨组织缺损和骨折的金标准。自体骨包含了多种能有效促进组织再生的基本因素:细胞、细胞外基质、生长因子。然而,自体骨移植花费较高、周期较长,可产生疼痛不适及一些并发症。除此以外,可用的自体骨组织有限,难以修复大面积的骨缺损。通过组织工程技术,植入适宜的种子细胞,为骨缺损修复提供了新的方法。
理想的种子细胞应具有以下特点:①增殖分化传代能力强、可塑性强;②植入机体后性能稳定,对受植区环境适应能力强,无免疫排斥反应;③取材简便,容易获得。成体干细胞可作为理想的种子细胞,其具有自我更新和多向分化能力。在机体需要的时候,成体干细胞可分化为所在组织的细胞,参与所在组织的代谢和结构功能的维持。在特定的诱导下,干细胞可以“横向分化”为其他组织细胞,实现其他组织的再生[6-7]。
BMSCs是目前研究较为成熟的一种成体干细胞,经过适当的体外诱导,BMSCs可以分化形成成骨细胞、软骨细胞、骨骼肌细胞、脂肪细胞等[8-10]。体内预临床研究[11]证实,BMSCs可加速长骨标准骨缺损修复。在牙科领域,利用BMSCs进行牙周组织再生及上颌窦提升也获得了良好的结果。BMSCs作为理想的组织工程种子细胞,具有优良的促进组织再生的作用。但是,获取BMSCs的过程较麻烦,也会产生疼痛不适,可获得的干细胞数目较低。牙周膜组织临床上易于获得,通过拔除牙齿就可以得到足够可用的牙周膜,并分离培养出PDLSCs。Seo et al[12]于 2004年发现 PDLSCs的存在,并证明PDLSCs可表达间充质干细胞相关标志物STRO-1、CDs、多种成牙骨质及成骨细胞标志物,具有成骨、成脂肪及成软骨的多向分化潜能。将PDLSCs移植进入裸鼠体内以后,可以形成牙骨质/牙周膜样组织,完成一定程度的牙周缺损修复。动物实验显示,除了牙骨质牙周膜样组织形成外,移植部位也可见新骨形成[13]。Kim et al[14]将使用普通培养液培养的犬BMSCs和PDLSCs分别植入犬种植体周围骨缺损中,结果显示BMSCs和PDLSCs都具有修复骨缺损的能力,但是BMSCs的新骨形成能力较强。
研究[15]证实,在含有β-甘油磷酸钠、维生素C、地塞米松的矿化诱导液中,PDLSCs可向成骨分化,在β-甘油磷酸钠和地塞米松的共同作用下形成矿化结节,并表达成骨细胞特异性蛋白,具有更强的成骨能力。
本实验通过使用含有地塞米松的骨诱导液体外诱导培养BMSCs与PDLSCs,并于裸鼠皮下接种细胞材料复合物研究两种细胞的骨向分化能力。石蜡切片HE染色结果显示,复合细胞的两组材料内均有骨样组织形成。免疫组织化学结果显示,OCN和BMP-2蛋白在BMSCs/β-TCP组和PDLSCs/β-TCP组内均有表达。
本研究结果证明BMSCs和PDLSCs均有较强的成骨能力,BMSCs较 PDLSCs强,但是由于PDLSCs易于获得,获取的过程创伤小。本研究结果证实了PDLSCs可作为骨组织工程理想的种子细胞,为颌面部骨组织缺损的修复治疗提供了新的方法。
[1] 宋 晨.基于人骨髓间充质干细胞的骨组织工程技术研究[D].杭州:浙江大学,2013.
[2] 唐 成.自体骨髓间充质干细胞外基质(ECM)支架在软骨组织工程中的应用研究[D].南京:南京医科大学,2013.
[3] Montezano A C,Zimmerman D,Yusuf H,et al.Vascular smooth muscle cell differentiation to an osteogenic phenotype involves TRPM7 modulation by magnesium[J].Hypertension,2010,56(3):453-62.
[4] Tang L,Li N,Xie H,et al.Characterization of mesenchymal stem cells from human normal and hyperplastic gingiva[J].J Cell Physio,2011,226(3):832-42.
[5] Rifas L,Arackal S,Weitzmann M N.Inflammatory T cells rapidly induce differentiation of human bone marrow stromal cells into mature osteoblasts[J].J Cell Biochem,2003,88(4):650-9.
[6] 伍 燕,邓 超,杨 琨,等.糖基化终末产物对PDLSCs增殖及其Wnt经典信号通路相关基因表达的影响[J].牙体牙髓牙周病学杂志,2012,22(5):255-9.
[7] Otsu K,Kishigami R,Oikawa-Sasaki A,et al.Differentiation of induced pluripotent stem cells into dental mesenchymal cells[J]. Stem Cells Dev,2012,21(7):1156-64.
[8] Suaid F F,Ribeiro F V,Gomes T R,et al.Autologous periodontal ligament cells in the treatment of Class III furcation defects:a study in dogs[J].J Clin Periodontol,2012,39(4):377-84.
[9] 徐 斌,徐 婕,刘宏伟,等.人牙周膜细胞的分离培养及体外诱导分化研究[J].口腔医学研究,2011,27(8):702-5.
[10]Del Fattore A,Teti A,Rucci N.Bone cells and the mechanisms of bone remodelling[J].Front Biosci(Elite Ed),2012,4:2302-21.
[11]吴治林.个体化组织工程骨修复人长骨缺损的回顾性对比研究[D].重庆:第三军医大学,2014.
[12]Seo B M,Miura M,Gronthos S,et al.Investigation of multipotent postnatal stem cells from human periodontal ligament[J].Lancet,2004,364(9429):149-55.
[13]Elloumi-Hannachi I,Yamato M,Okano T.Cell sheet engineering:a unique nanotechnology for scaffold-free tissue reconstruction with clinical applications in regenerative medicine[J].J Intern Med,2010,267(1):54-70.
[14]Kim S H,Kim K H,Seo B M,et al.Alveolar bone regeneration by transplantation of periodontal ligament stem cells and bone marrow stem cells in a canine peri-implant defect model:a pilot study[J]. J Periodontol,2009,80(11):1815-23.
[15]韦巧玲,徐建江.细胞层片技术及其在角膜组织工程研究的应用[J].中华眼科杂志,2011,47(1):75-8.
Comparison of the subcutaneous osteogenesis ability between BMSCs and PDLSCs in BALB/c-nu
Xu Mengdan,Zhou Yong,Zou Duohong
(Oral Implantology Center,Affiliated Stomatological Hospital of Anhui Medical University,
Key Laboratory of Oral Disease Research In Anhui Province,Hefei 230032)
Objective To compare the ability of osteogenesis of bone marrow stromal cells(BMSCs)and periodontal ligament stem cells(PDLSCs)of Labrador dog when seeded with β-phosphate scaffold tricalcium(β-TCP)respectively into nude mice subcutaneously.Methods 3 groups were divided for the subcutaneous implant experiment:β-TCP group,BMSCs/β-TCP complex group and PDLSCs/β-TCP complex group.8 weeks after the operation,all implants were harvested and fixed.Sections were cut and stained with hematoxylin and eosin(HE).Immunohistochemical(IHC)staining was operated to detect the expression of bone matrix protein 2(BMP2)and osteocalcin(OCN).Results Both BMSCs and PDLSCs could adhere to the β-TCP scaffold and grew well.HE staining showed there was bony-like tissue formation both in the BMSCs group and PDLSCs group in balbc-nu experiment. More expressions of BMP-2 and OCN were observed in the BMSCs group than that in the PDLSCs group.Conclusion Both BMSCs and PDLSCs can be induced to express the osteoblast specific protein and improve bony-like tissue formation.
bone marrow stem cells;periodontal ligament stem cells;β-tricalcium phosphate;nude mice;ectopic bone formation
R 783.3
A
1000-1492(2016)09-1244-04
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.006.html
2016-05-04接收
国家自然科学基金(编号:31370983);安徽省杰出青年科学基金(编号:1508085J08);高校优秀青年人才支持计划重点项目(编号:gxyqZD2016058);安徽医科大学“青年拔尖人才计划”
安徽医科大学附属口腔医院牙种植中心、安徽省口腔疾病
研究省级重点实验室,合肥 230032
徐孟丹,女,硕士研究生;
邹多宏,男,博士,副教授,责任作者,E-mail:zdhyy@ahmu. edu

