肿瘤坏死因子-α增强血管紧张素Ⅱ对人成纤维样滑膜细胞的增殖、迁移与侵袭的作用及机制
罗学霞,严尚学,王 颖,吴华勋,陈镜宇,魏 伟
肿瘤坏死因子-α增强血管紧张素Ⅱ对人成纤维样滑膜细胞的增殖、迁移与侵袭的作用及机制
罗学霞,严尚学,王 颖,吴华勋,陈镜宇,魏 伟
目的 明确肿瘤坏死因子(TNF-α)增强血管紧张素Ⅱ(AngⅡ)对人成纤维样滑膜细胞(FLS)增殖、迁移与侵袭的作用及其部分机制。方法 体外培养正常人FLS,用AngⅡ(10-9、10-8、10-7、10-6、10-5mol/L)、TNF-α(20 ng/ml)单用或联合使用,刺激48 h后,采用CCK8试剂盒检测FLS增殖功能;Transwell小室法检测迁移与侵袭功能;激光共聚焦、免疫荧光或蛋白免疫印迹法检测AngⅡ受体及G蛋白偶联受体激酶2(GRK2)的表达。结果 AngⅡ(10-7、10-6、10-5mol/L)能促进人FLS的增殖 (P<0.05),最适浓度为10-7mol/L;TNF-α(20 ng/ml)能显著增强 FLS的增殖 (P<0.05);AngⅡ(10-7mol/L)与TNF-α(20 ng/ml)联合使用可进一步促进FLS增殖(P<0.05);单用AngⅡ(10-7mol/L)、TNF-α(20 ng/ml)或者联合使用都能显著促进FLS的迁移(P<0.01)与侵袭能力(P<0.05);单用AngⅡ可显著升高FLS血管紧张素Ⅱ1型受体(AT1R)的表达水平(P<0.05),GRK2水平有上升趋势(P>0.05);单用TNF-α可显著升高FLS的 AT1R和 GRK2的蛋白表达水平(P<0.05);AngⅡ与TNF-α联合使用,AT1R与GRK2的表达水平显著升高(P<0.05);GRK2抑制剂可以下调AngⅡ与TNF-α联合诱导的FLS迁移、侵袭功能(P<0.01)。结论 AngⅡ促进FLS增殖、迁移和侵袭,TNF-α可以促进AngⅡ介导的FLS增殖、侵袭和转移,其机制可能与上调FLS的AT1R和GRK2表达有关。
血管紧张素Ⅱ;肿瘤坏死因子;滑膜细胞;迁移;侵袭
类风湿关节炎(rheumatoid arthritis,RA)是一种严重危害人类健康的进展性、慢性自身免疫性疾病[1]。RA的成纤维样滑膜细胞(RA fibroblast-like synoviocyte,RA-FLS)在RA的发生、发展中发挥重要作用[2]。RA-FLS与免疫细胞共同作用,通过分泌炎性因子如肿瘤坏死因子(tumor necrosis factorα,TNF-α)、促血管生成因子或基质金属蛋白酶进入滑膜液中,导致炎症加剧、血管翳形成、基质降解,并最终引起关节骨与软骨破坏[3],抑制RA-FLS的增殖、侵袭和迁移是RA治疗的重要策略。血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)是血管紧张素-醛固酮系统中的重要组成部分,有两型受体包括1型受体(angiotensinⅡtype 1 receptors,AT1R)和2型受体(angiotensinⅡtype 2 receptors,AT2R),二者均为G蛋白偶联受体。AngⅡ与AT1R作用后,可以刺激血管生成,抑制FLS凋亡[4]、胶原蛋白合成和生长因子的表达。研究[5]表明,RA患者的外周血单个核细胞和炎症滑膜组织中血管紧张素转化酶(angiotensin converting enzyme,ACE)、AngⅡ和AT1R表达升高,提示AngⅡ及其受体参与了RA疾病进程。该研究将观察TNF-α对AngⅡ促进人FLS增殖、迁移与侵袭能力的影响,并初步探讨其部分机制。
1 材料与方法
1.1 试剂与仪器 AngⅡ、TNF-α(美国Sigma公司);G蛋白偶联受体激酶2(G-protein-coupled receptor kinases 2,GRK2)抑制剂(C12H9NO6,美国Santa Cruz公司);兔来源抗人AT1R抗体、AT2R抗体(美国Abcam公司);兔来源抗GRK2抗体(美国Cell Signaling Technology公司);MH7A细胞株(FLS,广州吉妮欧生物科技有限公司);BioTek Elx× 808酶标仪(美国 BioTek公司);ImageQuant Las 4000mini化学发光成像分析仪(武汉爱斯佩科学仪器有限公司);Sp8激光共聚焦显微镜(德国Leica公司);SW-CJ-1F超净工作台(苏州苏净集团安泰公司);2306-2型CO2培养箱(美国 SHELLAB公司);IX-70荧光倒置显微镜(日本OLYMPUS公司)
1.2 方法
1.2.1 FLS的培养 FLS培养于50 ml玻璃培养瓶中,待细胞长满至底面90%时,弃去培养液,用PBS液洗2遍,胰蛋白酶消化。显微镜下观察细胞变形后弃掉胰蛋白酶,加入含20%胎牛血清(fetal bovine serum,FBS)的DMEM培养液,吹打混匀后,于5% CO2、37℃培养箱中培养48 h。根据细胞的生长情况及培养液的变化,每2~3 d更换培养液1次。
1.2.2 CCK8法检测细胞的增殖 培养瓶中已经长满的FLS经消化、计数后,用10%FBS培养液稀释成1×105/ml的细胞悬液,按每孔100 μl加入96孔板,于5%CO2、37℃培养箱中培养6 h。显微镜下观察,待全部细胞贴壁后,按分组情况每孔加用DMEM培养液配制的10 μl AngⅡ(终浓度分别为10-9、10-8、10-7、10-6、10-5mol/L)或TNF-α(终浓度为20 ng/ml),最终体积为110 μl或 120 μl,不足的用DMEM培养液补足液体。在培养箱中培养48 h,终止培养前每孔加入10 μl CCK8试剂,室温下震荡混匀后继续培养1~3 h。肉眼观察细胞孔中颜色由黄色变成深橙色,于酶标仪中读取波长450 nm处的吸光度值(optical density,OD)。OD值=实验组平均OD值-空白组平均OD值,计算细胞增殖。
1.3 Transwell小室检测FLS的迁移与侵袭功能
1.3.1 FLS的迁移 24孔板的FLS平铺至50%时,单独加入AngⅡ(终浓度10-7mol/L)、TNF-α(终浓度20 ng/ml)或两者联合加入培养48 h。细胞消化后用含10%FBS的DMEM培养液制备成细胞悬液(1×105/ml),取100 μl加入Transwell小室的上室,下室加入600 μl含20%FBS的DMEM培养液。培养箱中培养过夜,棉签擦去内面未迁移的细胞,下室已迁移的细胞用20%甲醇溶液配制的结晶紫室温下染色10 min。显微成像系统镜检迁移细胞数,4倍镜视野统计细胞数目。
1.3.2 FLS的侵袭 Transwell小室内面预先铺上20 μl已经稀释好的 Matrigel基质胶,放入37℃培养箱中凝固1 h。取100 μl已经用AngⅡ(终浓度10-7mol/L)、TNF-α(终浓度20 ng/ml)单独或联合作用48 h的浓度为1×105个/ml的FLS细胞悬液,加入已经铺胶的Transwell上室,下室加入600 μl含20%FBS的DMEM培养液。培养24 h后,棉签擦去内面未迁移的细胞,下室已迁移的细胞用20%甲醇配制的结晶紫室温下染色10 min。显微镜检查侵袭细胞数,4倍镜视野统计细胞数目。
1.4 激光共聚焦或免疫荧光定位受体的表达 经无菌处理后的载玻片放置于6孔板中,加入含10% FBS培养液稀释成5×104/ml的FLS悬液1 ml。待细胞贴壁于载玻片上后,分别加入AngⅡ(终浓度10-7mol/L)、TNF-α(终浓度20 ng/ml),或联合使用培养48 h。弃去培养液,PBS洗3遍,经4%多聚甲醛固定、Triton打孔、牛血清白蛋白(BSA)封闭后加入兔来源抗人AT1R抗体或抗AT2R抗体,4℃过夜后加入相应二抗室温孵育1 h,DIPA染色后玻片固定,拍片。
1.5 Western blot法检测受体及GRK2在FLS的表达情况 FLS加入6孔板中培养至90%时,分别加入AngⅡ(10-7mol/L)、TNF-α(20 ng/ml)、AngⅡ+ TNF-α、AngⅡ+TNF-α+GRK2抑制剂(终浓度50 μmol/L)后培养48 h。弃去培养液,用裂解液裂解FLS并提取细胞中的总蛋白。蛋白定量后,每孔30 μg蛋白加入10%SDS-PAGE凝胶电泳孔中按操作步骤电泳、转膜。室温封闭2 h,加入抗AT1R抗体、抗AT2R抗体、抗GRK2抗体或β-actin抗体4℃过夜。辣根过氧化物酶标记的相应二抗室温孵育2 h后在化学发光成像分析仪中显影。Image分析软件分析条带灰度值,β-actin抗体的条带灰度值作为内参。
1.6 统计学处理 采用SPSS 17.0统计软件处理,数据以表示,多组样本间两两比较用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 AngⅡ和TNF-α对FLS增殖的影响 图1显示,AngⅡ(10-7、10-6、10-5mol/L)作用于FLS 48 h后可显著促进FLS增殖(F=2.545,P<0.05);TNF-α (20 ng/ml)也可明显促进FLS的增殖(F=8.491,P<0.05),且TNF-α和AngⅡ(10-7、10-6、10-5mol/L)联合使用较TNF-α单一刺激更能促进FLS增殖(P<0.05)。根据增殖实验结果,在后述实验中选定10-7mol/L作为AngⅡ的体外刺激最适浓度。
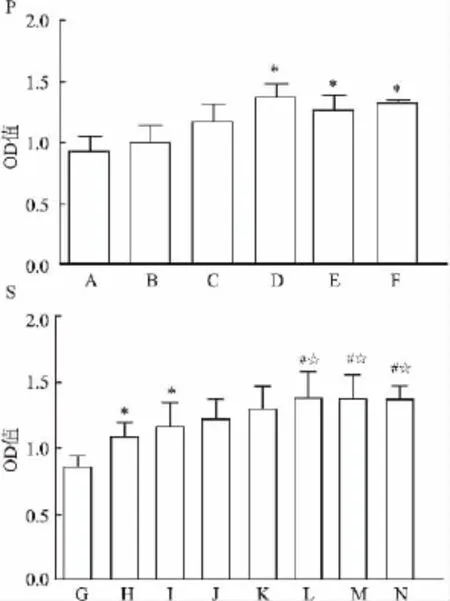
图1 AngⅡ与TNF-α诱导FLS的增殖(,n=3)
2.2 AngⅡ和TNF-α对FLS迁移和侵袭能力的影响
与正常组相比,AngⅡ(10-7mol/L)、TNF-α(20 ng/ ml)单用或者联合使用都可以增加FLS的迁移能力(F=147.973,P<0.01)和侵袭能力(F=59.320,P<0.05)。但单用TNF-α明显比单用AngⅡ更能促进FLS的迁移与侵袭,AngⅡ和TNF-α对FLS的迁移与侵袭能力存在显著性差异(P<0.05)。与单用相比,AngⅡ和TNF-α联合使用可显著增加FLS迁移与侵袭的细胞数量,GRK2抑制剂(50 μmol/L)可显著抑制AngⅡ和TNF-α诱导的FLS迁移与侵袭能力。见图2、3。

图2 Transwell小室检测AngⅡ和TNF-α对FLS迁移的影响(,n=3) ×10
2.3 AngⅡ和TNF-α对FLS AngⅡ受体表达的影响 AT1R主要表达于FLS的胞膜和胞质,部分表达于胞核;免疫荧光结果也显示,AT2R主要表达于FLS的胞膜、胞质,部分表达在核内。见图4。AngⅡ(10-7mol/L)、TNF-α(20 ng/ml)均可明显增加FLS上AT1R的蛋白表达水平,二者联合使用可显著增高AngⅡ诱导的AT1R蛋白水平(F=7.315,P <0.05)。单用AngⅡ(10-7mol/L)、TNF-α(20 ng/ ml)对FLS上AT2R的蛋白表达有上升趋势但差异无统计学意义,二者联合使用可显著升高FLS上AT2R的表达(F=6.036,P<0.05)。GRK2抑制剂(50 μmol/L)可显著抑制AngⅡ和 TNF-α刺激的FLS上AT1R和AT2R的表达(P<0.05)。见图5。

图3 Transwell小室检测AngⅡ和TNF-α对FLS侵袭的影响(,n=3) ×10

图4 激光共聚焦(上两排)和免疫荧光(下两排)定位FLS上的血管紧张素受体 ×10
2.4 AngⅡ和TNF-α对FLS的GRK2表达水平的影响 AngⅡ(10-7mol/L)刺激对FLS上GRK2的蛋白表达水平无明显影响,TNF-α(20 ng/ml)则可明显增加FLS上 GRK2的蛋白表达水平(P<0.05),AngⅡ与 TNF-α联合使用也能显著升高GRK2的蛋白表达 (P<0.05),但与TNF-α单一刺激相比差异无显著性。GRK2抑制剂(50 μmol/L)可显著抑制AngⅡ和TNF-α诱导的FLS上GRK2蛋白的表达(F=4.383,P<0.05)。见图6。
3 讨论
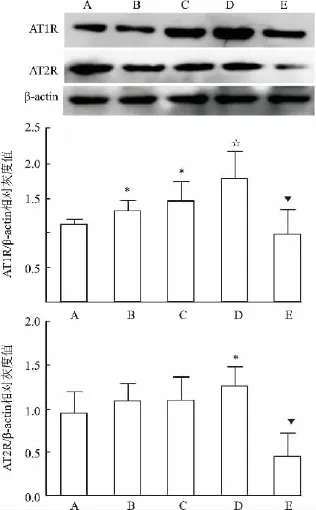
图5 AngⅡ和TNF-α对FLS上血管紧张素受体表达的影响(,n=3)

图6 AngⅡ和TNF-α对FLS上GRK2表达的影响(,n=3)
RA-FLS是一类有“类肿瘤细胞样”侵袭的生物学特性的细胞[6],在内皮细胞、巨噬细胞、B细胞、T细胞等多种炎性细胞及其分泌的炎症因子作用下活化,位于滑膜衬里层的FLS移动到软骨表面,通过增加基质金属蛋白酶类和组织蛋白酶的产生,对软骨造成破坏并迁移到骨,活化破骨细胞,增强骨质侵蚀和破坏[6-8]。FLS侵袭的机制十分复杂,迄今尚未完全阐明。一般认为RA关节局部低氧环境中,FLS与大量浸润的炎性细胞及其分泌的炎症因子相互接触、相互作用构成了一个错综复杂的网络,激活炎症信号通路并调控侵袭相关基因的表达,这可能是FLS侵袭的重要机制之一[9]。
研究[3-5]表明,AngⅡ及TNF-α都参与了RA疾病的病理进程。本实验结果显示,经AngⅡ(10-7mol/L)和TNF-α(20 ng/ml)处理后的FLS的增殖、迁移与侵袭能力显著增强,且AngⅡ和TNF-α联合作用后FLS的增殖、迁移与侵袭能力比单独作用更强。提示AngⅡ、TNF-α均可以促进FLS的增殖、迁移与侵袭,且TNF-α可以促进AngⅡ诱导的FLS增殖、迁移与侵袭。
进一步研究表明,AngⅡ和TNF-α均可显著提高FLS的AT1R表达水平,联合使用进一步提升了AT1R的表达,但AngⅡ和TNF-α单一作用对AT2R的表达无明显作用,联合使用也没有增高AngⅡ诱导的AT2R蛋白水平;AngⅡ不能促进FLS的GRK2表达,但TNF-α可显著升高FLS的GRK2表达水平;抑制GRK2活性可显著抑制FLS的增殖、迁移与侵袭能力。有研究[10-12]表明,TNF-α可以通过其相应受体招募肿瘤坏死因子受体相关因子2(TRAF2)活化NF-κB从而增强RA-FLS的侵袭性;AngⅡ也可通过AT1R激活NF-κB信号途径,激活下游丝裂原激活的蛋白激酶家族成员,抑制体外培养的FLS凋亡,促进其对关节软骨的破坏[5]以及RA-FLS的迁移与侵袭[13]。GRK是一组与GPCR磷酸化脱敏相关的激酶,活化后可以磷酸化受体,使受体与 β-arrestins形成复合体与G蛋白解偶联,从而使受体介导的信号转导效应消失或降低,GRK2也可与TRAF2相互作用调节cAMP-PKA通路和ERK信号影响FLS的功能[14-15]。以上结果提示,TNF-α可以增强AngⅡ诱导的FLS增殖、迁移与侵袭能力,而GRK2可能是其作用的关键分子。
[1] Scott D L,Wolfe F,Huizinga T W.Rheumatoid arthritis[J].Lancet,2010,376(9746):1094-108.
[2] Szekanecz Z,Besenyei T,Paragh G,et al.New insights in synovial angiogenesis[J].Joint Bone Spine,2010,77(1):13-9.
[3] Neumann E,Lefèvre S,Zimmermann B,et al.Rheumatoid arthritis progression mediated by activated synovial fibroblasts[J]. Trends Mol Med,2010,16(10):458-68.
[4] Pattacini L,Casali B,Boiardi L,et al.AngiotensinⅡprotects fibroblast-like synoviocytes from apoptosis via the AT1-NF-κB pathway[J].Rheumatology(Oxford),2007,46(8):1252-7.
[5] Wang D,Hu S,Zhu J,et al.Angiotensin II type 2 receptor correlates with therapeutic effects of losartan in rats with adjuvant-induced arthritis[J].J Cell Mol Med,2013,17(12):1577-87.
[6] Bartok B,Firestein G S.Fibroblast-like synoviocytes:key effector cells in rheumatoid arthritis[J].Immunol Rev,2010,233(1):233-55.
[7] Niedermeier M,Pap T,Korb A.Therapeutic opportunities in fibroblasts in inflammatory arthritis[J].Best Pract Res Clin Rheumatol,2010,24(4):527-40.
[8] Perlman H,Pope R M.The synovial lining micromass system:toward rheumatoid arthritis in a dish[J].Arthritis Rheum,2010,62(3):643-6.
[9] Li G,Liu D,Zhang Y,et al.Celastrol inhibits lipopolysaccharidestimulated rheumatoid fibroblast-like synoviocyte invasion through suppression of TLR4/NF-κB-mediated matrix metalloproteinase-9 expression[J].2013,8(7):e68905.
[10]Li Y,Sheng K,Chen J,et al.Regulation of PGE2 signaling pathways and TNF-alpha signaling pathways on the function of bone marrow-derived dendritic cells and the effects of CP-25[J].Eur J Pharmacol,2015,769:8-21.
[11]Hot A,Zrioual S,Lenief V,et al.IL-17 and tumour necrosis factor α combination induces a HIF-1α-dependent invasive phenotype in synoviocytes[J].Ann Rheum Dis,2012,71(8):1393-401.
[12]Li G,Zhang Y,Qian Y,et al.Interleukin-17A promotes rheumatoid arthritis synoviocytes migration and invasion under hypoxia by increasing MMP2 and MMP9 expression through NF-kappa B/ HIF-1 alpha pathway[J].Mol Immunol,2013,53(3):227-36.
[13]Wang C,Chang Q,Sun X,et al.AngiotensinⅡinduces an increase in matrix metalloproteinase 2 expression in aortic smooth muscle cells of ascending thoracic aortic aneurysms through JNK,ERK1/2,and p38 MAPK activation[J].J Cardiovasc Pharmacol,2015,66(3):285-93.
[14]Chen J Y,Wu H X,Chen Y,et al.Paeoniflorin inhibits proliferation of fibroblast-like synoviocytes through suppressing G-proteincoupled receptor kinase 2[J].Planta Med,2012,78(7):665-71.
[15]黄 蓓.重组人TNF-α受体融合蛋白联合甲氨蝶呤对小鼠胶原性关节炎的作用及TNF-α调节人滑膜细胞EP4信号的机制[D].合肥:安徽医科大学,2013.
Tumor necrosis factor α enhances human fibroblast-like synoviocyte proliferation,migration,and invasion induced by angiotensinⅡ and the mechanisms
Luo Xuexia,Yan Shangxue,Wang Ying,et al
(Institute of Clinical Pharmacology of Anhui Medical University,Hefei230032)
Objective To identify the effects and mechanisms of tumor necrosis factor α(TNF-α)enhances human fibroblast-like synoviocyte(FLS)proliferation,migration,and invasion induced by angiotensinⅡ(AngⅡ). Methods FLS was stimulated by different concentrations of AngⅡ(10-9,10-8,10-7,10-6,10-5mol/L)combined with or without TNF-α(20 ng/ml)for 48 h,and then CCK8 assay and Transwell chamber were used to test FLS proliferation,migration and invasion.The expressions of AngⅡ receptors(AT1R and AT2R)and GRK2 were measured by immunofluorescence,laser confocal or Western blot.Results AngⅡ(10-7,10-6,10-5mol/L)could promote the proliferation of FLS(P<0.05),10-7mol/L was the optimum concentration.TNF-α(20 ng/ml)significantly enhanced the proliferation of FLS(P<0.05).AngⅡ(10-7mol/L)combined with TNF-α(20 ng/ ml)had a further promotion on FLS proliferation(P<0.05).The migration and invasion of FLS were significantly increased by AngⅡ,TNF-α or their combination(migration:P<0.01,and invasion:P<0.05).The expression of AT1R was increased(P<0.05),but the expression of GRK2 only had a rising trend induced by AngⅡ(P>0.05).The expressions of AT1R and GRK2 on FLS were increased significantly induced by TNF-α(P<0.05)and their combination group(P<0.05).GRK2 inhibitor could down-regulate the combination group effects on FLS such as migration and invasion(P<0.01).Conclusion AngⅡ promotes FLS proliferation,migration and invasion. TNF-α could promote FLS proliferation,migration and invasion induced by AngⅡthrough up-regulating the expressions of AT1R and GRK2 on FLS.
AngiotensinⅡ;TNF-α;synovial fibroblasts;migration;invasion
时间:2016-8-1 14:07
http://www.cnki.net/kcms/detail/34.1065.R.20160801.1407.004.html
R 977.6
A
1000-1492(2016)09-1238-06
2016-05-04接收
国家自然科学基金(编号:81503084、81330081、81302784)
安徽医科大学临床药理研究所,合肥 230032
罗学霞,女,硕士研究生; 魏 伟,男,教授,博士生导师,责任作者,E-mail:wwei@ ahmu.edu.cn

