β-1,3-1,4-葡聚糖酶研究进展
夏许寒,朱成林,李 诚*
(四川农业大学食品学院,四川 雅安 625014)
β-1,3-1,4-葡聚糖酶研究进展
夏许寒,朱成林,李诚*
(四川农业大学食品学院,四川 雅安 625014)
β-1,3-1,4-葡聚糖酶(EC 3.2.1.73)是一类内切型糖苷水解酶,广泛存在于各类微生物及植物中,对谷物β-1,3-1,4-葡聚糖的水解具有重要作用。在食品工业及饲料工业有着广阔的应用前景。目前已有GH16、GH17及GH26 3 个糖苷水解酶家族的β-1,3-1,4-葡聚糖酶结构得到解析。本文针对β-1,3-1,4-葡聚糖酶的来源、性质、结构、功能及应用的国内外研究现状进行综述。
β-1,3-1,4-葡聚糖酶;酶学性质;结构与功能;应用
β-1,3-1,4-葡聚糖是由β-D-葡萄糖残基通过β-1,3和β-1,4糖苷键混合连接的一类直链高分子葡聚糖,主链由β-1,3糖苷键连接的纤维三糖和纤维四糖重复结构单元形成(图1),在大麦、燕麦、高粱等谷物胚乳细胞壁中的含量极为丰富。β-1,3-1,4-葡聚糖酶(又称地衣多糖酶;EC 3.2.1.73)作为一种重要的β-葡聚糖水解酶,能够特异性水解β-1,3-1,4-葡聚糖中与β-1,3糖苷键相邻的β-1,4糖苷键(图1),生成3-O-β-纤维二糖基-D-吡喃葡萄糖(G4G3G)和3-O-β-纤维三糖基-D-吡喃葡萄糖(G4G4G3G)[1]。β-1,3-1,4-葡聚糖酶作为一种重要的糖苷水解酶类,对谷物β-1,3-1,4-葡聚糖的水解具有重要作用,能够有效降低麦汁黏度和消除抗营养因子,因而被广泛应用于啤酒和饲料行业中[1-2]。然而,受到质量、价格等因素的影响,目前市场上的β-1,3-1,4-葡聚糖酶并不能完全满足现有工业应用的需求。因此,如何开发种类更多、酶活力更高、性质更好的β-1,3-1,4-葡聚糖酶来消除谷物类β-葡聚糖造成的负面作用,一直是酶制剂工业、酿造工业和饲料工业的研究重点。国内外研究者已对β-1,3-1,4-葡聚糖酶展开了系统性研究,为了归纳总结β-1,3-1,4-葡聚糖酶的研究热点和发展趋势,本文对β-1,3-1,4-葡聚糖酶的来源、蛋白质结构、催化机理、酶学性质及应用等方面的国内外研究现状进行了综述,为β-1,3-1,4-葡聚糖酶的进一步研究开发提供参考。

图1 1 β-1,3-1,4-葡聚糖酶降解大麦β-葡聚糖的作用方式[1]1Fig.1 Enzymatic depolymerisation of barley β-glucan by β-1,3-1,4-glucanase[1]
1 1 β-1,3-1,4-葡聚糖酶的来源
β-1,3-1,4-葡聚糖酶主要来源于各种微生物以及高等植物中[3]。由于微生物来源的β-1,3-1,4-葡聚糖酶具有生产周期短、酶活力稳定、生产容易放大等优点,目前已成为β-1,3-1,4-葡聚糖酶研究的最主要来源。一些微生物来源的β-1,3-1,4-葡聚糖酶能够高效水解植物胚乳中的β-葡聚糖,具有良好应用前景。关于β-1,3-1,4-葡聚糖酶来源,早期的研究主要集中在产酶菌株的筛选和发酵条件的优化、酶的分离纯化和性质的研究。随着研究的深入,研究者发现天然来源的β-1,3-1,4-葡聚糖酶往往难以同时满足工业生产对酶活性、反应温度和pH值等多方面的实际需求,无法直接应用于生产实践中。因此近年来,β-1,3-1,4-葡聚糖酶的基因克隆和外源表达成为获得工业用酶另一种有效途径。同时,随着生物信息学、结构生物学及酶催化作用机理研究的深入,一些宏基因组来源或人工分子改造β-1,3-1,4-葡聚糖酶也逐步得到重视。
1.1细菌来源β-1,3-1,4-葡聚糖酶
细菌β-1,3-1,4-葡聚糖酶是报道最为广泛,研究较为透彻的一类β-1,3-1,4-葡聚糖酶,也是目前工业应用β-1,3-1,4-葡聚糖酶的主要来源。产β-1,3-1,4-葡聚糖酶的细菌主要是芽孢杆菌,包括枯草芽孢杆菌(Bacillus subtilis)[4-8]、特基拉芽孢杆菌(Bacillus tequilensis)[9]、地衣芽孢杆菌(Bacillus licheniformis)[10-12]、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)[13-14]、嗜碱芽孢杆菌(Bacillus halodurans)[15]、环状芽孢杆菌(Bacillus circulans)[16]、类芽孢杆菌(Paenibacillus sp.)[17]、多黏芽孢杆菌(Bacillus polymyxa)[18]和高地芽孢杆菌(Bacillus altitudinis)[19]等。此外,还有一些产β-1,3-1,4-葡聚糖酶的细菌,如产琥珀酸丝状杆菌(Fibrobacter succinogenes)[20-22]、牛链球菌(Streptococcus bovis)[23]、硫磺菌(Laetiporus sulphureus)[24]和热纤维梭菌(Clostridium thermocellum)[25-26]等。其中在毕赤酵母(Pichia pastoris)中异源表达的产琥珀酸丝状杆菌来源的重组β-1,3-1,4-葡聚糖酶比活力达到10 800 U/mg,为已报道的细菌β-1,3-1,4-葡聚糖酶的最高比活力[21]。一些芽孢杆菌所产β-1,3-1,4-葡聚糖酶的性能较为优异,其热稳定性较强,且对底物有较强特异性。由于发酵条件较为成熟,目前工业应用的β-1,3-1,4-葡聚糖酶主要为地衣芽孢杆菌(Bacillus licheniformis)经液态深层发酵制备。
1.2真菌来源β-1,3-1,4-葡聚糖酶
真菌是β-1,3-1,4-葡聚糖酶的一个重要来源。产β-1,3-1,4-葡聚糖酶的真菌以嗜热真菌为主,包括嗜热拟青霉(Paecilomyces thermophila)[27]、米黑根毛霉(Rhizomucor miehei)[28]和樟绒枝霉(Malbranchea cinnamomea)[29],嗜酸真菌,如Bispora sp.[30]以及埃默森篮状菌(Talaromyces emersonii)[31]、致病疫霉(Phytophthora infestans)[32]、碎囊毛霉[33]等。其中米黑根毛霉(Rhizomucor miehei)来源β-1,3-1,4-葡聚糖酶胞外活力达到6 230 U/mL,在最适条件下的比活力达到28 820 U/mg,为已报道的真菌β-1,3-1,4-葡聚糖酶的最高比活力[28]。酵母菌也能产生几种β-葡聚糖酶,但基本不能水解由β-1,3糖苷键和β-1,4糖苷键混合连接的β-葡聚糖,且分泌量相对较少,作用也较弱[34]。由于饲料造粒温度及麦芽汁糖化工艺温度的需求,热稳定性成为考察β-1,3-1,4-葡聚糖酶适应性的重要指标,因此基于嗜热真菌发掘耐热β-1,3-1,4-葡聚糖酶成为目前的一大研究趋势[27-29]。此外,利用真菌固态发酵能够有效降低酶发酵制备成本,简化发酵流程,使得真菌来源β-1,3-1,4-葡聚糖酶的开发利用日渐受到重视。
1.3植物来源β-1,3-1,4-葡聚糖酶
β-1,3-1,4-葡聚糖酶也广泛存在于高等植物细胞壁中,尤其在大麦、燕麦和黑麦等谷类作物的胚乳细胞壁中含量最为丰富[35-36]。谷物种子本身不含有β-1,3-1,4-葡聚糖酶,但在其发芽过程中,胚乳细胞受到胚上皮细胞分泌的赤霉酸刺激,将逐步合成一系列内源性β-1,3-1,4-葡聚糖酶,用于分解胚乳细胞壁中的β-葡聚糖,解除其对胚乳中的抗性作用,保证种子的正常发芽[18]。但植物来源β-1,3-1,4-葡聚糖酶分泌量极少,且比活力较低,适应性较差,不适用于工业生产。目前研究多限于β-1,3-1,4-葡聚糖酶的植物生理活性功能或新来源的探索。
2 2 β-1,3-1,4-葡聚糖酶的结构和催化机理
糖苷水解酶基于氨基酸序列的进化关系可分类为不同家族,到目前为止,根据碳水化合物活性酶数据库(Carbohydrate-Active Enzymes Database,http:// www.cazy.org/[36])的分类,共有135 个糖苷水解酶家族(glycoside hydrolase family,GH)分属于14 个超家族(super family):GH-A-GH-N。已发现的β-1,3-1,4-葡聚糖酶可以归属于9 个GH:GH5、GH7、GH8、GH9、GH11、GH12、GH16、GH17和GH26。目前已有GH16、GH17及GH26 3个GH的β-1,3-1,4-葡聚糖酶结构得到解析(表1)。到目前为止,所有已报道的典型β-1,3-1,4-葡聚糖酶均归属于GH16和GH17家族,其他GH中β-1,3-1,4-葡聚糖酶分布较少,且多为纤维素酶/β-1,3-1,4-葡聚糖酶多功能酶或昆布多糖酶/β-1,3-1,4-葡聚糖酶多功能酶,不属于严格意义上的β-1,3-1,4-葡聚糖酶。植物和微生物来源的β-1,3-1,4-葡聚糖酶在氨基酸序列和三维结构上都存在较大差异。根据氨基酸序列的进化关系分类,已发现的微生物来源β-1,3-1,4-葡聚糖酶主要归属于GH16家族,而植物(如大麦芽、大米和烟草)来源的β-1,3-1,4-葡聚糖酶主要归属于为GH17家族。

表1 已解析的β-1,3-1,4-葡聚糖酶结构Table1 Structures oβf-1,3-1,4-glucanasesnases
2.1GH16家族β-1,3-1,4-葡聚糖酶

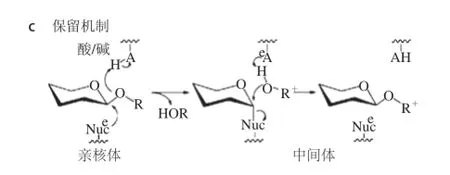
图2 GH16及GH17家族β-1,3-1,4-葡聚糖酶的结构与催化机理Fig.2 Structures and catalytic mechanisms of β-1,3-1,4-glucanases belonging to GH16 and GH17 families
GH16家族β-1,3-1,4-葡聚糖酶属于GH-B超家族,其三维结构由两组反相平行的β-折叠体系构成的紧密的β-折叠果冻卷结构(β-jelly roll),β-折叠堆砌在顶端形成蛋白质中心,每一个环的结构通过β-转角稳定,中心由7 条弯曲的反向平行链通过一端形成裂隙,构成贯穿于酶分子表面的狭长催化凹槽,作为与长链底物的结合区域[37]。两个保守的谷氨酸残基位于β-折叠果冻卷结构的第8个β-折叠上,分别发挥亲核试剂与酸/碱催化基团作用(图2a)。GH16家族遵循糖苷水解酶“保留型”催化机制。酶解反应在保守的活性氨基酸残基参与下执行两步反应,在反应历程中同样会形成不稳定的酶-糖基中间体。在反应的第一步,活性中心的谷氨酸残基作为广义酸攻击底物的异头碳。底物的β-1,4糖苷键断裂,离去基团被切去,并形成了酶-糖基不稳定中间体。随后,活性中心的谷氨酸残基作为广义碱,协助水分子攻击酶-糖基不稳定中间体的异头碳位置。最终,β-1,4糖苷键断裂,形成了最终的底物水解产物(图2c)。GH16家族β-1,3-1,4-葡聚糖酶属于内切型糖苷水解酶,从β-1,3-1,4-葡聚糖长链底物内部随机切断β-1,3糖苷键邻近的β-1,4糖苷键,水解产物为一系列聚合度不同的低聚糖。目前已有芽孢杆菌[38]、产琥珀酸丝状杆菌(Fibrobacter succinogenes)[22]、嗜热拟青霉(Paecilomyces thermophila)[37]等一些GH16家族的β-1,3-1,4-葡聚糖酶结构得到解析。一些GH16家族β-1,3-1,4-葡聚糖酶的酶-底物/抑制剂复合物的结构表明,GH16家族β-1,3-1,4-葡聚糖酶的催化凹槽中存在一些位阻氨基酸,将催化凹槽阻隔成为曲折构型,从而适宜于β-1,3与β-1,4糖苷键混合连接的非直线型底物的结合。这些复合物信息从结构上解释了GH16家族β-1,3-1,4-葡聚糖酶的底物特异性作用机制,阐述了三维结构类似的不同GH16家族蛋白具有水解不同类型底物的根本原因[38]。GH16家族β-1,3-1,4-葡聚糖酶分子内普遍存在一些二硫键,对酶的稳定性发挥重要作用。由于“保留型”催化机制,在反应历程中形成了不稳定的酶-糖基中间体,部分GH16家族β-1,3-1,4-葡聚糖酶存在微弱的转糖苷活性。目前已有针对GH16家族β-1,3-葡聚糖酶的分子改造研究,通过活性位点突变使其成为糖基转移酶用于合成环状β-1,3-葡寡糖[39]。因此,基于催化凹槽的理性设计改造使得GH16家族β-1,3-1,4-葡聚糖酶同样具有潜在的合成异源糖苷或低聚寡糖能力。同时,GH16家族β-1,3-1,4-葡聚糖酶丰富的结构信息及催化机制研究也为下一步的分子改造提供了理论基础。
2.2GH17家族β-1,3-1,4-葡聚糖酶
已发现的GH17家族β-1,3-1,4-葡聚糖酶全部为植物来源,在植物生理代谢中发挥着重要功能。GH17家族β-1,3-1,4-葡聚糖酶属于GH-A超家族,其三维结构呈现典型的TIM桶状结构(TIM-barrel fold),由8 个α-螺旋和8 个β-折叠环绕形成。酸碱催化、亲核试剂谷氨酸残基分别位于第4和第7个β-折叠上(图2b)。一个能够容纳长链底物的狭长催化凹槽贯穿整个酶的表面。已有的研究表明GH17家族内切β-1,3-14-葡聚糖酶与GH16家族蛋白类似,遵从“保留型”反应机制。酶解反应在保守的活性氨基酸残基(谷氨酸残基)参与下执行两步反应,在反应历程中同样会形成不稳定的酶-糖基中间体(图2c)。目前仅有1 例大麦(Hordeum vulgare)来源的GH17家族β-1,3-1,4-葡聚糖酶结构得到解析[40-41]。研究者同时解析了相同来源的GH17家族β-1,3-葡聚糖酶晶体结构。通过两者对比,狭长催化凹槽内的氨基酸残基位阻排布差异造成了两种酶对应底物的差异。尽管GH17家族中存在外切型β-1,3-葡聚糖酶,但已发现的GH17家族β-1,3-1,4-葡聚糖均属于内切型糖苷水解酶,从β-1,3-1,4-葡聚糖长链底物内部随机切断β-1,3糖苷键邻近的β-1,4糖苷键,水解产物同样为一系列聚合度不同的低聚糖。
3 3 β-1,3-1,4-葡聚糖酶的酶学性质

表2 不同β-1,3-1,4-葡聚糖酶性质Table2 Characterization of β-1,3-1,4-glucanases from different microbial origins
不同来源β-1,3-1,4-葡聚糖酶的性质各不相同,这种差异不仅表现在物种上,而且还表现在种属间(表2)。其中大多数为胞外酶,一般都采用常规处理方法进行分离纯化,如离心和/或超滤、硫酸铵或有机溶剂沉淀、离子交换等各种柱层析、电泳等。真菌来源β-1,3-1,4-葡聚糖酶分子质量通常在30~50 kD之间,最适pH值在4.8~7.0之间,以酸性酶居多,最适温度在55~80℃,一般具有较好的耐酸性和耐热性。耐热性较好的β-1,3-1,4-葡聚糖酶一般都是糖基化蛋白,但糖基化程度却大不相同。不同真菌来源的β-1,3-1,4-葡聚糖酶的米氏常数(Km)值差异较大,一般介于1.11~13.38 mg/mL之间,表明β-1,3-1,4-葡聚糖酶对于底物的亲和能力具有较大差异。目前,β-1,3-1,4-葡聚糖酶的研究主要以细菌为主,关于真菌发酵产β-1,3-1,4-葡聚糖酶的研究报道较少。Yang Shaoqing等[27]以玉米芯作为碳源,首次报道了嗜热拟青霉发酵产β-1,3-1,4-葡聚糖酶,该酶为分子质量为34.6 kD的单亚基蛋白,最适反应温度和pH值分别为70 ℃和7.0,具有较宽的pH值稳定范围(pH 4.0~10.0)和温度稳定性(<65℃)。Tang Yanbin等[28]利用米黑根毛霉液体发酵得到了一种耐热β-1,3-1,4-葡聚糖酶,其酶活力高达6 230 U/mL,该酶最适pH值为5.5,最适温度为60 ℃,在pH 4.5~8.5范围内具有较好的稳定性,在80 ℃处理30 min,酶活力仍能保持70%以上,具有良好的工业应用价值。真菌来源β-1,3-1,4-葡聚糖酶一般为耐酸性或中性酶,目前仅有樟绒枝霉来源的β-1,3-1,4-葡聚糖酶显示出耐碱特性。Yang Shaoqing等[29]以玉米芯为碳源,对樟绒枝霉进行液体发酵产β-1,3-1,4-葡聚糖酶,该酶最适pH值为10.0,在pH 4.5~10.0范围内保持稳定,最适作用温度为55 ℃,在50 ℃以下保持稳定,作为耐碱性β-1,3-1,4-葡聚糖酶,在洗涤剂工业具有一定潜在应用价值。细菌β-1,3-1,4-葡聚糖酶分子质量在20~50 kD之间,通常都是单亚基蛋白,最适pH值在5.0~7.0之间,最适温度在40~65 ℃之间。不同细菌来源的β-1,3-1,4-葡聚糖酶的Km值一般介于1.82~10.00 mg/mL之间,对于β-1,3-1,4-葡聚糖酶底物的水解能力差异较大。Mao Shurui等[19]从淤泥中筛选得到1 株产β-1,3-1,4-葡聚糖酶高地芽孢杆菌(Bacillus altitudinis),纯化得到该酶的分子质量为27 kD,最适反应温度和pH值分别为60 ℃和6.0,具有较宽的pH值稳定范围(pH 5.0~9.0)和温度稳定性(<60 ℃),该酶能够被Co2+、Fe2+、Ca2+等金属离子激活,比活力达到3 191.5 U/mg。Na等[17]报道了一种类芽孢杆菌(Paenibacillus sp.)来源的β-1,3-1,4-葡聚糖酶,该酶属于GH8家族,与常见β-1,3-1,4-葡聚糖酶不同,该酶具有较宽的底物特异性,除水解大麦葡聚糖外,还能水解壳聚糖、羧甲基纤维素钠。该酶分子质量为41.5 kD,最适反应温度和pH值分别为50 ℃、5.0。细菌来源β-1,3-1,4-葡聚糖酶热稳定性普遍低于真菌来源β-1,3-1,4-葡聚糖酶,最适pH值以中性居多。仅芽孢杆菌N137来源的β-1,3-1,4-葡聚糖酶最适pH值为9.0,在pH 12.0条件下仍然保持80%以上的活性[42]。由于细菌来源β-1,3-1,4-葡聚糖酶来源广泛、表达量大、制备条件成熟,目前已大规模用于工业生产。随着分子生物学技术的发展,越来越多的β-1,3-1,4-葡聚糖酶基因得到克隆表达,利用大肠杆菌、毕赤酵母等表达载体高效异源表达进一步拓宽了β-1,3-1,4-葡聚糖酶的来源,降低了β-1,3-1,4-葡聚糖酶的生产成本。
4 4 β-1,3-1,4-葡聚糖酶的应用
β-1,3-1,4-葡聚糖酶在食品工业中的应用潜力非常广泛。主要包括:提高果汁澄清度、提高啤酒及食用油榨取产率、提高烘焙食品质量以及饲料工业中用于提高饲料吸收率。其中在啤酒酿造及饲料工业中的应用目前研究较为充分。
4.1啤酒酿造中的应用
β-1,3-1,4-葡聚糖广泛应用于啤酒生产中。大麦是生产啤酒的主要原料,在啤酒制麦过程中,大麦中内源性β-1,3-1,4-葡聚糖酶因热失活,其胚乳细胞壁中的β-葡聚糖大量溶解在麦芽汁中,不仅使麦芽浸出率降低,而且还增大了麦芽汁黏度,造成过滤困难,最终还可能在啤酒中形成凝胶絮状沉淀,这不仅提高了啤酒的生产成本,还影响啤酒的质量。在啤酒生产过程中添加适量的β-1,3-1,4-葡聚糖酶能较好地解决上述问题。β-1,3-1,4-葡聚糖酶在啤酒生产中发挥的主要4 种功能为:降解麦芽中的β-葡聚糖,降低麦汁黏度,提高过滤速度与麦汁的澄清度;提高糖化生产能力,促进可发酵性糖比例的提高,降低粮耗;提高啤酒的胶体稳定性,消除β-葡聚糖引起的冷浑浊;降解β-葡聚糖,提高纯生啤酒生产过程中滤膜的使用效率,延长膜的使用寿命。目前商品β-1,3-1,4-葡聚糖的价格一般在800~1 500元/kg,β-1,3-1,4-葡聚糖在啤酒麦芽汁中的添加量一般为0.01%~0.02%(以麦芽干质量计)[2]。Bai Yingguo等[43]从Alicyclobacillus sp. A4中得到一种新的属于GH9家族的β-葡聚糖酶并将其应用于麦芽糖化实验中,添加20 U/mL的β-1,3-1,4-葡聚糖酶,能将麦芽汁过滤时间缩短26.7%,黏度降低6.12%,将该葡聚糖酶与商用木聚糖酶混合使用,麦芽汁过滤时间和黏度分别降低31.7%和8.79%。Celestino等[44]利用Rhizopus microsporus var. microsporus产的β-1,3-1,4-葡聚糖酶能将麦芽汁过滤时间缩短20.4%,黏度降低4.7%,而其用酶量仅为11.0 μg。McCarthy等[45]利用Talaromyces emersonii的紫外突变菌株所产的β-1,3-1,4-葡聚糖酶粗酶液能将麦芽汁的黏度由3.680 mPa·s最低降到1.587 mPa·s,相同过滤时间内,滤液由100 mL增加到115 mL。其所用的粗酶液中同时具有β-1,3-1,4-葡聚糖酶活性、纤维素酶活性、β-1,3-葡聚糖酶活性以及β-葡萄糖苷酶活性。
4.2饲料工业中的应用
β-1,3-1,4-葡聚糖目前也广泛应用在饲料工业中。用大麦作为饲料的主要原料时,猪及禽类等单胃动物自身不能合成β-1,3-1,4-葡聚糖酶,其消化道内也没有能够分泌该酶的微生物,从而使β-葡聚糖成为单胃动物饲料的一种抗营养因子,降低了饲料的效果和养分的消化吸收,限制了大麦等在饲料中的应用。此外,饲料中无法消化的葡聚糖使得饲料黏度较高,不利于小肠对营养物质的吸收。而β-葡聚糖酶能将大麦中的β-葡聚糖降解为小分子,使之失去抗营养特性,从而有利于动物对营养物质的消化和吸收,提高动物的生长性能和粮食的转化率[46]。研究表明,饲料中添加β-葡聚糖及木聚糖酶后,仔猪小肠对饲料中葡萄糖的有效摄取率有一定程度提高[47]。β-1,3-1,4-葡聚糖目前在禽类饲料添加中的研究较为广泛,其在家禽饲养实验中的应用效果也要明显好于家畜中的效果。调质制粒、挤压膨化是目前饲料生产中最主要的热处理工艺。饲料在制粒时,除了蒸汽加热作用外,还有环模与压辊的高压剪切作用,以及饲料中其他添加剂的混合作用,易对饲料中酶制剂的活性造成损坏。因此,开发稳定性较强,尤其是热稳定性较好的β-1,3-1,4-葡聚糖酶对于其在饲料中的应用具有重要意义。
5 结 语
β-1,3-1,4-葡聚糖酶作为一种新型添加剂,具有广泛而显著的经济效益和社会效益,开发前景十分广阔。但目前已有的β-1,3-1,4-葡聚糖酶还存在一些不足,例如稳定性较差、酶活力偏低、酸碱及温度适应性较差等,还不能完全满足工业应用的需求。因此,在现有研究基础上,开发种类更多、酶活力更高、稳定性和适用性更好的β-1,3-1,4-葡聚糖酶还有待进一步探索。此外,目前已报道的β-1,3-1,4-葡聚糖酶主要来源于GH16及GH17家族,其他家族的β-1,3-1,4-葡聚糖酶报道并不多见,其酶学性质、应用及催化机理均有待进一步研究。
随着基因工程及蛋白质工程技术的发展,越来越多不同来源及特异性各异的β-1,3-1,4-葡聚糖酶结构已得到解析。近年来,利用β-1,3-1,4-葡聚糖酶结构生物学信息,采用酶工程理性设计改造手段,得到具有更优异性能的β-1,3-1,4-葡聚糖酶也成为一项研究热点。越来越多的研究者涉及到这一领域,一些研究表明,对关键位点氨基酸的定点突变能够有效提高β-1,3-1,4-葡聚糖酶的热稳定性或提高酶的催化能力[13,48-49]。通过对β-1,3-1,4-葡聚糖酶催化凹槽的改造能够改变酶的底物特异性,使得β-1,3-1,4-葡聚糖酶同时能够接受支链木聚糖底物[50]。此外,定向进化等手段也是改造β-1,3-1,4-葡聚糖酶的一个有效手段。一些研究表明,通过定向进化能够得到热稳定性改善的新型β-1,3-1,4-葡聚糖酶[7,51]。因此,解析具有特殊功能的β-1,3-1,4-葡聚糖酶蛋白质结构,了解其催化机理,并利用现有结构生物学信息改造现有β-1,3-1,4-葡聚糖酶仍是今后的一项研究热点。
嗜热或嗜酸微生物是微生物资源中较为特殊的一类,它们通常能够在生长和代谢过程中产生一些具有特殊催化能力的酶类,这些酶类与一般微生物来源的酶相比具有稳定性强、适用面广等优势,在工业生产中具有更好的应用前景。近年来,嗜热及嗜酸微生物中的β-1,3-1,4-葡聚糖酶的筛选以及基因资源的开发也逐渐得到重视。一系列嗜热真菌中的β-1,3-1,4-葡聚糖酶得到纯化或部分新型β-1,3-1,4-葡聚糖酶基因得到克隆表达[19,27]。利用极端环境微生物这些优势,开发新型β-1,3-1,4-葡聚糖酶仍然值得进一步研究。
[1] PLANAS A. Bacterial 1,3-1,4-beta-glucanases: structure, function and protein engineering[J]. Biochimica et Biophysica Acta, 2000, 1543(2):361-382. DOI:10.1016/S0167-4838(00)00231-4.
[2] 毕静. β-葡聚糖酶在啤酒生产中的应用研究[J]. 中国酿造, 2011,30(9): 105-106. DOI:10.3969/j.issn.0254-5071.2011.09.028.
[3] 张洁, 蔡敬民, 吴克, 等. β-葡聚糖酶的研究与应用前景[J]. 安徽农业科学, 2003, 31(5): 895-896. DOI:10.3969/j.issn.0517-6611.2003.05.109.
[4] QIAO Jiayun, DONG Bing, LI Yihang, et al. Cloning of a beta-1,3-1,4-glucanase gene from Bacillus subtilis MA139 and its functional expression in Escherichia coli[J]. Applied Biochemistry and Biotechnology, 2009,152(2): 334-342. DOI:10.1007/s12010-008-8193-4.
[5] FURTADO G P, RIBEIRO L F, SANTOS C R, et al. Biochemical and structural characterization of a beta-1,3-1,4-glucanase from Bacillus subtilis 168[J]. Process Biochemistry, 2011, 46(5): 1202-1206. DOI:10.1016/j.procbio.2011.01.037.
[6] MASIL AMANI R, SHAMA O P, MUTHUVEL S K, et al. Cloning,expression of β-1,3-1,4-glucanase from Bacillus subtilis SU40 and the effect of calcium ion on the stability of recombinant enzyme: in vitro and in silico analysis[J]. Bioinformation, 2013, 9(19): 958-962. DOI:10.6026/97320630009958. eCollection 2013.
[7] PEI Honglei, GUO Xiaojing, YANG Wenhan, et al. Directed evolution of a beta-1,3-1,4-glucanase from Bacill us subtilis MA139 for improving thermal stability and other characteristics[J]. Journal of Basic Microbiology, 2015, 55(7): 869-878. DOI:10.1002/ jobm.201400664.
[8] APIRAKSAKOM J, NITISINPRASERT S, LEVIN R E. Grass degrading beta-1,3-1,4-D-glucanases from Bacillus subtilis GN156: purifi cation and characterization of glucanase J1 and pJ2 possessing extremely acidic pI[J]. Applied Biochemistry and Biotechnology,2008, 149: 53. DOI:10.1007/s12010-007-8058-2.
[9] WANG Jinjing, NIU Chengtuo, LIU Xiaoling, et al. Characterization of a new 1,3-1,4-beta-glucanase gene from Bacillus tequilensis CGX5-1[J]. Applied Biochemistry and Biotechnology, 2014, 173(3): 826-837. DOI:10.1007/s12010-014-0900-8.
[10] 郑元平, 袁康培, 冯明光. 啤酒用β-葡聚糖酶高产菌株的选育及发酵条件优化[J]. 农业生物技术学报, 2004, 12(3): 316-321. DOI:10.3969/j.issn.1674-7968.2004.03.015.
[11] TENG Da, FAN Ying, YANG Yalin, et al. Codon optimization of Bacillus licheniformis beta-1,3-1,4-glucanase gene and its expression in Pichia pastoris[J]. Applied Mi crobiology and Biotechnology, 2007,74(5): 1074-1083. DOI:10.1007/s00253-006-0765-z.
[12] CHAARI F, BHIRI F, BLIBECH M, et al. Potential application of two thermostable lichenases from a newly isolated Bacillus licheniformis UEB CF: purifi cation and characterization[J]. Process Biochemistry,2012, 47(3): 509-516. DOI:10.1016/j.procbio.2011.12.010.
[13] NIU Chengtuo, ZHU Linjiang, WANG Jinjing, et al. Simultaneous enhanced catalytic activity and thermostability of a 1,3-1,4-betaglucanase from Bacillus amyloliqueformis by chemical modifi cation of lysine residues[J]. Biotechnology Letter, 2014, 36(12): 2453-2460. DOI:10.1007/s10529-014-1616-0.
[14] 郝秋娟, 李永仙, 李崎, 等. 淀粉液化芽孢杆菌5582产β-葡聚糖酶的发酵条件和酶学性质 研究[J]. 食品工业科技, 2006, 27(8): 149-153. DOI:10.3969/j.issn.1002-0306.2006.08.048.
[15] AKITA M, KAYATAM K, HATADA Y, et al. A novel beta-glucanase gene from Bacillus halodurans C-125[J]. FEMS Microbiology Letter,2005, 2 48(1): 9-15. DOI:10.1016/j.femsle.2005.05.009.
[16] KIM J Y. Overproduction an d secretion of Bacillus circulans endo-beta-1,3-1,4-glucanase gene (bglBC1) in B. subtilis and B. megaterium[J]. Biotechnology Letters, 2003, 25(17): 1445- 1449. DOI:10.1023/A:1025059713425.
[17] NA H B, JUNG W K, JEONG Y S, et al. Characterization of a GH family 8 beta-1,3-1,4-glucanase with distinctive broad substrate specifi city from Paenibacillus sp. X4[J]. Biotechnology Letter, 2015,37(3): 643-655. DOI:10.1007/s10529-014-1724-x.
[18] 李卫芬, 陆平, 周绪霞. 多粘芽孢杆菌β-葡聚糖酶特性及其基因克隆[J]. 浙江大学学报(农业与生命科学版), 2004(3): 97-101. DOI:10.3321/j.issn:1008-9209.2004.03.021.
[19] MAO Shurui, LU Zhaoxin, ZHANG Chong, et al. Purification,characterization, and heterolog ous expression of a thermostable beta-1,3-1,4-glucanase from Bacillus altitudinis YC-9[J]. Applied Biochemistry and Biotechnology, 2013, 169(3): 960-975. DOI:10.1007/s12010-012-0064-3.
[20] WEN T N, CHEN J L, LEE S H, et al. A truncated Fibrobacter succinogenes 1,3-1,4-beta-d-glucanase with improved enzymatic ac tivity and thermotolerance[J]. Biochemistry, 2005, 44(25): 9197-9205. DOI:10.1021/bi0500630.
[21] HUANG Huoqing, YANG Peilong, LUO Huiying, et al. High-level expression of a truncated 1,3-1,4-beta-D-glucanase from Fibrobacter succinogenes in Pichia pastoris by optimizati on of codons and fermentation[J]. Applied Microbiology and Biotechnology, 2008,78(1): 95-103. DOI:10.1007/s00253-007-1290-4.
[22] TSAI L C, SHYUR L F, CHENG Y S, et al. Crystal structure of truncated Fibrobacter succinogenes 1,3-1,4- beta-D-glucanase in complex with beta-1,3-1,4-cellotriose[J]. Journ al of Molecular Biology, 2005, 354(3): 642-651. DOI:10.1016/j.jmb.2005.09.041.
[23] EKINCI M S, MCCRAE S I, FLINT H J. Isolation and overexpression of a gene encoding an extracellular beta-(1,3-1,4)-glucanase from Streptococcus bovis JB1[J]. Applied and Environmental Microbiology,1997, 63(10): 3752-3756.
[24] HONG M R, KIM Y S, JOO A R, et al. Purification and characterization of a thermostable b eta-1,3-1,4-glucanase from Laetiporus sulphureus var. miniatus[J]. Journal of Microbiology and Biotechnology, 2009, 19(8): 818-822. DOI:10.4014/jmb.0812.6 74.
[25] CHEN Chunchi, HUANG Jianwen, ZHAO Puya, et al. Structural analyses and yeast production of the beta-1,3-1,4-glucanase catalytic module encoded by the licB gene of Clostridium thermocellum[J]. Enzyme and Microbial Technology, 2015, 71: 1-7. DOI:10.1016/ j.enzmictec.2015.01.002.
[26] 吕文平, 许梓荣, 孙建义, 等. 一株嗜热梭菌β-葡聚糖酶基因的克隆和表达[J]. 科技通报, 2005(1): 45-49. DOI:10.3 969/ j.issn.1001-7119.2005.01.010.
[27] YANG Shaoqing, YAN Qiaojuan, JIANG Zhengqiang, et al. Biochemical characterization of a novel thermostable beta-1,3-1,4-glucanase (lichenase) from Paecilomyces thermophila[J]. Journal of Agricultural and Food Chemistry, 2008, 56(13): 5345-5351. DOI:10.1021/jf800303b.
[28] TANG Yanbin, YANG Shaoqing, YAN Qiaojuan, et al. Purifi cation and characterization of a novel beta-1,3-1,4-glucanase (lichenase) from thermophilic Rhizomucor miehei with high specific activity and its gene sequence[J]. Journal of Agricultural and Food Chemistry, 2012,60(9): 2354-2361. DOI:10.1021/jf2049799.
[29] YANG Shaoqing, XIONG Hao, YA N Qiaojuan, et al. Purifi cation and characterization of a novel alkaline beta-1,3-1,4-glucanase (lichenase)from thermophilic fungus Malbranchea cinnamomea[J]. Journal of Industrial Microbiology and Biotechnology, 2014, 4 1(10): 1487-1495. DOI:10.1007/s10295-014-1494-4.
[30] LUO Huiying, YANG Jun, YANG Peilong, et al. Gene cloning and expression of a new acidic family 7 endo-beta-1,3-1,4-glucanase from the acidophilic fungus Bispora sp. MEY-1[J]. Applied Microbiology and Biotechnology, 2010, 85(4): 1015-1023. DOI:10.1007/s00253-009-2119-0.
[31] MURRAY P G, GRASSICK A, LAFFEY C D, et al. Isolation and characterization of a th ermostable endo-beta-glucanase active on 1,3-1,4-beta-D-glucans from the aerobic fungus Talaromyces emersonii CBS 814.70[J]. Enzyme and Microbial Technology, 2001, 29(1): 90-98. DOI:10.1016/S0141-0229(01)00354-4.
[32] MCLEOD A, SMART C D, FRY W E. Characterization of 1,3-betagl ucanase and 1,3;1,4-beta-glucanase genes from Phytophthora infestans[J]. Fungal Genetics and Biology, 2003, 38(2): 250-263. DOI:10.1016/S1087-1845(02)00523-6.
[33] 丁叶梅, 贠建民, 魏龙, 等. 碎囊毛霉产β-1,3-1,4-葡聚糖酶的分离纯化及其酶学性质[J]. 食品科学, 2014, 35(11): 143-148. DOI:10.7506/ spkx1002-6630-201411029.
[34] 孙玉英, 王瑞明. β-葡聚糖酶的研究进展[J]. 山东商业职业技术学院学报, 2002(3): 11-13. DOI:10.3969/j.issn.1671-4385.2002.03.004.
[35] KUGE T, NAGOYA H, TRYFONA T, et al. Action of an endo-beta-1,3(4)-glucanase on cellobiosyl unit structure in barley beta-1,3:1,4-glucan[J]. Bioscience, Biotechnology, and Biochemistry, 2015, 79(11): 1810-1817. DOI:10.1080/09168451.2015.1046365.
[36] RIEDER A, BALLANCE S, KNUTSE S H. Viscosity based quantification of endogenous beta-glucanase activity in flour[J]. Carbohydrate Polymers, 2015, 115: 104-111. DOI:10.1016/ j.carbpol.2014.08.075.
[37] CHENG Y S, HUANG C H, CHEN C C, et al. Structural and mutagenetic analyses of a 1,3-1,4-beta-glucanase from Paecilomyces thermophila[J]. Biochimica et Biophysica Acta, 2014, 1844(2): 366-373. DOI:10.1016/j.bbapap.2013.11.005.
[38] GAISER O J, PIOTUKH K, PONNUSWAMY M N, et al. Structural basis for the substrate specificity of a Bacillus 1,3-1,4-betaglucanase[J]. Journal of Molecular Biology, 2006, 357(4): 1211-1225. DOI:10.1016/j.jmb.2006.01.014.
[39] VASUR J, KAWAI R, JONSON K H, et al. Synthesis of cyclic beta-glucan using laminarinase 16A glycosynthase mutant from the basidiomycete Phanerochaete chrysosporium[J]. Journal of the American Chemical Society, 2010, 132(5): 1724-1730. DOI:10.1021/ ja909129b.
[40] VARGHESE J N, GARRETT T P, COLMAN P M, et al. Threedimensional structures of two plant beta-glucan endohydrolases with distinc t substrate specifi cities[J]. Proceedings of the National Academy of Sciences of the United States of America, 1994, 91(7): 2785-2789. DOI:10.1073/pnas.91.7.2785.
[41] MÜLLER J J, THOMSEN K K, HEINEMANN U. Crystal structure of barley 1,3-1,4-beta-glucanase at 2.0-☒ resoluti on and comparison with Bacillus 1,3-1,4-beta-glucanase[J]. The Journal of Biological Chemistry, 1998, 273: 3438-3446. DOI:10.1074/jbc.273.6.3438.
[42] TABEMERO C, COLL P M, FERNÁNDEZ-ABALOS J M, et al. Cloning and DNA sequencing of bgaA, a gene encoding an endo-beta-1,3-1,4-glucanase, from an alkalophilic Bacillus strain (N137)[J]. Applied and Environmental Microbiology, 1994, 60(4): 1213-1220.
[43] BAI Yingguo, WANG Jianshe, ZHANG Zhifang, et al. A novel family 9 beta-1,3(4)-glucanase from thermoacidophilic Alicyclobacillus sp. A4 with potential applications in the brewing industry[J]. Applied Microbiology and Biotechnology, 2010, 87(1): 251-259. DOI:10.1007/ s00253-010-2452-3.
[44] CELESTINO K R S, CUNHA R B, FELIX C R. Characterization of a beta-glucanase produced by Rhizopus microsporus var. microsporus,and its potential for application in the brewing industry[J]. BMC Biochemi stry, 2006, 7: 23. DOI:10.1186/1471-2091-7-23.
[45] MCCARTHY T C, LALOR E, HANNIFFY O, et al. Comparison of wild-type and UV-mutant beta-glucanase-producing strains of Talaromyces emersonii with potential in brewing applications[J]. Journal of Industrial Microbiology and Biotechnology, 2005, 32(4): 125-134. DOI:10.1007/s10295-005-0207-4.
[46] 郭小权, 胡国良, 刘妹. β-葡聚糖的抗营养作用及β-葡聚糖酶在饲料中的应用[J]. 江西饲料, 2001(2): 11-13. DOI:10.3969/ j.issn.1008-6137.2001.02.007.
[47] AGYEKUM A K, SANDS J S, REGASSA A, et al. Effect of supplementing a fi brous diet with a xylanase and beta-glucanase blend on growth performance, intestinal glucose uptake, and transportassociated gene expression in growing pigs[J]. Journal of Animal Science, 2015, 93(7): 3483-3493. DOI:10.2527/jas.2015-9027.
[48] MAO Shurui, GAO Peng, LU Zhaoxin, et a l. Engineering of a thermostable beta-1,3-1,4-glucanase from Bacillus altitudinis YC-9 to improve its catalytic effi ciency[J]. Journal of the Science of Food and Agriculture, 2016, 96(1): 109-115. DOI:10.1002/jsfa.7066.
[49] NIU C, ZHU L, ZHU P, et a l. Lysine-based site-directed mutagenesis increased rigid beta-sheet structure and thermostability of mesophilic 1,3-1,4-beta-glucanase[J]. Journal of Agricultural and Food Chemistry,2015, 63(21): 5 249-5256. DOI:10.1021/acs.jafc.5b00480.
[50] ADDINGTON T, CALISTO B, ALFONSO-PRIETO M, et al. Re-engineering specificity in 1,3-1,4-beta-glucanase to accept branched xyloglucan substrates[J]. Proteins Structure Function and Bioinfo rmatics, 2011, 79(2): 365-375. DOI:10.1002/prot.22884.
[51] 秦久福, 高威威, 李崎, 等. 通过体外分子进化技术提高淀粉液化芽胞杆菌BS5582 β-1,3-1,4-葡聚糖酶热稳定性[J]. 生物工程学报,2010, 26(9): 1293-1301. DOI:10.13345/j.cjb.2010.09.008.
Advances in Research on β-1,3-1,4-Glucanase
XIA Xuhan, ZHU Chenglin, LI Cheng*
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
β-1,3-1,4-Glucanases (EC 3.2.1.73) are a class of endo-type glucoside hydrolases widely distributed in bacteria,fungi and plants. They can randomly hydrolyze β-1,4-linkages in β-1,3-1,4-glucans from cereals and have great potential in the food and feed industries. To date, there are three glycoside hydrolase families (GH16, GH17 and GH26) which β-1,3-1,4-glucanases belong to whose crystal structures have been resolved. This paper reviews the current knowledge about the sources, properties, structures and functionalities of β-1,3-1,4-glucanases as well as their recent applications in the food and feed industry.
β-1,3-1,4-glucanase; enzyme characteristics; structure and functionality; application
10.7506/spkx1002-6630-201619048
Q814.4
A
1002-6630(2016)19-0289-07
夏许寒, 朱成林, 李诚. β-1,3-1,4-葡聚糖酶研究进展[J]. 食品科学, 2016, 37(19): 289-295. DOI:10.7506/spkx1002-6630-201619048. http://www.spkx.net.cn
XIA Xuhan, ZHU Chenglin, LI Cheng. Advances in research on β-1,3-1,4-glucanase[J]. Food Science, 2016, 37(19):289-295. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201619048. http://www.spkx.net.cn
2016-03-10
夏许寒(1995—),男,本科,研究方向为食品科学与工程。E-mail:xiaxuhanxh@163.com
李诚(1964—),男,教授,硕士,研究方向为畜产品加工与质量安全控制。E-mail:lichenglcp@163.com

