妊娠期糖尿病大网膜前脂肪细胞原代培养及增殖分化模型的建立*
潘宝龙,马润玫
(昆明医科大学,云南 昆明 650031)
妊娠期糖尿病大网膜前脂肪细胞原代培养及增殖分化模型的建立*
潘宝龙,马润玫
(昆明医科大学,云南 昆明 650031)
目的建立妊娠期糖尿病(GDM)大网膜前脂肪细胞原代培养及向成熟脂肪细胞增殖分化的模型,为脂肪细胞体外研究奠定基础。方法使用改良的细胞培养法,以GDM剖宫产患者大网膜纯脂肪组织为原材料,作前脂肪细胞的原代培养和传代,绘制传代前脂肪细胞的生长曲线,并对传代前脂肪细胞做诱导分化,对已诱导分化细胞通过油红O染色和逆转录聚合酶链反应检测脂联素mR NA,并进行细胞冻存和复苏实验。结果培养出的前脂肪细胞基本均为梭形细胞,增殖旺盛,第4天细胞开始快速增殖,倍增时间约为48h。第7天原代前脂肪细胞开始出现脂肪颗粒,而传代细胞仍然保持梭形和无脂滴。传代前脂肪细胞经成脂诱导,出现定向分化,经油红O脂肪染色和脂联素mR NA测定,证明已诱导分化为成熟脂肪细胞。结论GDM大网膜脂肪组织中具有前脂肪细胞,可进行连续传代和大量扩增。原代前脂肪细胞在培养增殖过程中,会自然出现向成熟脂肪细胞分化,而传代后前脂肪细胞则失去分化能力,经适当诱导后可定向分化为成熟脂肪细胞。模型的建立,可为后续脂肪细胞体外实验研究做好前期准备。
前脂肪细胞;细胞培养;细胞模型
脂肪组织是一个功能强大的内分泌器官,可分泌瘦素、脂联素等脂肪因子,其可能对胰岛素抵抗、心血管功能、糖脂代谢、系统炎症及骨代谢起调节作用[1-3]。目前,学术界对脂肪因子展开的生物学研究的体外实验载体基本采用啮齿类动物脂肪细胞[4-6]。不可忽视的一个影响因素是,啮齿类动物与人类存在明显的遗传学差异,两者的代谢途径也截然不同。因此,将其作为实验载体往往难以避免潜在的实验缺陷问题,从而影响实验数据和结论的科学性。相对而言,人源前脂肪细胞是人体中一种特异化的前体细胞,具有增殖能力和向成熟脂肪细胞定向分化的能力,在人的一生中均存在并持续作用,且与糖尿病、肥胖、动脉硬化等代谢类疾病关系密切[7]。以人源细胞作为研究载体,更具科学性,并且以取自相应疾病患者网膜组织而培养传代的前脂肪细胞,可能更多地保留该疾病其他的基因信息,更真实地模拟疾病的基因环境,使结果更具有说服力。本研究在查阅大量文献的基础上,对体外脂肪细胞的培养方法做一定程度的改良,尝试建立妊娠期糖尿病(gestational diabetes mellitus,GDM)患者大网膜前脂肪细胞体外原代培养及增殖分化模型,以期为后续的研究奠定基础。
1 材料与方法
1.1前脂肪细胞的原代培养
实验前,遵循医学伦理学规定报批,并取得患者知情同意。取GDM剖宫产患者大网膜相对纯净脂肪组织10~20g,去除可见血管及纤维成分,pH 7.2磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤,剪成尽可能小的碎糊状。按照1∶2体积比加入Ⅰ型胶原酶溶液(2mg/ml),5%二氧化碳CO2培养箱,37℃消化3 h,1 000 r/min离心10 min。弃上清液和漂浮的脂肪细胞,37℃红细胞裂解液处理沉淀细胞5~10min,分别以100和200目不锈钢网过滤。1000r/min离心10min,弃上清,将沉淀细胞加入前脂肪细胞基本培养基[杜尔伯科改良伊格尔培养基(dulbecco modified eagle medium,DMEM)],轻轻吹打悬浮细胞,调配细胞浓度为1×105个/cm3,接种于6孔板中,37℃、5%CO2培养。观察细胞贴壁后立即进行培养基更换,并除去未贴壁细胞。每日监测,每3天进行1次培养基更换。
1.2前脂肪细胞的传代
待细胞生长至单层融合接近80%时,可进行细胞传代。实验前用75%酒精擦拭超净工作台,并提前开启紫外灯静态杀菌30min。弃培养瓶内的培养基,PBS洗涤细胞2次,弃PBS液,加入2 ml胰酶37℃进行消化,待细胞稍微变圆后,立即将培养瓶竖起使胰酶与细胞分离,弃瓶中胰酶,加入新鲜培养基,并将瓶壁上的细胞吸管反复吹打混匀,调整细胞密度为1×105个/cm3,分别接种至75 cm2培养皿6和24孔板中。每3天进行1次培养基更换。当传代细胞生长至单层融合接近80%时,可再次进行,往下传代。
1.3绘制传代前脂肪细胞的生长曲线
使用1个24孔板作为细胞生长曲线监测板,每2孔为1组,将24孔随机分成12组,每天检测1组,计数2孔各自细胞总数,取平均值,以此类推,连续计数12d,至12组结束,并绘制细胞生长曲线。
1.4传代前脂肪细胞的诱导分化
待传代细胞生长至单层融合接近80%时,可进行细胞诱导分化。将培养基更换为分化培养基(制备方法见附表),5%CO2培养箱中培养48 h,更换培养基为含10μg/ml胰岛素的基本培养基,培养48h后,将培养基更换为基本培养基继续培养,监测细胞内出现脂肪颗粒的数量和速度。可根据实验需求继续或停止培养。
1.5油红O染色
吸弃孔板内培养液,PBS冲洗细胞3次,每孔分别加入10%甲醛磷酸盐缓冲溶液1.5ml,在常温下固定20 min,吸弃固定液,PBS冲洗细胞3次,60%异丙醇冲洗1次,37℃干燥5 min,每孔加入油红O染液1.5 ml,室温染色2 h,双蒸水反复冲洗将油红洗去,37℃干燥5min,置显微镜下观察和拍照。

附表 分化培养基配制
1.6前脂肪细胞、成熟脂肪细胞逆转录聚合酶链反应检测脂联素mRNA
1.6.1R NA提取使用美国Invitrogen公司生产的Trizol试剂抽提,按照试剂盒说明书进行操作,以日本UV-2450紫外分光光度计检测所抽提RNA含量和纯度。
1.6.2聚合酶链反应(polymerase chain reaction,PCR)扩增和琼脂糖凝胶电泳脂联素mRNA引物序列:正向引物:5'-ATCGGTGAAACCGGAGTACC-3',反向引物:5'-GCATGTTGGGGATAGTAACGTAA-3',扩增产物长度148bp,体系为25μl。扩增产物以2%琼脂糖凝胶电泳,紫外灯下判读,凝胶成像系统拍照。
1.7细胞冻存
培养瓶内细胞经消化和吹打制成细胞悬液,1 000 r/min离心10 min,弃上清液,加入1 ml冷冻液保存(DMEM∶胎牛血清∶二甲基亚砜=8∶1∶1)吹打混匀后移入冻存管,封口,4℃放置40 min,置入-20℃冰箱冷冻2 h,再置入-80℃冰箱冷冻保存,如短期内不使用则移入液氮(-196℃)中保存。
1.8细胞复苏
从液氮中取出冷冻管,迅速投到37℃水中,并不断摇动(使管中的液体迅速融化),待完全溶解后取出,75%酒精擦拭冻存管外壁,超净工作台内取出管内液体,1000r/min离心10min,弃上清液,加入37℃、10 ml基本培养基,吹打制成细胞悬液,计数后调整浓度为1×105个/ml,分装入培养瓶内,37℃、5%CO2培养箱中进行培养,24h后更换为新鲜培养基,每日监测,每3天进行1次培养基更换。待细胞长到培养瓶的80%后进行传代培养。
2 结果
2.1原代培养的前脂肪细胞
培养6 h即可见部分细胞贴壁,13 h细胞贴壁率70%,24 h后基本全部贴壁,细胞呈不规则形,较为分散,数目较少。第3天观察基本变为梭形细胞,少数呈多角形,细胞数目也有所增加。第4天细胞开始进入快速增殖,第7天原代前脂肪细胞形态出现改变,逐渐由梭形变椭圆或圆形,胞内可见脂肪颗粒,而传代后细胞形态仍然保持梭形,局部可出现单层融合,细胞排列较为紧密。第9天发现原代前脂肪细胞内含有大量脂肪颗粒,说明大量原代细胞已自行分化为成熟脂肪细胞。而传代细胞至第9天后仍继续保持梭形,细胞基本单层融合,排列紧密,油红O染色仍未着色。见图1~3。

图1 原代前脂肪细胞第3天(油红O染色×100)

图2 原代前脂肪细胞第4天(油红O染色×100)
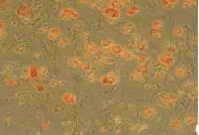
图3 原代前脂肪细胞第9天(油红O染色×100)
2.2传代培养的前脂肪细胞
传代后前脂肪细胞前4 d细胞形态及生长状况与原代前脂肪细胞极为相似,基本为梭形,大小较为均匀。5~6d后细胞进入快速增殖,排列平行紧密。通常第7天即可完成单层融合,光镜下观察,细胞内无反光小滴,说明无脂肪颗粒产生,即便培养9 d后油红O染色仍未着色(见图4)。其连续传代可大量扩增,但发现传代到5代后,增殖和分化率开始降低。
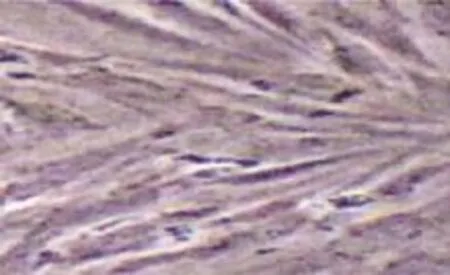
图4 传代前脂肪细胞第9天(油红O染色×100)
2.3前脂肪细胞的生长曲线
以第2代传代细胞为监测对象,使用1个24孔板作为细胞生长曲线监测板,每天随机计数2孔细胞,取平均值,连续计数12d。见图5。

图5 前脂肪细胞生长曲线
2.4第3代传代前脂肪细胞诱导分化
第3代传代细胞诱导后,出现向成熟脂肪细胞的定向分化。第6天即可见部分细胞开始出现单个散在反光小滴。随培养时间延长,细胞内脂滴逐渐增多,第12天可见胞内已聚集大量脂滴,经油红O染色初步证实分化成功。见图6、7。

图6 分化第6天(油红O染色×400)

图7 分化第12天(油红O染色×400)
2.5逆转录聚合酶链反应
前脂肪细胞无脂联素mRNA表达,成熟脂肪细胞有脂联素mRNA表达。见图8。

图8 逆转录聚合酶链反应
3 讨论
在传统医学中,脂肪组织仅被认为是人体储存脂质的场所,在人体能量不足的情况下,受刺激而释放能量。直到上世纪90年代,学者们发现脂肪瘦素的存在,传统医学对脂肪的认知才得以改变。脂肪组织不但可以作为人体能量的储存“库房”,同时其自身也具有活跃的内分泌功能,包括脂肪因子等,在人体能量稳态及调控糖、脂代谢平衡的维持中,发挥着重要作用。近年来,针对脂肪因子的研究越来越受到学术界的关注[8-10],因涉及医学伦理学原因,许多研究只能是局限于人体血清学和体内组织学的表象研究,而进一步更深层次的研究,如对于基因表达(过表达或沉默)与疾病的关系研究,只能以体外实验方式进行,常见的是细胞培养和动物模型。体外前脂肪细胞的培养,对于研究脂肪细胞、脂肪因子、相应细胞因子等与相关疾病的关系,具有重要的作用。同时,作为理想的脂肪细胞研究模型,有利于观察各种相关因素在脂肪组织发生、增殖及肥大整个演变过程中的调控作用,有助于对相关机制进行深入研究。
近年来,随着对人体脂肪组织大量研究工作的开展,对前脂肪细胞的原代培养方法、分离获取能力也提出更高的要求。学者们的培养方法不尽一致,各操作者自身的经验不一,实验室的条件也不尽相同,因而得出的结果和经验也各具特点[11-13]。对于人源前脂肪细胞培养,目前采用较多的是血管基质组分细胞培养法,操作较为简便,但最大的缺点是细胞的增殖和分化速度较慢,培养基中杂质较多,并且容易出现细胞大小不均,导致后期实验结果容易受到影响[12-13]。GARCIA等[14]曾提出细胞岛学说,认为细胞岛存在于成熟脂肪组织中,岛内细胞均为前脂肪细胞,具有高增殖速度和高分化能力,是脂肪组织的发源地,对脂肪组织的增生和肥大起至关紧要的作用。本研究笔者基于上述学说,总结前人经验,将天花板培养与脂肪组织块贴壁的方法相结合,着重加强和改良消化方式,将多数文献使用的消化方式(37℃、1 mg/mlⅠ型胶原酶,30~120 min)改良为按照1∶2体积比加入Ⅰ型胶原酶溶液(2 mg/ml),5%CO2培养箱,37℃消化3h,增加消化液使用量和浓度,延长消化时间,并且使用红细胞裂解液37℃处理沉淀细胞5~10min,以去除残留红细胞的污染,从而尽可能地达到较好地消化效果。实践证明上述改良是较为成功的,所得到培养细胞成分均一,数量较多,增殖较为旺盛,可能延长消化时间,更完全地消化成熟脂肪细胞,也更多地分离出细胞岛中前脂肪细胞。
对于前脂肪细胞的判别标准,有学者提出必须满足3个条件[15-16]:①细胞为经典的梭形形态,脂肪组织来源,胞浆内极少或无脂肪颗粒;②细胞增殖速度与同一个体的成纤维细胞类似,增倍时间短;③胰岛素促进下,细胞在单层融合后能形成成熟脂肪细胞,胞内可见脂肪滴,或者能检出特异性酶或脂联素。本研究取材于剖宫产GDM患者大网膜组织,经过消化、过滤、离心等系列处理后得到一些长梭形细胞,光镜下胞浆内不见反光小滴,也不能被油红O着色,培养之后细胞增殖快速,从细胞生长曲线可以看出,倍增时间约为48h,控制条件下可进行传代培养,传代细胞经诱导后可出现分化,经过油红O染色,初步证实分化成功。脂联素是目前国内外已经公认的成熟脂肪细胞特有的细胞因子[17-19],运用逆转录聚合酶链反应对诱导分化前后的细胞进行脂联素mRNA表达检测,发现诱导分化后的细胞有脂联素mRNA的表达,而未经诱导的传代细胞未能检测到脂联素mRNA,从而证实诱导分化后的细胞为成熟脂肪细胞。而本实验从网膜组织中分离得到的细胞,上述3个条件,是人源原代前脂肪细胞。
值得一提的是,本实验中笔者在原代和传代培养中发现,原代前脂肪细胞第7天开始有部分细胞形态发生改变,逐渐由梭形变椭圆乃至圆形,并且光镜下胞内可见脂肪颗粒,第9天发现原代前脂肪细胞内含有大量脂肪颗粒,说明大量原代细胞已自行分化为成熟脂肪细胞。而传代后前脂肪细胞直至第12天仍继续保持梭形,油红O染色仍未着色,必须经过诱导,才会出现细胞分化。本实验中经过多次重复培养,仍然出现该现象,证实GDM原代前脂肪细胞在体外培养过程中,会自然出现向成熟脂肪细胞分化,并不需要外加高浓度胰岛素和地塞米松,而传代后前脂肪细胞则出现失去分化的能力。原代前脂肪细胞会出现自然分化,无法传代,可能与该现象有关。而该现象的发生,可能与原代细胞来源于体内成熟脂肪组织,在体内可能已经被激活,或者仍然会携带某些体内分化因子,与外加的诱导剂作用相类似[20]。而传代后前脂肪细胞出现失去分化的能力,可能是随着不断传代,与人体内环境比较,体外培养环境出现越来越大的偏差,导致传代细胞发生一定程度生物学特性的变化,并且该变化随传代数增加而表现越发明显,具体表现为增殖和分化能力的不断下降。本研究结果也证实,通常传代在5代以内时,细胞的增殖及分化能力尚可,再往后传代则增殖和分化率开始降低。本实验后期所做细胞冻存和复苏实验中,也发现冷冻保存的细胞最佳选择为传代第2代或第3代细胞,并且只宜冻存复苏1次。同样涉及到细胞增殖和分化能力降低的问题,也从一个侧面说明本实验目前所使用冻存和复苏技术还存在一定的缺陷,有待进一步改进。
综上所述,GDM大网膜脂肪组织中具有前脂肪细胞,可进行连续传代和大量扩增。经适当诱导后可定向分化为成熟脂肪细胞。本课题组成功建立GDM患者大网膜前脂肪细胞原代培养及增殖的模型,为脂肪组织体外细胞学研究、脂肪因子体外表达研究、疾病发病机理等实验研究奠定基础。
[1]BAUMGARD L H,HAUSMAN G J,SANZ FERNANDEZ MV,et al.Insulin:pancreatic secretion and adipocyte regulation[J].Domest Anim Endocrinol,2016,54(1):76-84.
[2]MAO J,BATH S C,VANDERLELIE J J,et al.No effect of modest selenium supplementation on insulin resistance in UK pregnant women,as assessed by plasma adiponectin concentration[J]. Br J Nutr,2016,115(1):32-38.
[3]GARCIA-CARRIZO F,NOZHENKO Y,PALOU A,et al.Leptin effect on acetylation and phosphorylation of pgc1alpha in muscle cells associated with ampk and akt activation in high-glucose medium[J].J Cell Physiol,2016,231(3):641-649.
[4]聂绪强,杨建文,史海霞,等.IR-3T3-L1脂肪胰岛素抵抗细胞的建立[J].南方医科大学学报,2015,35(1):103-108.
[5]PRIETO-HONTORIA P L,PEREZ-MATUTE P,FERNANDEZGALILEA M,et al.Effects of alpha-lipoic acid on chemerin secretion in 3T3-L1 and human adipocytes[J].Biochim Biophys Acta,2016,1861(3):260-268.
[6]WANG C,WANG L,LI W,et al.Irisin has no effect on lipolysis in 3T3-L1 adipocytes or fatty acid metabolism in HepG2 hepatocytes[J].Endocrine,2015,49(1):90-96.
[7]LUJAN-HERNANDEZ J,LANCEROTTO L,NABZDYK C,et al. Induction of adipogenesis by external volume expansion[J].Plast Reconstr Surg,2016,137(1):122-131.
[8]BIL-LULA I,SOCHOCKA M,ZATONSKA K,et al.Adenovirus type 9 enhances differentiation and decreases cytokine release from preadipocytes[J].J Med Virol,2015,87(2):230-239.
[9]徐晓丽,丁攀,李晓霞,等.瘦素、脂联素与代谢综合征相关指标的关系[J].宁夏医科大学学报,2016,38(2):169-171.
[10]WURST U,EBERT T,KRALISCH S,et al.Serum levels of the adipokine Pref-1 in gestational diabetes mellitus[J].Cytokine,2015,71(2):161-164.
[11]闫美玲.LOX-1在棕榈酸诱导前脂肪细胞死亡、炎症及脂肪生成中的作用及机制[D].长沙:中南大学,2014.
[12]高鹏.生长激素与其信号分子STAT5B对脂肪细胞分化的影响[D].济南:山东大学,2015.
[13]张文瑾,孙建军.人脂肪间充质干细胞的分离及培养和鉴定[J].临床耳鼻咽喉头颈外科杂志,2016,24(9):57-60.
[14]GARCIA de HERREROS A,BIRNBAUM M J.The acquisition ofincreased insulin-responsive hexose transportin3T3-L1 adipocytes correlates with expression of a novel transporter gene[J]. J Biol Chem,1999,264(33):19994-19999.
[15]JANKOVIC A,KORAC A,SRDIC-GALIC B,et al.Differences in the redox status of human visceral and subcutaneous adipose tissues-relationships to obesity and metabolic risk[J].Metabolism, 2014,2(14):S0026-S0034.
[16]FERNANDEZ-TRASANCOS A,GUEROLA-SEGURA R,PARADELA-DOBARRO B,et al.Glucose and inflammatory cells decrease adiponectin in epicardial adipose tissue cells:paracrine consequences on vascular endothelium[J].J Cell Physiol,2016, 231(5):1015-1023.
[17]BAO W,BAECKER A,SONG Y,et al.Adipokine levels during the first or early second trimester of pregnancy and subse quent risk of gestational diabetes mellitus:a systematic review[J]. Metabolism,2015,64(6):756-764.
[18]WHITE U A,MAIER J,ZHAO P,et al.The modulation of adiponectin by STAT5-activating hormones[J].Am JPhysiol Endocrinol Metab,2016,310(2):E129-E136.
[19]CAWTHORN W P,SCHELLER E L,PARLEE S D,et al.Expansion of bone marrow adipose tissue during caloric restriction is associated with increased circulating glucocorticoids and not with hypoleptinemia[J].Endocrinology,2016,157(2):508-521.
[20]ABUNA R P,de OLIVEIRA F S,SANTOS TDE S,et al.Participation of TNF-alpha in inhibitory effects of adipocytes on osteoblast differentiation[J].J Cell Physiol,2016,231(1):204-214.
(童颖丹编辑)
Establishment of primary culture,proliferation and differentiation model of GDM preadipocytes*
Bao-long Pan,Run-mei Ma
(Kunming Medical University,Kunming,Yunnan 650031,China)
Objective To establish the model of primary culture,proliferation and differentiation of the gestational diabetes mellitus(GDM)epiploon preadipocytes,so as to lay the foundation for the follow-up study. Methods Using improved cell culture method,the pure fat tissue of greater omentum from GDM patients having cesarean section was used for the primary culture and passage.The growth curve of the preadipocytes was drawn.The adipocytes differentiated from preadipocytes after induction were determined by oil red O staining,and their adiponectin mRNA level was detected with RT-PCR to confirm the differentiation,and then the experimentsofcellcryopreservationandresuscitationwerecarriedout.ResultsTheprimarycultured preadipocytes were almost spindle cells with strong proliferation capacity.They began to proliferate rapidly on the 4th day,the doubling time was about 48 h.On the 7th day,the original generation of preadipocytes began to have fat particles,and the passage cells remained to be spindle without lipid drops.After induction,the passage preadipocytes showed oriented differentiation,oil red O staining and adiponectin mRNA measurement proved that the cells had differentiated into mature adipocytes.Conclusions Preadipocytes exit in GDM mature adipose tissue,can be continuously passaged and greatly amplified.In the culture progress,the original generation of preadipocytes will naturally differentiate into mature adipocytes,but the passaged preadipocyteslose the ability of differentiation,after appropriate induction,they can differentiate into mature fat cells. Keywords:preadipocyte;cell culture;cell model
R 714.255;R 589.2
A
10.3969/j.issn.1005-8982.2016.19.003
1005-8982(2016)19-0011-06
2016-05-23
国家自然科学基金(No:81160082)
马润玫,E-mail:pbl6916@163.com

