COX-2抑制剂联合舒尼替尼增强对荷瘤小鼠肾癌抑制作用的机制
赵 奇 胡骁轶△ 王国民 郭剑明 储以微
(1复旦大学附属中山医院泌尿外科 上海 200032;2复旦大学基础医学院免疫学系 上海 200032)
COX-2抑制剂联合舒尼替尼增强对荷瘤小鼠肾癌抑制作用的机制
赵奇1胡骁轶1△王国民1郭剑明1储以微2
(1复旦大学附属中山医院泌尿外科上海200032;2复旦大学基础医学院免疫学系上海200032)
目的通过COX-2抑制剂与舒尼替尼联合用药,观察其对荷RenCa肾癌BALB/c小鼠移植瘤的抑制作用,以及对小鼠外周血、脾脏、淋巴结的骨髓源性抑制细胞(myeloid-derived suppressor cell,MDSC)与调节性T细胞(regulatory T cell,Treg)的影响。方法建立BALB/c小鼠RenCa肾癌皮下移植瘤模型。模型动物分为4组,每组10只,分别为舒尼替尼治疗组、COX-2抑制剂(塞来昔布)治疗组、舒尼替尼+COX-2抑制剂治疗组和空白对照组。各组按时给药并绘制肿瘤生长曲线;流式细胞术检测小鼠外周血、脾脏中Treg、MDSC数目的变化;流式细胞术分选MDSC,提取蛋白质,Western blot检测STAT-3水平。结果联合用药组相较于对照组,脾脏MDSC数目明显降低(1.22%±0.15% vs.9.34%±0.58%,P <0.01),外周血MDSC数目明显降低(12.7%±0.85% vs.23.0%±1.68%,P <0.01),脾脏Treg明显降低 (11.3%±1.69% vs.22.4%±2.31%,P<0.01),外周血Treg明显降低(3.30%±0.64% vs.11.9%±1.53%,P<0.01)。经流式细胞术分选后的脾脏MDSC中,联合用药组较单用药组STAT-3水平明显下降(P<0.01)。结论COX-2抑制剂与舒尼替尼联合用药对肾透明细胞癌的抗肿瘤作用优于任何单独用药,其机制可能是通过减少免疫抑制细胞,调节机体肿瘤免疫环境,从而增强分子靶向药物的抗肿瘤效果。
酪氨酸激酶;肾细胞癌;环氧合酶-2;骨髓源性抑制细胞;调节性T细胞;抑制剂
近年来,以VEGF受体酪氨酸激酶抑制剂(vascular endothelial growth factor receptor tyrosine kinase inhibitor,VEGFR-TKI)为代表的分子靶向药物治疗,已经逐步替代传统的干扰素、白介素治疗,成为转移性肾细胞癌(metastatic renal cell carcinoma,mRCC)的标准治疗方案。然而,在临床实践中,TKI对晚期肾癌的疗效并不令人满意。同时,一些实验现象也不能通过TKI的作用机制来解释,如患者血清中VEGF水平与药物的反应率不平行,药物是否有效与患者VEGF水平并不相关[1];用药后肿瘤细胞凋亡发生在肿瘤滋养血管抑制之前,这与药物使肿瘤血管减少而抑制肿瘤生长的机制在时间顺序上存在矛盾[2]。这些研究都表明TKI除了抑制肿瘤血管形成以外,可能存在其他的抗肿瘤机制,需要其他治疗方式的协同作用。因此,肾癌的免疫治疗又开始重新进入了人们的视野。
本课题组前期的研究发现,肾癌作为一种免疫源性肿瘤过度表达Treg;COX-2抑制剂通过对Treg的抑制,可以对肾癌细胞产生明显的抑制作用。因此,本研究试图探讨COX-2抑制剂塞来昔布(celecoxib)增强舒尼替尼(sunitinib)对肾癌的抗肿瘤作用,并阐明TKI与肾癌免疫细胞之间的作用机制。
材 料 和 方 法
实验动物及主要试剂(1) 实验动物:清洁级BALB/c小鼠,雌性,40只,6~8周龄,(20±2) g,购自复旦大学动物实验中心。(2) 细胞系:BALB/c小鼠来源的肾癌细胞(RenCa),由复旦大学附属中山医院泌尿外科刘立博士惠赠,来源为ATCC® CRL-2947TM。(3)主要试剂及仪器:塞来昔布(美国辉瑞公司);苹果酸舒尼替尼原粉由美国辉瑞公司惠赠;抗鼠CD4、抗鼠CD25、抗鼠Foxp3、抗鼠CD11b、抗鼠Gr-1(上海莱兹生物公司);抗鼠STAT-3(英国Abcam公司);FC50FACS流式细胞检测仪(美国Beckman Coulter公司)。
荷肾癌小鼠模型建立及给药含10%胎牛血清的RPMI-1640培养液传代RenCa细胞,常规方法将1×107个RenCa细胞接种于BALB/c小鼠的靠近左大腿根部的肋侧皮下。相同饲料喂养15~20天左右,当肿瘤大小约为8 mm时随机抽取2只荷瘤小鼠,经病理检查符合小鼠异位肾癌(图1A、B)。
所有小鼠共分为4组:舒尼替尼治疗组、塞来昔布治疗组、舒尼替尼+塞来昔布治疗组和空白对照组。给药途径均为灌胃,给药量为:舒尼替尼53.6 mg/kg,塞来昔布50 mg/kg,隔日喂药,共给药4周,舒尼替尼和塞来昔布的给药剂量通过参考相关文献并结合预试验结果来确定[3],空白对照组予等体积PBS液灌胃。
观察并记录荷瘤小鼠肿瘤生长情况每隔一天用游标卡尺测量荷瘤小鼠移植瘤的最大径,计算各组平均值,并据此绘制瘤体生长曲线,同时密切观察小鼠进食情况、毛色光泽、精神状态等。根据实体瘤治疗疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST) 1.1判定药物的疗效。
A:The tumor of 8 mm;B:Under microscopy (HE,×200).
图1荷肾癌BALB/c小鼠建模(皮下种植16天后成瘤)
Fig 1RenCa tumor-bearing BALB/c mouse (16 days after implantation)
流式细胞术检测MDSC、Treg数目变化给药结束后眼眶取血收集荷瘤小鼠外周血1 mL,处死解剖小鼠并取脾脏,10 mL红细胞裂解液去除红细胞,室温500×g离心5 min洗涤细胞2次,去上清,用流式缓冲液制备成5×107个/mL单细胞悬液,加入含0.5 μL Fc-Block抗体混合均匀,4 ℃静置15 min,500×g离心5 min后去上清;加入含0.5 μL相应荧光标记的抗体,冰浴45 min;洗涤细胞,500×g离心5 min后去上清;用500 mL流式缓冲液重悬细胞,流式细胞仪上机检测相应蛋白的表达;BD Cell Quest软件分析相应数据。
流式细胞术分选MDSC把取得的脾脏细胞重悬稀释,运用流式细胞仪分离其中的MDSC。分选结束后再次用流式细胞仪检测,鉴定分选纯度。部分以0.4%台盼蓝染色,检测分选后细胞存活情况。
Western blot检测STAT-3水平分选得到的MDSC进行裂解并收集上清液,BCA试剂盒检测蛋白质浓度。每孔取20 μg样品经12% SDS-PAGE分离。电泳后转膜,加入稀释一抗过夜。洗膜后加入相应二抗,采用电化学发光法显色,用Bio-Rad凝胶成像系统照相记录。运用Image J软件进行分析,GraphPad Prism软件进行统计分析。
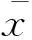
结 果
测量小鼠肿瘤模型皮下肿瘤各组小鼠经用药后,进食情况、毛色光泽及精神状态等均无明显差别。运用One way ANOVA进行组间比较,皮下移植瘤生长情况见图2。联合用药组7天后肿瘤大小与对照组的差异有统计学意义(P <0.01),塞来昔布组17天后起效(P <0.01),舒尼替尼组11天后起效(P<0.01)。21天后,联合用药组较两单药组抗肿瘤效果更为明显(P <0.01)。
图2各组皮下移植瘤生长曲线
Fig 2The growth curves of RenCa tumors in different groups
流式细胞术检测MDSC及Treg数目比较联合用药组与对照组、舒尼替尼组、塞来昔布组之间的外周血MDSC(图3)、脾脏MDSC(图4)、外周血Treg(图5)、脾脏Treg(图6),均呈明显抑制作用(P<0.01)。由于MDSC、Treg的下降,使得用药组小鼠外周血CD4+(图7)、脾脏CD4+(图8)细胞数目明显上升(P<0.01)。
MDSC的分选及其STAT-3检测经流式分选后的MDSC纯度为96.8%±0.89%。联合用药明显降低MDSC中STAT3信号通路的表达(P<0.01,图9)。
讨 论
肿瘤血管的生成需要肿瘤组织或间质组织分泌促血管生成的相关细胞因子,以这些因子为靶点抑制肿瘤血管生成,阻断肿瘤的营养来源和迁移通路,从而达到抑制肿瘤的目的,这是目前肿瘤靶向药物的主要作用机制。舒尼替尼是当前晚期肾癌靶向治疗的一线药物,但其在临床的使用过程中仍然面临着耐药及不良反应较大等问题。
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01.
图3各组外周血MDSC变化
Fig 3The changes of MDSC in peripheral blood of different groups
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01.
图4各组脾脏MDSC变化
Fig 4The changes of MDSC in spleen of different groups
本课题组前期的研究发现,肾癌石蜡标本上癌旁Treg增多与肾癌总生存率及疾病无进展生存率呈显著负相关,肾癌癌旁Treg增多可作为其不良预后的一个独立指标;而癌旁Treg与肿瘤中COX-2表达呈正相关,COX-2可明显诱导非Treg向Treg转化;而在高表达COX-2的肾癌中可以通过应用COX-2抑制剂(NS-398)来减弱这一转化过程[4-5]。由此,一方面可以减少肿瘤局部的免疫抑制因素,另一方面又可以诱发局部抗肿瘤免疫应答。后续的动物实验中,我们利用小鼠RenCa皮下肾癌模型,观察了COX-2抑制剂(NS-398)对肾癌的抑制作用,并证实了COX-2抑制剂通过对Treg的抑制,可以对肾癌细胞产生明显的抑制作用[6]。
目前,分子靶向药物治疗已成为转移性肾细胞癌治疗的主流。而肾癌的TKI与COX-2抑制剂的联用鲜有报道,仅Wang 等[3]报道在裸鼠肾癌模型中,塞来昔布可以增强舒尼替尼的治疗作用,延长无进展生存期(progression free survival,PFS),并且发现舒尼替尼的耐药与COX-2的高表达有关;相应的,由于舒尼替尼抑制血管作用而产生的肿瘤缺氧坏死区域中COX-2呈低表达。但是这一研究中,研究者使用的是裸鼠动物模型,而人类的肿瘤免疫系统是一个复杂的网络,因此裸鼠模型实验结果的实用性和可外推性必定逊于本实验的小鼠模型。本研究采用BALB/c小鼠RenCa模型,塞来昔布联合舒尼替尼用药组在用药1周左右药效即开始体现,较两个单独用药组小鼠荷瘤体积明显减小,部分疗效可达部分缓解,且耐受性良好。根据图2皮下移植瘤生长曲线,单药组中塞来昔布的抑制肿瘤作用明显弱于舒尼替尼,舒尼替尼可能在联合用药中起主要作用,塞来昔布则增强了舒尼替尼的药效。
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01,(2)P<0.005.
图5各组外周血Treg细胞变化
Fig 5The changes of Treg in peripheral blood of different groups
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01,(2)P<0.005.
图6各组脾脏Treg细胞变化
Fig 6The changes of Treg in spleen of different groups
Xin等[2]发现舒尼替尼可以通过STAT-3途径诱导肿瘤细胞与免疫抑制细胞的凋亡,由此把舒尼替尼的作用机制从血管内皮等间质细胞推向了肿瘤免疫细胞。MDSC和Treg是两种重要的免疫调节细胞。MDSC来源于骨髓,是具有免疫抑制功能的异质性细胞,肿瘤微环境中的多种细胞因子或生长因子可通过激活相应的信号通路促进MDSC扩增及活化,进而通过包括抑制TCR通路、抑制T细胞生物学活性、Treg扩增在内的多种机制抑制免疫细胞的功能,促进肿瘤个体免疫耐受的发生。Flörcken等[7]通过健康者与mRCC患者外周血MDSC数目对比发现,mRCC患者MDSC数目远高于健康人群,并且在经过舒尼替尼治疗后有所下降。本研究通过流式细胞术对荷瘤小鼠的脾脏、血液中MDSC水平进行检测,显示舒尼替尼对于MDSC扩增和激活具有抑制作用,可以增加T细胞数目,从而增强细胞免疫的肿瘤杀伤作用。
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01.
图7各组外周血CD4+免疫细胞变化
Fig 7The changes of CD4+immune cells in peripheral blood of different groups
A:Control;B:Sunitnib;C:Celecoxib;D:Celecoxib+ Sunitnib.(1)P<0.01,(2)P<0.005.
图8各组脾脏CD4+免疫细胞变化
Fig 8The changes of CD4+immune cells in spleen of different groups
图9各组STAT-3蛋白质水平的变化
Fig 9The changes of STAT-3 protein level of different groups
MDSC细胞内信号转导主要通过STAT家族信号通路与S100钙结合信号蛋白信号通路[8]。STAT3是STAT家族一员,在细胞内起着重要的信号传递作用,负责将细胞外的信号传递至细胞核,通过诱导Bcl-2、Bcl-xl、Mcl-1、Survivin等抗凋亡基因转录表达,发挥细胞增殖、分化的效应作用。在肿瘤微环境中STAT-3的持续活化通过诱导 MYC 、Bcl-xl以及细胞周期蛋白D1等表达促进MDSC 的存活,引起 MDSC 表达精氨酸酶-1和诱生型一氧化氮合成酶(iNOS)的上调。本研究提取了分选后的MDSC,通过Western blot检测STAT-3蛋白,结果显示联合用药可以降低MDSC细胞内STAT-3的表达,证明可能通过此细胞内信号途径来调控MDSC的数目与功能。
除了MDSC为代表的免疫调节细胞外,Treg也是一类功能独特的T淋巴细胞亚群,参与自身免疫性疾病、移植免疫、肿瘤免疫等疾病的发生、发展。它能够分泌IL-4、IL-10和TGF-β等细胞因子,对效应T细胞具有抑制作用。已有研究证实Treg数目的增加与肾癌分期和分级呈正相关。本研究亦显示舒尼替尼和COX-2抑制剂对Treg协同抑制作用优于单药治疗。研究表明,舒尼替尼治疗后,引起I型T细胞增殖的细胞因子反应有所增强,并且运用分离得到的Treg输注经舒尼替尼治疗后的T细胞后发现Treg免疫抑制作用减弱,表明舒尼替尼有明确的抑制Treg作用[9]。运用流式细胞术可以直接观测舒尼替尼治疗后各类T细胞的改变,Treg受到抑制后可以促进效应T细胞对肿瘤的杀伤作用[10]。但也有文献指出索拉非尼具有更明显的诱导外周血Treg的作用,可能由于索拉非尼相较于舒尼替尼具有抑制Raf1激酶作用,后者与Treg分化有关[11]。
综上所述,本研究部分揭示了分子靶向药物舒尼替尼对肾癌患者免疫细胞功能的影响,并证实了COX-2抑制剂塞来昔布与舒尼替尼联合用药对肾透明细胞癌的抗肿瘤作用优于单独用药,其机制可能是通过减少免疫抑制细胞,调节机体肿瘤免疫环境,从而增强分子靶向药物的抗肿瘤效果。
[1]SHOJI S,NAKANO M,SATO H,et al.The current status of tailor-made medicine with molecular biomarkers for patients with clear cell renal cell carcinoma [J].Clin Exp Metastasis,2014,31(1):111-134.
[2]XIN H,ZHANG C,HERRMANN A,et al.Sunitinib inhibition of Stat3 induces renal cell carcinoma tumor cell apoptosis and reduces immunosuppressive cells [J].Cancer Res,2009,69(6):2506-2513.
[3]WANG X,ZHANG L,O′NEILL A,et al.Cox-2 inhibition enhances the activity of sunitinib in human renal cell carcinoma xenografts [J].Br J Cancer,2013,108(2):319-326.
[4]LI JF,CHU YW,WANG GM,et al.The prognostic value of peritumoral regulatory T cells and its correlation with intratumoral cyclooxygenase-2 expression in clear cell renal cell carcinoma [J].BJU Int,2009,103(3):399-405.
[5]LI J,FENG G,LIU J,et al.Renal cell carcinoma may evade the immune system by converting CD4+Foxp3-T cells into CD4+CD25+Foxp3+ regulatory T cells:Role of tumor COX-2-derived PGE2 [J].Mol Med Report,2010,3(6):959-963.
[6]胡骁轶,蔡佳荣,储以微,等.COX-2抑制剂联合IL-2增强小鼠肾癌免疫治疗敏感性的研究 [J].复旦学报(医学版),2013,40(4):436-440.
[7]FLÖRCKEN A,TAKVORIAN A,SINGH A,et al.Myeloid-derived suppressor cells in human peripheral blood:Optimized quantification in healthy donors and patients with metastatic renal cell carcinoma [J].Immunol Lett,2015,168(2):260-267.
[8]TRIKHA P,CARSON WE.Signaling pathways involved in MDSC regulation [J].Biochim Biophys Acta,2014,1846(1):55-65.
[9]DESAR IM,JACOBS JH,HULSBERGEN-VANDEKAA CA,et al.Sorafenib reduces the percentage of tumor infiltrating regulatory T cells in renal cell carcinoma patients [J].Int J Cancer,2011,129:507-512.
[10]GU Y,ZHAO W,MENG F,et al.Sunitinib impairs the proliferation and function of human peripheral T cell and prevents T-cell-mediated immune response in mice [J].Clin Immunol,2010,135(1):55-62.
[11]FLÖRCKEN A,TAKVORIAN A,VAN LESSEN A,et al.Sorafenib,but not sunitinib,induces regulatory Tcells in the peripheral blood of patients with metastatic renal cell carcinoma [J].Anticancer Drugs,2012,23(3):298-302.
E-mail:mighu@sina.com
COX-2 inhibitor enhances the activity of sunitinib in renal cell carcinoma-bearing mice and its mechanism
ZHAO Qi1, HU Xiao-yi1△, WANG Guo-min1, GUO Jian-ming1, CHU Yi-wei2
(1Department of Urology,Zhongshan Hospital,Fudan University,Shanghai 200032,China;2Department of Immunology,School of Basic Medical Science,Fudan University,Shanghai 200032,China)
ObjectiveTo explored the potential benefits of COX-2 inhibitor (celecoxib) in combination with sunitinib and explain the mechanism about the suppression of myeloid derived suppressor cell (MDSC) and regulatory T cell (Treg) in peripheral blood,spleen,lymph node of RenCa tumor-bearing BALB/c mice.MethodsBALB/c mice transplanted of RenCa cells were divided into 4 groups (n=10) and then treated with sunitinib,COX-2 inhibitor (celecoxib),combined medication (celecoxib+sunitinib) and PBS by gavage.Tumor growth curve and the mice survival were observed.The changes of Treg and MDSC in the peripheral blood and spleen were determined by flow cytometry.MDSC cells were selected by flow cytometry and its protein was extracted for STAT-3 analysis by Western blot.ResultsCombined medication can reduce MDSC in spleen (1.22%±0.15% vs.
tyrosine kinase;renal cell carcinoma;COX-2;myeloid derived suppressor cells;regulatory T cell;inhibitor
R737.11
Adoi: 10.3969/j.issn.1672-8467.2016.05.004
9.34%±0.58%,P <0.01) and peripheral blood (12.7%±0.85% vs.23.0%±1.68%,P<0.01).Meanwhile,combined medication can reduce Treg in spleen (11.3%±1.69% vs.22.4%±2.31%,P <0.01) and peripheral blood (3.30%±0.64% vs.11.9%±1.53%,P<0.01).The expression of STAT3 in MDSC selected from the spleen by flow cytometry was also down-regulated in combined medication group compared with celecoxib and sunitinib groups.ConclusionsCOX-2 inhibitor in combination with sunitinib has more effectivethan sunitinib or COX-2 inhibitor alone on renal cell carcinoma.Its mechanism might be that COX-2 inhibitor and sunitinib combination therapy can enhance anti-tumor effect by reducing immunosuppressive cells and regulating tumor microenvironment.
2016-04-19;编辑:王蔚)
*This work was supported by Youth Scientific Research Project of Shanghai Municipal Commission of Health and Family Planning (20124Y141).
上海市卫计委青年科研基金(20124Y141)

