Fe(Ⅲ)-EDDS体系紫外光降解橙黄Ⅱ
孙 杰,王 浪,张 晗
(中南民族大学 资源与环境学院,武汉430074)
Fe(Ⅲ)-EDDS体系紫外光降解橙黄Ⅱ
孙杰,王浪,张晗
(中南民族大学 资源与环境学院,武汉430074)

Fe(Ⅲ)-EDDS配合物;橙黄Ⅱ;光降解;响应面法;猝灭法
橙黄Ⅱ (C16H11N2NaO4S)是一种酸性偶氮类染料,其染料废水可生化性差,属典型的难降解工业废水.该废水具有较高的处理难度,混凝、吸附等方法因其只能转移污染物而应用受限.近年来,铁-羧酸盐体系对有机污染物的去除引起了广泛关注[1].许多学者对铁系配合物的光催化性能进行了研究,证明Fe-羧酸盐配合物体系具有较好的光催化氧化性质,在废水处理中对有机物具有明显的去除效果.如孙杰等[2]利用UV/Fe(Ⅲ)-富马酸盐体系在初始pH=3条件下,紫外照射40 min后使对硝基苯酚降解率达到96.0%以上;吴锋等[3]运用铁(Ⅲ)-柠檬酸盐体系对橙黄Ⅱ进行了脱色研究,证明酸性条件下降解效果良好[3].目前在酸性条件下对污染废水的降解研究较成熟,而高效清洁低毒、适用较广pH范围的光助Fe(Ⅲ)-羧酸盐体系研究是目前的热点.
乙二胺二琥珀酸(EDDS, 结构式见图1)是一种天然的氨基多羧酸,EDDS与EDTA互为同分异构体[4],具有很强的金属络合能力.EDDS可生物降解、低毒安全和环境友好性[5,6],常作为EDTA的替代品用于土壤修复,而且Fe-EDDS螯合物稳定性高[7,8],与 Fe(Ⅲ)螯合后在中性和偏碱性条件下也能稳定存在而不沉淀[9],使Fe-EDDS体系能在较宽的pH范围对污染物进行降解,较传统的Fe(Ⅲ)-草酸盐、Fe(Ⅲ)-羧酸盐更适用于实际应用.

图1 乙二胺-N,N′-二琥珀酸结构式Fig.1 Structure formula of ethylenediamine-N,N′-disuccinic acid
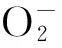
1 试验部分
1.1试剂和仪器
35%(S,S)-乙二胺-N,N′-二琥珀酸三钠盐溶液(美国sigma公司)、Fe(ClO4)3·6H2O、橙黄Ⅱ、香豆素、异丙醇(上海aladdin试剂)、二氯甲烷(国药集团化学试剂有限公司),试验用水为二次蒸馏水.
紫外可见分光广度计(UV1800, 上海凤凰光学科技有限公司),精密酸度计(pHs-3C, Multi340i, WTW, Germany),FC204型电子天平、GGZ 500型 500 W紫外高压汞灯(上海亚明照明有限公司),磁力搅拌器、L5SS荧光光度计(美国Perkin Elmer公司),傅里叶红外光谱仪(Nicolet Nexus 470, 美国赛默飞科技有限公司),总有机碳仪(MultiN/C3100型, 德国耶拿分析仪器股份公司).
1.2测试和分析方法
将配制好的含有一定量Fe(Ⅲ)、EDDS和橙黄Ⅱ的溶液加入200 mL石英烧杯中,调节所需pH值,置于紫外光反应器中进行反应,分别在0, 1, 3, 5, 10, 15, 20, 25, 30, 40 min时取样,用紫外可见分光光度计在最大吸收波长λmax=488 nm处测定样品中橙黄Ⅱ吸光度,用1 cm石英比色皿,以水为参比.
利用橙黄Ⅱ浓度与吸光度间的标准线性关系式(1)计算橙黄Ⅱ的去除率R,按照式(2)对反应过程中溶液橙黄Ⅱ浓度C与光反应时间t进行拟合.
R=(1-Ct/C0)×100%=(1-At/A0)×100%,
(1)
C/C0=D+Ae-kt.
(2)
式中,Ct为光照t时刻后溶液中剩余橙黄Ⅱ的浓度,C0为反应溶液橙黄Ⅱ初始浓度,At为光照t时刻后溶液剩余橙黄Ⅱ的吸光度值,A0为反应初始时橙黄Ⅱ吸光度值,D、A为常数,k为反应速率常数.
1.3羟基自由基的测定
该反应产生的羟基自由基的测定采用荧光法测定[10,12].香豆素能与·OH反应生成7-羟基香豆素(7-hydroxycoumarin),该物质在332 nm光的激发下,在450 nm处有较强的荧光,该反应具有特异选择性,其他自由基对其荧光效果几乎不产生干扰,根据7-羟基香豆素受激发后产生的荧光强度来间接测定体系中·OH的产生情况.配制实验所需的溶液,调节溶液pH值,加入香豆素,在紫外光反应器下进行反应,按设定时间取样并测定样品的荧光强度.
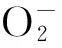
2 结果和分析
2.1橙黄Ⅱ降解的对照实验
调节Fe(Ⅲ)、EDDS均为0.15 mM,橙黄Ⅱ为20 mg/L,调节溶液pH至6.0,进行紫外光光照反应.在不同的降解时间取样,测得橙黄Ⅱ在不同时刻吸光度,由标准曲线得橙黄Ⅱ去除率,不同体系对橙黄Ⅱ去除率结果如图2.由图2可知,光照反应40 min后,在EDDS的体系中,橙黄Ⅱ去除率仅为14.8%,在Fe(Ⅲ)的体系中去除率为19.1%,在紫外光的条件下仅为5.8%,而Fe(Ⅲ)-EDDS体系在紫外光条件下对橙黄Ⅱ的去除率可达到51.0%.

图2 不同条件下橙黄Ⅱ去除率的比较Fig.2 Comparision of removal rate of Orange Ⅱ under different conditions
UV/Fe(Ⅲ)/EDDS体系中橙黄Ⅱ可能的光降解机理如图3所示[17,18],Fe(Ⅲ) 和EDDS在紫外光的照射下发生一系列的反应,产生的氧化性物种对橙黄Ⅱ进行氧化降解,当无光照时,橙黄Ⅱ的去除率几乎为零.对照实验结果表明,紫外光是此反应的必要条件,Fe(Ⅲ) 和EDDS的存在能提高橙黄Ⅱ的去除效率.
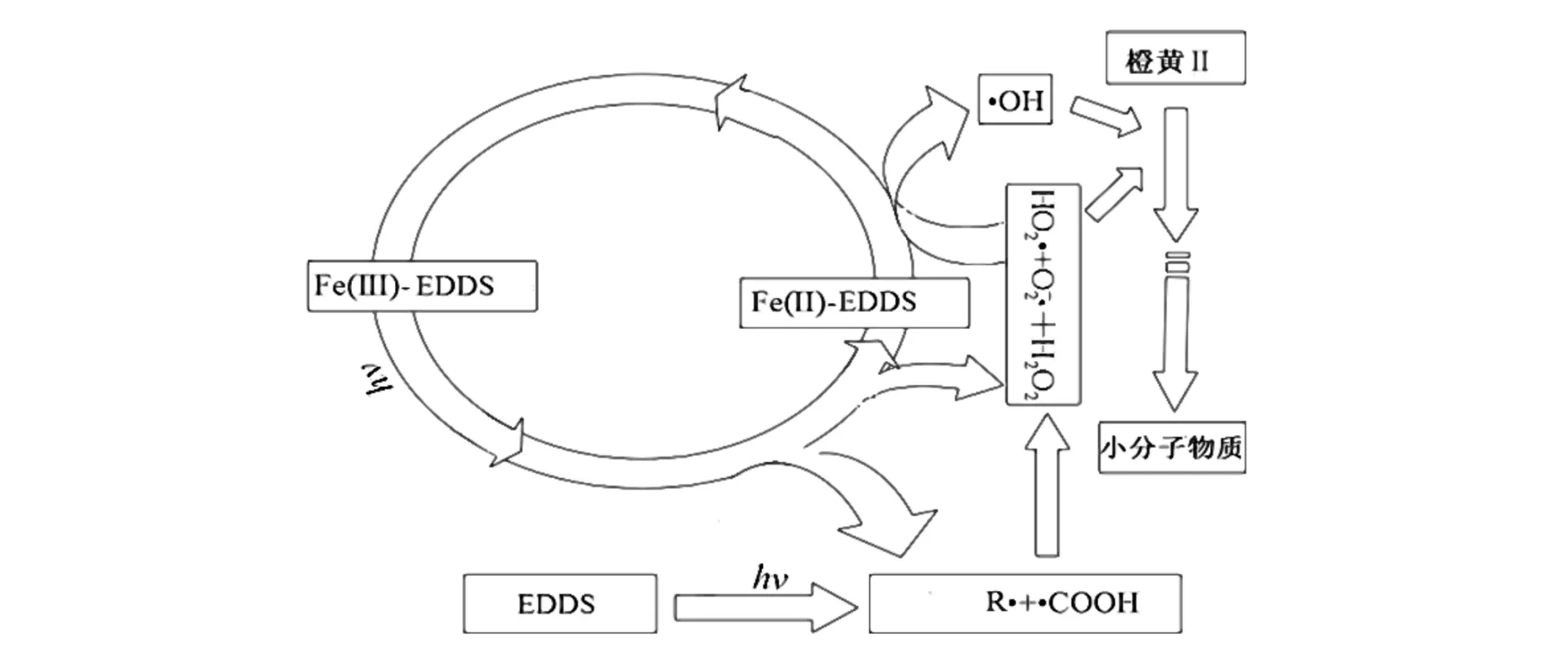
图3 Fe(Ⅲ)-EDDS体系对橙黄Ⅱ的光氧化机理图Fig.3 Photooxidation mechanism of Orange Ⅱ in Fe(Ⅲ)- EDDS system
2.2体系pH对橙黄Ⅱ降解的影响
配制含橙黄Ⅱ 20 mg/L、Fe(Ⅲ)-EDDS 0.15 mM的溶液,分别调节pH值为3.0, 4.0, 5.0, 6.0,
7.0, 8.0, 9.0,在紫外光反应器中进行反应.按照设定时间取样并测定样品中橙黄Ⅱ吸光度,用橙黄Ⅱ去除率对反应时间作图,结果如图4所示. 由图4可见,在pH为3.0~ 9.0的范围内,体系pH值对橙黄Ⅱ去除率影响不显著,说明此体系能在较宽的pH范围保持良好的降解效率.在周单娜等[19]Fe-草酸盐体系中,当体系pH值由4升高到6时,体系对橙黄Ⅱ的去除率降低了约21%;王光华等[20]使用磁性膨润土对橙黄Ⅱ进行类Fenton催化降解,当pH由3升高到6时,体系对橙黄橙黄Ⅱ的去除率下降了约30%;秦烜等[21]用针铁矿/H2O2体系对染料橙黄Ⅱ进行光化学脱色研究,当pH由3升高到5时,橙黄Ⅱ的脱色率由99.4%下降到5.4%.

图4 pH值变化对橙黄Ⅱ降解的影响Fig.4 Effect of pH value on removal rate
2.3橙黄Ⅱ降解过程的动力学分析
对降解过程进行动力学分析,结果如表1所示,在pH=3.0~9.0时体系的拟一级反应动力学拟合相关系数R2均大于0.95,相关性良好,说明橙黄Ⅱ在体系中的降解符合拟一级动力学反应规律.

表1 橙黄Ⅱ光脱色动力学分析
a)c[Fe(III) -EDDS]=0.15 mM,ρ(橙黄II)=20 mg·L-1; b) pH=6,ρ(橙黄II)=20 mg·L-1; c)c[Fe(III) -EDDS]=0.15 mM, pH=6
由表1可知体系在pH= 6.0~9.0时的反应系数大于在pH= 3.0~5.0时的反应系数,说明体系在pH= 6.0~9.0条件下的降解速率较快.当Fe(Ⅲ)-EDDS浓度由0.05 mM增至0.1 mM时,反应速率常数逐渐增大,当Fe(Ⅲ)-EDDS浓度由0.1 mM增至0.2 mM时,在一定范围内反应速率常数逐渐减小,表明当Fe(Ⅲ)-EDDS浓度为0.1 mM时橙黄Ⅱ的降解速率最大.在实验范围内,随橙黄Ⅱ初始浓度增加,体系反应速率常数相应减小,说明在橙黄Ⅱ初始浓度较低时其降解速率较大.
2.4响应面分析降解橙黄Ⅱ降解影响因素
采用中心组合设计法,实验设置4因素5水平,共30组,中心点重复实验6组,选取溶液pH、Fe(Ⅲ) 初始浓度、EDDS初始浓度和橙黄Ⅱ初始浓度4个因素作为考察对象,结果见表2.
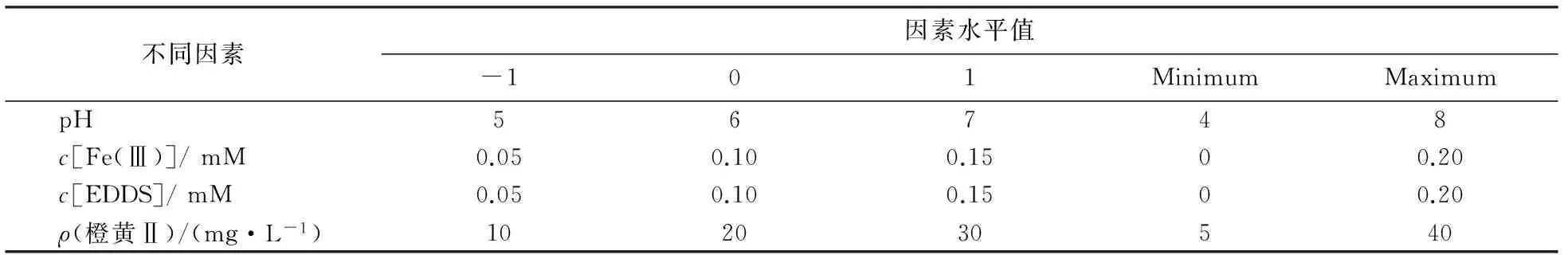
表2 独立过程变量的试验水平和范围
选取每组实验的去除率为响应值,求得反应达到最佳去除率时的实验条件.利用Design Expert软件对所获结果进行分析,结果表明:实验数据与二次回归方程模型相符合,R2=0.9266,拟合程度良好,模型的p< 0.0001,回归模型非常显著,可用来拟合实验数据,各因素显著性分析结果如表3所示.由表3可知,EDDS浓度、橙黄Ⅱ浓度对橙黄Ⅱ的光降解响均显著,其中因素EDDS的回归系数为正值,表明体系中EDDS浓度的增加对橙黄Ⅱ的光降解有促进作用,而因素橙黄Ⅱ的回归系数为负值,表明体系中橙黄Ⅱ浓度的增加对橙黄Ⅱ的光降解有抑制作用.
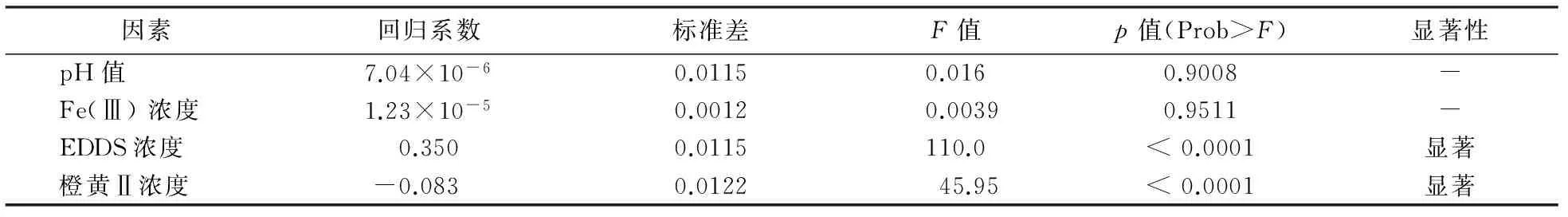
表3 因素显著性水平
Fe(Ⅲ)、EDDS和橙黄Ⅱ初始浓度的变化对光还原的影响结果见图5.

a) EDDS和橙黄Ⅱ初始浓度的变化对去除率的影响; b) Fe(Ⅲ)和橙黄Ⅱ初始浓度的变化对去除率的影响图5 Fe(Ⅲ)、EDDS和橙黄Ⅱ初始浓度的变化对去除率的影响Fig.5 Effect of initial concentration of Fe(Ⅲ)、EDDS and Orange Ⅱon removal rate
由图5可知,当体系初始pH= 6.0,c[Fe(Ⅲ)]=0.1 mM,EDDS浓度在0.00~ 0.20 mM时,橙黄Ⅱ的去除率随EDDS浓度的增加相应增高;在2~20 mg/L内,体系对橙黄Ⅱ的去除率随橙黄Ⅱ初始浓度的增加而逐渐减小,表明Fe(Ⅲ)和EDDS初始浓度的提高有利于橙黄Ⅱ的光氧化,且在橙黄Ⅱ初始浓度较低时体系氧化效果更好;当体系初始pH= 6.0,c(EDDS)=0.1 mM,Fe(Ⅲ)浓度在0.00~ 0.20 mM内变化时,随体系Fe(Ⅲ)浓度的增加,橙黄Ⅱ的去除率相应增加,达到峰值后,去除率随Fe(Ⅲ)浓度的增加而降低.
通过响应面分析的结果,得出橙黄Ⅱ降解的最优条件为pH= 4.0,c[Fe(Ⅲ)]=0.06 mM,c(EDDS)=0.20 mM,即r[Fe(Ⅲ)︰EDDS]=3︰10,表明体系在pH值较低的条件下具有较好的降解效果,尽管Fe(Ⅲ)与EDDS按照1︰1的浓度比形成螯合物,但实际反应中适当提高体系中EDDS的浓度比有利于增强体系的光氧化效果.
2.5.1·OH的检测
为了解此体系在反应过程中·OH的产生情况,配制Fe(Ⅲ)-EDDS为0.1 mM、香豆素(A.R 阿拉丁)为5 mM、pH= 3.0的溶液,在紫外光反应器中进行反应,体系在0 ~ 15 min产生·OH的光谱图如图6a所示,在20~60 min产生·OH的光谱图如图6b所示.

λ/nn λ/nn图6 Fe(Ⅲ)-EDDS配合物光反应0-15min(a)和20-60min(b)产生·OH的荧光光谱图 Fig.6 Fluorescence spectrum of ·OH in Fe(Ⅲ)-EDDS solution under irradiation for 0~15min(a) and 20~60 min(b)
香豆素与·OH反应生成的7-羟基香豆素,其荧光强度越强表明7-羟基香豆素浓度越大,即体系产生的·OH越多.由荧光强度可见,随着反应的进行,·OH 的产生量先增大后减小,15 min时体系产生的·OH的量达到峰值,·OH 产生量的变化与其反应机理有关[22]:
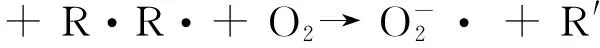
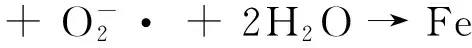
反应初期 ·OH产生量随反应进行逐渐增多,随着光反应的继续进行,体系中的EDDS继续消耗,导致配体自由基R·含量降低,使H2O2产量相应降低,从而导致体系产生的·OH的量减少.

1) Fe(Ⅲ)-EDDS-UV ; 2) Fe(Ⅲ)-EDDS-UV-0.5mL氯仿;3) Fe(Ⅲ)-EDDS-UV-0.5mL异丙醇图7 加入不同猝灭剂后橙黄Ⅱ降解去除效果Fig.7 Degradation efficiencies of orangeⅡat different quencher
2.6体系的紫外降解和橙黄Ⅱ脱色机理
为探究Fe(Ⅲ)-EDDS配合物在紫外光下的降解情况,对进行光反应的Fe(Ⅲ)-EDDS配合物进行紫外扫描,结果如图8a所示.Fe(Ⅲ)-EDDS配合物在紫外光照射下发生了光降解,随着光反应的进行,体系中Fe(Ⅲ)-EDDS配合物的浓度降低,使体系对紫外光的响应程度随之降低.由图8b可知,体系的TOC值随着反应的进行不断降低,说明随着反应的进行EDDS不断被转化,降解成了小分子.
为考察体系光氧化反应前后橙黄Ⅱ的结构变化,对比了反应0 min和120 min后橙黄Ⅱ样品的FT-IR图,通过其分子官能团的变化来反映橙黄Ⅱ降解过程中的结构变化.对比橙黄Ⅱ降解前后的红外谱图(见图9)可知,其中苯环的特征谱带消失,838 cm-1和757 cm-1附近证明橙黄Ⅱ苯环上取代基存在情况的谱带也消失,说明在光降解过程中,苯环发生开环,橙黄Ⅱ的结构被破坏,生成小分子物质.

λ/nm t/min图8 Fe(Ⅲ)-EDDS配合物体系紫外光降解过程(a)和TOC随时间的变化图(b)Fig.8 Ultraviolet degradation process of Fe(Ⅲ)-EDDS complex system (a) and variation diagram of TOC with the time (b)
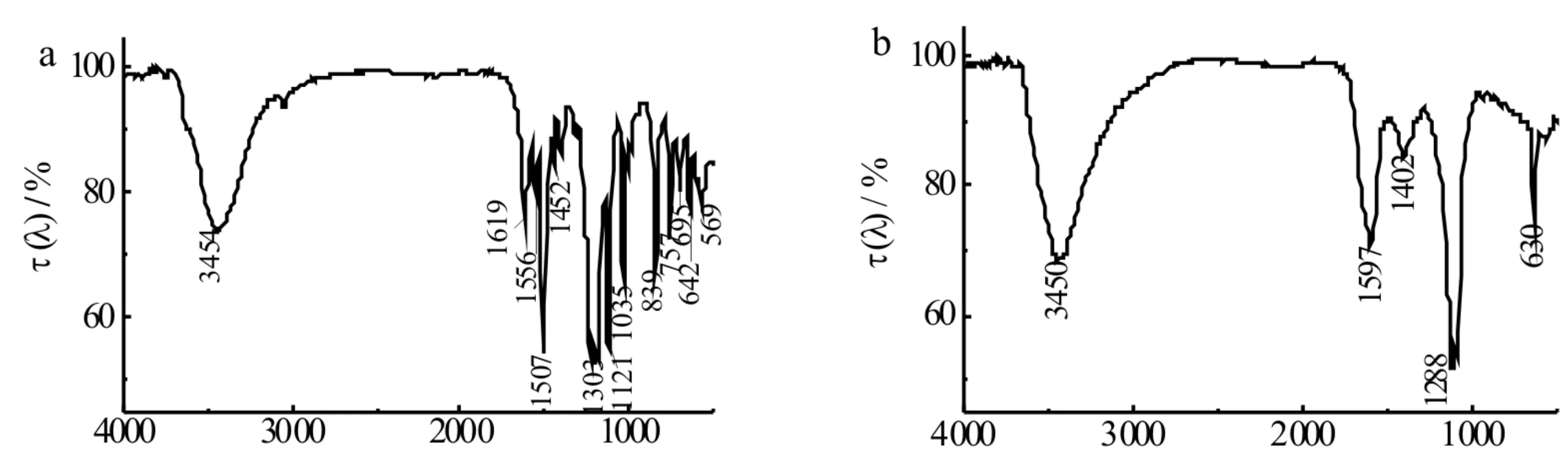
σ/cm-1 σ/cm-1图9 橙黄Ⅱ降解前(a)和降解后(b)的红外光谱图Fig.9 FTIR spectra of Orange Ⅱ before degradation (a) and after degradation(b)
3 结论
(1) 无紫外光照射下,Fe(Ⅲ)-EDDS体系无法对橙黄Ⅱ进行有效地光降解,故紫外光是此体系降解橙黄Ⅱ顺利进行的必要条件.
(2) 该体系能在较宽的pH范围保持较好的降解效率;Fe(Ⅲ)-EDDS配合物对橙黄Ⅱ的光氧化符合拟一级动力学,当溶液中Fe(Ⅲ)-EDDS浓度为0.1 mM时橙黄Ⅱ降解速率最大,橙黄Ⅱ初始浓度较低时其降解速率较大;响应面分析得出橙黄Ⅱ降解的最优条件为pH=4.0,c[Fe(Ⅲ)]=0.06 mM,c(EDDS)=0.20 mM,即r[Fe(Ⅲ)︰EDDS]为3︰10.
(4) 样品在光降解过程中,苯环发生开环,橙黄Ⅱ的结构被破坏,生成小分子物质,表现为橙黄Ⅱ脱色.
[1]丁世敏, 刘元华, 封享华, 等. Fe(Ⅲ)/苹果酸/H2O2体系对有机物的光降解特性研究[J].环境科学学报, 2010, 30(9):1839-1845.
[2]孙杰, 陈果仓 ,曾沛,等.UV/Fe(Ⅲ)-富马酸盐体系降解对硝基苯酚[J].化学通报, 2014, 77(8):814-818.
[3]吴峰, 朱凡, 邓南圣, 等.铁(Ⅲ)-柠檬酸盐配合物光解引发橙黄Ⅱ的脱色[J].应用化学, 2004, 21(6): 546-550.
[5]Nagaraju V,Goje T,Crouch A Ml.Determination of copper and iron using[S,S′]-ethylenediaminedisuccinic acid as a chelating agent in wood pulp by capillary electrophoresis [J].Anal Sci, 2007, 23(4):493-496.
[6]Zhang L, Zhu Z, Zhang R, et al. Extraction of copper from sewage sludge using biodegradable chelant EDDS [J] .J Environ Sci (China),2008,20(8): 970- 974.
[7]Jelusic M, Lestan D. Effect of EDTA washing of metal polluted garden soils. Part I: Toxicity hazards and impact on soil properties[J]. Sci Total Environ, 2014,475:132-141.
[8]Voglar D,Lestan D.Pilot-scale washing of metal contaminated garden soil using EDTA[J]. J Hazard Mater, 2012,215/216(4):32-39.
[9]Huang W Y, Brigante M, Wu F, et al.Assessment of the Fe(Ⅲ)-EDDS complex in Fenton-like process: from the radical formation to the degration of Bisphenol A [J].Environ Sci Technol, 2013,47(4):1952-1959.
[10]An J, Zhu L, Zhang Y, et al. Efficient visible light photo-Fenton-like degradation of organic pollutants usinginsitusurface-modified BiFeO3as a catalyst[J]. J EnvironSci, 2013,6(25):1213-1225.
[11]Nie L, Meng A, Yu J, et al. Hierarchically macro-mesoporous Pt/γ-Al2O3composite microspheres for efficient formaldehyde oxidation at room temperature[J]. Sci Rep, 2013,3:3215-3215.
[12]褚衍洋,王蒙.钛基氧化物电极导致的H2O2分解及其对苯胺氧化的影响[J].化工学报, 2010,61(3):761-766.
[13]Yu J, Qi L , Jaroniec M. Hydrogen production by photocatalytic water splitting over Pt/TiO2nanosheets with exposed (001) facets[J]. J Phys Chem C, 2010, 114 (30): 13118-13125.
[14]Guan H, Zhu L, Zhou H,et al. Rapid probing of photocatalytic activity on titania-based self-cleaning materials using 7-hydroxycoumarin fluorescent probe[J]. Anal Chim Acta, 2008, 608(1):73-78.
[15]Li, G Zhu M, Chen J, et al. Production and contribution of hydroxyl radicals between the DSA anode and water interface [J]. J Environ Sci-China, 2011, 23(5):744-748.
[16]Sangchul H,Huling S G,Saebom K.Fenton-like degradation of MTBE: Effects of iron counter anion and radical scavengers [J] . Chemosphere , 2010 (78) :563-568.
[17]Zhang C, Lei W, Gang P, et al. Degradation of atrazine photoinduced by Fe(Ⅲ)-pyruvate complexes in the aqueous solution[J].J Hazard Mater, 2009,169(1/3):772-779.
[19]周丹娜, 葛苏军. Fe(Ⅲ)-草酸盐配合物对橙黄Ⅱ的光降解[J].水处理技术, 2001, 27(6):329-331.
[20]王光华, 万栋, 李文兵, 等.磁性膨润土的制备、表征及类Fenton催化降解橙黄Ⅱ [J].环境工程学报, 2014, 8(5):1857-1862.
[21]秦烜,陈龙,匡劼,等.针铁矿/H2O2体系对染料橙黄Ⅱ光化学脱色的实验研究[J].环境科学与技术,2013,36(5):33-37.
[22]Li J, Mailhot G, Wu F, et al. Photochemical efficiency of Fe(Ⅲ)-EDDS complex: ·OH radical production and 17β-estradiol degradation[J]. J Photoch Photobio A, 2010,212(1):1-7.
Degradation of Orange Ⅱ by Fe(Ⅲ)-EDDS Under Ultraviolet Irradiation
SunJie,WangLang,ZhangHan
(College of Resources and Environmental Science,South-Central University for Nationalities,Wuhan 430074,China)
Photo-degradation of Orange Ⅱ was studied in the Fe(Ⅲ)-EDDS system under UV irradiation. The dependence of photochemical bleaching kinetics of Orange Ⅱ was investigated under different conditions, and the favorable degradation condition was obtained by using response surface analysis (RSA). The results showed that the Fe(Ⅲ)-EDDS system was effective for the degradation of Orange Ⅱ, which occurred in the pH range of 3~9 and followed pseudo-first order kinetics. The optimal degradation conditions obtained by using RSA was as follows: pH=4,c[Fe(Ⅲ)]=0.06 mM, andc(EDDS)=0.20 mM. The quenching experiment confirmed that the system produced the superoxide anion radical and hydroxyl radical, and the hydroxyl radicals were the main intermediate during degradation. The infra-red spectra also demonstrated that the molecular structure of Orange Ⅱ was decomposed and the benzene ring was oxidized into smaller molecules during the process.
Fe(Ⅲ)-EDDS complexes; Orange Ⅱ; photo-degradation; response surface methodology; quenching
2015-09-23
孙杰 (1976-), 副教授, 博士, 研究方向:废水物化预处理技术及应用研究, E-mail: sunjie2076@hotmail.com
湖北省自然科学基金资助项目(2008CDB400);中央高校基本科研业务费专项资金资助项目(CZY16011)
TQ138.1
A
1672-4321(2016)03-0006-07

