水体中布洛芬的间接光降解作用机理研究
白 莹,崔正国*,苏荣国,曲克明
水体中布洛芬的间接光降解作用机理研究
白 莹1,崔正国1*,苏荣国2,曲克明1
(1.中国水产科学研究院黄海水产研究所,农业农村部海洋渔业可持续发展重点实验室,青岛海洋科学与技术试点国家实验室,海洋渔业科学与食物产出过程功能实验室,山东 青岛 266071;2.中国海洋大学化学化工学院,海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100)
为阐明布洛芬(IBP)在海水中的间接光降解机理,研究了4种不同来源的溶解有机物(DOM)以及溶液初始pH值、盐度、NO3-和HCO3-对IBP间接光降解的影响.结果表明,4种DOM均可促进IBP的间接光降解作用,降解过程符合准一级反应动力学, 4种DOM对IBP间接光降解的促进效果从大到小为:腐殖酸(JKHA)> Suwannee 河腐殖酸(SRHA)> Suwannee 河富里酸(SRFA)> Suwannee 河天然有机物(SRNOM). DOM主要通过产生活性自由基促进IBP的间接光降解过程,其中1O2和∙OH的作用较显著.在初始pH5~11的范围内,IBP的光降解速率先降低后增加,在pH5时最快.盐度、NO3-和HCO3-初始浓度的增加均会促进IBP的间接光降解.
布洛芬;间接光降解;溶解有机物;活性自由基
药品和个人护理用品(PPCPs)是与人类生活密切相关的一类新型化学物质[1-2].大多数PPCPs是水溶性的,有的还带有酸性或碱性官能团,半衰期短,其活性官能团在自然环境中易发生光降解、水解和微生物降解等,但由于人类的大量使用,导致PPCPs形成“假持续现象”,从而对人类和环境造成潜在危害[3-4].PPCPs的大量使用污染了近海的水体环境,破坏了海洋养殖业良好的水体状态,严重危害了海洋渔业资源.
布洛芬(IBP)是一种非甾体类抗炎药,疗效确切,不良反应少,具有解热、镇痛的作用.常用于减轻感冒发烧、偏头痛、肌肉疼痛、关节炎、肩周炎和牙疼等,是应用最广泛的药物之一[5].IBP产量世界第3,每年约为15000t[6].IBP可以在生物体内累计,对人类的健康和生态系统的平衡造成危害,例如长期摄入IBP会导致生物畸形和产生抗药性[7].
间接光降解主要是指光敏剂吸收光子激发后与污染物分子发生反应,或者通过生成的活性含氧自由基氧化污染物使其降解的过程.间接光降解过程中的光敏剂主要是指溶解有机物(DOM).DOM是分布最为广泛的天然有机质,作为一种重要的光敏化剂,其光降解生成的活性自由基主要有:激发三线态DOM(3DOM*)、单线态氧(1O2)、羟基自由基(∙OH)和有机过氧化物其中3DOM*、1O2和∙OH被认为是参与外源性物质降解的主要自由基[8-9].通过研究Suwannee河、Pony湖和Old Woman溪的富里酸对IBP光降解的影响发现,富里酸促进了IBP的间接光降解,∙OH在IBP的光降解过程中起着一定的作用,IBP的光降解速率与DOM的组成有重要的关系[10].间接光降解是IBP在环境中的重要消失途径之一,不仅是决定IBP环境归趋的重要方式,而且还会影响其生态效应[11-12].虽然国内外对IBP的光降解开展了部分研究,但是目前对海水中IBP的间接光降解作用及其机理的认识尚不明确.本文研究了4种DOM产生的活性自由基以及溶液初始pH值、盐度、NO3-和HCO3-对IBP间接光降解的影响,为预测IBP在海水中的光化学归趋和评价其生态风险提供科学依据.
1 材料与方法
1.1 实验试剂与仪器
实验仪器: XPA-7多试管搅拌式光化学反应仪(南京胥江机电厂),UV-2550紫外可见分光光度计(日本岛津公司),Agilent 1260 高效液相色谱仪(安捷伦科技有限公司),C18液相色谱柱(Agilent PLRP-S,5μm, 150mm´4.60mm),FE28pH计(梅特勒-托利多),KQ2200超声波清洗器(昆山市超声仪器有限公司).
实验试剂:IBP(³99%,Sigma-Aldrich), Suwannee 河腐殖酸(SRHA)(2S101H, 国际腐殖酸协会), Suwannee河天然有机物(SRNOM)(2S101N, 国际腐殖酸协会),Suwannee 河富里酸(SRFA)(2S101F,国际腐殖酸协会),异丙醇(99.9%,Sigma-Aldrich),糠醇(FFA,98%,Sigma-Aldrich),腐殖酸(JKHA)(百灵威科技有限公司),硫酸奎宁(³99%,百灵威科技有限公司),标准海水(OSIL, Environmental Instruments and Systems),甲醇(色谱纯,德国默克股份两合公司),乙腈(色谱纯,德国默克股份两合公司),磷酸(色谱纯,国药集团化学试剂有限公司),浓硫酸(分析纯,烟台三和化学试剂有限公司),盐酸(优级纯,国药集团化学试剂有限公司),氢氧化钠(优级纯,国药集团化学试剂有限公司).
1.2 溶液的配置
用乙腈配制2mmol/L的IBP储备液,放于冰箱4℃冷藏保存.用Milli-Q 超纯水分别配制2,5,10mg C/L的SRHA、SRFA、SRNOM和JKHA溶液,以0.1mol/L的盐酸和氢氧化钠调节溶液pH值至(8.0±0.1),放于冰箱冷藏备用.
1.3 光降解实验
光降解实验在XPA-7多试管搅拌式光化学反应仪中进行,光源为1000W氙灯,用滤光膜滤去320nm以下的紫外光避免直接光降解反应[13],控制反应温度为(25±1)℃.在光照条件下,研究DOM、(溶液)初始pH值、盐度、NO3-和HCO3-对IBP间接光降解的影响.同时,以未添加DOM的IBP溶液为对照,分析IBP的直接光降解作用.光降解溶液用0.1mol/L的盐酸和氢氧化钠调节pH值至(8.0±0.1),每组实验做3个平行样品,最终结果取平均值.
1.4 分析方法
采用Agilent 1260高效液相色谱仪分析测定IBP的浓度,色谱条件为:安捷伦C18液相色谱柱(5μm,150mm´4.60mm),流动相是乙腈:磷酸水溶液(pH=2.9)=60:40(体积比),检测器检测波长为230nm,流速为1.0mL/min,进样量为20μL.
2 结果与讨论
2.1 IBP在不同DOM溶液中的间接光降解作用
分别移取40mL浓度为2,5,10mg C/L的DOM溶液和200μL浓度为2mmol/L的IBP溶液到50mL的石英试管中,然后将反应溶液置于光化学反应仪中照射24h,结果如图1所示.光照24h后,IBP在Milli-Q超纯水中的降解率为4.5%. IBP在波长>290nm时基本没有光吸收(图2),说明在波长>320nm的光照条件下IBP几乎不能进行直接光降解.
在4种DOM溶液中,IBP的间接光降解均符合准一级反应动力学方程.溶液中添加DOM后,IBP的间接光降解速率明显增加,4种DOM均对IBP的间接光降解具有促进作用,但IBP的间接光降解速率随着DOM初始浓度的增加呈现非线性增加的趋势.DOM对PPCPs的间接光降解既有促进作用也有抑制作用:(1)DOM光敏化作用产生的活性自由基,如3DOM*,1O2,∙OH和有机过氧化物等,可促进PPCPs的间接光降解[13-14],(2)DOM可以与活性自由基反应,通过与PPCPs竞争活性自由基来抑制其间接光降解作用,DOM还可以通过猝灭光降解过程中产生的活性自由基来抑制PPCPs的间接光降解[9]. DOM对IBP光降解的这种促进或抑制作用的相对强弱变化,是导致IBP的间接光降解速率随DOM的浓度表现出非线性变化的主要原因.4种DOM对IBP间接光降解的促进效果从大到小为:JKHA> SRHA>SRFA>SRNOM,这种差异主要是由不同组成的DOM产生活性自由基的效率不同导致的[14-15]. Batista等[16]研究发现,3DOM*和∙OH的稳态浓度与DOM的芳香性有良好的正相关关系.Timko等[17]发现,1O2和∙OH稳态浓度的变化与DOM的性质有关,陆源类腐殖质能够产生较多的1O2和∙OH.
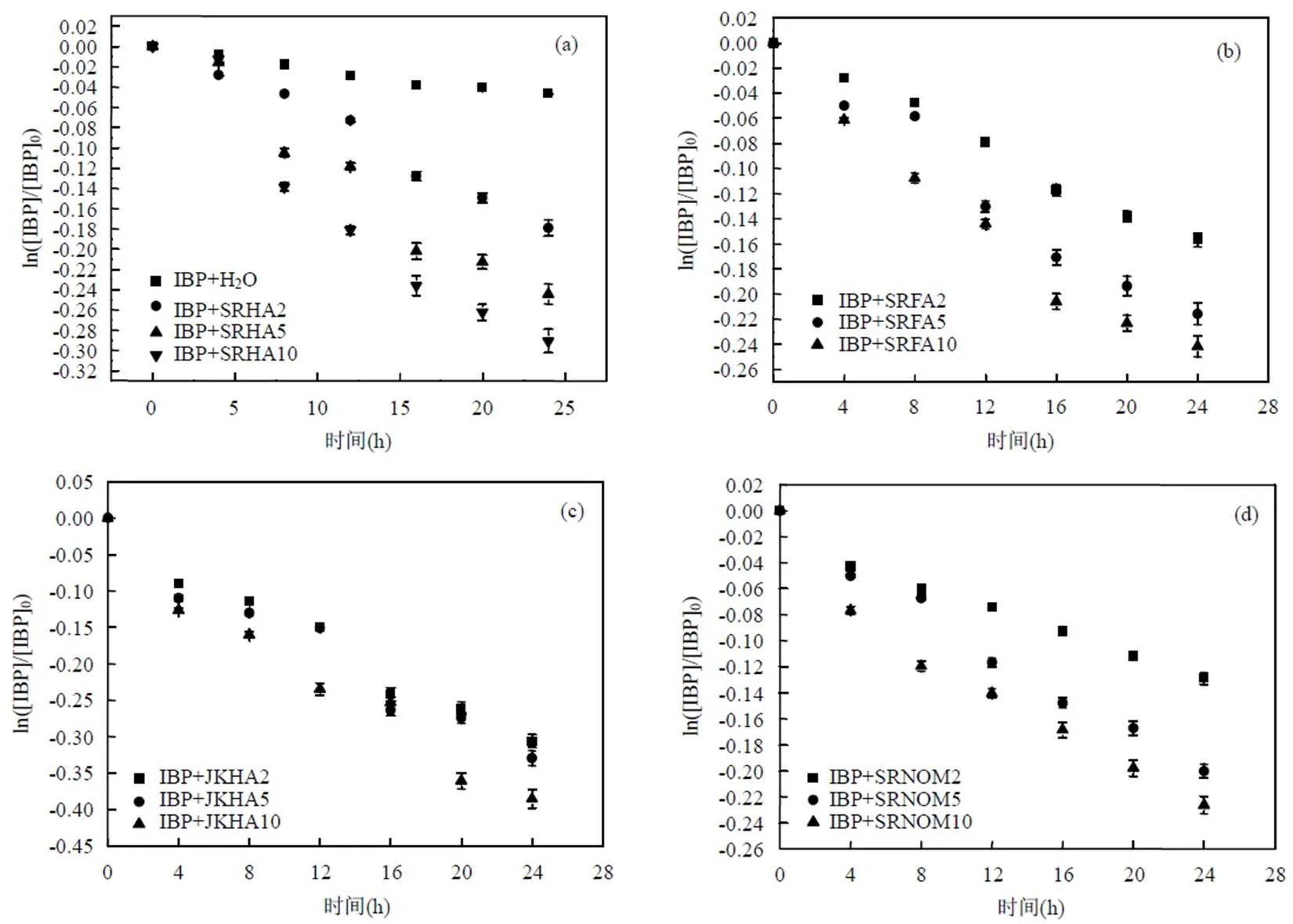
图1 不同DOM溶液中IBP的光降解作用
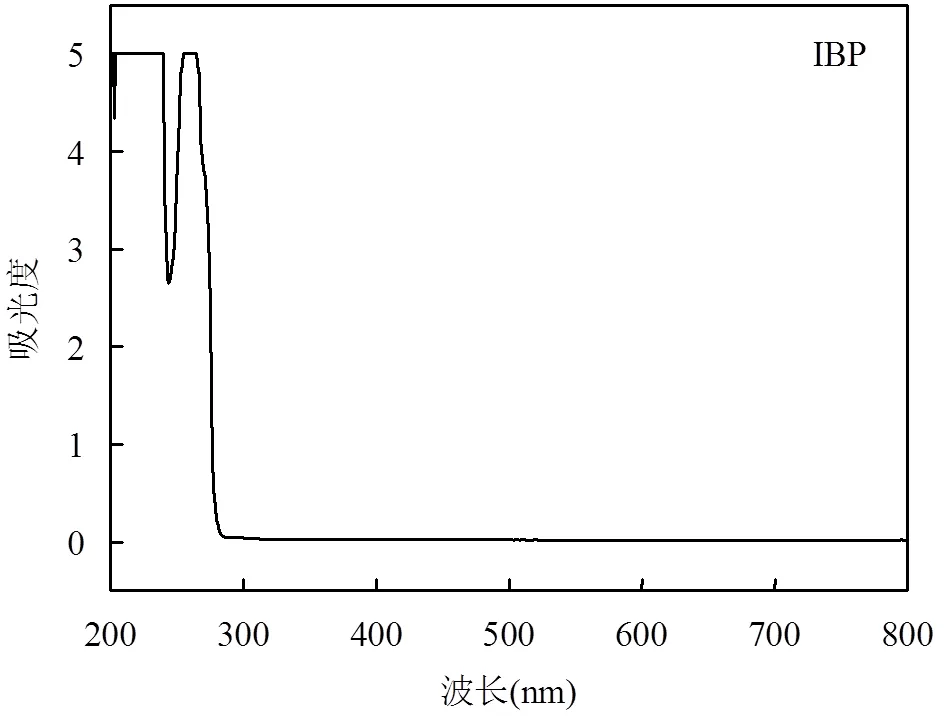
图2 IBP的紫外可见吸收光谱图
2.2 DOM产生的活性自由基对IBP间接光降解的影响
DOM吸收光子后产生的3DOM*、1O2和∙OH等活性自由基可促进药物的间接光降解.本文通过自由基猝灭实验探讨了活性自由基在IBP间接光降解中的作用,异丙醇为∙OH的猝灭剂,对∙OH的猝灭率高达98.4%~99.6%[8], FFA为1O2的猝灭剂,结果如图3a和3c所示.光降解溶液中添加异丙醇后IBP的间接光降解速率明显降低,说明∙OH的减少对IBP的间接光降解有显著影响.Jacobs等[10]也证实∙OH参与了IBP的间接光降解.添加FFA的反应溶液中,IBP的间接光降解速率比未添加FFA体系低,但程度不如添加异丙醇的明显,说明∙OH和1O2都对IBP的间接光降解有重要影响,且∙OH的影响较显著.
O2是3DOM*的猝灭剂,能获得1DOM*的能量产生1O2,从而减少3DOM*的生成[18].在充满O2的溶液中,1O2的稳态浓度会得到显著性的提高,与此同时,3DOM*的稳态浓度会降低到最小值.在去氧的溶液中,3DOM*的稳态浓度会得到显著性的提高,而1O2的稳态浓度会降低到极小值[19].本研究分别以O2和N2作为3DOM*和1O2的猝灭剂来研究3DOM*对IBP间接光降解的影响,实验结果如图3b和3d所示.在充N2的条件下,IBP的间接光降解速率没有显著变化但是在充O2的条件下,IBP的间接降解速率明显加快,说明1O2在IBP的间接光降解过程中起着重要的作用,而3DOM*的作用不显著.

图3 猝灭剂存在条件下IBP的光降解动力学
2.3 pH值对IBP间接光降解的影响
水体中pH值的变化既能够改变药物和DOM的存在形态,又能够影响活性自由基的生成速率[20],因此对水体中IBP的间接光降解有着显著影响.为了研究pH值对IBP间接光降解的影响,以10mg C/L的SRHA和SRFA溶液配制初始pH值为5,7,9,11的10μmol/L的IBP溶液进行光降解实验,结果如图4所示.在初始pH值为5时,IBP的光降解速率最快,当pH>7时,IBP的光降解速率随着pH值的增加而增大.IBP的pa=4.8,在pH值为5时,IBP在溶液中几乎不带电[21],以分子的形式存在腐殖酸和富里酸的结构中除含有大量的苯环外,还有羧基、羰基和酚羟基等官能团,使得腐殖酸和富里酸具有酸性[22].在酸性条件下,腐殖酸和富里酸也主要以分子的形式存在,这使得IBP容易吸附在DOM的表面,增加了IBP与∙OH和1O2的接触机率,从而提高了IBP的光降解速率.在中性和碱性条件下,IBP和DOM在水溶液中电离均带负电荷,随着pH值的增加,DOM与IBP的排斥增强、吸附减弱,这样会抑制IBP的光降解速率,但IBP的间接光降解主要是IBP与∙OH和1O2反应,而∙OH和1O2的稳态浓度会随着pH值的增大逐渐增加[14],这种促进作用强于抑制作用,所以IBP的间接光降解速率呈现出随pH值的增大逐渐加快的趋势.

图4 pH值对IBP间接光降解的影响
2.4 盐度对IBP间接光降解的影响
近海水体中的盐度是影响药物光降解的重要因素之一.盐度的增加可促进磺胺类抗生素的光催化降解,但对噁唑烷酮类抗生素和菲的光降解无显著影响[23-25].为了研究盐度对IBP间接光降解的影响,以Milli-Q超纯水和标准海水配制盐度分别为0,5,15,25,35的10mg C/L的JKHA溶液,加入一定量的IBP储备液,使其初始浓度为10μmol/L,进行光降解实验,结果如图5所示.IBP的间接光降解速率随着盐度的增大而增加,这主要有2方面的原因:(1)盐度能够大幅度的增加水体中DOM光解产生的水合电子[26],促进H2O2的生成[27],最终导致水体中∙OH稳态浓度的增加;(2)高盐海水中的Cl-和Br-能够与3DOM*发生反应生成Cl-•和Br-•,从而与IBP发生电子转移或抽氢反应等促进其光降解[28].

图5 盐度对IBP间接光降解的影响
2.5 NO3-对IBP间接光降解的影响

图6 NO3-对IBP间接光降解的影响
NO3-是海水中普遍存在的阴离子,同时也是∙OH的重要来源,浓度在1~80μmol/L之间.为了研究NO3-对IBP间接光降解的影响,以10mg C/L的JKHA溶液配制不同NO3-浓度(0,10,20,30,40μmol/L)的10μmol/L的IBP溶液进行光降解实验,结果如图6所示.在不同NO3-浓度的条件下,IBP的间接光降解均符合准一级反应动力学方程,且间接光降解速率随着NO3-浓度的增加而加快,NO3-促进了IBP的间接光降解.在波长大于280nm的光照条件下,NO3-有两个主要的光致降解过程[29-30]:
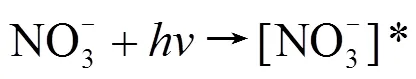

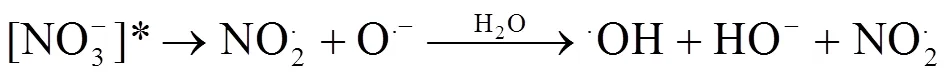
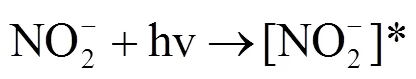


NO3-吸收B段的紫外光变为[NO3-]*(式1),然后通过2个途径进行分解:一个过程是生成NO2-和O(3P)(式2),NO2-能够光解形成∙OH(式4~6);另一个过程是[NO3-]*快速的质子化形成∙OH(式3).所以NO3-的光解可以产生∙OH,从而促进IBP的间接光降解.
2.6 HCO3-对IBP间接光降解的影响
HCO3-也是海水中最常见的阴离子之一[31],其在水环境中的浓度一般不超过4mmol/L.HCO3-既是水环境中∙OH的清除剂又是∙CO3-的主要来源(式7),对药物的光降解既有促进作用也有抑制作用[32-33].为了研究HCO3-对IBP间接光降解的影响,以10mg C/L的JKHA溶液配制不同HCO3-浓度(0,1,2,3, 4mmol/L)的10μmol/L的IBP溶液进行光降解实验,结果如图7所示.在不同HCO3-浓度的条件下,IBP的间接光降解均符合准一级反应动力学方程,且间接光降解速率都随着HCO3-浓度的增加而增大, HCO3-对IBP的间接光降解有促进作用.HCO3-与∙OH反应生成的∙CO3-是一种选择性自由基,可以通过电子转移或抽氢反应与富电子的化合物,如含N、S的化合物和酚类化合物等发生反应[34].HCO3-也可与激发态的IBP或3DOM*发生反应生成∙CO3-;同时∙CO3-较稳定,不易被DOM掩蔽,导致较高浓度的∙CO3-参与IBP的光降解.

3 结论
3.1 4种DOM均可促进IBP的间接光降解作用,降解过程符合准一级反应动力学.4种DOM对IBP间接光降解的促进效果从大到小为:JKHA>SRHA> SRFA>SRNOM,这种差异主要是由DOM的来源不同导致.
3.2 DOM主要通过产生活性自由基促进IBP的间接光降解作用,其中1O2和∙OH的作用较显著,3DOM*基本不起作用.
3.3 在初始pH值为5~11的范围内,IBP的光降解速率先降低后增加,在pH=5时最快,这与不同pH值条件下IBP和DOM的存在形态及∙OH和1O2稳态浓度有关.
3.4 盐度和NO3-的增加对IBP间接光降解的促进作用主要是由于它们使活性自由基的稳态浓度增加.HCO3-的增加对IBP间接光降解的促进作用主要与生成的∙CO3-有关.
[1] Benotti M, Brownawell B. Microbial degradation of pharmaceuticals in estuarine and coastal seawater [J]. Environmental Pollution, 2009, 157(3):994-1002.
[2] Carballa M, Omil F, Lema J M, et al. Behavior of pharmaceuticals, cosmetics and hormones in a sewage treatment plant [J]. Water Research, 2004,38(12):2918-2926.
[3] Snyder S A, Westerhoff P, Yoon Y, et al. Pharmaceuticals, Personal Care Products, and Endocrine Disruptors in Water: Implications for the Water Industry [J]. Environmental Engineering Science, 2004, 20(5):449-469.
[4] Daughton C G, Ternes T A. Pharmaceuticals and personal care products in the environment: agents of subtle change [J]. Environmental Health Perspectives, 1999,107(6):907-938.
[5] Scheytt T, Mersmann P, Lindstädt R, et al. 1-octanol/water partition coefficients of 5pharmaceuticals from human medical care: carbamazepine, clofibric acid, diclofenac, ibuprofen, and propyphenazone [J]. Water, Air, and Soil Pollution, 2005,165(1-4):3-11.
[6] Ghauch A, Tuqan A M, Kibbi N. Ibuprofen removal by heated persulfate in aqueous solution: a kinetics study [J]. Chemical Engineering Journal, 2012,197:483-492.
[7] Vieno N M, Tuhkanen T, Kronberg L. Seasonal variation in the occurrence of pharmaceuticals in effluents from a sewage treatment plant and in the recipient water [J]. Environmental Science and Technology, 2005,39(21):8220-8226.
[8] Bahnmüller S, Gunten U V, Canonica S. Sunlight-induced transformation of sulfadiazine and sulfamethoxazole in surface waters and wastewater effluents [J]. Water Research, 2014,57:183-192.
[9] Jannis W, Urs V G, Silvio C. Effect of Dissolved Organic Matter on the Transformation of Contaminants Induced by Excited Triplet States and the Hydroxyl Radical [J]. Environmental Science and Technology, 2011,45(4):1334-1340.
[10] Jacobs L E, Fimmen R L, Chin Y P, et al. Fulvic acid mediated photolysis of ibuprofen in water [J]. Water Research, 2011,45(15): 4449-4458.
[11] Li R, Zhao C, Yao B, et al. Photochemical Transformation of Aminoglycoside Antibiotics in Simulated Natural Waters [J]. Environmental Science and Technology, 2016,50(6):2921-2930.
[12] Xu Y, Nguyen T V, Reinhard M, et al. Photodegradation kinetics of p-tert-octylphenol, 4-tert-octylphenoxy-acetic acid and ibuprofen under simulated solar conditions in surface water [J]. Chemosphere, 2011,85(5):790-796.
[13] Niu X, Liu C, Gutierrez L, et al. Photobleaching-induced changes in photosensitizing properties of dissolved organic matter [J]. Water Research, 2014,66:140-148.
[14] Bai Y, Cui Z, Su R, et al. Influence of DOM components, salinity, pH, nitrate, and bicarbonate on the indirect photodegradation of acetaminophen in simulated coastal waters [J]. Chemosphere, 2018, 205:108-117.
[15] Oliveira C, Lima D L, Silva C P, et al. Photodegradation of sulfamethoxazole in environmental samples: The role of pH, organic matter and salinity [J]. Science of The Total Environment, 2019, 648:1403-1410.
[16] Batista A P S, Teixeira A C S, Cooper W J, et al. Correlating the chemical and spectroscopic characteristics of natural organic matter with the photodegradation of sulfamerazine [J]. Water Research, 2016, 93:20-29.
[17] Timko S A, Romera-Castillo C, Jaffé R, et al. Photo-reactivity of natural dissolved organic matter from fresh to marine waters in the Florida Everglades, USA [J]. Environmental Science Processes & Impacts, 2014,16(4):866-878.
[18] Chen Y, Hu C, Hu X, et al. Indirect photodegradation of amine drugs in aqueous solution under under simulated sunlight [J]. Environmental Science and Technology, 2009,43(8):2760-2765.
[19] Baena-Nogueras R M, González-Mazo E, Lara-Martín P A. Degradation kinetics of pharmaceuticals and personal care products in surface waters: photolysis vs biodegradation [J]. Science of The Total Environment, 2017,590:643-654.
[20] Illés E, Takács E, Dombi A, et al. Hydroxyl radical induced degradation of ibuprofen [J]. Science of The Total Environment, 2013, 447:286-292.
[21] Ritchie J D, Perdue E M. Proton-binding study of standard and reference fulvic acids, humic acids, and natural organic matter [J]. Geochimica et Cosmochimica Acta, 2003,67(1):85-96.
[22] Yamashita Y, Mccallister S L, Koch B P, et al. Dynamics of dissolved organic matter in fjord ecosystems: contributions of terrestrial dissolved organic matter in the deep layer [J]. Estuarine, Coastal and Shelf Science, 2015,159:37-49.
[23] De Bruyn W J, Clark C D, Ottelle K, et al. Photochemical degradation of phenanthrene as a function of natural water variables modeling freshwater to marine environments [J]. Marine pollution bulletin, 2012, 64(3):532-538.
[24] 杨 凯,葛林科,那广水,等.水中噁唑烷酮类抗生素利奈唑酮的光化学行为[J]. 环境通报, 2012,57(26):2469-2474. Yang K, Ge L K, Na G S, et al. Aqueous photochemical behavior of oxazolidinone antibiotic linezolid (in Chinese). Chin Sci Bull (Chin Ver), 2012,57(26):2469-2474.
[25] Assel M, Laenen R, Laubereau A. Ultrafast electron trapping in an aqueous NaCl-solution [J]. Chemical Physics Letters, 1998,289(3-4):267-274.
[26] Mostofa K M G, Sakugawa H. Spatial and temporal variations and factors controlling the concentrations of hydrogen peroxide and organic peroxides in rivers [J]. Environmental Chemistry, 2009,6(6):524-534.
[27] Brigante M, Minella M, Mailhot G, et al. Formation and reactivity of the dichloride radical (Cl2-) in surface waters: a modelling approach [J]. Chemosphere, 2014,95:464-469.
[28] Mack J, Bolton J. Photochemistry of nitrite and nitrate in aqueous solution: a review [J]. Journal of Photochemistry and Photobiology A: Chemistry, 1999,128(1-3):1-13.
[29] Zepp R, Hoigné J, Bader H. Nitrate-induced photooxidation of trace organic chemicals in water [J]. Environmental Science and Technology, 1987,21(5):443-450.
[30] Espinoza L, Neamtu M. The effect of nitrate, Fe(III) and bicarbonate on the degradation of bisphenol A by simulated solar-UV irradiation [J]. Water Research, 2007,41(19):4479-4487.
[31] Lin A Y C, Wang X H, Lee W N. Phototransformation determines the fate of 5-fluorouracil and cyclophosphamide in natural surface waters [J]. Environmental Science and Technology, 2013,47(9):4104-4112.
[32] Vione D, Falletti G, Maurino V, et al. Sources and Sinks of Hydroxyl Radicals upon Irradiation of Natural Water Samples [J]. Environmental Science and Technology, 2006,40(12):3775-3781.
[33] Wu C, Linden K G. Phototransformation of selected organophosphorus pesticides: roles of hydroxyl and carbonate radicals [J]. Water Research, 2010,44(12):3585-3594.
The indirect photodegradation mechanism of ibuprofen in simulated seawater.
BAI Ying1, CUI Zheng-guo1*, SU Rong-guo2, QU Ke-ming1
(1.Laboratory for Marine Fisheries Science and Food Production Processes, Pilot National Laboratory for Marine Science and Technology (Qingdao), Key Laboratory of Sustainable Development of Marine Fisheries, Ministry of Agriculture and Rural Affairs, Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China;2.Laboratory of Marine Chemistry Theory and Technology, Ministry of Education, Ocean University of China, Qingdao 266100, China)., 2019,39(7):2831~2837
To clarify the indirect photodegradation mechanism of IBP, the indirect photodegradation behaviors of IBP were investigated in the presence of four kinds of dissolved organic matter (DOM) and were also assessed in the presence of seawater components and conditions such as salinity, pH, nitrate and bicarbonate. Firstly, the indirect photodegradation of IBP could be accelerated by the four different sources of DOM and followed pseudo-first-order kinetics, the photodegradation rate constants of APAP were found to decrease in the following order: JKHA> SRHA> SRFA> SRNOM. DOM promoted the indirect photodegradation of IBP through the formation of various reactive intermediates, ∙OH and1O2were the main contributors. Secondly, in the range of pH 5~11, the photodegradation rate of IBP was firstly decreased and then increased, the highest photodegradation rate of IBP was found at pH 5.0. Lastly, the photodegradation rate constants of IBP increased with increasing salinity, nitrate and bicarbonate.
ibuprofen;indirect photodegradation;dissolved organic matter;reactive intermediates
X703
A
1000-6923(2019)07-2831-07
白 莹(1988-),女,山东聊城人,博士后,主要从事水体中抗生素的光降解机理研究.发表论文6篇.
2018-11-30
中国博士后科学基金资助项目(2018M632750);山东省支持青岛海洋科学与技术试点国家实验室重大科技专项(2018SDKJ05);青岛市博士后研究人员应用研究项目资助(喹诺酮类抗生素的间接光降解机理研究-以莱州湾为例)
*责任作者, 副研究员, cuizg@ysfri.ac.cn

