新型固态聚合物电解质在锂硫电池中的性能研究
马 强,戚兴国,容晓晖,胡勇胜,周志彬,李 泓,陈立泉,黄学杰
新型固态聚合物电解质在锂硫电池中的性能研究
马 强1,2,戚兴国1,容晓晖1,胡勇胜1,周志彬2,李 泓1,陈立泉1,黄学杰1
(1中国科学院物理研究所,北京 100190;2华中科技大学,湖北 武汉 430074)
本工作采用(氟磺酰)(三氟甲基磺酰)亚胺锂{Li[(FSO2)(CF3SO2)N],LiFTFSI}和聚氧乙烯(PEO)分别作为导电锂盐和聚合物主链,通过简单的溶液浇铸法制备了新型固态聚合物电解质(SPEs),并采取示差扫描量热(DSC)、热重(TGA)、线性扫描伏安(LSV)、交流阻抗(EIS)和恒电位直流(DC)极化等方法研究了LiFTFSI/PEO (EO/Li+摩尔比为16)电解质的理化性质和电化学性质。结果表明,LiFTFSI/PEO电解质具有较高的室温离子电导率(≈10−5S/cm),较高的氧化电位(4.63 V. Li/Li+),并且耐热温度高达256 ℃。锂硫电池测试结果表明,该类SPEs展现出相对高的首周放电比容量(881 mA·h/g),有效地抑制了多硫离子的“穿梭效应”,表现出良好的电池循环性能。
(氟磺酰)(三氟甲基磺酰)亚胺锂;固态聚合物电解质;聚氧乙烯;锂硫电池
近20年来,以嵌入化合物(LiCoO2、LiMn2O4和LiFePO4等)为正极的锂离子电池已经取得了巨大的进步,但是它们的可用比容量远远不能满足日益增长的电动车和储能电网的需求[1]。由于硫价格便宜、无毒且具有较高的理论比容量,是一种非常有前途的可充电锂电池阳极材料。锂硫电池具有高的理论能量密度(2600 W·h/kg或2800 W·h/L),是现有商业锂离子电池的3~5倍[2-3]。尽管锂硫电池具有上述提到的种种优势,但是以液态电解质为主的锂硫电池仍面临一些挑战,其中包括正极硫的利用率低、多硫离子的穿梭、金属锂负极的循环效率低、安全问题等[4-7],这些问题已经严重阻碍其在商业中的应用。
到目前为止,大部分的研究一直致力于研发复合阳极、优化电解液和保护金属锂负极等[8-11]。然而,由于液态电解质自身的不稳定性,使其很难从根本上解决锂硫电池的安全问题。固态聚合物电解质(SPEs)由于能够有效地抑制多硫离子的穿梭,同时提高锂硫电池的安全性和能量密度,将是替代液态电解质去改善锂硫电池的有效途径之一。据文献调研,很少有工作报道SPEs在锂硫电池中的应用, 主要是由于传统的SPEs在锂硫电池充放电过程中的界面稳定性差和硫的利用率低。
本工作采用(氟磺酰)(三氟甲基磺酰)亚胺锂{Li[(FSO2)(CF3SO2)N],LiFTFSI}作为导电锂盐,聚氧乙烯(PEO)作为聚合物主链,通过简单的溶 液浇铸法制备出新型SPEs,系统地研究了LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的理化性质和电化学性质, 包括离子电导率()、锂离子迁移数()、热稳定性(d)、耐氧化能力和锂硫电池性能。
1 实 验
1.1 试剂与仪器
(氟磺酰)(三氟甲基磺酰)亚胺锂(纯度 > 99.5%,苏州氟特电池材料有限公司);聚氧乙烯(w= 6×105g/mol,Acros);锂片(电池级14,天津中能锂业);CMK-3(南京先丰纳米);Super P导电剂(瑞士,特密高);PVDF黏结剂(阿尔法);硫粉(山西力之源电池材料有限公司);铝片(电池级,东莞新能源)。
手套箱(德国布劳恩公司);示差扫描量热仪(DSC,Netzsch DSC 200 F3,德国Netzsch公司);热重分析仪(TGA,Netzsch TG 209,德国Netzsch公司);Autolab电化学工作站(PGSTAT128N,荷兰Autolab公司);扣式电池充放电仪(CT2001A,武汉蓝电电子有限公司)。凡涉及对水和氧气敏感的试剂和材料的操作,均在填充高纯氩气的手套箱中(H2O、O2含量小于1×10-6)或高纯氩气保护下完成。
1.2 聚合物电解质膜的制备
在填充高纯氩气的手套箱(H2O、O2含量小于1×10-6)中,称取一定计量比的LiFTFSI和PEO并溶解于提纯的乙腈中(乙腈提纯方法:先氢化钙回流6 h,再蒸馏出乙腈),配制成EO单元与Li+摩尔比为16∶1的均匀黏稠溶液。将配制好的黏稠溶液缓慢倾倒在聚四氟乙烯板上,在60 ℃下真空干燥48 h,得到厚度为160~220 μm的均匀半透明薄膜。
1.3 电极极片的制备
CMK-3/S复合物是采用热处理方式制备得 到[12-13]。将CMK-3和硫粉研磨混合均匀,密封封装在玻璃管中,将其加热至155 ℃,恒温24 h。
首先将正极活性材料(CMK-3/S)、Super P、SPEs和PVDF按质量比65∶10∶20∶5溶于乙腈中制备成浆料。然后将硫正极浆料均匀涂覆于碳包覆的集流体铝箔上,在60 ℃下真空干燥12 h制得电极极片,转移至手套箱中备用。硫正极活性物质的面密度为1.0 mg/cm2左右。
1.4 聚合物电解质的物化及电化学性质评价
在高纯氮气保护下,使用DSC测定样品相变。测量温度范围为−150~150 ℃,升温速率为10 ℃/min;相变温度取相应DSC曲线上对应相变的中值。在高纯氩气保护下,采用TGA测定样品热稳定 性。测试温度范围为30~600 ℃,升温速率为 10 ℃/min;分解温度取样品质量损失为5%时对应的温度。
聚合物电解质的电导率()采用交流阻抗(EIS)的方法进行测定。将该聚合物电解质膜夹在一对不锈钢电极之间,测试温度范围为25~95 ℃,每个测试温度点间隔恒温1 h。聚合物电解质的锂离子电迁移数()通过EIS和恒电位直流(DC)极化相结合的方法测量,测试温度恒温在70 ℃,极化电位为10 mV。采用线性扫描伏安法(LSV)来研究聚合物电解质的耐氧化能力,以不锈钢为工作电极,金属锂为对电极,测试电位范围为2.5~6.0 V(. Li/Li+),扫描速度为1 mV/s,测试温度恒温在70 ℃。
1.5 电池性能评价
CR 2032扣式电池的组装在手套箱中完成,以金属锂为正负极,聚合物电解质既为电解质又为隔膜,组装成锂锂电池;以碳硫复合材料为正极,金属锂为负极,聚合物电解质既为电解质又为隔膜,组装成锂硫电池。锂硫电池的容量由硫正极确定。电池测试在电池充放电仪上进行(CT2001A,武汉蓝电电子有限公司),采取恒电流充/放电(0.1/0.1 C)的模式,充放电电压范围为1.5~3.0 V,测试温度恒温在60 ℃。锂锂电池测试采用同样恒流充/放电的模式,电流密度为0. 5 mA/cm2,每周测试时间为4 h,测试温度恒温在60 ℃。
2 结果与讨论
2.1 聚合物电解质膜的形貌
本工作通过简单的溶液浇铸法制备出LiFTFSI/PEO(EO/Li+摩尔比为16)电解质膜,膜的均匀性和厚度对聚合物电池的性能有重要影响。图1(a)和1(b)分别是LiFTFSI/PEO电解质膜的照片和SEM图像。由图1可知,通过溶液浇铸法制备出LiFTFSI/PEO电解质膜是均匀半透明的,且膜的厚度约为200 μm。
(a)(b)
图1(a)LiFTFSI/PEO(EO/Li+摩尔比为16)电解质膜的照片;(b)扫描电子显微镜图像
Fig.1 The photograph (a) and SEM image (b) for the membrane of LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte
2.2 聚合物电解质的理化性质及电化学性质
2.2.1 LiFTFSI/PEO电解质的相变及热稳定性
纯的LiFTFSI盐、PEO和LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的相变和热稳定性分别通过DSC和TGA进行测量,部分测量数据结果列于表1中。
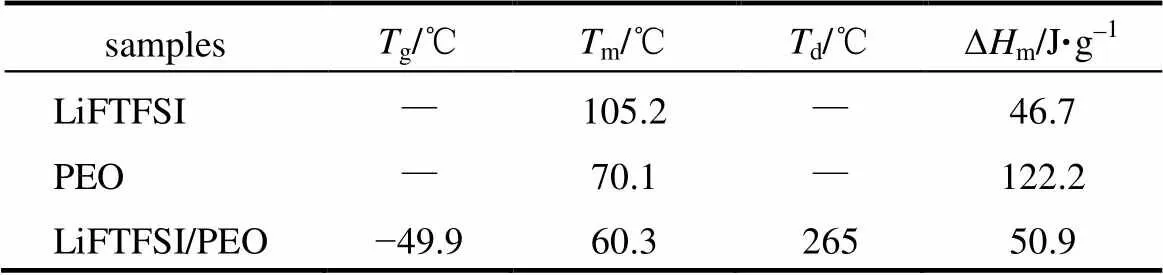
表1 纯的LiFTFSI、PEO和LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的相转变行为及热分解温度
图2(a)为纯的LiFTFSI盐、PEO和LiFTFSI/PEO电解质的DSC曲线图。与纯PEO结果相比,LiFTFSI/PEO电解质在升温过程中依次出现较低的玻璃化转变温度(g=−49.9 ℃,表1)和熔点(m=60.3 ℃,表1),这是由于LiFTFSI盐具有 较强的增塑效果;此外,从表1中可以看出,LiFTFSI/PEO电解质的熔化焓值(m=50.9 J/g, 表1)明显低于纯PEO的熔化焓值(m=122.2 J/g,表1),表明LiFTFSI和PEO共混可以降低PEO的结晶度,有利于提高离子电导率[14]。图2(b)是LiFTFSI/PEO电解质的TGA曲线图。其结果显示,LiFTFSI/PEO电解质的热分解温度(d)高达 256 ℃,满足了锂电池在室温或者100 ℃附近的应用要求。
(a)
(b)
图2(a)纯的LiFTFSI盐、PEO、LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的差式扫描量热曲线;(b)LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的热重曲线
Fig.2 (a) DSC traces of neat LiFTFSI, PEO, and the LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte at the heating scan; (b) TGA traces of the LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte
2.2.2 LiFTFSI/PEO电解质的电导率
图3是LiFTFSI/PEO电解质的电导率随温度的变化关系曲线图。可以看出,LiFTFSI/PEO电解质的电导率随温度升高而增加,该电解质的室温离子电导率为9.9×10−6S/cm,这与传统的LiTFSI/PEO电解质的电导率几乎一致。值得注意的是,该电解质的电导率在60 ℃左右出现一个拐点(=1.1×10−4S/cm),这主要是由于结晶区PEO的熔化引起,该结论与DSC相变曲线的结果吻合(表1和图2)。此时,离子传输过程由结晶或半结晶态转变成无定形态,使得离子迁移速率增加,因而电导率增加[14-16]。
2.2.3 LiFTFSI/PEO电解质的迁移数
SPEs的锂离子迁移数常采用EIS和DC极化相结合的方法测试[17-18],图4为LiFTFSI/PEO电解质的[Li|SPEs|Li]电池在极化前后的EIS曲线[图4(a)]和10 mV DC极化下的电流随时间的变化关系曲线[图4(b)]。LiFTFSI/PEO电解质的锂离子迁移数测试和计算得到的相关结果汇总在表2中。
(a)
(b)
图4 LiFTFSI/PEO(EO/Li+摩尔比为16)电解质在锂锂电池中的迁移数测试曲线:(a)阻抗谱;(b)电流随时间的变化关系曲线
Fig.4 Impedance spectra (a) and time-dependence response of DC polarization (b) for the LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte on the [Li|SPEs|Li] cells
表2 LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的锂离子迁移数()测试和计算结果
Table 2 Measured and corresponding calculated values for the lithium-ion transference number () of the LiFTFSI/PEO [n(EO)∶n(Li+)=16] electrolyte
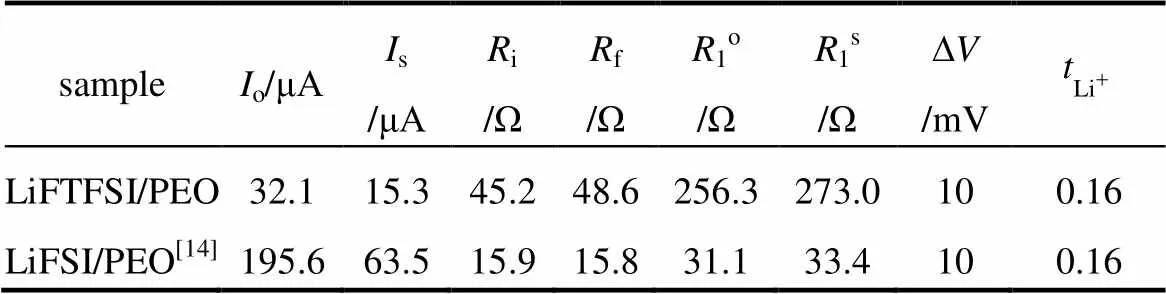
表2 LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的锂离子迁移数()测试和计算结果
sampleIo/μAIs/μARi/ΩRf/ΩR1o/ΩR1s/Ω∆V/mV LiFTFSI/PEO32.115.345.248.6256.3273.0100.16 LiFSI/PEO[14]195.663.515.915.831.133.4100.16
由表2可知,LiFTFSI/PEO电解质的锂离子迁移数为0.16。这与先前报道的LiFSI/PEO电解质的锂离子迁移数一致[14],也与传统双离子导体(即LiTFSI/PEO)的锂离子迁移数基本一致[19-20]。表明该电解质属于双离子导体。
2.2.4 LiFTFSI/PEO电解质的耐氧化性
图5是LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的线性扫描伏安曲线图。如图5所示,以 10 μA/cm2为电流密度截止值,LiFTFSI/PEO电解质的氧化电位为4.63 V(. Li/Li+),表明该电解质的耐氧化性能较好,能够满足4 V锂电池的应用要求。
2.2.5 LiFTFSI/PEO电解质与金属锂的界面性能
图6为LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的锂锂电池循环性能曲线图。结果表明,LiFTFSI/PEO电解质在锂锂电池测试中,能够稳定循环超过100 h,展现出对金属锂优秀的界面稳定性。
2.2.6 LiFTFSI/PEO电解质的锂硫电池性能
图7为LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的锂硫电池循环性能曲线图。如图7(b)所示,该锂硫电池的充放电容量随着循环周数的增加,呈现先增加后降低的趋势。从第1周到第10周[图7(a)],该锂硫电池的放电容量由881 mA·h/g增加到904 mA·h/g,原因可能是锂离子在SPEs和正极之间的传输较慢,导致需要较长时间活化[21]。然而在随后的循环中,容量缓慢衰减,当循环到第30周时,该锂硫电池的放电容量为647 mA·h/g,可能是由于硫正极在充放电过程中,较大的体积形变导致界面接触变差或者活性物质的团聚,从而降低了锂离子的传输和硫的利用率[22]。值得一提的是,除了第一周,该锂硫电池的库仑效率一直稳定在100%左右,表明LiFTFSI/PEO电解质有效地抑制了多硫离子的“穿梭效应”。
(a)第一周、第二周和第十周的恒流充放电曲线
(b)容量和效率随循环周数的变化关系曲线
图7 LiFTFSI/PEO(EO/Li+摩尔比为16)电解质的锂硫电池循环性能曲线
Fig. 7 Cycling perfomance of the Li|S cells with the LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte
3 结 论
本工作采用简单的溶液浇铸法制备出由(氟磺酰)(三氟甲基磺酰)亚胺锂(LiFTFSI)和聚氧乙烯(PEO)组成的新型固态聚合物电解质(SPEs)。通过DSC、TGA、LSV、EIS和DC极化等方法对该SPEs(LiFTFSI/PEO,EO/Li+摩尔比为16)的理化性质及电化学性质进行了系统的研究。结果表明,LiFTFSI/PEO电解质的室温电导率为9.9×10−6S/cm、耐氧化能力达到4.63 V(Li/Li+)、热分解温度高达256 ℃。值得指出的是,LiFTFSI/PEO电解质展现出对金属锂优秀的界面稳定性和对锂硫电池良好的循环能力,且有效地抑制了多硫离子的“穿梭效应”。综上所述,LiFTFSI/PEO电解质在锂硫电池中具有广阔的应用前景。
参 考 文 献
[1] CAIRNS E J,ALBERTUS P. Batteries for electric and hybird-electric vehicles[J]. The Annual Review of Chemical and Biomolecular Engineering,2010,1:299-320.
[2] MANTHIRAM A,FU Y Z,SU Y S. Challenges and prospects of lithium-sulfur batteries[J]. Accounts of Chemical Research,2013,46(5):1125-1134.
[3] EVERS S,NAZAR L F. New approaches for high energy density lithium-sulfur battery cathodes[J]. Accounts of Chemical Research,2013,46(5):1135-1143.
[4] YE X M,MA J,HU Y S,et al. MWCNT porous microspheres with an efficient 3D conductive network for high performance lithium-sulfur batteries[J]. Journal of Materials Chemistry A,2016,4:775-780.
[5] FU Y Z,SU Y S,MANTHIRAM A. Highly reversible lithium/dissolved polysulfide batteries with carbon nanotube electrodes[J]. Angewandte Chemie International Edition,2013,52:6930-6935.
[6] SEH Z W,LI W Y,CHA J J,et al. Sulphur-TiO2yolk-shell nanoarchitecture with internal void space for long-cycle lithium-sulphur batteries[J]. Nature Communications,2013,4:1331-1336.
[7] YIN Y X,XIN S,GUO Y G,et al. Lithium-sulfur batteries:Electrochemistry, materials, and prospects[J]. Angewandte Chemie International Edition,2013,52:13186-13200.
[8] FU Y Z,MANTHIRAM A. Core-shell structured sulfur-polypyrrole composite cathodes for lithiumsulfur batteries[J]. RSC Advances,2012,2:5927-5929.
[9] DING F,XU W,GRAFF G L,et al. Dendrite-free lithium deposition via self-healing electrostatic shield mechanism[J]. Journal of the American Chemical Society,2013,135:4450-4456.
[10] SHIN J A,JINE M,NA B K,et al. Facile preparation and electrochemical properties of carbon-enfolded sulfur particles for Li-S battery application[J]. Journal of the Electrochemical Society,2016,163(2):A57-A61.
[11] WU F,QIAN J,CHEN R J,et al. An effective approach to protect lithium anode and improve cycle performance for Li-S batteries[J]. ACS Applied Materials & Interfaces,2014,6:15542-15549.
[12] JI X L,LEE K T,NAZAR L F. A highly ordered nanostructured carbon-sulphur cathode for lithium-sulphur batteries[J]. Nature Materials,2009,8:500-506.
[13] SUO L M,HU Y S,LI H,et al. A new class of solvent-in-salt electrolyte for high-energy rechargeable metallic lithium batteries[J]. Nature Communications,2013,4:1481-1489.
[14] MA Q,XIA Y,FENG W F,et al. Impact of the functional group in the polyanion of single lithium-ion conducting polymer electrolytes on the stability of lithium metal electrodes[J]. RSC Advances,2016,6:32454-32461.
[15] MOHAN V M,RAJA V,BHARGAV P B,et al. Structural, electrical and optical properties of pure and NaLaF4doped PEO polymer electrolyte films[J]. Journal of Polymer Research,2007,14:283-290.
[16] MOHAPATRA S R,THAKUR A K,CHOUDHARY R. Studies on PEO-based sodium ion conducting composite polymer films[J]. Ionics,2008,14:255-262.
[17] EVANS J,VINCENT C A,BRUCE P. Electrochemical measurement of transference numbers in polymer electrolytes[J]. Polymer,1987,28:2324-2328.
[18] ABRAHAM K M,JIANG Z,CARROLL B. Highly conductive PEO-like polymer electrolytes[J]. Chemistry of Materials,1997,9:1978-1988.
[19] MA Q,ZHANG H,ZHOU C W,et al. Single lithium-ion conducting polymer electrolytes based on a super-delocalized polyanion[J]. Angewandte Chemie International Edition,2016,55:2521-2525.
[20] FENG S W,SHI D Y,LIU F,et al. Single lithium-ion conducting polymer electrolytes based on poly[(4-styrenesulfonyl)(trifluoromethanesulfonyl)imide] anions[J]. Electrochimica Acta,2013,93:254-263.
[21] ZHANG Y G,ZHAO Y,GOSSELINK D,et al. Synthesis of poly(ethylene-oxide)/nanoclay solid polymer electrolyte for all solid-state lithium/sulfur battery[J]. Ionics,2015,21:381-385.
[22] JEON B H,YEON J H,CHUNG I J. Preparation and electrical properties of lithium-sulfur-composite polymer batteries[J]. Journal of Materials Processing Technology,2003,143-144:93-97.
Novel solid polymer electrolytes for all-solid-state lithium-sulfur batteries
MA Qiang1,2, QI Xingguo1, RONG Xiaohui1, HU Yongsheng1, ZHOU Zhibin2, LI Hong1,CHEN Liquan1, HUANG Xuejie1
(1Institute of Physics, Chinese Academy of Sciences, Beijing 100190, China;2Huazhong University of Science and Technology, Wuhan 430074, Hubei, China)
Novel solid polymer electrolytes, composed of lithium (fluorosulfonyl)(trifluoromethanesulfonyl) imide {Li[(FSO2)(CF3SO2)N], LiFTFSI} and poly(ethylene oxide) (PEO), are prepared by solution casting method. The physicochemical and electrochemical properties of LiFTFSI/PEO [(EO)∶(Li+)=16] electrolyte are investigated by the differential scanning calorimeter (DSC), thermogravimetric analysis (TGA), linear sweep voltammogram (LSV), electrochemical impedance spectroscopy (EIS), and potentiostatic direct current (DC) polarization. It is demonstrated that LiFTFSI/PEO electrolyte exhibits a relatively high ionic conductivity (≈10−5S/cm) at 25 ℃, sufficient electrochemical stability (4.63 V. Li/Li+), and is thermally stable up to 256 ℃. More importantly, the complex of LiFTFSI/PEO displays a relatively high initial discharge capacity (881 mA·h/g) and effectively inhibits the shuttle effect arising from dissolved polysulfides in lithium-sulfur (Li-S) batteries, and exhibits a good cycling performance of Li-S batteries.
lithium (fluorosulfonyl)(trifluoromethanesulfonyl) imide; solid polymer electrolytes; poly (ethylene oxide); lithium-sulfur batteries
10.12028/j.issn.2095-4239.2016.0021
O 646.21
A
2095-4239(2016)05-713-06
2016-06-02;修改稿日期:2016-06-12。
国家自然科学基金(51222210,51472268),国家高技术研究发展计划(863计划)(2009AA033101)及中国科学院“百人计划”项目。
马强(1989—),男,博士研究生,研究方向为锂电池电解质以及器件,E-mail:D201477090@hust.edu.cn;通讯联系人:胡勇胜,研究员,研究方向为新能源材料及其相关基础科学问题,E-mail:yshu@iphy.ac.cn;周志彬,教授,研究方向为锂离子电解质材料,E-mail:zb-zhou@mail.hust.edu.cn。

