普洱茶茶褐素对大鼠尿液影响的代谢组学研究
刘建,彭春秀,盛军,高斌,龚加顺*
普洱茶茶褐素对大鼠尿液影响的代谢组学研究
刘建1,彭春秀2,盛军1,高斌1,龚加顺1*
1. 云南农业大学食品科学技术学院,云南昆明 650201;2. 云南农业大学园林园艺学院,云南昆明 650201
本研究采用核磁共振(NMR)代谢组学法研究普洱茶茶褐素(TB,分子量>50 kDa)对大鼠尿液代谢的影响。将实验大鼠分为正常对照组、正常+TB组、高脂组和高脂+TB组,以生物核磁共振技术结合正交偏最小二乘-判别分析(OPLS-DA)研究灌胃高剂量普洱茶茶褐素后大鼠尿液内源性代谢物的变化。结果表明,正常+TB组与正常对照组,高脂+TB组与高脂组的尿液代谢谱有明显差异;筛选出缬氨酸、柠檬酸、牛磺酸、丙酸盐、α-酮戊二酸、β-羟基丁酸等6种普洱茶茶褐素标志性代谢物;普洱茶茶褐素对大鼠尿液的影响可能涉及到氨基酸代谢、能量代谢、三羧酸循环、脂类代谢和氧化应激反应。
茶褐素;代谢组学;核磁共振
普洱茶是以云南大叶种茶树的鲜叶经杀青、揉捻、日晒等工序制成的晒青绿毛茶为原料,再经发酵、蒸压、成型工艺制成的各种形状的成品茶[1]。研究表明,普洱茶有较为明显的降脂、降糖、防止动脉硬化等功效[2-4]。普洱茶中主要功能活性来源于茶多酚以及茶色素,茶色素可以分为茶黄素、茶红素和茶褐素,其中以茶褐素的含量最高,可达17%[5-6]。目前公认茶褐素是一类分子差异极大的复杂的高聚合物,不溶于氯仿、乙酸乙酯以及正丁醇,且茶褐素中含有相当数量的蛋白质、糖类、酸类物质(包括羧酸基以及酚羟基)[7-8]。
茶褐素是普洱茶重要的活性物质,已有多篇文献报道普洱茶茶褐素具有降脂减肥的功效[9-10]。陈婷等[11]研究表明,茶褐素能减少肝脏脂肪沉积,具有预防实验动物脂肪肝形成的作用。与陈婷的研究结果相同,王秋萍等[12]以水提醇沉法制备紫娟普洱茶茶褐素饲喂大鼠,发现该茶褐素不仅能减少肝脏脂肪沉积,而且可以显著抑制大鼠体重的增长速度。高斌等[13]研究发现,普洱茶茶褐素可显著增强大鼠肝脏和附睾脂肪组织HSL活性及其mRNA的表达,对大鼠降血脂效果明显。
普洱茶茶褐素如何在生物体内吸收、代谢以及发生降血脂功效等情况尚不清楚。代谢组学是一种系统研究生物体内代谢物的组学方法,可以从整体上把握生物体内源性代谢产物的变化及其发展规律,能够全面、即时地反映机体的变化信息[14],以核磁共振(NMR)为基础的代谢组分析技术已得到快速发展和较为广泛的应用[15-16]。本文通过水提醇沉法提取普洱茶茶褐素并灌胃大鼠,采用基于1H-NMR的代谢组学技术,检测不同组别的大鼠尿液内源性代谢物的变化,为研究普洱茶在体内的降血脂作用机制提供新的思路。
1 材料与方法
1.1 主要试剂和仪器
普洱茶(大益牌,一级茶),购自云南大益茶业集团有限公司;乙醇(纯),D2O购自美国默克试剂公司,水为自制纯净水。MSC300超滤杯,上海靡速科技器材有限公司;FD-1PF真空冷冻干燥机,北京德天佑科技发展有限公司;RE-52A旋转蒸发仪,上海亚荣仪器厂;AVANCE 500核磁共振仪,德国BRUKER公司;CT15RE冷冻离心机,日本HITACHI公司;-80℃冰箱,美国Thermo Scientific公司。
1.2 普洱茶茶褐素的制备
普洱茶茶褐素参考杨大鹏[17]、王秋萍等[12]的制备方法,具体如下:取茶样加入10倍蒸馏水浸提2次(70℃,0.5 h),过滤后合并滤液、减压浓缩(65℃,0.07 MPa),再加乙醇醇沉6 h [(滤液)∶(无水乙醇)=1∶4],离心(4 000 r·min-1, 20 min),收集沉淀,加蒸馏水溶解进行超滤(膜孔径5 nm),最后将滤液真空冷冻干燥,得到普洱茶茶褐素(分子量>50 kDa)。
该茶褐素呈黑褐色,细沙状小颗粒,易溶于水。通过600℃下的CP-GC-MS分析显示,含N-类化合物:18.42%;有机烃类:18.18%;酯类:16.2%;酚类:12.63%;生物碱:9.41%;醇类:7.4%;呋喃类:7.2%;酸类:4.82%;酮类:1.82%;其他:3.92%。
1.3 灌胃剂量的确定
龚加顺等[6]研究发现,受试物的LD50>10 g·kg-1(95%可信限),属实际无毒级物质。根据敬明武等[18]报道,茶色素的人体推荐量为45 mg·kg-1。按《保健食品评价程序和检验方法》的要求,设高、中、低3个剂量组[19],其中1个剂量组是人体可能摄入量的5~10倍,最高不超过30倍。因此本实验将人体推荐量的3倍设为低剂量,中、高剂量分别为人体推荐摄入量的9倍、27倍,即135 mg·kg-1、405 mg·kg-1、1215 mg·kg-1。最后本试验采用高剂量即1215 mg·kg-1且分子量大于50 kDa的茶褐素。
1.4 动物分组和处理
基础饲料由昆明医学院动物实验中心提供,配方为:玉米350 g·kg-1、麦麸250 g·kg-1、豆粕250 g·kg-1、鱼粉 80g·kg-1、酵母20 g·kg-1、骨粉20 g·kg-1、乳清粉10 g·kg-1、盐5 g·kg-1、菜油5 g·kg-1、矿物添加剂1 g·kg-1、复合维生素0.3 g·kg-1、蛋氨酸1.3 g·kg-1、赖氨酸0.7 g·kg-1和鱼肝油0.5 g·kg-1;高脂饲料配方来源于《保健食品检验与评价技术规范》[19],配方为:基础饲料78.8%、熟猪油10.0%、蛋黄粉10.0%、胆固醇1.0%、胆盐0.2%。
实验动物由昆明医学院实验动物中心提供(许可证号:SYXKX(滇2011-0004)),选择健康成年雄性SD大鼠,体质量180~200 g。将20只大鼠置于简易代谢笼中,室内保持12 h光照,12 h避光循环饲养,自由摄食,自由饮水。每天定时通风,环境温度控制在(20±2)℃,湿度45%~60%。
所有大鼠饲喂基础饲料1周以适应环境和饲喂方式,1周后根据大鼠体质量水平,随机分为4组,每组5只大鼠,分别为正常对照组、正常+TB组、高脂组、高脂+TB组。适应期结束后进入为期14 d的干预期,前两组给予基础饲料,后两组给予高脂饲料。其中,正常+TB组和高脂+TB组按照设计剂量每日经口灌胃茶褐素,其他组别均给予相同剂量蒸馏水灌胃。具体分组见表1。

表1 试验大鼠组别设计
干预期14 d结束时,收集每只大鼠第14天24 h内的尿液,3 000 r·min-1低速离心15 min,用移液枪吸取上层尿液分装于离心管中并放入-80℃冰箱保存备用。
1.5 尿液的1H-NMR分析
将尿液取出解冻,取尿样0.5 mL置离心管中,1 2000 r·min-1离心10 min。取上清液300 μL加入5 mm核磁管中,再加入30 μL重水混合均匀,进行1H-NMR测定。以肌酐甲基峰化学位移3.10为内标,采用Noesygpprld脉冲序列,参数如下:谱宽8 000 Hz,累积扫描32次,采样点数64 000,采样时间4 s,弛豫延迟8 s,试验温度300 K。自由感应衰减信号(FID)经过傅立叶转换后为一维NMR谱图,利用MestReNova 6.1软件对1H-NMR谱进行相位矫正和基线矫正,经相位和基线校正后,去除水峰4.3~6.0,然后将谱图中0.2~4.3的谱峰,以每段0.02 mg·kg-1的宽度进行分段积分,将积分数据按每一张谱的总积分归一化,以文本文件或Excel文件贮存,用于多元统计分析。
1.6 数据处理和分析
将所得积分数据输入SIMCA-P+12.0软件,进行平均中心化(Mean centering)和Pareto定标(Pareto scaling),利用正交偏最小二乘-判别分析(OPLS-DA)等分析方法进行分析。根据变量投影重要性(Variable importance in the projection, VIP)值、化学位移值以及Chenomx NMR suite 7.5数据库对主要代谢物的化学位移进行归属,VIP>1且具有统计意义的变量被认为是对模型有显著贡献的潜在生物标志物。将潜在生物标志物输入KEGG数据库查找代谢物涉及的代谢途径。采用检验考察代谢物组间差异的统计学意义,统计数据采用SPSS (version 19.0S, Beijing Stats Data Mining Co. Ltd., China) 统计软件进行单因素方差分析,<0.05为差异有统计学意义,数据以平均值±标准差(±SD)表示。
2 结果与分析
2.1大鼠尿液1H-NMR图谱的变化
尿液等终端代谢物是机体各种细胞、组织和器官功能变化的综合反映,尿液的组成及其代谢物的浓度受机体各系统功能状态的直接影响,反映机体的代谢状况[20]。
不同组别大鼠尿液1H-NMR谱见图1,利用library of the Chenoms NMR suite 7.5,并根据相关参考文献[21-24]对主要代谢物的化学位移进行归属,图1中包含了7种内源性代谢物,分别为丙酸盐、β-羟基丁酸盐、氧化三甲胺、牛磺酸、肌酸、α-酮戊二酸和柠檬酸。与正常对照组相比,正常+TB组的图谱直接观察变化不大,而高脂组和高脂+TB组均可看到明显变化。通过目测很难得出不同组别大鼠尿液代谢物的具体差异,为寻找大鼠尿液的细微成分变化,通过正交偏最小二乘-判别分析(OPLS-DA)对图谱数据进行统计学分析,详细研究茶褐素对大鼠尿液内源代谢物的影响。
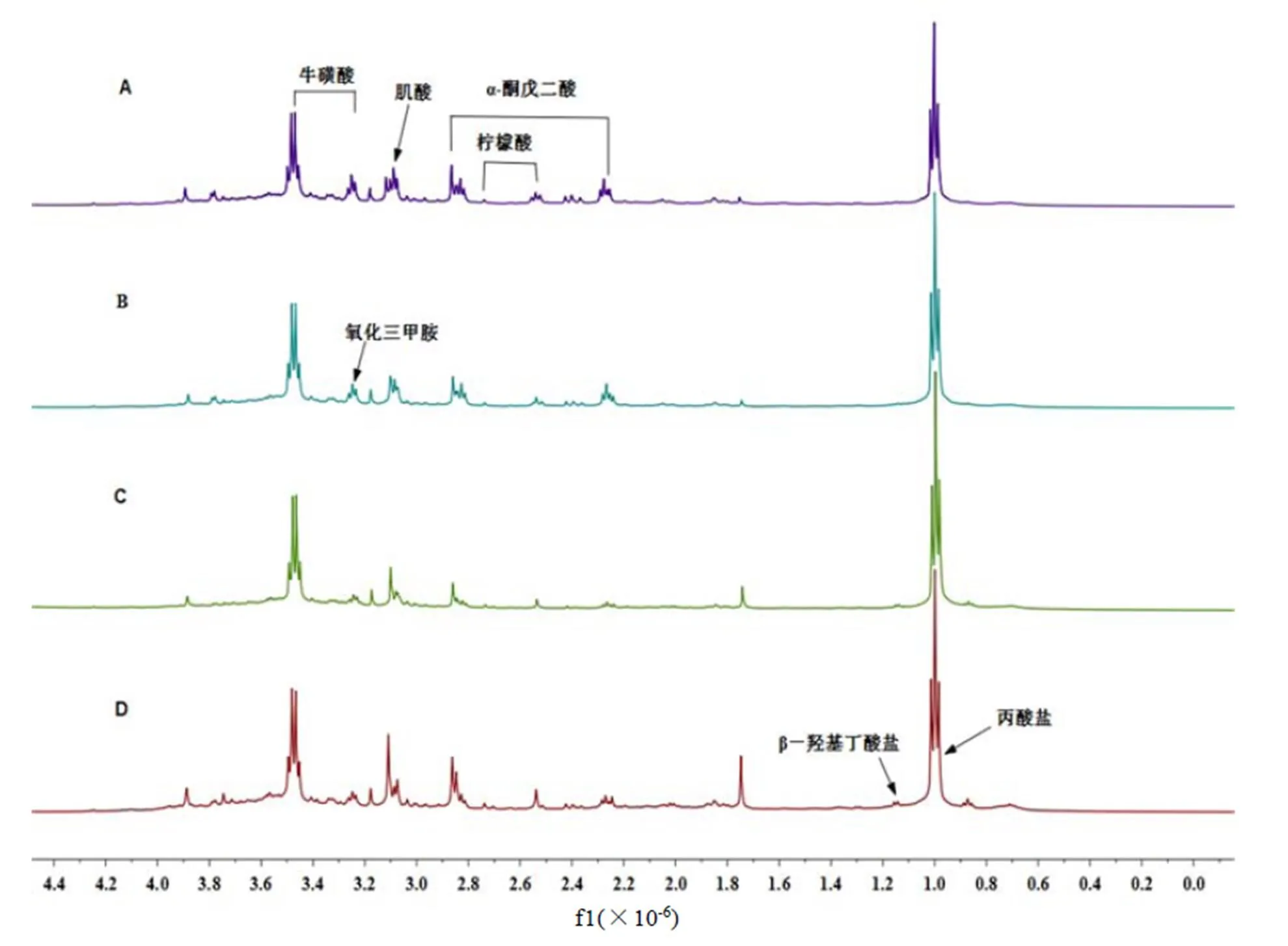
注:A-正常对照组,B-正常+TB组,C-高脂组,D-高脂+TB组。
2.2 大鼠尿液OPLS-DA分析
试验所建立的OPLS-DA模型的得分图、载荷图、S-图如图2所示。模型参数R2Y用来衡量已建立的模型对包含分类变量的Y矩阵的解释能力,Q2表征模型对Y矩阵的预测能力[25]。试验所建立的OPLS-DA模型的R2Y、Q2值列于图2中,两组模型拟合效果较好,有良好的预测能力。
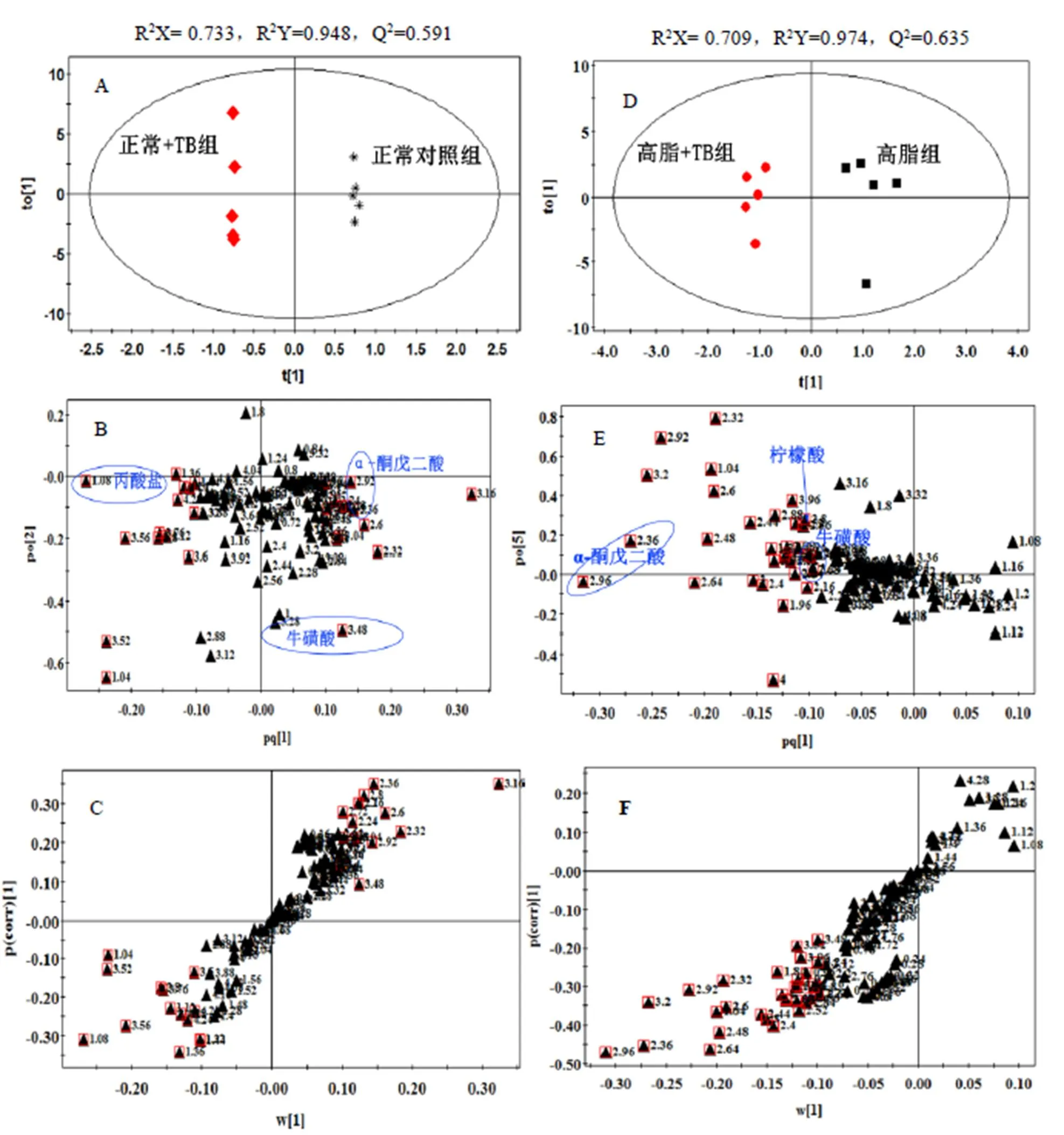
注:正常对照组和正常+TB组比较(A:得分图,B:载荷图,C:S-plot图),高脂组和高脂+TB组比较(D:得分图,E:载 荷图,F:S-plot图)。正常对照组与高脂组为对照组,载荷图中数字代表化学位移,红色方框代表VIP值>1的化学位移。
根据得分矩阵主成分1可以区分正常+TB组和正常对照组,高脂+TB组和高脂组,对应积分矩阵图可见积分值集中分布于散点图的椭圆内(95%可信区间),不存在特异点,两组的分布区域完全分开,说明普洱茶茶褐素对饲喂不同饲料的大鼠尿液均产生了影响。相应的OPLS-DA载荷图和S-plot图,其中每个点代表1个谱峰段。通常在样本分组方向上如果谱峰段偏离零点越远,表明这个谱峰段对分类的贡献越大,越有可能是潜在的特征代谢物,部分相关代谢物见图2载荷图中标注。
2.3 茶褐素对尿液内源性化合物的影响
在OPLS-DA模型中得出的与茶褐素代谢相关度较高的化合物,其浓度变化以及VIP (Variable importance in the projection)值列于表2。VIP值大于1的代谢物被认为是对组别分类贡献较大的物质,VIP值越大,贡献越大。从表2可以看出,正常对照组和高脂组大鼠分别灌胃普洱茶茶褐素后,有多种代谢物发生明显变化。正常对照组和正常+TB组比较中,丙酸盐、蛋氨酸、α-酮戊二酸、柠檬酸、牛磺酸等对两组差异贡献较大。高脂组和高脂+TB组比较中,缬氨酸、β-羟基丁酸盐、α-酮戊二酸、柠檬酸、牛磺酸、甘氨酸等对两组差异贡献较大。这些代谢物涉及到的代谢途径主要包括氨基酸代谢、能量代谢、三羧酸循环和氧化应激等。

表2 Chenomx NMR Suite确认的尿液样品中代谢物质
注:s为单峰,d为双重峰,t为三重峰,m为多重峰,dd为2×2峰。↑表示增加,↑↑表示相对于对照组显著增加(<0.05);↓表示降低,↓↓表示相对于对照组显著降低(<0.05),正常对照组和高脂组为对照组。
Note: s, d, t, m, dd represent single peak, double peaks, triple peaks, multiple peaks and 2×2 peaks, respectively. Metabolites marked with ↑ are increased and those marked with ↑↑ are significantly increased in comparison to the control (<0.05). Metabolites marked with ↓ are decreased and those marked with ↓↓ are significantly decreased in comparison to the respective group (<0.05), before vs is the comparative group.
2.4不同组别大鼠尿液中的差异代谢物
采用SPSS软件对上述贡献较大的代谢物进一步处理,图3为经过检验的差异代谢物在4组大鼠尿液中的含量比较。相对于正常对照组,正常+TB组大鼠尿液中丙酸盐显著升高(<0.05),α-酮戊二酸、柠檬酸、牛磺酸显著降低(<0.05);相对于高脂组,高脂+TB组大鼠尿液中缬氨酸、α-酮戊二酸、柠檬酸、β-羟基丁酸盐显著升高(<0.05);牛磺酸显著降低(<0.05);相对于正常对照组,高脂组大鼠尿液中丙酸盐、α-酮戊二酸显著升高(<0.05),缬氨酸、牛磺酸显著降低(<0.05);相对于正常+TB组,高脂+TB组大鼠尿液中柠檬酸、α-酮戊二酸、β-羟基丁酸盐显著升高(<0.05),牛磺酸显著降低(<0.05)。

注:同一化合物对应的组别小写字母不同,代表差异显著,P<0.05。
3 讨论
自1999年以来,基于相关仪器和分析技术的快速提升,代谢组学研究发展迅速,发表的相关科学文献和综述的数量呈指数上升趋势[26-28]。本实验运用1H-NMR代谢组学技术对灌胃普洱茶茶褐素(TB)后大鼠尿液中内源性代谢产物的变化及其降血脂机制进行探讨。
由试验可知,不同组别大鼠尿液的核磁氢谱有一定差别,经过OPLS-DA的进一步分析和筛选,发现缬氨酸、丙酸盐等代谢物的不同变化和涉及到的代谢途径。最后经过检验统计学分析,确定缬氨酸、柠檬酸、牛磺酸、丙酸盐、α-酮戊二酸、β-羟基丁酸为主要的差异代谢物。
已知丙酸盐具有抑制胆固醇合成的功能[29]。据研究表明,乳酸盐、丙酸盐和氨基酸的增加有利于丙酮酸盐的产生[30]。Stanko等[31]考察了丙酮酸盐对身体的影响,结果显示人体补充丙酮酸盐后,脂肪消耗有明显的增加趋势。尿液中的柠檬酸、α-酮戊二酸是三羧酸循环的重要中间产物。由草酰乙酸和乙酰CoA合成柠檬酸是三羧酸循环的重要调节点,由柠檬酸经脱氢脱羧后生成α-酮戊二酸,是三羧酸循环中的限速步骤。
缬氨酸是人体必需的8种氨基酸和生糖氨基酸之一,牛磺酸是一种由胱氨酸转化而来的含硫的β-氨基酸,这两种氨基酸都能调节血糖,促进肌细胞对葡萄糖和氨基酸的摄取和利用。其中,牛磺酸还可以加速糖酵解,增加糖原异生[32]。牛磺酸与胆酸结合成牛磺胆酸,参与脂类的消化吸收[33]。同时有报道指出,高脂饮食动物由于肝内胆固醇堆积造成牛磺酸结合的胆汁酸排泄增加,导致尿中牛磺酸减少[34]。Gong等[3]发现普洱茶茶褐素不仅可以促进胆固醇的转化,还可以促进大鼠体内胆固醇的排泄。β-羟基丁酸盐是肝脏内脂肪酸氧化的一种产物,Thiess等[35]发现高脂饮食条件下,猫血清中β-羟基丁酸盐和胆固醇等显著升高。牛磺酸和β-羟基丁酸盐的变化表明了氧化应激的产生[36-37]。
丙酸盐、柠檬酸和α-酮戊二酸涉及到能量代谢,正常+TB组相对于正常对照组,丙酸盐、柠檬酸和α-酮戊二酸都有显著变化,说明正常饮食条件下,茶褐素会影响大鼠体内的能量代谢;高脂+TB组相对于高脂组,α-酮戊二酸、柠檬酸显著升高(<0.05),与正常+TB组对比正常对照组的变化不同,有可能是高脂饲料的饲喂条件下,茶褐素加速了大鼠体内三羧酸循环过程,产生了更多的能量进行脂肪代谢。
正常+TB组相对于正常对照组,高脂+TB组相对于高脂组的牛磺酸含量均显著减少(<0.05),很有可能是茶褐素调节牛磺酸更多地与胆酸结合,消化吸收脂类成分。高脂+TB组相对于高脂组,β-羟基丁酸盐含量显著升高(<0.05),这可能与茶褐素调节大鼠体内脂肪酸代谢有关。此外,高脂+TB组大鼠尿液中缬氨酸含量相对于高脂组显著升高(<0.05),反映出高脂饮食条件下,普洱茶茶褐素可以调节大鼠体内的氨基酸代谢。
4结论
本文利用基于1H-NMR的代谢组学技术,探讨了普洱茶茶褐素对大鼠尿液代谢产物的影响及其降血脂机制。筛选出缬氨酸、柠檬酸、牛磺酸、丙酸盐、α-酮戊二酸、β-羟基丁酸为普洱茶茶褐素在大鼠体内的标志性代谢物。普洱茶茶褐素通过这些代谢物,影响到大鼠机体的氨基酸代谢、能量代谢、脂类代谢和三羧酸循环等代谢途径。这些标志性代谢化合物和相关的代谢途径,初步揭示了普洱茶茶褐素在生物体内的代谢和作用机制,为解释普洱茶的降血脂机制提供了新的思路。
参考文献
[1] 龚加顺, 周红杰, 张新富, 等. 云南晒青绿毛茶的微生物固态发酵及成分变化研究[J]. 茶叶科学, 2005, 25(4): 300-306.
[2] Hou Y, Shao WF, Xiao R, et al. Pu-erh tea aqueous extracts lower atherosclerotic risk factors in a rat hyperlipidemia model [J]. Experimental Gerontology, 2009, 44 (6/7): 434-439.
[3] Gong JS, Peng CX, Chen T, et al. Effects of theabrownin from Pu-erh Tea on the metabolism of serum lipids in rats: Mechanism of action [J]. Journal of Food Science, 2010, 75(6): 182-189.
[4] Yan SJ, Wang L, Li Z, et al. Inhibition of advanced glycation end product formation by Pu-erh tea ameliorates progression of experimental diabetic nephropathy [J]. Journal of Agricultural and Food Chemistry, 2012, 60(16): 4102-4110.
[5] 秦谊, 龚加顺, 张惠芬, 等. 普洱茶茶褐素提取工艺及理化性的初步研究[J]. 林产化学与工业, 2009, 29: 95-98.
[6] 龚加顺, 陈文品, 周红杰, 等. 云南普洱茶特征成分的功能与毒理学评价[J]. 茶叶科学, 2007, 27(3): 201-2l0.
[7] Wang QP, Peng CX, Gong JS. Effects of enzymatic action on the formation of theabrownin during solid state fermentation of Pu-erh tea [J]. J Sci Food Agric, 2011, 13(91): 2412-2418.
[8] 周红杰, 秘鸣, 韩俊. 普洱茶的功效及品质形成机理研究进展[J]. 茶叶科学, 2003, 23 (2): 75-77.
[9] 郭韦韦. 普洱茶减肥功效评价与研究[D]. 昆明: 昆明医学院, 2011: 29-38.
[10] 熊昌云. 普洱茶降脂减肥功效及作用机理研究[D]. 杭州: 浙江大学, 2012: 25-93.
[11] 陈婷. 普洱茶茶褐素降血脂功效及其作用机制研究[D]. 云南: 云南农业大学, 2009: 25-50.
[12] 王秋萍, 龚加顺. “紫娟” 普洱茶茶褐素对高脂饮食大鼠生长发育的影响[J]. 茶叶科学, 2012, 32(1): 87-94.
[13] 高斌, 彭春秀, 龚加顺, 等. 普洱茶茶褐素对大鼠激素敏感性脂肪酶活性及其mRNA表达的影响[J]. 营养学报, 2010, 4(32): 362-366.
[14] Nicholson JK, Connelly J, Lindon JC, et al .Metabonomics: a platform for studying drug toxicity and gene function [J]. Nat Rev Drug Discov, 2002, 1(2): 153-161.
[15] Azmi J, Griffin JL, Shore RF, et al. Chemometric analysis of biofluids following toxicant induced hepatotoxicity: a metabonomic approach to distinguish the effects of 1-naphthylisothiocyanate from its products [J]. Xenobiotica, 2005, 35(8): 839-852.
[16] Griffin JL. Metabonomics: NMR spectroscopy and pattern recognition analysis of body fluids and tissues for characterization of xenobiotic toxicity and disease diagnosis [J]. Current Opinion in Chemical Biology, 2003, 7(5): 648-654.
[17] 杨大鹏, 史文斌, 陈一江, 等. 不同微生物发酵的云南普洱茶样中茶褐素提取物的化学成分分析[J]. 林产化学与工业, 2010, 30(1): 49-52.
[18] 敬明武, 葛宇杰, 刘科亮. 茶色素胶囊对大鼠辅助调节血脂的研究[J]. 中国现代医生, 2007, 45(5): 18-19.
[19] 中华人民共和国卫生部. 保健食品检验与评价技术规范[M]. 北京: 人民卫生出版, 2003: 2.
[20] 刘树民, 崔立然. 代谢组学技术在中药毒性研究中的应用前景[J]. 毒理学杂志, 2008, 22(2): 155.
[21] Wilson ID, Nicholson JK. Solid phase extraction chromatography and NMR spectroscopy (SPEC-NMR) for the rapid identification of drug metabolites in urine [J]. J Pharm Biomed, 1988, 6(2): 151-165.
[22] Gartland KPR, Eason CT, Wade KE. Proton NMR spectroscopy of bile for onitoring the excretion of endogenous and xenobiotic metabolites: application to paraminophenol [J]. J PharmBiomed,1989, 7(6): 699-707.
[23] Tuli PK, Nicholson JK, Timbrell JAA. Study of the metabolism of dimethylformamide in the rat by high resolution proton NMR spectroscopy [J]. J Pharm Biomed, 1989, 7(4): 499-505.
[24] Wilson ID, Wade KE, Nicholson JK. Analysis of biological fluids by high-field nuclear magnetic resonance spectroscopy [J]. Trends Anal Chem, 1989, 8(10): 368-374.
[25] Liang X, Chen X, Liang Q, et al. Metabonomic study of Chinese medicine Shuanglong formula as an effective treatment for myocardial infarction in rats [J]. J Proteome Res, 2011, 10(2): 790-799.
[26] Sumner LW, Mendes P, Dixon RA. Plant metabolomics: largescale phytochem is try in the functional genomics era [J]. Phytochemistry, 2003, 62(6): 817-836.
[27] Rochfort S. Metabolomics reviewed: a new “omics” platform technology for systems biology and implications for natural products research [J]. J Nat Prod, 2005, 68(12): 1813-1820.
[28] Dettmer K, Aronov PA, Hammock BD. Mass spectrometry–based metabolomics [J]. Mass Spectrom Rev, 2007, 26(1): 51-78.
[29] 林金鸳, 许劲松. 菊粉的功能与应用[J]. 四川食品与发酵, 1999(4): 57-59.
[30] Yoshikawa H, Tajiri Y, Sako Y, et al. Effects of free fatty acids on beta-cell functions: a possible involvement of peroxisome proliferator activated receptors alpha or pancreatic/duodenal homeobox [J]. Metabolism, 2001, 50(5): 613-618.
[31] Stanko RT, Adibi SA. Inhibition of lipid accumulation and enhancement of energy expediture by the addition of pyruvate and dihydroxyacetone to a rat diet [J]. Metabolism, 1986, 35(2): 182-186.
[32] Rahman MM, Park HM, Kim SJ, et al. Taurine prevent shypertension and increases exercise capacity in rats with fructose-induced hypertension [J]. Am J Hypertens, 2011, 24(5): 574-581.
[33] Gavachan CL, Holmes E, Len ZE, et al. An NMR-based metabonomic approach to investigate the biochemical consequences of genetic strain differences;application to the C57BL10J and Alpk:Apfcd mouse [J]. FEBS Lett, 2000, 484(3): 169.
[34] Rull A, Vinaixa M, Angel Rodriguez M, et al. Metabolic phenotyping of genetically modified mice: An NMR metabonomic approach [J]. Biochimie, 2009, 91(8): 1053-1057.
[35] Thiess S, Becskei C, Tomsa K, et al. Effects of a high carbohydrate and high fat diet on plasma metabolite levels and on iv glucose tolerance test in intact and neutered male cats [J]. J Feline Med Surg, 2004, 4(6): 207-218.
[36] Shimazu T, Hirschey MD, Newman J, et al. Suppression of oxidative stress by β-hydroxybutyrate, an endogenous histone deacetylase inhibitor [J]. Science, 2013, 339(11): 211-214.
[37] Jiang L, Huang J, Wang Y, et al. Metabonomic Analysis Reveals the CCl4-Induced Systems Alterations for Multiple Rat Organs [J]. J Proteome Res, 2012, 11(7): 3848-3859.
Metabolomic Analysis of Rat Urine after Intragastric Infusion of Pu-erh Theabrownins
LIU Jian1, PENG Chunxiu2, SHENG Jun1, GAO Bin1, GONG Jiashun1*
1. Faculty of Food Science and Technology, Yunnan Agricultural University, Kunming 650201, China; 2. Horticultural Department, Yunnan Agricultural University, Kunming 650201, China
The study was aimed to understand the effects of Pu-erh theabrownin (TB) (Mw>50 kDa) on the metabolism of rat urine by nuclear magnetic resonance (NMR)-based metabolomics. Rats were divided into four groups including rats receiving a basic diet alone (control group), a basic diet and intragastric infusion of Pu-erh TBs (TB infusion group), a high-lipid diet alone (high lipid group) and high-lipid diet and intragastric infusion of Pu-erh TBs (high lipid-TB infusion group) for 14 d. Urine samples were analyzed by biochemical assays, NMR and orthogonal partial least-square-discriminant analysis (OPLS-DA) to identify differential metabolism among these groups. The results showed that considerable differences in metabolite profiles of rat urine were detected between control group and TB infusion group, and between high lipid group and high lipid-TB infusion group. Valine, citric acid, taurine, propionate, α-ketoglutaric acid and β-hydroxybutyrate were identified as metabolic markers of Pu-erh TB. Besides, Pu-erh TBwas likely to influence several metabolic pathways in rat, including amino acid metabolism, energy metabolism, tricarboxylic acid cycle, lipid metabolism and oxidativestress.
theabrownins, metabolomics, NMR
TS272.5+4;Q946.84+1
A
1000-369X(2016)05-491-09
2016-02-25
2016-05-30
国家自然科学基金资助项目(No. 31260195、30960241、30760152)
刘建,男,硕士,主要从事营养与食品安全研究,E-mail:sanliujian@126.com。
gong199@163.com

