一种毛尖茶叶多糖MTP06的提取分离及其活性测定
范海涛,刘庄,张照康,程湘懿,乔善义
一种毛尖茶叶多糖MTP06的提取分离及其活性测定
范海涛1,2,刘庄3,张照康4,程湘懿4,乔善义2*
1. 北京电子科技职业学院生物工程学院,北京 100176;2. 军事医学科学院毒物药物研究所,北京 100850;3. 北京联合大学校医院,北京 100101;4. 华中师范大学物理科学与技术学院生物物理研究所,湖北武汉 100191
本研究对一种毛尖茶叶多糖的结构与活性开展了研究。采用水提醇沉法提取毛尖茶叶粗多糖,经除蛋白后得到精制多糖(MP),以不同的柱层析方法对MP进行多次分离纯化,得到1个均一组分的毛尖茶叶多糖(Maojian Tea Polysaccharides No. 06,MTP06)。采用1,1–二苯基–2–三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical 2,2-diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl,DPPH)自由基清除、小鼠免疫细胞RAW264.7增殖、吞噬能力和产生NO等试验方法对MTP06的活性进行研究。结果显示MTP06对0.1 mmol·L-1DPPH溶液的自由基清除率为30.85%,对小鼠巨噬细胞RAW264.7的增殖、吞噬能力和产生NO的能力均有促进作用,与空白对照组间有显著差异(<0.01),且质量浓度为500 mg·L-1时,活性最大。
毛尖茶叶;多糖;活性;免疫细胞
我国茶叶资源丰富,饮用历史悠久,茶叶中多种有效成分具有降血糖、降血脂、抗氧化、清除自由基、提高免疫力和抗肿瘤等活性[1-2]。多糖(Polysaccharides)是由单糖连接形成的大分子物质。据文献报道,诸多植物来源的多糖具有抗氧化、清除自由基和免疫活性,是部分天然食品提高免疫力、发挥保健功能的物质基础之一[3-4]。茶叶中也含有多糖类成分,并且针对茶多糖的抗氧化、清除自由基等活性的研究多有报道。Wang Y等[5-6]阐明了茶叶多糖抗氧化及作用于人体细胞的药理活性,为研究和理解茶叶多糖的药理活性提供了依据。毛尖茶叶作为公认的茶叶重要品种,目前研究内容主要集中在多糖的提取工艺、含量测定、抗氧化活性等方面[7-8],对毛尖茶叶多糖的免疫活性研究至今未见报道。本研究通过提取和分离纯化,从毛尖茶叶中得到1个均一组分MTP06,并对其进行特征分析和免疫活性测定,为毛尖茶叶的开发利用提供依据。
1材料与方法
1.1 仪器
CARY 50全波长紫外扫描仪(美国Varian公司),WZZ-2S自动旋光仪(上海精密科学仪器有限公司),Agilent 7890A-5975C气相色谱-质谱联用仪、DB-5色谱柱(30 m×0.25 mm,0.25 μm)、质谱检测器、AgilentAgilent1200高效液相色谱仪,G1352A RID检测器(美国Agilent科技有限公司),TSK®G5000PWXL凝胶色谱柱(300 mm×7.8 mm)、LABORATA 4000旋转蒸发仪(德国Heidolph公司),AR224CN电子天平(美国Ohaus公司),TD5A-WS高速离心机(上海安亭科学仪器厂),ZRQ30冷冻干燥机(天津因赛科技发展有限公司),WF2 UV-2100紫外可见分光光度计(尤尼柯(上海)仪器有限公司)。
1.2 材料与试剂
毛尖茶叶,购于吴裕泰北京北苑店(产地:河南信阳)。留样标本存于北京联合大学校医院实验室标本保存室(编号20150822–1)。RAW264.7巨噬细胞由北京大学医学部惠赠。
DMEM培养基(中科迈晨(北京)科技有限公司)、胎牛血清(德国PAN优级,北京华美兰博生物科技有限公司)、一氧化氮(NO)测定试剂盒(硝酸还原酶法)(南京建成生物工程研究所)、1,1–二苯基–2–三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical 2,2- Diphenyl-1-(2,4,6-trinitrophenyl) hydrazyl, DPPH, 美国Sigma-Aldrich公司)。多糖分子量测定用系列标准品(分子量分别为12 000、25 000、50 000、80 000、270 000、410 000、670 000 Da,美国Sigma-Aldrich公司)。透析袋(截留分子量2 000 Da,美国MYM生物科技有限公司)。葡萄糖、木糖、半乳糖、阿拉伯糖、甘露糖、氯化钠、三氯甲烷、正丁醇和无水乙醇等试剂均为分析纯。
1.3 实验方法
1.3.1 毛尖茶叶多糖的提取
称取1 250 g毛尖茶叶,以无水乙醇回流提取2次,残渣按照文献[8]中多糖的提取方法提取粗多糖,并以Sevag法除蛋白直至全波长紫外扫描280 nm处无明显吸收峰,再以无水乙醇、丙酮反复洗涤得到毛尖茶叶精制多糖。
1.3.2 毛尖茶叶多糖的分离纯化
称取毛尖茶叶精制多糖8.72 g,用蒸馏水溶解,以DEAE DE-52离子交换色谱柱分离,分别采用蒸馏水及0.2、0.4、0.6 mol·L-1NaCl溶液洗脱,每个部位收集约5.0 L。将用0.2 mol·L-1NaCl洗脱的部分浓缩后置于透析袋中,进行透析,之后以Sepharose CL-6B琼脂糖凝胶柱进行分离纯化,以水为流动相进行洗脱,洗脱速度为1 mL·min-1,以收集器收集洗脱部分,每管收集洗脱液约3 mL,将各管洗脱液以高效液相色谱法检测,合并相同峰的洗脱液,最终得到1个单一对称峰的毛尖茶叶多糖组分,该组分命名为MTP06(Maojian Tea Polysaccharides No. 06)。
1.3.3 旋光度测定
精密称定MTP06 10.0 mg置25 mL容量瓶中,用水溶解,配制成质量浓度为0.4 g·L-1的多糖溶液。取20 mL上述溶液置于旋光管中,以水为空白,用自动旋光仪测量MTP06旋光度。
1.3.4 分子量分布的测定
以HPLC法对系列多糖标准溶液和MTP06溶液进行测定。色谱柱为TSK®G5000PWXL(300 mm×7.8 mm)凝胶色谱柱;柱温40℃;流动相为0.002 mol·L-1磷酸二氢钠(含0.05% NaN3);流速为0.8 mL·min-1;RI检测器检测。
分别称取适量的分子量为12 000、25 000、50 000、80 000、270 000、410 000、670 000 Da的Dextran标准品,加入去离子水,配成质量浓度约2 g·L-1的对照溶液,并以0.45 μm水系滤膜过滤,进行HPLC检测,以保留时间(RT)为横坐标,分子量的常用对数(以10为底数的对数)值为纵坐标,得标准曲线=-0.332+10.224(=0.9980)。
称取一定量的MTP06,加入去离子水,配成质量浓度约2 g·L-1的样品溶液,按上述方法进行检测,由MTP06保留时间依上述标准曲线公式进行计算。
1.3.5 单糖组成的测定
按照文献[9]所述方法对MTP06进行全水解还原乙酰基衍生化,以标准单糖为参照,对MTP06进行单糖组成的测定。
气相条件为采用DB-5(30 m×0.25 mm× 0.25 μm)色谱柱;检测器为质谱检测器;进样口温度250℃;检测器温度280℃;氮气流速0.6 mL·min-1;分流比20∶1;进样量5 μL;升温程序为200℃保持2 min,以3℃·min-1的速率升至245℃,再以10℃·min-1的速率升至270℃,保持2 min。
1.3.6 MTP06清除自由基活性测定
按照文献[10]所述方法对MTP06进行清除自由基活性测定,重复6次,以样品对DPPH自由基的清除率作为评价指标。
1.3.7 MTP06对小鼠巨噬细胞增殖的影响
按照文献[11]所述方法,以96孔板测定MTP06对RAW 264.7小鼠巨噬细胞增殖能力的影响。设1个空白对照组和6个给药组,给药组细胞分别给予终质量浓度为30、90、150、300、500、800 mg·L-1的多糖溶液。细胞给药后在5% CO2、37℃培养箱中培养24 h,然后吸去培养液,每孔加入20 μL MTT,上述条件下继续培养4 h,弃上清,每孔加入150 μL DMSO,振荡器上震荡10 min,酶标仪570 nm波长检测吸光值,以空白对照组的吸光值为100%,通过各给药组与对照组的吸光度比值计算细胞相对增殖率。
1.3.8 MTP06对小鼠巨噬细胞吞噬能力的影响
按照文献[12]所述方法,以中性红作为目标异物,以96孔板测定MTP06对RAW264.7小鼠巨噬细胞吞噬能力的影响,分组及给药情况同1.3.7。细胞给药后在5% CO2、37℃培养箱中培养24 h后,每孔加720 mg·L-1的中性红溶液100 μL,将细胞在5% CO2、37℃培养箱中继续培养24 h后,吸去培养液,每孔加入50 μL冰醋酸及50 μL乙醇,置于4℃冰箱中2 h。从冰箱中取出96孔板,置于振荡器上震荡10 min,酶标仪495 nm波长检测吸光值,以空白对照组的吸光值为100%,以各给药组与对照组的吸光度比值计算细胞相对增殖率。
1.3.9 MTP06对小鼠巨噬细胞产生NO的影响
采用硝酸还原酶法测定细胞培养上清液中NO2-间接反应生成NO的量,分组及给药情况同1.3.7,增加1个细菌脂多糖(LPS)阳性对照组,给予终质量浓度为10 mg·L-1的LPS。将细胞给药后在5% CO2、37℃培养箱中培养24 h后,按照NO检测试剂盒说明书进行操作,于酶标仪495 nm波长检测吸光值,以吸光值反映细胞产生NO的能力。
1.4 数据统计分析方法
以正版Graphpad prism 5软件对数据进行处理和作图,以双侧检验对实验结果进行统计分析,以<0.01或<0.05为有统计学差异的检验标准。
2结果与分析
2.1 MTP06的特征分析结果
经计算,MTP06旋光度为[ɑ]20D=+39.0°。HPLC色谱图见图1,经标准曲线计算,其重均分子量(Molecular Weight,Mw)为2.2×105Da。测得MTP06由阿拉伯糖、木糖、葡萄糖和半乳糖组成,摩尔比为2.03∶1∶7.81∶1.18。
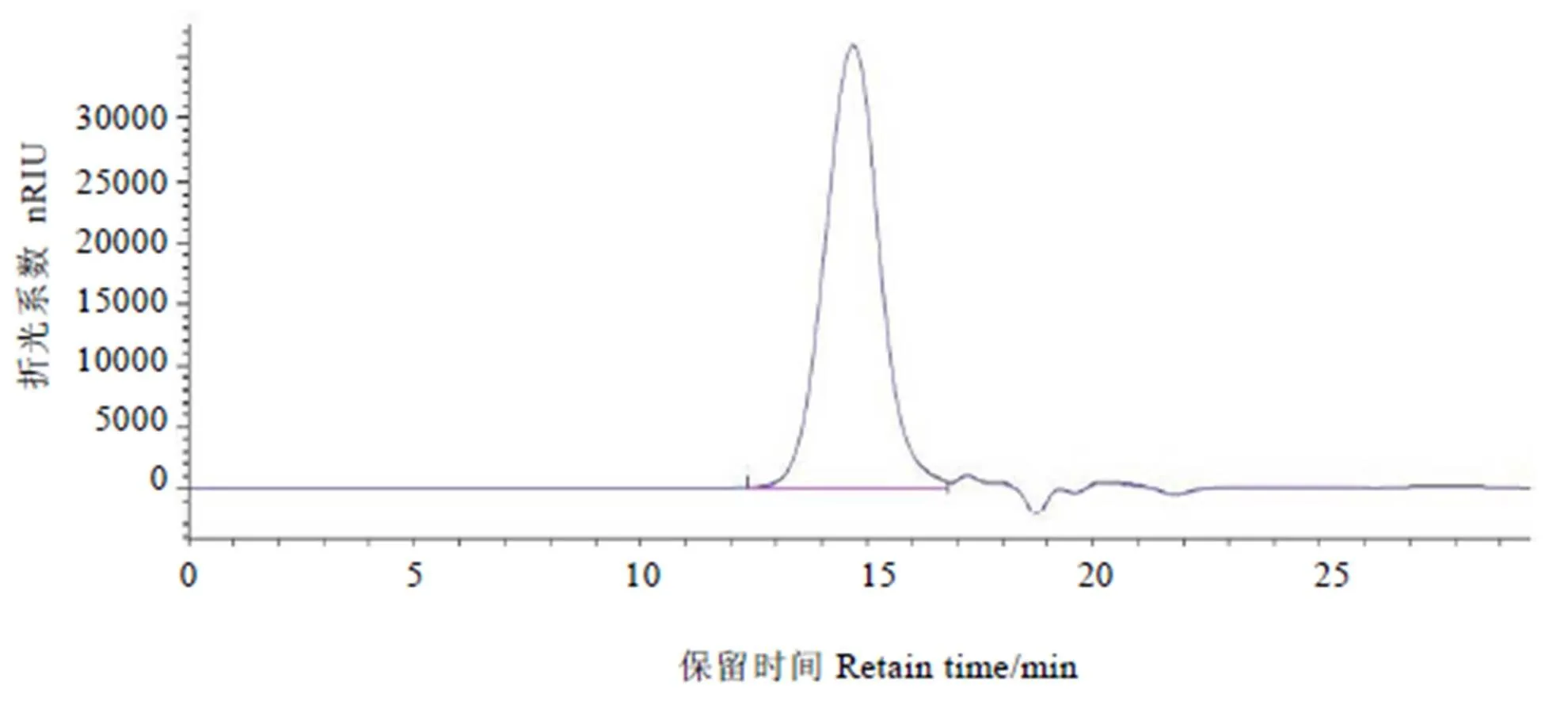
图1 MTP06的高效液相色谱图
2.2 MTP06清除自由基活性测定结果
MTP06对浓度0.1 mmol·L-1的DPPH溶液的自由基清除率为30.85%(RSD=4.91%)。
2.3 MTP06对小鼠巨噬细胞增殖的影响
不同浓度的MTP06对小鼠巨噬细胞增殖的影响见图2。从图中可知,不同浓度的MTP06溶液对细胞的增殖作用影响不同,在30~500 mg·L-1的范围内,多糖给药组与空白对照组有显著性差异,随着浓度的增大,对细胞的增殖促进作用逐渐增强,并在质量浓度为500 mg·L-1时达到最大值。
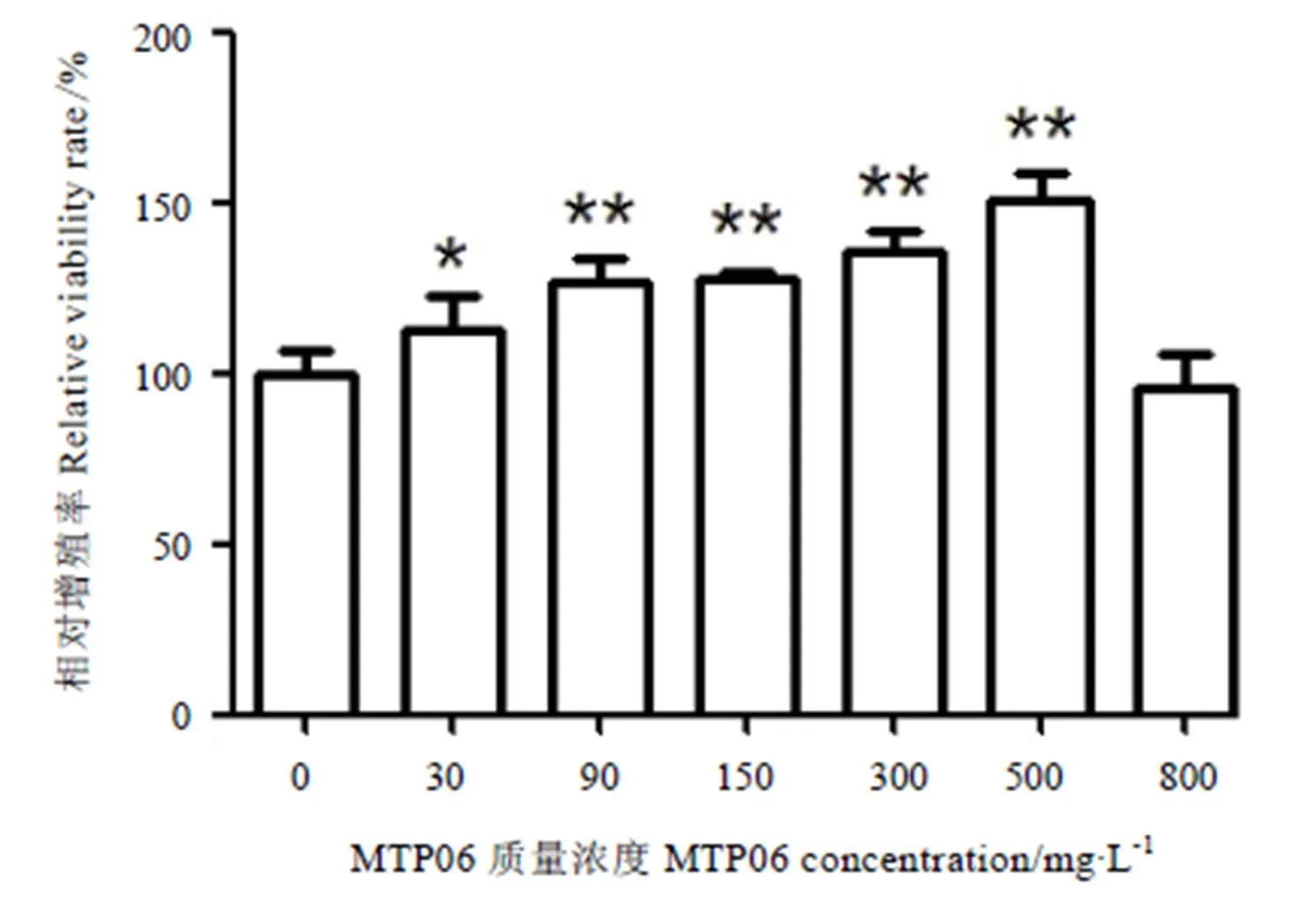
注:与空白对照组比较,*:P<0.05;**P<0.01。Note: Compare with control, *:P<0.05, ** P<0.01.
2.4 MTP06对小鼠巨噬细胞吞噬能力的影响
不同浓度的MTP06对小鼠巨噬细胞吞噬能力的影响见图3。从图中可知,不同浓度的MTP06溶液对细胞吞噬能力的影响不同,在30~500 mg·L-1的范围内,多糖给药组与空白对照组有显著性差异,且随着MTP06浓度的增大,细胞的吞噬能力逐渐增强,并在质量浓度为500 mg·L-1时细胞的吞噬能力达到最大值。
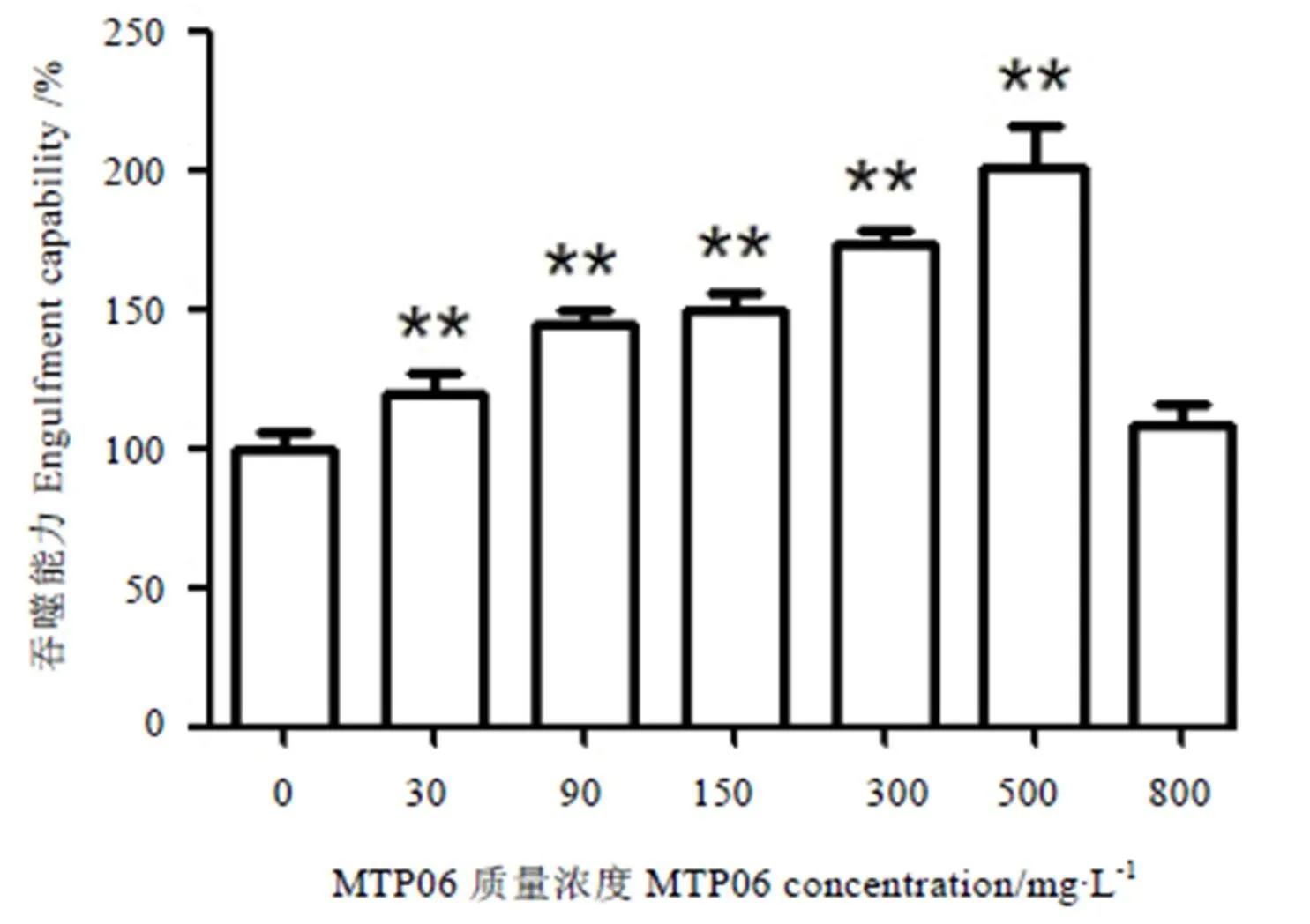
注:与空白对照组比较,**:P<0.01。Note: Compare with control, **: P<0.01.
2.5 MTP06对小鼠巨噬细胞产生NO的影响
不同质量浓度给药条件下NO的产生量结果见图4。从图中可知,不同浓度的MTP06溶液对细胞产生NO的影响不同,在300~800 mg·L-1的范围内,MTP06处理细胞产生NO的量与阳性对照LPS组相当,且与空白对照组间均有显著差异,并且当MTP06质量浓度为500 mg·L-1时,细胞产生NO的量达到最大。
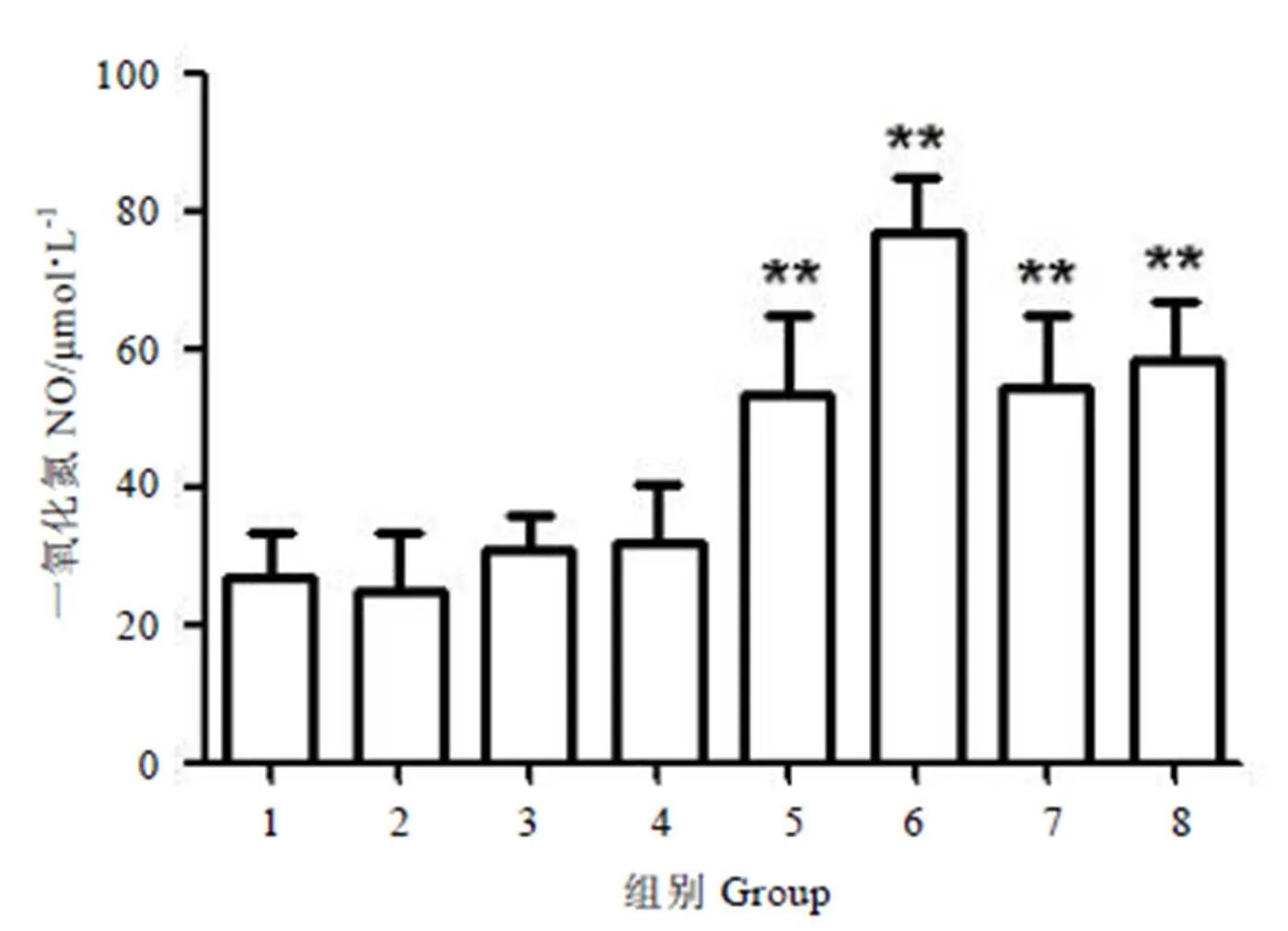
注:与空白对照组比较,**:P<0.01。1-MTP06 0 mg·L-1,2- MTP06 30 mg·L-1,3- MTP06 90 mg·L-1,4- MTP06 150 mg·L-1,5- MTP06 300 mg·L-1,6- MTP06 500 mg·L-1,7- MTP06 800 mg·L-1,8-LPS。
3讨论
本研究首次从毛尖茶叶中分离纯化得到1个均一分子量的多糖成分MTP06,并进行了单糖组成与分子量分布的分析,对该多糖成分进行了表征。以不同药理活性检测方法,研究了MTP06的药理活性,为该多糖及其他毛尖茶叶多糖的开发利用提供了实验依据。
药理实验结果表明,MTP06具有一定的清除DPPH自由基的能力,可能是毛尖茶叶作为茶饮品产生保健功效的活性来源之一,该结果与其他研究者的研究结果趋于一致[8],进一步肯定了毛尖茶叶多糖成分的清除自由基活性。
在以RAW264.7细胞为体外药理模型的活性测试中,考察了不同质量浓度MTP06对小鼠巨噬细胞不同生理指标的影响,在30~ 500 mg·L-1范围内,随着给药质量浓度的增加,MTP06促进小鼠巨噬细胞的增殖能力,细胞吞噬和产生NO的能力增强,显示了毛尖茶叶多糖产生的免疫促进作用,为该多糖的进一步深入研究提供了实验参考。当MTP06质量浓度过高时,相应以上指标反而出现下降,推测与大剂量MTP06作用于细胞,干扰了细胞代谢或产生了细胞毒作用有关。该实验结果为客观认识毛尖茶叶及其多糖成分,以及进一步开发利用毛尖茶叶提供了参考。
参考文献
[1] Baruch Narotzki, Abraham Z Reznick, Dror Aizenbud, et al. Green tea:a promising natural product in oral health [J]. Arch Oral Biol, 2012, 57(5): 429-435.
[2] 全吉淑, 尹学哲, 金泽武道. 茶多糖抗氧化作用的研究[J]. 中药材, 2007, 30(9): 1116-1118.
[3] Mateos Aparicio, C Mateos Peinado, A Jiménez Escrig, et al. Multifunctional antioxidant activity of polysaccharide fractions from the soybean byproduct okara [J]. Carbohydrate Polymers, 2010, 82(2): 245-250.
[4] 赵津, 常军民, 郑杰, 等. 刺糖多糖免疫活性的初步研究[J]. 西北药学杂志, 2016, 31(2): 158-161.
[5] Wang Y, Yang Z, Wei X. Antioxidant activities potential of tea polysaccharide fractions obtained byultra filtration [J]. Int J Biol Macromol, 2012, 50(3): 558-564.
[6] Chen X, Wang Y, Wu Y, et al. Green tea polysaccharide-conjugates protect human umbilical vein endothelialcells against impairments triggered by high glucose [J]. Int J BiolMacromol, 2011, 49(1): 50-54.
[7] 陈仕学, 田艺, 卢忠英, 等. 响应面法优化都匀毛尖茶多糖的提取及抗氧化性研究[J]. 食品工业, 2015, 36(9): 83-88.
[8] 曲伟, 王孟君, 于海燕, 等. 毛尖茶叶多糖及其结合物的抗氧化活性研究[J]. 天然产物研究与开发, 2015, 27(2): 210-213.
[9] 白娣斯, 张静. 气相色谱分析多糖衍生化方法的研究与比较[J]. 食品工业科技, 2011, 32(2): 322-324.
[10] 吴玉娟, 王懿萍, 姜延伟, 等. 黄连多糖含量测定及抗氧化活性研究[J]. 时珍国医国药, 2008, 19(8): 1906-1908.
[11] 蔡海兰, 黄晓君, 聂少平, 等. 铁皮石斛多糖对RAW264.7细胞分泌TNF-α的影响[J]. 中国药理学通报, 2012, 28(11): 1553-1556.
[12] 武俊华, 罗成. Viili多糖对巨噬细胞RAW264.7激活及分泌细胞因子的影响[J]. 现代免疫学, 2013, 33(2): 113-118.
Purification and Activity Determinationof Polysaccharides MTP06 from Maojian Tea
FAN Haitao1,2,LIU Zhuang3,ZHANG Zhaokang4,CHENG Xiangyi4,QIAO Shanyi2*
1. College of Bioengineering, Beijing Polytechnic, Beijing 100176, China; 2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences , Beijing 100850, China; 3. Hospital of Beijing Union University, Beijing 100101, China;4.Department of Physics and Institute of Biophysics, Central China Normal University, Wuhan 100191, China
To investigate the structure and activity of polysaccharides (MTP06), the polysaccharides were extracted and purified from Maojian tea. The refined Maojian tea polysaccharides (MP) were obtained after removing proteins. Different column chromatography methods were used for several times to purify the MP and an uniform polysaccharide named MTP06 was obtained. The effects of MTP06 on DPPH radical-scavenging activity, cell viability, engulfment capability and NO production of RAW264.7 macrophages were investigated . The results showed that the free radical scavenging rate of MTP06 to 0.1 mmol·L-1DPPH solution was 30.85%.The highest viability, engulfment capability and NO production of RAW264.7 macrophages had been stimulated by MTP06 at 500 mg·L-1. The present results confirmed MTP06 can eliminate DPPH radicals and stimulate cell viabilities.
Maojian tea, polysaccharides, activity, macrophages
TS272;Q539
A
1000-369X(2016)05-531-06
2016-02-15
2016-05-30
北京电子科技职业学院重点课题项目资助、国家“重大新药创制”科技重大专项(2013ZX09508-105)资助。
范海涛,男,讲师,主要从事天然来源多糖的分离、结构鉴定与活性的研究。
crbj611202@sina.com

