基于转录组测序对茶树GST基因表达的研究
张亚真,韦康,王丽鸳,成浩
基于转录组测序对茶树基因表达的研究
张亚真,韦康*,王丽鸳,成浩
中国农业科学院茶叶研究所国家茶树改良中心农业部茶树生物学与资源利用重点实验室,浙江杭州 310008
谷胱甘肽转移酶(Glutathione-transferases,)在植物体内普遍存在,是一类具有多种生物学功能的超家族蛋白酶。本研究通过对中黄2号、龙井43在正常光照和遮荫处理下的转录组测序,筛选获得了49个基因家族成员,并对其中19个在芽叶中表达量较高的基因进行了序列分析和聚类分析。另外对表达量较高的8个候选基因进行荧光定量表达分析,研究它们在龙井43不同叶位中的表达模式。结果表明这些基因在一芽一叶到第六叶中均有表达,但各自呈现出不同的变化规律。在龙井43一芽一叶到第六叶中的表达量逐渐上升,可能与植物抗胁迫有关,而的表达量则显著下降,可能与花青素代谢有关。
茶树;转录组测序;谷胱甘肽转移酶;表达分析
谷胱甘肽转移酶()是一类由多基因编码、具有多种功能的超家族蛋白酶,普遍存在于动物、植物及微生物中。根据基因结构及蛋白同源性可分为8类,即phi(F型)、tau(U型)、zeta(Z型)、theta(T型)、lambda(L型)、脱氢抗坏血酸还原酶(Dehydroascorbate reductase, DHAR)、四氯代氢醌脱卤素酶(Tetrachlorohy droquione dehalogenase, TCHQD)和微粒体GST(Membrane-associated proteins in eicosanoid and glutathione metabolism, MAPEG),除微粒体GST外,其他7类均为可溶性GST,且GSTF和GSTU一般只存在于植物体内,含量较高,种类也最为丰富[1]。自20世纪70年代在玉米中首次发现GST以来[2],许多植物中的GST也都相继被发掘。目前,基因已在17种植物中得到克隆和研究[3],如拟南芥中有54个基因,水稻59个,玉米42个,大豆26个[4]。
虽然家族数量众多,序列差异较大,但具有相似的三维结构,一般是由两个亚基组成的同源或异源二聚体,且每个亚基都具有两个基本的功能域:位于N端的谷胱甘肽结合位点(G-site)和位于C端的疏水性底物作用位点(H-site)[4]。不同种类基因的差异主要体现在G位点功能和H位点结合底物的不同,由此决定了基因具有解毒、调节植物次级代谢[5]和参与植物生长发育、细胞信号转导及细胞凋亡等多种功能[6-9]。
茶树作为我国重要的经济作物,在生长发育的不同阶段,往往会受到多种生物或非生物胁迫,如病原菌侵害、干旱、高温等,由此造成茶叶产量和品质的下降;另一方面,茶叶对人体具有多种营养价值和保健功效,而类黄酮物质是其首要的生物活性成分,占鲜叶干重的18%~36%[10]。近年来,已有大量研究表明,在多种植物体内与抗胁迫和类黄酮等次生代谢产物紧密相关,而茶树中有关基因家族只有少量研究,完整序列也仅有2条(登录号分别为FJ014478、KF612020),在茶树体内的相关功能研究则更为缺乏。因此,本研究在对不同处理下龙井43和中黄2号进行转录组测序的基础上,获得基因,再经过进一步筛选、生物信息学分析和不同组织部位的表达分析,以明确候选基因的时空表达规律,为以后开展基因克隆及功能的研究提供理论基础。
1 材料与方法
1.1 材料
以种植于中国农业科学院茶叶研究所的龙井43和中黄2号为转录组测序材料,一组经遮荫处理(20 m×20 m遮阳网覆盖,遮光率为80%±5%),另一组不遮荫(CK)。7 d后采一芽一叶,液氮速冻后于-80℃冰箱保存,用于转录组测序。
用于荧光定量PCR的材料为种植于中国农业科学院茶叶研究所的龙井43,选取生长势相对一致的正常植株,于2015年8月7日采摘一芽一叶、第二叶、第三叶、第四叶、第五叶、第六叶,液氮速冻后于-80℃冰箱保存。
1.2 CsGSTs的筛选及其差异表达分析
根据Wei等[11]的方法对4组样品(龙井43对照、龙井43遮荫、中黄2号对照、中黄2号遮荫)的测序结果进行分析,主要是将序列重新组装和进行功能注释,筛选得到基因。
1.3 CsGSTs序列分析及聚类分析
将得到的序列在NCBI网站上利用ORF Finder和BLASTX工具进行保守结构域分析;并与拟南芥基因家族成员进行BLASTX比对;然后根据RPKM (Reads Per kb Million reads) 最大值大于10进一步筛选,得到的序列,经修饰后用MEGA6进行多序列比对和聚类分析。
1.4 总RNA提取及cDNA合成
茶树叶片总RNA提取方法参照天根公司提供的多糖多酚植物总RNA提取试剂盒进行,然后以500 ng RNA为模板,根据天根Fast Quant RT Kit(with gDNase)提供的的方法反转录成cDNA,稀释至统一浓度(40 ng·μL-1),作为荧光定量模板。
1.5 CsGSTs基因荧光定量PCR分析
以龙井43一芽一叶、第二叶、第三叶、第四叶、第五叶、第六叶的cDNA为模板,选取RPKM值较高的基因进行荧光定量PCR分析。根据前期转录组测序获得的基因序列片段,使用NCBI在线Prime-blast软件设计荧光定量特异引物(表1)。采用相对定量的方法,以GAPDH为内参基因,分析基因的表达量。反应体系为SYBR Premix Ex Taq 10mL,ROX DyeⅡ 0.4mL,10mmol·L-1上、下游引物各0.8mL,cDNA 2mL,加水至终体积20mL,反应在ABI PRISM 7500实时定量PCR仪上进行。反应程序如下:95℃预变性30 s,95℃变性5 s,62℃退火延伸34 s,40个循环,反应结束后分析荧光值变化曲线和融解曲线。4次技术性重复,结果采用2-∆∆CT算法分析。

表1 实时荧光定量PCR引物
2 结果与分析
2.1 CsGSTs基因的筛选结果及表达情况
根据转录组测序结果筛选得到49个基因,按照基因序列号从小到大进行命名,并对其进行亚家族分类。4组转录组数据中,以RPKM最高值进行统计(表2),结果表明,49个基因可分为7个亚家族,其中近一半基因属于U型(25个:)其次是F型(10个:),T型(6个:),DHAR型(3个:),Z型(2个:),TCHQD型(2个:),MAPEG型最少(1个:)。按照基因表达水平进行分析,结果表明,12.24%的基因为超高表达水平(RPKM≥100),主要是U型和F型;26.53%的基因为高表达水平(10≤RPKM<100);42.86%的基因为中表达水平(1≤RPKM<10);18.37%的基因为低表达水平(0<RPKM<1),总体来说,基因在茶树芽叶中表达量较为丰富。

表2 不同亚家族CsGSTs基因的RPKM值分布
亚家族中基因的表达量差异较大(图1),大部分为中低表达水平。其中,以的RPKM值最高,在中黄2号对照组中甚至高达650,其次是、和。大部分基因在经过遮荫处理后,表达量均有一定程度的下降,如、和;、和的RPKM值在品种之间的差异明显大于处理之间的差异,如在不同品种对照组间的表达差异达到6倍以上。
CsGSTF亚家族的表达情况如图2所示。其中以的表达量最高,4组数据中RPKM的平均值在470左右。中黄2号品种,大部分基因的表达量经遮荫处理后略有上升;而龙井43多数基因的表达量在遮荫后则略有降低,尤其是,对照组与处理组的RPKM值相差3倍,说明茶树基因的表达具有一定的品种差异。
其他CsGSTs亚家族的表达情况如图3所示。大部分基因为中高表达水平,以MAPEG亚家族的表达量最高;GSTT亚家族中,的表达量最高,RPKM最大值约为50;DHAR亚家族中,最高,RPKM最大值接近100;而Z型和TCHQD型的RPKM值则相对较低;大部分基因在不同品种和处理之间的表达量变化较小,相对稳定。
2.2 CsGSTs的序列分析及聚类分析
进一步对RPKM最高值大于10且包含完整ORF阅读框的19个基因进行分析表明,(7个)和(5个)仍占主导地位(表3)。其中3个基因与AtGSTU19的序列相似度较高,说明这类基因可能在茶树芽叶中具有重要作用。
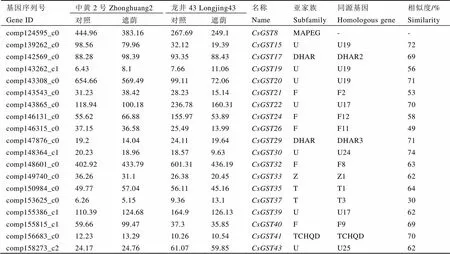
表3CsGSTs基因的RPKM值及BLASTX结果
基于氨基酸序列对这19个基因进行系统进化分析(图4),结果与BLASTX分类结果基本一致。和被聚在相距较远的两个分支中。除CsGSTT基因外,同属一个亚家族的基因都聚在一起,说明不同亚家族基因之间的序列差异较大。
2.3 CsGSTs基因的表达分析
选取RPKM值较高的8个基因(CsGST8、、、、、、和),分别测定它们在龙井43不同叶位的表达量(图5)。结果表明,这8个基因在一芽一叶到第六叶中均有表达,但表达量及其变化规律不同。除和外,其他基因在一芽一叶中的表达量均小于在其他叶位的表达量。其中,的表达量随叶片成熟度的增加明显下降,在第四叶中的表达量只有一芽一叶的1%,第六叶中仅检测到微量的表达。而的表达量变化规律则完全相反,随着叶子成熟度的增加,表达量逐渐上升,第六叶中的表达量为一芽一叶的15.86倍。其他基因的表达规律并不明显:除在第六叶中表达量略有下降外,总体有一定的上升趋势;CsGST8与的表达量变化相对稳定。、、的表达量变化规律相似,在第二叶或第四叶的表达量达到最高,整体呈波动变化。
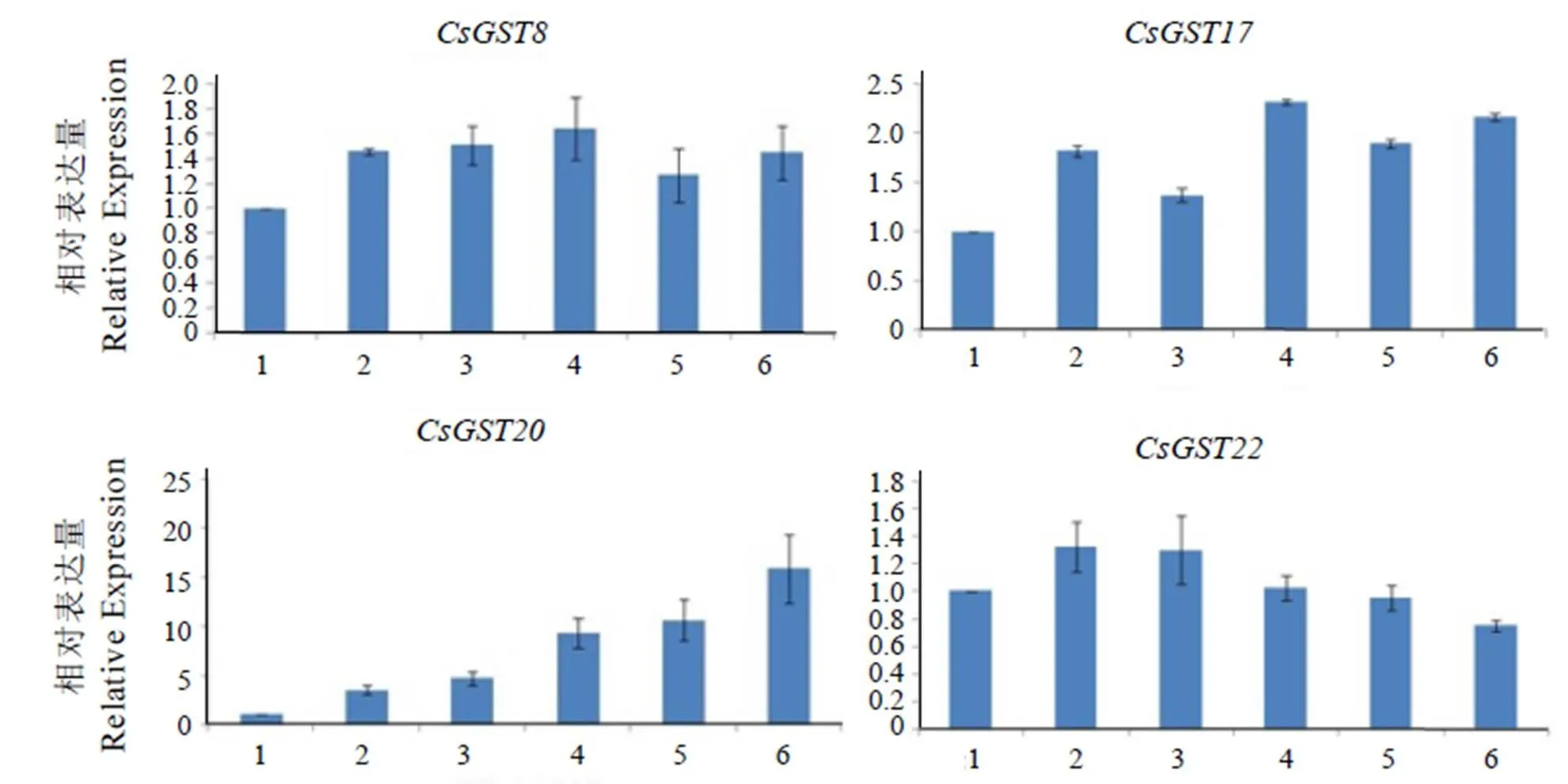
注:1代表一芽一叶;2代表第二叶;3代表第三叶;4代表第四叶;5代表第五叶;6代表第六叶。
Notes:1 represents a bud with a leaf, 2 represents the second leaf, 3 represents the third leaf, 4 represents the fourth leaf, 5 represents the fifth leaf, 6 represents the sixth leaf.
图5在龙井43不同叶位的表达量
Fig. 5 Relative expression ofin different leaf positions of Longjing43
3 小结与讨论
本研究主要通过转录组测序、生物信息学分析和实时荧光定量PCR等试验对茶树中基因进行了筛选和分析。前期转录组测序筛选获得了49个差异表达的基因,它们的表达量变化范围较大(表2),同一基因在不同品种和处理之间的RPKM值也不尽相同(图1~图3)。大部分基因在经遮荫处理后的表达量有一定程度下降(图1);而基因在不同品种中对遮荫有不同的响应:中黄2号大多数基因的表达量在遮荫后略有上升,而龙井43中基因的表达量在遮荫后普遍降低(图2);其他亚家族成员在不同品种和处理之间的表达量则相对稳定(图3)。
部分基因的表达具有明显的品种差异,尤其是,它在两个品种之间的RPKM值相差6倍以上(图1);qRT-PCR结果表明,基因的表达随叶子成熟度的增加而显著上升,一芽一叶与第六叶中的表达量甚至相差16倍。与拟南芥()的相似度达71%,研究表明,与植物抗胁迫能力紧密相关,如抗旱和抗盐胁迫[12-14]。一方面,可能作为抗氧化酶直接与活性氧(Reactive Oxygen Species, ROS)反应,减少细胞损伤[15],提高植物抗性;另一方面,还可能作为胁迫调控因子,当植物受到胁迫时可激活胁迫响应途径,使相应的抗氧化酶活性提高,间接参与植物抗胁迫反应[14]。可能与的功能相似,通过减少ROS在植物体内的积累,直接或间接参与植物抗逆反应。
而则对遮荫处理较为敏感,与龙井43对照组相比,遮荫组的RPKM值明显下降(图2)。qRT-PCR结果表明,基因的表达量随叶子成熟度的增加而急剧下降,在第六叶中仅有微量表达。与拟南芥中的相似度最高,诸多研究表明,作为转运蛋白,可将花青素和原花青素从合成部位(主要是细胞质)运至液泡并累积[16-18],这样不仅能减少产物对反应的抑制作用,促进花青素和原花青素的合成,还可以减少类黄酮等次级代谢产物对细胞的毒害作用[19]。Hu等[20]发现荔枝()中(F型)也与花青素累积相关。茶树体内的多酚类主要集中分布在新梢生长旺盛的部分,也随着叶子成熟度的增加而逐渐减少[21-23],这与的表达量变化规律也相对一致。此外,Wang等人的研究表明中黄2号中类黄酮如花青素和儿茶素的含量显著低于龙井43[24],且经遮荫处理后,会促进茶树氮代谢,碳代谢相应减弱,导致类黄酮途径中多酚类含量降低[21],这与转录组测序中的RPKM值变化规律也相对一致。因此与功能相似,也可能作为转运蛋白参与类黄酮物质从细胞质到液泡中的转运和累积,从而影响茶树体内花青素等类黄酮物质的代谢。
是仅有的MAPEG型的GST,表达量相对稳定。目前,植物中的MAPEG蛋白大部分都具有谷胱甘肽转移酶的活性[25],但难溶于水,与其他几类可溶性GST蛋白相比,它在大部分植物中的酶活性相对较低[26]。因此,Basantani等[3]认为在正常生长环境条件下,此类基因可能无明显功能,但经一定条件诱导后可发挥重要作用;的表达量变化也较小,与拟南芥AtGSTU17的序列相似度较高。AtGSTU17可通过影响谷胱甘肽库的平衡来参与调节光信号传导和植物生长发育等过程[27];Chen等[28]还发现在干旱和盐胁迫中,AtGSTU17还可作为负调节因子,低表达量或基因缺失有利于提高植物抗性。与拟南芥中AtGSTF8的相似度最高。研究表明,在多种生物和非生物胁迫条件下,包括H2O2[29]、水杨酸[30]、生长素、除草剂和微生物侵染[31]等,AtGSTF8均可被诱导表达,还可作为早期氧化胁迫反应信号[32],参与植物抗氧化胁迫反应。而、、虽然分别属于DHAR型、Z型、T型,但表达规律相似,在第二叶和第四叶的表达量较高。植物中的DHAR型GST具有巯基转移酶活性,可作为氧化还原酶参与抗坏血酸循环[33],水稻[34]和蝴蝶兰[35]中的DHAR还与植物抗高温胁迫有关;Z型GST主要是作为马来酰乙酰乙酸异构酶,参与植物体内酪氨酸代谢[36-37],此外,水稻中还可被茉莉酸诱导,可能参与抗胁迫反应[38];T型具有谷胱甘肽过氧化物酶活性,在植物抗氧化胁迫反应中,可减少有机过氧化物的生成,减少细胞损伤[39]。
由于是由众多基因组成的庞大而复杂的家族,其编码产物也具有多种功能。虽然家族成员之间存在着功能冗余的现象,但每一个基因在不同物种中可能都具有一定的特异性和特定的表达模式[40]。结合以上转录组测序和实时荧光定量PCR的结果,推测茶树中的成员亦是如此:在不同茶树品种、组织部位或不同处理下,即使同属一个亚家族,不同基因之间的表达模式和功能也可能不尽相同。因此在茶树中是否具有转运花青素或抗胁迫等类似功能,仍需进一步研究。
参考文献
[1] Mohsenzadeh S, Esmaeili M, Moosavi F, et al. Plant glutathione-transferase classification, structure and evolution [J]. African Journal of Biotechnology, 2011, 10(42): 8160-8165.
[2] Shimabukuro RH, Swanson HR, Walsh WC. Glutathione conjugation: atrazine detoxification mechanism in corn [J]. Plant Physiology, 1970, 46(1): 103-107.
[3] 马立功, 孟庆林, 张匀华, 等. 向日葵谷胱甘肽-S-转移酶基因的克隆及抗病功能研究[J]. 中国油料作物学报, 2015, 37(5): 635-643.
[4] Basantani M, Srivastava A. Plant glutathione transferases—a decade falls short [J]. Canadian Journal of Botany, 2007, 85(5): 443-456.
[5] Dixon DP, Skipsey M, Edwards R. Roles for glutathione transferases in plant secondary metabolism [J]. Phytochemistry, 2010, 71(71): 338-350.
[6] Bilang J, Sturm A. Cloning and characterization of a glutathione-transferase that can be photolabeled with 5-Azido-indole-3-acetic acid [J]. Plant Physiology, 1995, 109(1): 253-260.
[7] Dixon DP, Lapthorn A, Madesis P, et al. Bingding and glutathione conjugation of porphyrinogens by plant glutathione transferases [J]. The Journal of Biological Chemistry, 2008, 283(29): 20268-20276.
[8] Loyall L, Uchida K, Braun S, et al. Glutathione and a UV light-induced glutathione-transferases are involved in signaling to chalcone synthase in cell cultures [J]. Plant Cell, 2000, 12(10): 1939-1950.
[9] Kampranis SC, Damianova R, Atallah M, et al. A novel plant glutathione-transferase/peroxidase suppresses bax lethality in yeast [J]. The Journal of Biological Chemistry, 2000, 275(38): 29207-29216.
[10] 夏涛, 高丽萍. 类黄酮及茶儿茶素生物合成途径及其调控研究进展[J]. 中国农业科学, 2009, 42(8): 2899-2908.
[11] Wei K, Wang LY, Wu LY, et al. Transcriptome analysis of indole-3-butyric acid-induced adventitious root formation in nodal cuttings of(L.) [J]. PLoS ONE, 2014, 9(9): e107201.
[12] Bianchi MW, Roux C, Vartanian N. Drought regulation of GST8, encoding the Arabidopsis homologue of ParC/Nt107 glutathione tranferase/peroxidase [J]. Physiologia plantarum, 2002, 116(1): 96-105.
[13] Wagner U, Edwards R, Dixon DP, et al. Probing the diversity of the Arabidopsis glutathione-transferase gene family [J]. Plant Molecular Biology, 2002, 49(5): 515-532.
[14] Xu J, Tian YS, Xing XJ, et al. Over-expression ofprovides tolerance to salt, drought and methy viologen stresses in Arabidopsis [J]. Physiologia Plantarum, 2015, 156(2): 164-175.
[15] Jiang Y, Yang B, Harris NS, et al. Comparative proteomic analysis of Arabidopsis roots [J]. Journal of Experimental Botany, 2007, 58(13): 3591-3607.
[16] Kitamura S, Shikazono N, Tanaka A. Transparent testa 19 is involved in the accumulation of both anthocyanins and proanthocyanidins in Arabidopsis [J]. The Plant Journal, 2004, 37(1): 104-114.
[17] Sun Y, Li H, Huang JR. Arabidopsis TT19 function as a carrier to transport anthocyanin from the cytosol to tonoplasts [J]. Molecular Plant, 2012, 5(2): 387-400.
[18] Li X, Gao P, Cui DJ, et al. The Arabidopsis tt19-4 mutant differentially accumulates proanthocyanidin and anthocyanin through a 3′amino acid substitution in glutathione-transferase [J]. Plant Cell and Environment, 2010, 34(3): 374-388.
[19] Zhao J. Flavonoid transport mechanisms: how to go, and with whom [J]. Trends in Plant Science, 2015, 20(9): 576-585.
[20] Hu B, Zhao J, Lai B, et al.is an anthocyanin-related glutathione-transferase gene in Litchi chinensis Sonn [J]. Plant Cell Rep, 2016. DOI: 10.1007/s00299-015-1924-4.
[21] 宛晓春. 茶叶生物化学[M]. 北京: 中国农业出版社, 2003: 132-140.
[22] 张琳, 何晓叶, 李建科. 紫阳富硒地区茶叶中茶多酚及硒含量不同季节与叶片分布规律[J]. 农产品加工, 2014, 10: 13-15.
[23] 游见明, 曹新志. 福林酚法测定茶树中茶多酚的分布水平[J]. 湖北农业科学, 2013, 52(10): 2417-2419.
[24] Wang L, Yue C, Cao HL, et al. Biochemical and transcriptome analysis of a novel chlorophyll-deficient chlorina tea plant cultivar [J]. BMC Plant Biology, 2014, 14(1): 1-13.
[25] Bresell A, Weinander R, Lunsqvist G, et al. Bioinformatic and enzymatic characterization of the MAPEG superfamily [J]. FEBS Journal, 2005, 272(7): 1688-1703.
[26] Pflugmacher S, Schroder P, Sandermann H Jr. Taxonomic distribution of plant glutathione-transferases acting on xenobiotics [J]. Phytochemistry, 2000, 54(3): 267-273.
[27] Jiang HW, Liu MJ, Chen IC, et al. A glutathione-transferase regulated by light and hormones participates in the modulation of Arabidopsis seedling development [J]. Plant Physiology, 2010, 154(4): 1646-1658.
[28] Chen JH, Jiang HW, Hsieh EJ, et al. Drought and salt stress tolerance of an Arabidopsis glutathione-transferase U17 knockout mutant are attributed to the combined effect of glutathione and abscisic acid [J]. Plant Physiology, 2012, 158(1): 340-351.
[29] Chen WQ, Chao G, Singh KB. The promoter of a H2O2-inducible, Arabidopsis glutathione-transferase gene contains closely linked OBF- and OBP1-binding sites [J]. The Plant Journal, 1996, 10(6): 955-966.
[30] Chen W, Singh KB. The auxin, hydrogen peroxide and salicylic acid induced expression of the Arabidopsis GST6 promoter is mediated in part by an ocs element [J]. The Plant Journal, 1999, 19(6): 667-677.
[31] Kovtun Y, Chiu WL, Tena G, et al. Functional analysis of oxidative stress-activated mitogen-activated protein kinase cascade in plants [J]. Proc Natl Acad Sci, 2000, 97(6): 2940-2945.
[32] Thatcher LF, Carrie C, Andersson CR, et al. Differential gene expression and subcellular targeting of Arabidopsis glutathione-transferase F8 is achieved through alternative transcription start sites [J]. The Journal of Biological Chemistry, 2007, 282(39): 28915-28928.
[33] Dixon DP, Davis BG, Edwards R. Functional divergence in the glutathione transferase superfamily in plants [J]. The Journal of Biological Chemistry, 2002, 277(34): 30859-30869.
[34] Urano J, Nakagawa T, Maki Y, et al. Molecular cloning and characterization of a rice dehydroascorbate reductase [J]. Federation of European Biochemical Societies, 2000, 466(1): 107-111.
[35] Ali MB, Hahn EJ, Paek KY. Effects of temperature on oxidative stress defense systems, lipid peroxidation and lipoxygenase activity in[J]. Plant Physiology and Biochemistry, 2005, 43(3): 213-223.
[36] Dixon DP, Cole DJ, Edwards R. Characterisation of a zeta class glutathione transferase fromwith a putative role in tyrosine catabolism [J]. Archives of Biochemistry and Biophysics, 2000, 384(2): 407-412.
[37] Thom R, Dixon DP, Edwards R, et al. The structure of a zeta class glutathione-transferase from: characterisation of a GST with novel active-site architecture and a putative role in tyrosine catabolism [J]. Journal of Molecular Biology, 2001, 308(5): 949-962.
[38] Tsuchiya T, Takesawa T, Kanzaki H, et al. Genomic structure and differential expression of two tandem-arranged GSTZ genes in rice [J]. Gene, 2004, 335(23): 141-149.
[39] Reumann S, Quan S, Aung K, et al. In-depth proteome analysis ofleaf peroxisomes combined with in vivo subcellular targeting verification indicates novel metabolic and regulatory functions of peroxisomes [J]. Plant Physiology, 2009, 150(1): 125-143.
[40] Sappl PG, Carroll AJ, Clifton R, et al. Theglutathione transferase gene family displays complex stress regulation and co-silencing multiple genes results in altered metabolic sensitivity to oxidative stress [J]. The Plant Journal, 2009, 58(1): 53-68.
Analysis ofGenes in Tea Plant () Based on Transcriptome Analysis
ZHANG Yazhen, WEI Kang*, WANG Liyuan, CHENG Hao
Tea Research Institute, Chinese Academy of Agricultural Sciences; National Center for Tea Improvement; Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China
Glutathione-transferases (GSTs) belong to a superfamily of multifunctional enzymes and are ubiquitous in plants. Forty ninegenes were identified by transcriptome analysis of Zhonghuang2 and Longjing43 under control and shading treatment. Nineteenwith relatively high expression levels in buds were used for sequence and phylogenetic tree analysis. Real-time fluorescence quantitative PCR (qRT-PCR) was performed to analyze the expression patterns of 8 candidate genes in different leaf positions of Longjing43. The results showed thatwere expressed in all tested leaves, but exhibited different expression patterns.showed an increasing expression from a bud with a leaf to the sixth leaf, suggesting a potential role in stress resistance. On the other hand, the expression level ofdropped significantly, suggesting thatmight participate in anthocyanin accumulation in tea plants.
tea plant (), transcriptome analysis, GST, expression analysis
S571.1;Q51
A
1000-369X(2016)05-513-10
2016-04-14
2016-05-20
现代农业(茶叶)产业技术体系(CARS-23)、国家自然科学基金项目(31470396)、浙江省自然科学基金项目(LY14C020001)。
张亚真,女,硕士研究生,主要从事茶树分子生物学研究。
weikang@tricaas.com

