L-茶氨酸对产肠毒素大肠杆菌引起的免疫应激小鼠肠道的保护作用研究
刘遵莹,刘秋玲,邓燕莉,陈凌,肖文军,3*
L-茶氨酸对产肠毒素大肠杆菌引起的免疫应激小鼠肠道的保护作用研究
刘遵莹1,2,刘秋玲1,2,邓燕莉1,2,陈凌1,2,肖文军1,2,3*
1. 湖南农业大学茶学教育部重点实验室,湖南长沙 410128;2. 湖南农业大学国家植物功能成分利用工程技术研究中心,湖南长沙 410128;3. 湖南农业大学湖南省植物功能成分利用协同创新中心,湖南长沙 410128
以SPF级Balb/c雌性小鼠为实验动物,对其适应性饲养3 d后连续30 d灌喂不同剂量L-茶氨酸,然后腹腔注射产肠毒素大肠杆菌E44813诱导免疫应激,5 h后取样,分析研究了L-茶氨酸对小鼠体重,回肠组织谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)、过氧化氢酶(Homogenate catalase, CAT)与诱导型一氧化氮合成酶(Inducible nitric oxide synthase, iNOS)活性,丙二醛(Malondialdehyde, MDA)含量、空肠组织病理学变化,以及血清肿瘤坏死因子α (Tumor necrosis factor-α, TNF-α)、细胞间粘附分子1(Intercellular cell adhesion molecule-1, ICAM-1)和白介素1β(Interleukin-1β, IL-1β)表达量的影响,以探明L-茶氨酸对产肠毒素大肠杆菌免疫应激小鼠肠道的保护作用。结果表明,各剂量L-茶氨酸均能显著增加小鼠体重,可减轻产肠毒素大肠杆菌E44813引起的肠道组织病变程度,升高回肠组织GSH-Px和CAT酶活性,降低MDA含量和iNOS酶活性,在不同程度上抑制血清TNF-α、IL-1β和ICAM-1的表达量。说明L-茶氨酸可通过抑制炎性细胞因子表达水平、降低脂质过氧化程度和提高抗氧化能力来维护肠道组织形态与结构的完整性,并达到保护肠道的作用。
L-茶氨酸;产肠毒素大肠杆菌;免疫应激;保护肠道
肠道不仅是消化吸收和交换营养物质的重要场所,也是保护机体免受各种病菌和毒素侵染的重要免疫器官[1-2]。产肠毒素大肠杆菌(,ETEC)是一类常见的致人和幼畜腹泻的人畜共患型病原体,可通过黏附素结合到小肠黏膜上皮细胞,然后在肠道内大量增殖,产生一种或多种肠毒素,进而引起小肠分泌大量液体从而导致腹泻[3-4]。长期或大量使用复合抗生素不仅使ETEC产生耐药性和变异,而且造成抗生素低效和在体内累积,导致胃肠道菌群紊乱,引发多种疾病[5]。因此,寻找天然、安全、有效的植物功能成分来替代抗生素是未来防治大肠杆菌感染、保护肠道健康的重要发展方向[6-8]。
L-茶氨酸(L-Theanine)是茶叶中的特征性氨基酸[9],经口摄入后在小肠黏膜刷状缘经钠离子依赖的转运体转运入血而被运输到各个组织器官中[10]。L-茶氨酸具有安全、稳定等优点,能够促进生长、保护神经、提高抗氧化能力和免疫力等生物活性[11-19],但尚未见L-茶氨酸对产肠毒素大肠杆菌引起的免疫应激小鼠肠道保护作用的研究报道。本研究以SPF级Balb/c雌性小鼠为实验动物,采用L-茶氨酸预防干预,再腹腔注射产肠毒素大肠杆菌E44813,研究L-茶氨酸对产肠毒素大肠杆菌免疫应激小鼠肠道的保护作用,为L-茶氨酸的深层开发利用及临床大肠杆菌感染病的防治提供科学依据。
1 材料与方法
1.1 材料与试剂
L-茶氨酸(≥98%)购于德国sigma试剂公司;产肠毒素大肠杆菌菌株O78:K80(44813)即E44813由中国食品药品检定研究院提供;地塞米松片(批号:140911,天津药业集团新郑股份有限公司);HyClone磷酸盐缓冲液(批号:211362,北京博艾尔科技有限公司);氯化钠注射液(批号:1410032704,石家庄鹏海制药有限公司);乙醇、乙酸(国药集团化学试剂有限公司);小鼠肿瘤坏死因子α(TNF-α)、小鼠细胞间粘附分子1(ICAM-1)、小鼠白介素1β(IL-1β)ELISA试剂盒购自武汉华美生物工程有限公司;谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)、诱导型一氧化氮合成酶(iNOS)、过氧化氢酶(CAT)可见光试剂盒购自南京建成生物工程研究所。
1.2 仪器设备
多功能酶标仪(美国Thermo公司);96孔酶标板(深圳金灿华实业有限公司);冷冻离心机(美国Thermo公司);Starorius精密电子天平(瑞士Starorius公司);系列量程移液枪(德国Eppendorf公司);恒温摇床(江苏苏昆公司);DSY-2-8 水浴锅(北京国华医疗器械厂);NanoDrop 2000/2000c分光光度仪(Thermo Scientific,德国)。
1.3 方法
1.3.1 动物实验设计
Balb/c小鼠,SPF级,雌性,6~8周龄,19~21 g,60只,由湖南斯莱克景达实验动物有限公司提供,生产单位许可证编号:SCXK(湘)2011-0003,实验动物质量合格证编号:43004700009227,接受日期:20141009。动物饲养于湖南农业大学茶叶研究所,温度(22±2)℃,湿度40%~60%,光照:12 h明、12 h暗,通风:≥15次·h-1全新风。小鼠购回后于动物房适应性饲养3 d,期间自由饮水进食。
小鼠适应性喂养结束后,按平均体重分为6组,每组10只,分别为正常对照组(Control组)、免疫模型组(ETEC组)、L-茶氨酸低剂量组(L.L组)、L-茶氨酸中剂量组(L.M组)、L-茶氨酸高剂量组(L.H组)、地塞米松对照组(DEX组)。所有剂量处理组按体重给药,L.H组、L.M组和L.L组分别给予L-茶氨酸500、300、100 mg·kg-1·d-1;DEX组给予地塞米松5 mg·kg-1·d-1,Control组与ETEC组给予相同剂量生理盐水,按上述试验方法连续灌喂30 d。第31天采用产肠毒素大肠杆菌E44813造模,造模前禁食6 h,用1 mL无菌注射器腹腔注射E44813,剂量为0.02 mL·g-1,Control组腹腔注射生理盐水0.02 mL·g-1。
1.3.2 取样及样品分析
按小鼠分组和体重给药,连续灌喂30 d,分别在第1天、第8天、第15天、第22天和第29天记录小鼠体重。E44813造模5 h后取样。小鼠摘眼球采血,常温静置2 h,3 500 r·min-1离心10 min取上清,用ELISA试剂盒检测各处理组小鼠血清中TNF-α、ICAM-1和IL-1β的表达量。脱颈椎处死取肠道组织,取空肠末端2 cm放入10%中性甲醛中固定用于HE染色,观察小鼠空肠组织的病变情况。取回肠组织约100 g研磨后置于生理盐水中制备10%的回肠组织匀浆,用于检测各处理组小鼠回肠GSH-Px、CAT、MDA和iNOS活性。
1.3.3 统计分析方法
2 结果与分析
2.1 L-茶氨酸对小鼠体重变化的影响
不同剂量L-茶氨酸对小鼠饲养过程中体重变化的影响如表1所示。连续灌喂过程中正常对照组、免疫模型组、L-茶氨酸各剂量组小鼠体质量均增加,且L-茶氨酸各剂量组与正常对照组之间均有显著性差异(<0.05),其中L-茶氨酸中剂量组小鼠体质量的增加量显著高于L-茶氨酸低剂量组和L-茶氨酸高剂量组。地塞米松对照组与正常对照组相比,小鼠体重下降,这可能是由于地塞米松作为一种治疗型的抗炎药物,对正常小鼠肠道吸收与消化营养物质有影响所致。

表1 不同剂量L-茶氨酸对小鼠饲养过程中体重变化的影响(n=10)
注:*:与control组比较,<0.05;#:与L.M组比较,<0.05。
Note: *: Compared with control,<0.05. #: compared with L.M,<0.05.
2.2 L-茶氨酸对小鼠血清中细胞因子表达水平的影响
由图1可知,与正常对照组相比,免疫模型组小鼠血清中TNF-α含量显著增加(<0.05),不同剂量L-茶氨酸组小鼠血清中TNF-α含量较免疫模型组显著降低(<0.05);与正常对照组相比,免疫模型组小鼠血清中IL-1β含量显著增加(<0.05),不同剂量L-茶氨酸组小鼠血清中IL-1β含量较免疫模型组均降低,其中中、高剂量L-茶氨酸组与免疫模型组之间有显著性差异(<0.05)。
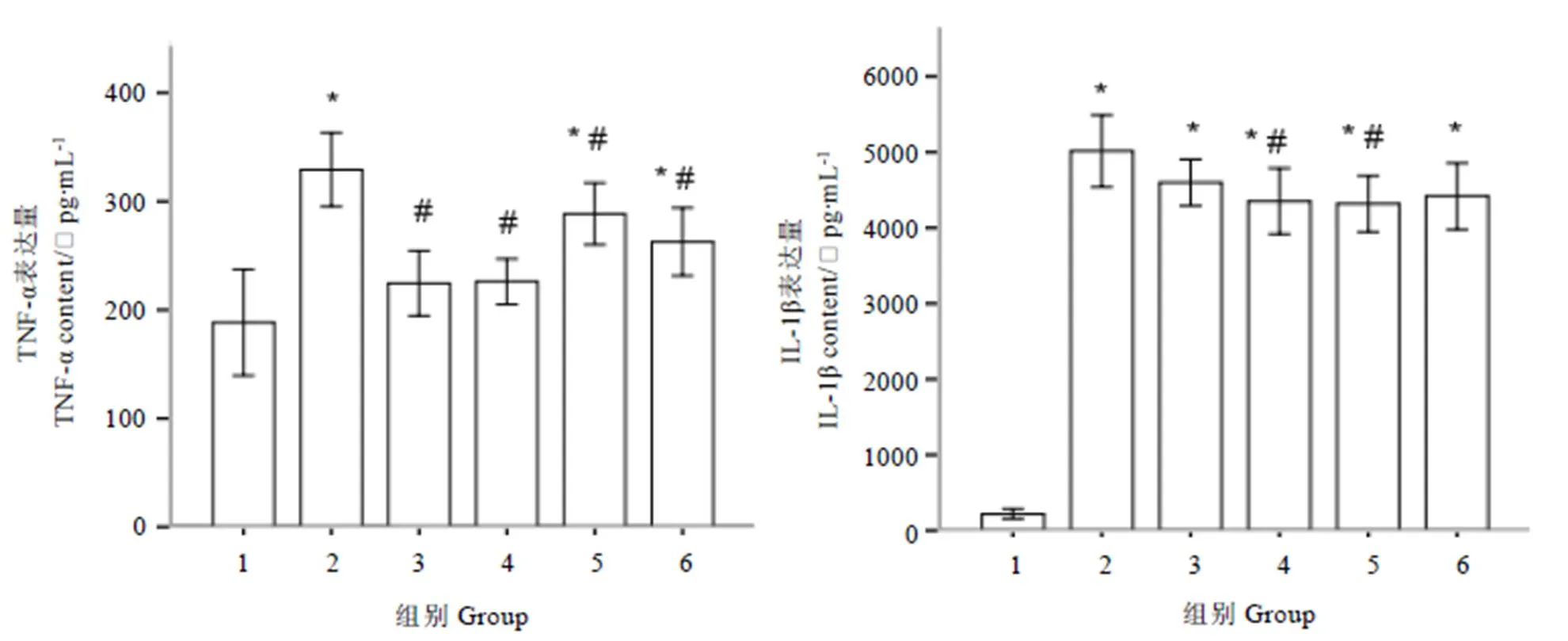
注:1:正常对照组;2:免疫模型组;3:L-茶氨酸低剂量组;4:L-茶氨酸中剂量组;5:L-茶氨酸高剂量组6:地塞米松对照组。与正常对照组比较,*:P<0.05;与免疫模型组比较,#:P<0.05,下同。
L-茶氨酸对小鼠血清中ICAM-1表达量的影响见图2。从图中可以看出,与正常对照组相比,各处理组小鼠血清中ICAM-1表达量显著增加(<0.05),不同剂量L-茶氨酸组小鼠血清中ICAM-1表达量较免疫模型组均降低,其中低、中剂量L-茶氨酸组与免疫模型组之间差异显著(<0.05);高剂量L-茶氨酸组ICAM-1表达量高于低、中剂量L-茶氨酸组的表达量,这可能是因为L-茶氨酸剂量过高,对机体造成轻微的损伤,促进了血清中ICAM-1的表达水平。因此,一定剂量范围内的L-茶氨酸对小鼠血清中细胞因子的表达具有抑制作用。
2.3 L-茶氨酸对免疫应激小鼠肠道组织病理的影响
各处理小鼠空肠组织切片见图3。从图中可以看出,正常对照组小鼠空肠组织肠黏膜结构完整,层次分明,肠黏膜上皮细胞的轮廓清晰,排列规则。免疫模型组小鼠空肠黏膜组织结构病理改变明显,黏膜上皮受损,部分上皮细胞脱落,固有层裸露,黏膜层、黏膜下层及肌层大量淋巴细胞等炎性细胞浸润和充血较为严重,并且大范围水肿。地塞米松对照组和L-茶氨酸各剂量处理组空肠组织病变程度较轻,其中,L-茶氨酸中剂量组病变程度最轻,高剂量组次之,黏膜层、黏膜下层及肌层轻度炎性细胞浸润和充血,仅局部水肿,说明L-茶氨酸能够减轻ETEC引起的空肠组织病变。

注:1:正常对照组;2:免疫模型组;3:L-茶氨酸低剂量组;4:L-茶氨酸中剂量组;5:L-茶氨酸高剂量组6:地塞米松对照组。
2.4 L-茶氨酸对小鼠回肠组织酶活性的影响
各处理组小鼠回肠组织GSH-Px和CAT酶活性如图4所示。与正常对照组相比,免疫模型组小鼠回肠组织中GSH-Px和CAT活性均降低;不同剂量L-茶氨酸组小鼠回肠组织中GSH-Px和CAT活性较免疫模型组均增加,其中,中、高剂量L-茶氨酸组与免疫模型组之间均具有显著性差异(<0.05),低剂量L-茶氨酸组与免疫模型组之间无显著性差异。因此,L-茶氨酸具有提高小鼠回肠组织GSH-Px和CAT活性的作用。
各处理组小鼠回肠组织MDA含量和iNOS活性如图5所示。与正常对照组相比,免疫模型组小鼠回肠组织MDA含量和iNOS活性均升高,不同剂量L-茶氨酸组小鼠回肠组织中MDA含量较免疫模型组均下降,其中低、中剂量组与免疫模型组之间有显著性差异(<0.05);低、中剂量L-茶氨酸组小鼠回肠组织iNOS活性低于免疫模型组,高剂量L-茶氨酸组的高于免疫模型组,且低、中剂量L-茶氨酸组与免疫模型组之间有显著性差异(<0.05)。与免疫模型组比较,高剂量L-茶氨酸对小鼠回肠组织MDA含量和iNOS活性均无显著影响,这可能是因为L-茶氨酸剂量过高,对机体造成轻微的损伤,削弱了其抑制肠道MDA含量和iNOS活性的作用。可见,在一定的剂量范围内,L-茶氨酸具有降低小鼠回肠组织MDA含量和iNOS活性的作用。
3 讨论
ETEC感染肠道后与肠道上皮细胞受体结合,随后通过信号转导引发宿主细胞的蛋白磷酸化等作用,使ETEC定殖并大量生长繁殖,大量毒素持续不断地释放到肠腔内,超出肠道自身免疫调节能力范围,引起Cl-、Na+、HCO3-和水在小肠内的分泌量大量增加,从而导致腹泻,并且细胞会释放多种细胞因子,如TNF-α、IL-1β和ICAM-1等。若大量细胞因子持续释放则会导致炎症扩大和加重,肠腔内液体的过量分泌导致脱水及代谢性酸中毒等,使肠道黏膜组织损伤、脱落,进而糜烂,严重影响肠道吸收功能和免疫功能[20-21]。
从研究结果中不难看出,以L-茶氨酸干预小鼠,能显著增加小鼠体重,并以中剂量最佳;对小鼠腹腔注射产肠毒素大肠杆菌E44813后,小鼠空肠组织结构受损、炎性细胞浸润和充血等病变情况严重,其血清TNF-α、IL-1β和ICAM-1表达量以及回肠组织匀浆MDA含量和iNOS活性显著升高,而GSH-Px和CAT活性显著降低,说明ETEC感染造成小鼠肠道抗氧化能力下降、炎症反应剧烈,严重损伤肠道。各剂量L-茶氨酸均能减轻E44813引起的空肠组织病变,且能降低TNF-α、IL-1β、ICAM-1表达量以及MDA含量和iNOS活性,升高GSH-Px和CAT活性,并也以300 mg·kg-1剂量最佳,说明L-茶氨酸可通过抑制炎性细胞因子表达水平、降低脂质过氧化程度和提高抗氧化能力等途径,保护由产肠毒素大肠杆菌感染所致免疫应激小鼠肠道组织形态与结构的完整性,并达到保护肠道的作用。
参考文献
[1] Sonnenburg J L, Angenent L T, Gordon J I. Getting a grip on things: how do communities of bacterial symbionts become established in our intestine [J]. Nature Immunology, 2004, 5(6): 569-573.
[2] 王其洲, 周元军, 黄胜昌, 等. 人兽共患病及其防治[J]. 医学动物防制, 2005, 21(9): 675-676.
[3] Qadri F, Svennerholm A M, Faruque A S G, et al. Enterotoxigenic Escherichia coli in developing countries: epidemiology, microbiology, clinical features, treatment, and prevention [J]. Clinical microbiology reviews, 2005, 18(3): 465-483.
[4] GiIIigan P H.EAEC, EHEC, EIEC, ETEC [J]. Clinics in laboratory medicine, 1999, 19(3): 505-521.
[5] 王星, 覃宗华, 刘定发. 大肠杆菌不耐热肠毒素的分子生物学及黏膜免疫佐剂效应[J]. 广东畜牧兽医科技, 2005, 30(4): 18-21.
[6] 李成洪, 王孝友, 杨睿. 植物提取物饲料添加剂对生长猪生产性能的影响[J]. 饲料工业, 2012, 33(17): 14-16.
[7] 卫智权, 阎莉, 邓家刚. 芒果苷对脂多糖诱导的慢性炎症大鼠MAPK通路及血清细胞因子的影响[J]. 中草药, 2013, 44(1): 52-58.
[8] 宋丹, 张立艳, 白换力. 香芪汤及其有效成分对LPS诱导的巨噬细胞MAPK信号通路的影响[J]. 中国兽医学报, 2013, 33(5): 776-779.
[9] Juneja L R, Chu D C, Okubo T, et al. L-theanine-a unique amino acid of green tea and its relaxation effect in humans [J]. Trends in Food Science & Technology, 1999, 10(6): 199-204.
[10] Kitaoka S, Hayashi H, Yokogoshi H, et al. Transmural potential changes associated with theabsorption of theanine in the guinea pig intestine [J]. Bioscience, Biotechnology and Biochemistry, 1996, 60(11): 1768-1771.
[11] Nishida K, YasudA E, Nagasawa K, et al. Altered levels of oxidation and phospholipase C isozyme expression in the brains of theanine -administered rats [J]. Biological & Pharmaceutical Bulletin, 2008, 31(5): 857-860.
[12] 文慧, 魏时来, 张石蕊, 等. L-茶氨酸对黄羽肉鸡生产性能和免疫功能的影响[J]. 动物营养学报, 2012, 24(10): 1946-1954.
[13] 孙浪, 鲁双庆, 肖调义, 等. 饲料中添加茶氨酸对草鱼免疫和血清生化指标的影响[J]. 饲料研究, 2012(6): 63-65.
[14] 谭俊峰, 林智, 李靓. 茶氨酸复合制剂增强免疫力的功能研究[J]. 茶叶科学, 2012, 32(3): 224-228.
[15] 王庆利, 张力军, 吴明春. 茶氨酸对脑缺血损伤大鼠自由基代谢的影响[J]. 实用医学杂志, 2008, 24(11): 1898-1900.
[16] 刘婉如. 茶氨酸神经保护作用的体外和体内实验研究[D]. 北京: 中国疾病预防控制中心, 2007: 14-62.
[17] 张燕辉, 吴明春, 王庆利. 茶氨酸对大鼠局灶性脑缺血性损伤后炎性细胞因子表达的影响[J]. 中国临床神经外科杂志, 2010, 15(9): 544-546.
[18] De Roux N, Genin E, Carel J C, et al. Hypogonadotropic hypogonadism due to loss of function of the KiSSl-deftved peptide receptor GPR54 [J]. Proceedings of the National Academy of Sciences, 2003, 100(19): 10972-10976.
[19] Borzelleca JF, Peters D, Hall W. A 13-week dietary toxicity and toxicokinetic study with L-theanine in rats [J]. Food and Chemical Toxicology, 2006, 44(7): 1158-1166.
[20] Inoue T, Tsuji T, Koto M, et al. Amino acid sequence of heat-labile enterotoxin from chicken enterotoxigenic Escherichia coli is identical to that of human strain H 10407 [J]. FEMS Microbiology Letters, 1993, 108(2): 157-162.
[21] 陈培富, 朱兴全. 大肠杆菌耐热肠毒素的结构与特性[J]. 中国预防兽医学报, 2012, 34(3): 244-246.
Study on the Protective Effect of L-Theanine on the Intestinal in Mice with Immune Stress Induced by ETEC
LIU Zunying1,2, LIU Qiuling1,2, DENG Yanli1,2, CHEN Ling1,2, XIAO Wenjun1,2,3*
1. Key Lab of Tea Science of Ministry of Education, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Hunan Collaborative Innovation Center for Utilization of Botanical Functional Ingredients, Hunan Agricultural University, Changsha 410128, China
SPF grade Balb/c female mice were used as experimental animals. After adaptive feeding for 3 days, mice were orally pre-treated with different dosages of L-theanine once daily for 30 days before ETEC E44813 intraperitoneal injection. The body weight change in mice was analyzed during the breeding process. Mice were scarified 5 hours after ETEC injection and tissues were collected for analysis. The activities of ileum Glutathione peroxidase (GSH-Px), homogenate Catalase (CAT), Malondialdehyde (MDA) and Inducible nitric oxide synthase (iNOS) were measured and the pathological changes of intestinal and the levels of serum Tumornecrosisfactor-α (TNF-α), Interleukin-1β (IL-1β) and Intercellular cell adhesion moleculeICAM-1) were examined. This study was aimed to explore the protective effects of L-theanine on intestinal of ETEC-induced immune stress model in mice. The results showed that: pretreatment with L-theanine at different dosages significantly increased mouse body weight; lowered the levels of ileum homogenate MDA and iNOS, improved the activities ofileum homogenate CAT, GSH-Px, decreased the expressions of serum TNF-α、IL-1β and ICAM-1, and improved pathological structure of jejunum tissue. These data demonstrated that pre-treatment with L-theanine prevented ETEC-induced intestinal injury through inhibiting TNF-α、IL-1β and ICAM-1, and inflammatory reaction and enhancing intestinal antioxidant abilities.
L-theanine,, immune stress, intestinal protection
Q51;Q939.1
A
1000-369X(2016)05-469-08
2016-03-24
2016-06-18
国家“十二五”科技支撑计划项目(2011BAD10B00)
刘遵莹,女,硕士研究生,主要从事茶叶功能成分利用研究。
xiaowenjun88@sina.com

