茶树硝态氮转运蛋白NRT1.1基因的克隆及表达分析
杨亦扬,胡雲飞,万青,李荣林,王枫,阮建云
茶树硝态氮转运蛋白NRT1.1基因的克隆及表达分析
杨亦扬1,2,胡雲飞1,万青1,李荣林1,王枫3,阮建云2*
1. 江苏省农业科学院园艺研究所江苏省高效园艺作物遗传改良重点实验室,江苏南京 210014;2. 中国农业科学院茶叶研究所农业部茶树生物学与资源利用重点实验室,浙江杭州 310008;3. 南京农业大学园艺学院作物遗传与种质创新国家重点实验室,江苏南京 210095
以茶树((L.))品种龙井43为试材,采用PCR结合RACE技术,克隆得到硝态氮转运蛋白基因()的cDNA全长序列,基因序列全长1 880 bp,其中开放阅读框(ORF)1 788 bp,编码595个氨基酸,预测蛋白质分子量为65.9 kD,理论等电点为8.99,命名为。序列分析表明,与葡萄氨基酸序列的相似性最高。通过生物信息学分析,对的氨基酸理化性质、亲/疏水性、跨膜区域及亚细胞定位进行了预测。实时定量PCR表达分析表明,茶树根和叶片中在1 mol·L-1NO3-处理5 min内均受到抑制,叶部表达量0.5 h后即达到最大值,24 h内各个时间点均高于根部,根中表达量始终低于对照。本研究结果为研究茶树对NO3-的吸收、转运和调控机理提供了分子生物学基础。
茶树;硝态氮;基因;实时定量PCR
茶树((L.))是原产中国的多年生木本植物,它以叶片为收获目标,对氮素需求量较大。氮肥施用量与茶叶品质成分氨基酸、茶多酚含量密切相关,所以,氮肥是茶园中主要的肥料,通常占施肥总量的一半以上[1]。茶树对不同氮源具有偏性吸收特性,对铵态氮的吸收量高于硝态氮的10倍以上,研究表明,造成这种差异的原因,主要在于吸收运载系统的差异[2-3]。故研究茶树NO3-吸收、转运和累积的机制,对于提高其NO3-的利用效率,从而提高茶树氮素利用率,提高茶叶品质,具有重要的理论和现实意义。
硝态氮转运蛋白(Nitrate transporters, NRTs)负责植物根系对NO3-的吸收和转运,一直是植物营养领域研究的热点之一。植物具有3个NO3-转运系统,以适应外界不同的NO3-浓度。两个高亲和运载系统(High-affinity transport system, HATS),在低浓度NO3-的环境下发挥作用,而当外界NO3-的浓度较高时,植物通过低亲和运载系统(Low-affinity transport system, LATS)进行NO3-的吸收[4-5]。目前,已证实拟南芥基因组有53个NRT1亚家族成员,7个NRT2亚家族成员[6-7],水稻中NRT1亚家族成员有100多个,NRT2亚家族成员有6个[8]。
茶树吸收利用氮素的生理特性已有研究,但对于氮吸收转运蛋白特性的研究仍较为缺乏,对茶树NRT2家族基因研究已有报道[9-10],而茶树NRT1家族分子水平研究还显空白。本文对茶树基因进行分离克隆,并对其表达特性进行研究,将为进一步研究茶树NRTs在茶树氮吸收转运中的作用及是否与茶树偏铵特性有关奠定理论基础。
1 材料与方法
1.1 试验材料
供试茶树品种为龙井43。采用两年生龙井43扦插苗,挑选整齐一致的茶苗移栽至营养液中进行培养。无氮营养液基本组成为大量元素(mmol·L-1):KH2PO4(0.03),MgSO4(0.13),CaCl2+Ca(NO3)2(0.27),K2SO4(0.33);微量元素(μmol·L-1):H3BO3(3.33),MnSO4(0.5),ZnSO4(0.33),CuSO4(0.07),(NH4)6Mo7O24(0.17),FeEDTA (2.10)。茶苗在上述营养液中培养1周后,移至光照培养箱(光照16 h/黑暗8 h、光照强度2 000 lx、温度25℃、湿度80%),NO3-浓度为1 mmol·L-1的Ca(NO3)2溶液中进行NO3-吸收试验,取未处理及处理5 min、0.5 h、1 h、2 h、4 h、8 h、12 h和24 h后的茶苗根和叶片作为提取总RNA的试验材料。
1.2 RNA提取及cDNA合成
分别取0.1 g茶树根和叶片,利用RNA simple Total RNA Kit(Tiangen,北京)提取茶树总RNA,用1.0%变性琼脂糖凝胶电泳检测总RNA的完整性,置于-80℃保存备用。用PrimeScript RT reagent Kit(TaKaRa,大连)将提取的总RNA反转录成cDNA。
1.3 CsNRT1.1基因的克隆
根据GenBank中拟南芥硝酸盐转运蛋白NRT1.1(At1g12110)基因序列,将它与茶树转录组数据进行比对,获取它在茶树中的同源序列,并以此序列为参考,利用Primer 5.0设计RACE特异引物(表1),通过RACE技术,对茶树的3′和5′端进行扩增,拼接出茶树全长序列。最后,再设计特异引物,扩增出茶树基因全长序列。以cDNA第1链为模板进行扩增,PCR反应条件为:94℃ 5 min,94℃ 30 s,54℃ 30 s,72℃ 60 s,30个循环;72℃ 10 min。反应产物经1.0%琼脂糖凝胶电泳回收后,连接pMD18-T载体并转化大肠杆菌DH5a,提取质粒经PCR鉴定为阳性的菌落进行测序。

表1 茶树CsNRT1.1 cDNA克隆相关引物
1.4 序列生物信息学分析
利用NCBI进行开放阅读框的查询,通过BLAST进行同源性分析,用MEGA6构建系统进化树;基因编码蛋白的理化性质采用Protparam程序预测,疏水性/亲水性预测分析通过ProtScale程序预测,跨膜结构域通过TMHMM服务器分析,亚细胞定位通过wolfpsort软件进行预测。
1.5 表达模式分析
分别以茶苗的根、叶mRNA反转录成的cDNA为模板,采用定量PCR技术对不同处理时间茶树基因的表达进行定量分析。以茶树β-actin为内标基因,反应体系按照Power 2×SYBR Real-time PCR premixture使用说明书配制。25 μL体系:2.0 μL cDNA,12.5 μL 2×Premix,0.5 μL上、下游引物,0.5 μL ROX和9 μL ddH2O。PCR反应程序:95℃ 60 s,95℃ 10 s,60℃ 10 s,72℃ 30 s,40个循环。根据CT值分别计算出目标基因的相对表达量2–ΔΔT。
2 结果与分析
2.1 茶树CsNRT1.1 cDNA全长序列的克隆及分析
以茶树总cDNA为模板,以引物GSP3′RACER1、GSP3′RACER2进行3′-RACE,扩增出1条大小421 bp的片段(图1-A)。以引物GSP5′RACER1、GSP5′RACER1,5′末端cDNA扩增方式扩增出大小350 bp序列(图1-C)。利用引物NRT1.1F、NRT1.1R进行RT-PCR扩增,获得了2 000 bp左右的片段(图1-B)。测序分析表明,茶树硝态氮转运蛋白基因,序列全长为1 880 bp,含1 788 bp的开放阅读框(ORF),编码595个氨基酸,预测其蛋白质分子量为65.9 kD,理论等电点为8.99(图2)。
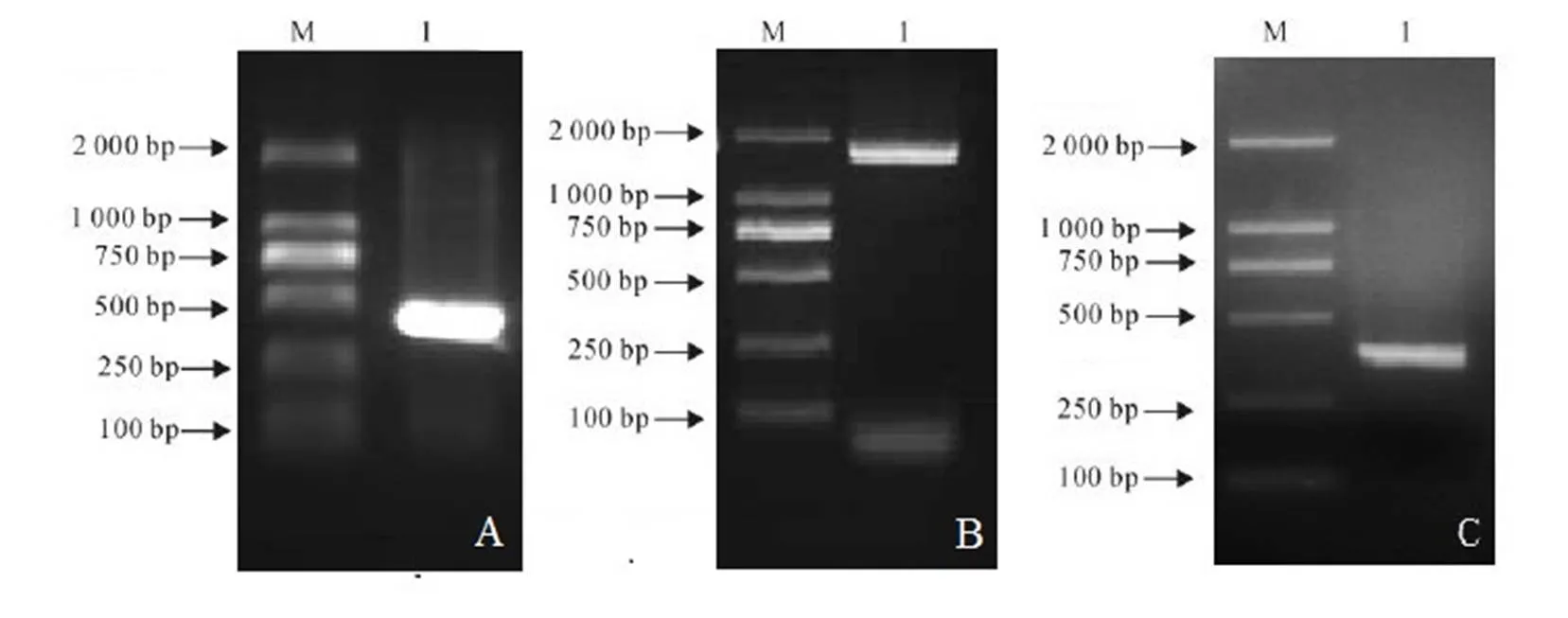
注:M:DL2000;1:扩增产物;A:3′端产物;B:全长扩增产物;C:5′端产物。

注:方框内表示起始密码子和终止密码子,阴影部分为保守的蛋白激酶C的识别位点(S/T-X-R/K)。
将茶树与GenBank中登录的其他物种基因的氨基酸序列进行比对,利用Mega 6软件,采用邻位相近法分析绘制系统进化树(图3)。结果表明,茶树与葡萄具有相对较高的同源性,氨基酸一致性分别为:芝麻80%、番茄77%、葡萄81%、野草莓80%、杨树79%、橙80%、可可80%、桉树80%、黄瓜76%、大豆74%。
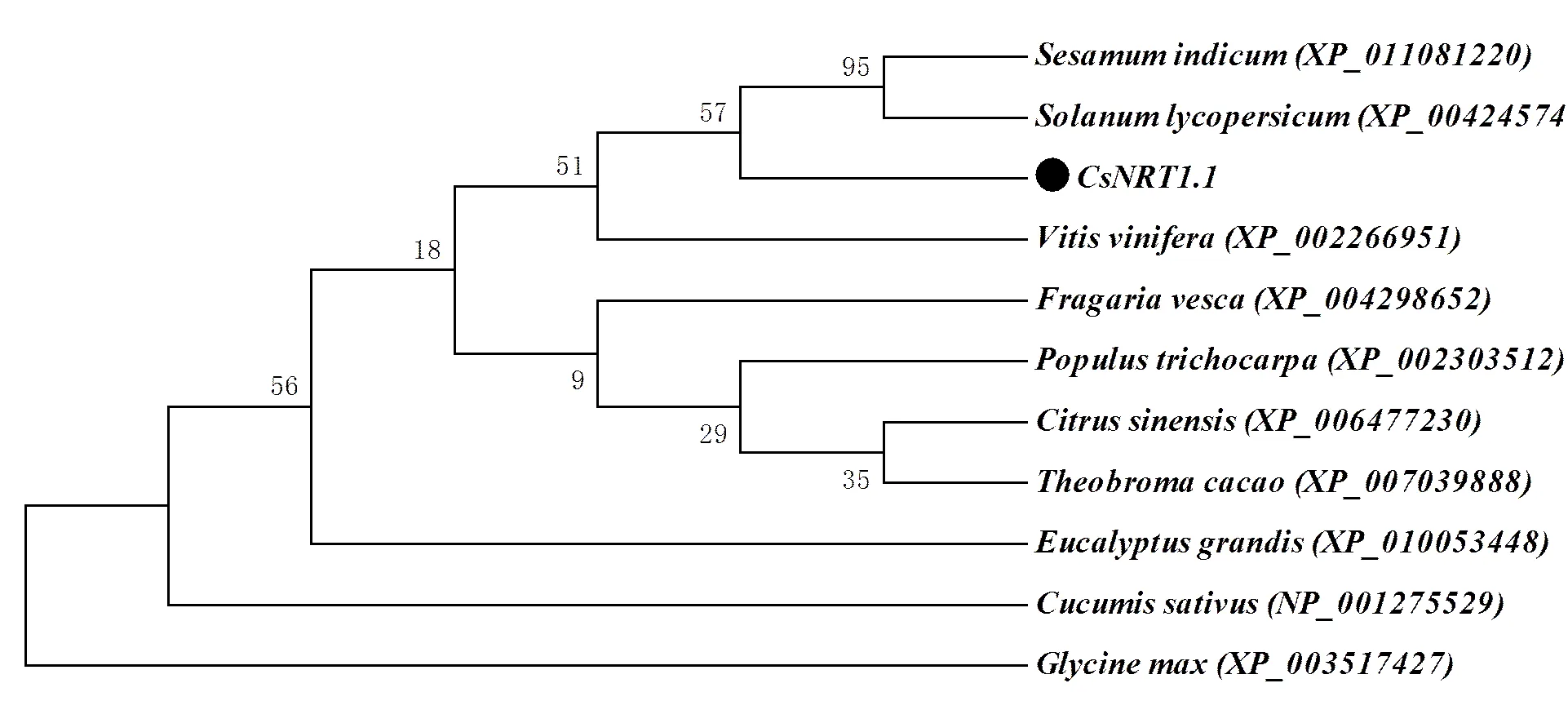
注:XP_011081220:芝麻;XP_004245746:番茄;XP_002266951:葡萄;XP_004298652:野草莓;XP_002303512:杨树;XP_006477230:橙;XP_007039888:可可;XP_010053448:桉树;XP_001275529:黄瓜;XP_003517427:大豆。
2.2 茶树CsNRT1.1编码蛋白的生物信息学分析
2.2.1茶树CsNRT1.1氨基酸序列的理化性质分析
利用在线分析软件Protparam对CsNRT1.1所对应的氨基酸序列进行分析,结果表明,茶树CsNRT1.1所对应的氨基酸数目为595个,分子量为65.9 kD,理论等电点为8.99,氨基酸组成如图4所示。负电荷氨基酸残基数为(Asp+Glu)40个,正电荷氨基酸残基数为(Arg+Lys)49个。不稳定系数为32.96,为稳定蛋白,脂肪系数为101.92。总平均亲水性为0.315。
2.2.2 茶树CsNRT1.1疏水性/亲水性预测分析
通过ProtScale程序绘制茶树CsNRT1.1的亲/疏水性序列谱,结果如图5,甘氨酸(235位)分值最高,为3.511,谷氨酸(293位)分值最低,为-3.333,根据正值越大,疏水性越高;负值越小,亲水性越高的规律判断,茶树CsNRT1.1的疏水性氨基酸较多,为疏水性蛋白。
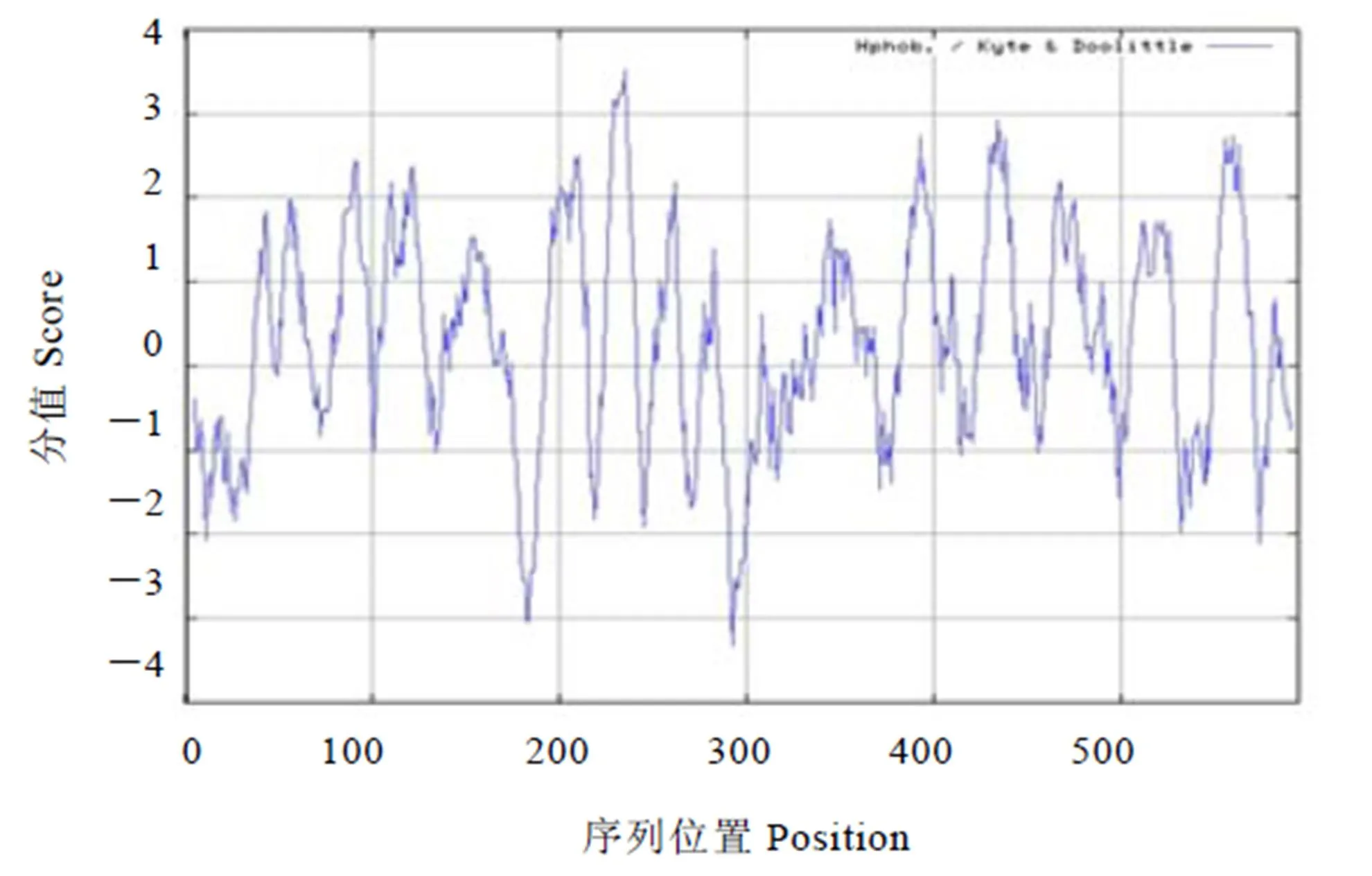
注:横向为氨基酸顺序,由左向右;疏水和亲水位点分别在零水平线的上方和下方。
2.2.3 茶树CsNRT1.1跨膜区结构预测
利用TMHMM分析表明,该蛋白序列跨膜螺旋(TMhelix)区预测位置分别在41~63、78~100、107~129、149~171、192~214、218~240、340~362、380~402、423~442、462~484、505~527、547~569。从输出的图形文件中也可以明显看到这12个跨膜螺旋区(图6),其中,第6个和第7个跨膜结构域之间存在一个大的亲水环。茶树CsNRT1.1蛋白氨基酸N端和C端均处于细胞膜内部。
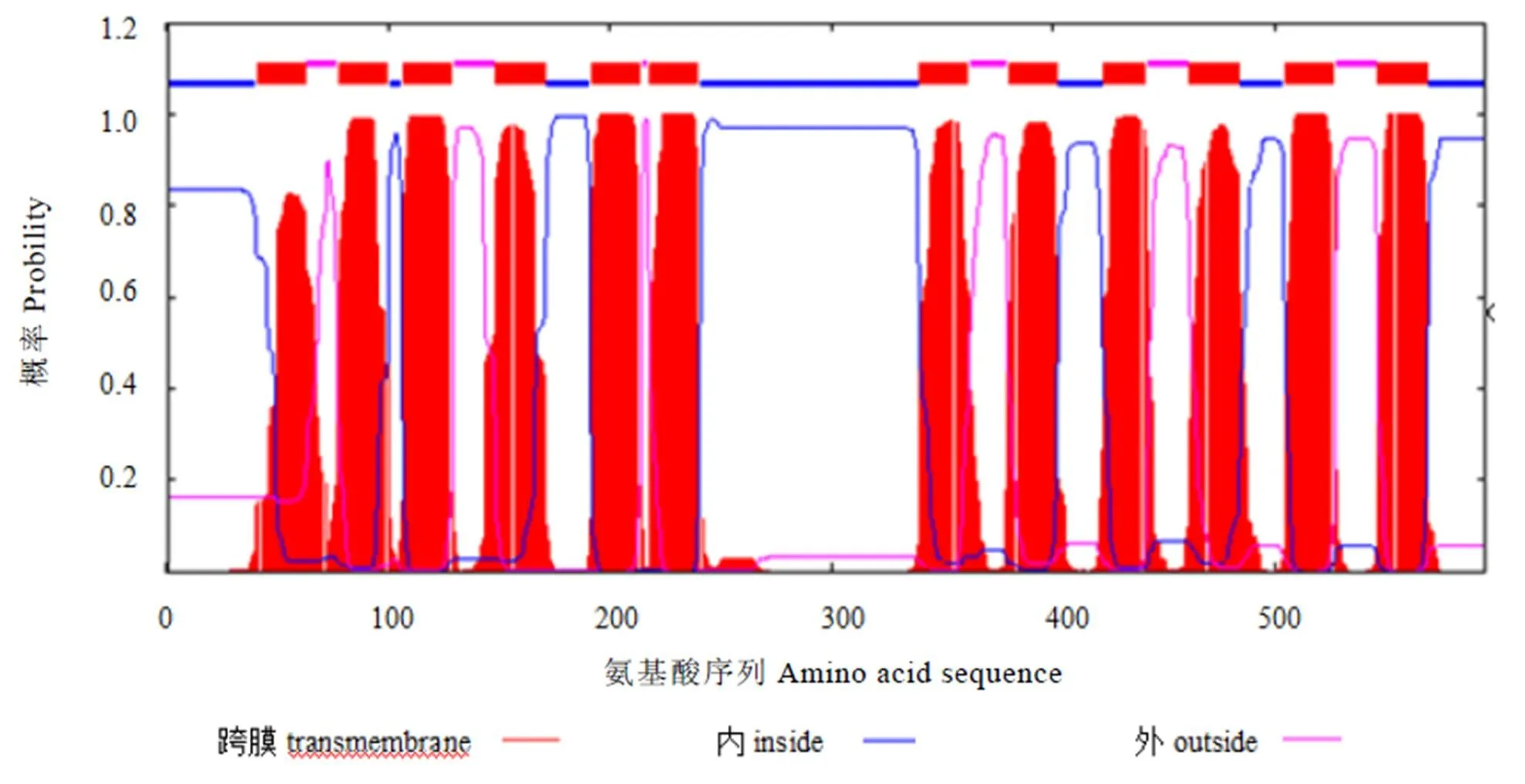
图6 茶树CsNTR1.1蛋白跨膜结构模式图
2.2.4 茶树CsNRT1.1亚细胞定位预测
采用软件wolf psort对茶树CsNRT1.1蛋白的亚细胞定位进行分析,结果显示,茶树CsNRT1.1蛋白在细胞质膜的得分最高,为10.0,液泡和细胞外得分均为2.0,推测其定位在细胞质膜上行使氮转运的功能,为膜蛋白。
2.3茶树CsNRT1.1基因表达模式分析
分别提取茶树根和叶片中的mRNA进行实时荧光定量RT-PCR分析,结果如图7所示。与对照相比,茶树受NO3-处理5 min后根和叶的表达量均下降,尤其是根部,下降显著。根部表达量始终低于对照,叶部表达量24 h内各个时间点均高于根部,半小时后即达到最大值。
3 讨论
NRT1.1(CHL1)是植物中鉴定的第一个硝酸盐转运蛋白[11],无论外界环境中NO3-浓度高低均可以发挥作用[12],故成为研究的焦点,目前模式植物上仍在进行新的研究[13]。茶树氮吸收转运蛋白研究尚处于起步阶段,NRT1.1的功能是否与其他作物中的一样尚不明确。本文从龙井43茶树中成功克隆了一个硝酸盐转运蛋白基因。Blast比对结果表明,基因核苷酸和氨基酸序列与其他植物的NRT1.1有较高的同源性。系统进化树分析发现,它与葡萄等植物有较高的同源性,与黄瓜、大豆等作物关系相对较远。
NRT1转运蛋白一般含有450~600个氨基酸,并含有12个跨膜区,在第6和第7跨膜区之间有一个大的亲水环[14],本研究中,茶树NRT1.1含有12个跨膜螺旋区,其中,第6个和第7个跨膜结构域之间存在一个大的亲水环。且该蛋白为疏水性蛋白,可能定位在细胞质膜上,为膜蛋白,这与茶树NRT1.2和NRT1.5的结果一致[9],说明二者行使氮转运功能的位置一致。
根据基因的表达是否受NO3-诱导可以将NRT基因分为诱导型和组成型两大类[6],实时定量结果表明,在茶树根系和叶部开始吸收NO3-5 min内表达均受到抑制,说明茶树为诱导型基因,且根部受抑制作用影响较大,叶片中影响较小。植物中很多基因可以在短时间内响应NO3-的处理[15-17],并表现出一定的昼夜节律特征[18-19]。本研究吸收试验处理从上午9:00开始,吸收12 h后,即到晚上9:00,黑暗情况下,根系和叶片中均降到了最低点,说明茶树受光照影响。24 h动态追踪结果表明,茶树叶片中在0.5 h达到较高水平,而根部一直低于对照,没有显著增加。说明在不同组织部位中,吸收同化NO3-的机理可能存在差异,叶片对NO3-的处理响应更明显。另外,不仅只作为硝酸盐转运蛋白,更可能是感受硝酸盐的信号受体,它对茶树其他硝酸盐转运蛋白、茶树生长和发育的作用还需进一步研究和鉴定。
参考文献
[1] Kamau D M, Spiertz J H J, Oenema O, et al. Productivity and nitrogen use of tea plantations in relation to age and genotype [J]. Field Crops Research, 2008, 108(1): 60-70.
[2] 杜旭华, 彭方仁. 无机氮素形态对茶树氮素吸收动力学特性及个体生长的影响[J]. 作物学报, 2010, 36(2): 327-334.
[3] Yang Y Y, Li X H, Ratcliffe R G, et al. Characterization of ammonium and nitrate uptake and assimilation in roots of tea plants [J]. Russian Journal of Plant Physiology, 2013, 60(1): 91-99.
[4] Dechorgnat J, Nguyen C T, Armengaud P, et al. From the soil to the seeds: the journey of nitrate in plants [J]. Journal of Experimental Botany, 2010, 62(4): 1349-1359.
[5] Gojon A, Krouk G, Perrine-Walker F, et al. Nitrate transceptor(s) in plants [J]. Journal of Experimental Botany, 2011, 62(7): 2299-2308.
[6] Okamato M, Vidmar J J, Glass A D M. Regulation of NRT1 and NRT2 gene families of Arabidopsis thaliana: responses to nitrate provision [J]. Plant Cell Physiology, 2003, 44(3): 304-317.
[7] Orsel M, Krapp A, Daniel-Vedele F. Analysis of the NRT2 nitrate transporter family in Arabidopsis. Structure and gene expression [J]. Plant Physiology, 2002, 129(2): 886-896.
[8] Araki R, Hasegawa H. Expression of rice (L.) genes involved in high-affinity nitrate transport during the period of nitrate induction [J]. Breeding Science, 2006, 56(3): 295-302.
[9] 冯素花. 茶树硝酸根转运蛋白NRT1.2、NRT1.5和NRT2.5基因的克隆和表达[D]. 杭州: 中国农业科学院茶叶研究所, 2014: 24-25.
[10] 汪进, 添先凤, 江昌俊, 等. 茶树硝酸盐转运蛋白基因的克隆和表达分析[J]. 植物生理学报, 2014, 50(7): 983-988.
[11] Tsay Y F, Schroeder J I, Feldmann K A, et al. The herbicide sensitivity gene CHL1 of Arabidopsis encodes a nitrate- inducible nitrate transporter [J]. Cell, 1993, 72: 705-713.
[12] Wang R C, Liu D, Crawford N M. The Arabidopsis CHL1 protein plays a major role in high-affinity nitrate uptake [J]. Proceedings of the national academy of sciences, 1999, 95(25): 15134-15139.
[13] Anthony D M, Glass Z K. A reevaluation of the role of Arabidopsis NRT1.1 in high-affinity nitrate transport [J]. Plant physiology, 2013, 163: 1103-1106.
[14] Tsay Y F, Chiu C C, Tsai C B, et al. Nitrate transporters and peptide transporters [J]. FEBS Letters, 2007, 581: 2290-2300.
[15] Wang R C, Okamoto M, Xing X J, et al. Microarray analysis of the nitrate response in Arabidopsis roots and shoots reveals over 1000 rapidly responding genes and new linkages to glucose, trehalose-6-phosphate, iron, and sulfate metabolism [J]. Plant Physiology, 2003, 132(2): 556-567.
[16] Wang R C, Xing X J, Crawford N M. Nitrate acts as transcriptome signal at micromolar concentrations in Arabidopsis roots [J]. Plant Physiology, 2007, 145(4): 1735-1745.
[17] 孔敏, 杨学东, 侯喜林, 等. 白菜NRT2基因的克隆及表达模式分析[J]. 园艺学报, 2011, 38(12): 2309-2316.
[18] Cardenas-Navarro R, Adamowicz S, Robin P. Diurnal nitrate uptake in young tomato (Mill) plants: test of a feedback-based model [J]. Journal of Experimental Botany, 1998, 49(321): 721-730.
[19] 徐海荣, 谷俊涛, 路文静, 等. 水稻硝酸盐转运蛋白基因的编码蛋白特征和表达[J]. 作物学报, 2007, 33(5): 723-730.
Cloning and Expression Analysis of Nitrate Transporter NRT1.1 Gene in Tea Plant ((L.))
YANG Yiyang1,2, HU Yunfei1, WAN Qing1, LI Ronglin1, WANG Feng3, RUAN Jianyun2*
1. Institute of Horticulture, Jiangsu Academy of Agricultural Science, Jiangsu Key Laboratory for Horticultural Crop Genetic Improvement, Nanjing 210014, China; 2. Tea Research of Institute, Chinese of Academy of Agricultural Science, Key Laboratory of Tea Biology and Resources Utilization, Ministry of Agriculture, Hangzhou 310008, China; 3. College of Horticulture, Nanjing Agricultural University, State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing 210095, China
A full length cDNA sequence of Nitrate transport gene () was obtained from tea plant ((L.)) cultivar ‘Longjing 43’ by polymerase chain reaction (PCR) and rapid amplification of cDNA ends PCR (RACE-PCR). The length of nucleotide sequence of this gene was 1 880 bp, containing a complete open reading frame (1 788 bp) to encode 595 amino acids. The putative protein had an isoelectric point of 8.99 and a calculated molecular weight of 65.9 kD.was highly homologous to the geneby sequence alignment. Several parameters of these sequences, including sequences composition, physicochemical property, topological structure of transmembrane regions, hydrophobicity or hydrophilicity, subcellular localization were predicted by bioinformatics tools. Quantitative real-time PCR analysis showed that the expression ofin roots and leaves were inhibited after incubation in 1 mol·L-1NO3-for 5 min. The expressions oferealways lower than thatof CKwithin 24 h.Its expressions in leaves were higher than those in roots with its peak at 0.5 h.Our results provides favorably help to reveal NO3-uptake and utilization in tea plants.
, nitrate,,RT-PCR
S571.1;Q51
A
1000-369X(2016)05-505-08
2016-04-25
2016-05-27
国家自然科学基金(31400587)、江苏省自然科学基金(BK20160590)、茶树生物学与资源利用国家重点实验室开放基金(SKLTOF20150114)、江苏省农业科技自主创新资金(CX(16)1003)。
杨亦扬,女,博士,副研究员,主要从事茶树生理与营养研究。
jruan@mail.tricaas.com

