小麦Bowman-Birk型蛋白酶抑制因子的克隆表达及其抑制鱼糜凝胶软化的效果研究
李树红,陈 恩,蒋光阳,陈治光,李 冉,杨 娟,钟海霞
(四川农业大学食品学院,四川雅安 625014)
小麦Bowman-Birk型蛋白酶抑制因子的克隆表达及其抑制鱼糜凝胶软化的效果研究
李树红,陈 恩,蒋光阳,陈治光,李 冉,杨 娟,钟海霞
(四川农业大学食品学院,四川雅安 625014)
为探究重组小麦(Triticumturgidum)Bowman-Birk蛋白酶抑制剂(BBI)抑制活性特征及其对鲢鱼肌原纤维蛋白自溶反应的抑制效果,采用TA克隆技术克隆小麦BBI成熟肽基因片段,并对原核表达的小麦BBI蛋白进行镍亲和层析纯化,利用SDS-PAGE、TSK-GEL G2000SWxl高效液相色谱检测诱导及纯化效果。在测定重组小麦BBI对胰蛋白酶的抑制活性的基础上,进一步通过SDS-PAGE分析了重组BBI对鲢鱼肌原纤维蛋白自溶反应的抑制作用。结果表明,经双酶切鉴定证实成功获得了BBI成熟肽基因片段,该基因与野生二粒小麦BBI相关基因(GenBank登录号EU346892.1)序列相似性为99.63%。目的蛋白在SDS-PAGE及TSK-GEL G2000SWxl高效液相色谱分析中,分别表现为单一带和单一峰,产物得到有效纯化,分子量约10.5 kD。该重组小麦BBI对胰蛋白酶有明显的抑制活性。添加量5 μg·mg-1重组BBI可显著抑制鲢鱼肌原纤维蛋白(尤其是肌球蛋白重链)在pH 7.5,50 ℃下的自溶。
小麦BBI;克隆表达;纯化;抑制活性;鱼糜凝胶软化
丝氨酸蛋白酶抑制剂(Serine Protease Inhibitor, SPI)作为主要的生物蛋白酶抑制剂之一,对调节蛋白酶活性和蛋白质代谢具有重要作用。根据抑制剂的氨基酸排列顺序、拓朴学性质及结合机制,可将丝氨酸蛋白酶抑制因子超家族分为16个家族[1]。植物中已发现的7个家族,主要以Bowman-Birk家族、Serpin家族、Kunitz家族研究最多[1]。
Bowman-Birk型蛋白酶抑制因子(BBI)由Bowman于1944年首次从大豆中分离,Birk于1961年纯化并定义[2]。双子叶植物如(豇豆[3]、绿豆[4])来源的BBI的共同结构特征是均具有一个结构域,但同时有两个独立的、可与两种不同蛋白酶(胰蛋白酶、胰凝乳蛋白酶)结合的活性中心,因此也被称为双头抑制因子[5-7]。目前对双子叶植物源BBI的克隆表达、结构分析、生理活性等研究较为全面,并且发现其在抗虫[8]、辐射保护[9]、抗肿瘤[10]等领域均有潜在作用。单子叶禾本科植物来源的BBI结构域相对复杂,根据目前已知单子叶植物BBI的抑制活性特征,可基本将其分为2类:第一类主要是抑制胰蛋白酶,这类抑制剂一般含有1~3个序列高度相似的结构域[11-15];第二类为只有一个结构域的WIP1(Wound-induced protein)蛋白[16-18],其N端具有保守的抑制反应位点。
目前对禾本科单子叶植物水稻、玉米BBI的研究已有报道,但对麦类来源的BBI研究却寥寥无几,对其生物学性质、生理功能及可能的应用前景了解甚微。目前仅有对大麦(HordeumvulgareL.)BBI晶体结构的报道[19],阐明了16 kD单子叶植物大麦源BBI的三维结构。此外,对栽培品种小麦(SR3)中一耐盐相关基因进行了克隆,并根据基因结构,推测其为一类BBI[20]。但是对该抑制剂蛋白的纯化、分子量、活性特征等未进行系统研究。目前对麦类来源BBI除探索其在作物病害防治领域[21-22]的潜在作用外,未见其在食品领域的应用。
鲢鱼(Hypophthalmihthysmolitrix)是我国的重要淡水经济鱼种,年产量达385.09万t,居全国淡水养殖的第二位[23]。鲢鱼价格低廉,且肉色洁白,因此开发具有高附加值的鱼糜制品前景较好。然而鲢鱼鱼糜容易发生热诱导的鱼糜凝胶软化[24-25]。目前研究表明,软化主要是由肌原纤维结合的丝氨酸蛋白酶(MBSP)[26]和内源半胱氨酸组织蛋白酶 B、L、L-like、H[27]水解鱼糜蛋白的肌球蛋白重链(MHC)等肌原纤维蛋白导致的。
本课题组已经报道了小分子半胱氨酸蛋白酶抑制因子(CPIs)可显著抑制半胱氨酸蛋白酶引起的肌球蛋白的降解、抑制鲢鱼自身鱼糜的凝胶软化[28]。蒋欣静[6]、张 宾[29]、Sun L C[30]等也报道了双子叶植物大豆、绿豆源BBI对MBSP活性有抑制作用,推测其可用于鱼糜制品凝胶弹性品质改良。但对单子叶植物麦类来源的BBI防止鱼糜结构蛋白水解及鱼糜凝胶软化方面的研究尚未见报道。
为此,本研究在克隆、原核表达小麦BBI的基础上,进一步对层析纯化的重组小麦BBI的活性特征进行分析,探讨其对鲢鱼肌原纤维蛋白自溶的抑制作用,为深入研究麦类来源BBI的性质及其对鲢鱼鱼糜制品弹性品质的改良效应提供理论和试验基础。
1 材料与方法
1.1材 料
小麦(人工合成六倍体SHW-L1)BBI的cDNA、表达质粒pET-30a、感受态大肠杆菌E.coliDH5α、感受态大肠杆菌E.coliBL21(DE3) 均由四川农业大学小麦研究所提供。
1.2试验方法
1.2.1BBI基因特异性引物的设计
根据野生二粒小麦(Triticumdicoccoidessubsp.)中可能与损伤诱导(wound-induced)相关的BBI基因序列(GenBank登录号:EU346892.1)设计小麦BBI成熟肽基因引物,上游引物为:5′-GGAATTCCATATGAAGAGCACCAAGCT-3′,下划线部分为NdeⅠ酶切位点;下游引物为:5′-CCGCTCGAGGTGCTTTTTGCATGGC-3′,下划线部分为XhoⅠ酶切位点。
1.2.2BBI基因分子克隆
以小麦(人工合成六倍体SHW-L1)BBI的cDNA为模板,利用BBI引物进行PCR扩增(94 ℃预变性5 min;94 ℃变性1 min,61 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸5 min);1.2%的琼脂糖电泳。将纯化回收的目的基因连接至载体pMD19-T,得到重组质粒BBI-pMD19-T;将其转化至感受态E.coliDH5α,经蓝白斑筛选和NdeⅠ/XhoⅠ双酶切鉴定,将阳性克隆送Invitergen生物公司进行测序(以T7引物扩增、双向全长测序)。
1.2.3表达载体BBI-pET-30a的构建及重组菌的表达
重组质粒BBI-pMD19-T和pET-30a分别经双酶切后,回收目的基因片段和载体片段,16 ℃连接16 h。将连接产物转化至感受态E.coliBL21,以BBI成熟肽引物进行PCR检测和双酶切鉴定。
将成功转入BBI-pET-30a的E.coliBL21(DE3)重组菌株37 ℃培养,当OD600为0.6时,加入终浓度为1 mmol·L-1的IPTG(异丙基硫代半乳糖苷),37 ℃分别诱导培养0、1、2、3、4 h;离心收集菌体,经洗涤液洗涤、离心后,1 mg菌体加入3 mL裂解液,重悬沉淀;反复冻融3次,1 mg菌体加入1 mL溶菌酶(100 mg·mL-1),37 ℃反应30 min;超声破碎菌体,8 000 r·min-1离心10 min,收集上清液用于纯化、鉴定。
1.2.4重组小麦BBI的纯化和鉴定
将1.2.3中的上清液分别经截留分子量为30 kD和3 kD的超滤膜进行浓缩(4 ℃),收集3~30 kD蛋白液,经镍亲和层析纯化、回收目的蛋白,SDS-PAGE[31]鉴定重组BBI的诱导及纯化效果。通过TSK G2000 SWxl凝胶柱高效液相层析对重组BBI进行纯度鉴定。
1.2.5重组小麦BBI对胰蛋白酶的抑制活性测定
参照Schwert等[32]的方法略作修改。以1 mmol·L-1的对甲苯磺酰-L-精氨酸甲酯(TAME)为底物,在25 ℃下,247 nm处连续扫描测定胰蛋白酶酶反应和重组小麦BBI的抑制反应的紫外吸光值。计算ΔA247/min,求得酶反应速度。调节BBI加量范围,测定该加量范围内的残余酶活百分比。
1.2.6重组BBI对鲢鱼肌原纤维蛋白自溶反应的抑制作用分析
鲢鱼肌原纤维蛋白的制备参考Aranishi等[33]的方法。取一定量的肌原纤维蛋白沉淀,按1∶2.5的比例悬浮于100 mmol·L-1的磷酸盐缓冲液(pH 7.5)中,按1 mg鲢鱼肌原纤维蛋白添加5 μg重组BBI(对照组不加),于50 ℃进行自溶反应。分别于反应0、0.5、1、3、6、9、12和24 h后从对照组和试验组中取样10 μL,与等体积的终止液(2% SDS,8 mol·L-1脲,5% β-巯基乙醇,0.005%溴酚蓝,20 甘油,62.5 mmol·L-1pH 6.8 Tris-HCl)混合,煮沸5 min,作为电泳样品,SDS-PAGE电泳采用12%的分离胶。
2 结果与分析
2.1小麦BBI基因的扩增结果
小麦BBI基因的PCR扩增产物经过1.2%琼脂糖凝胶电泳成像后,结果如图1所示,在270 bp左右可以看到与预期片段大小一致的清晰目的条带。
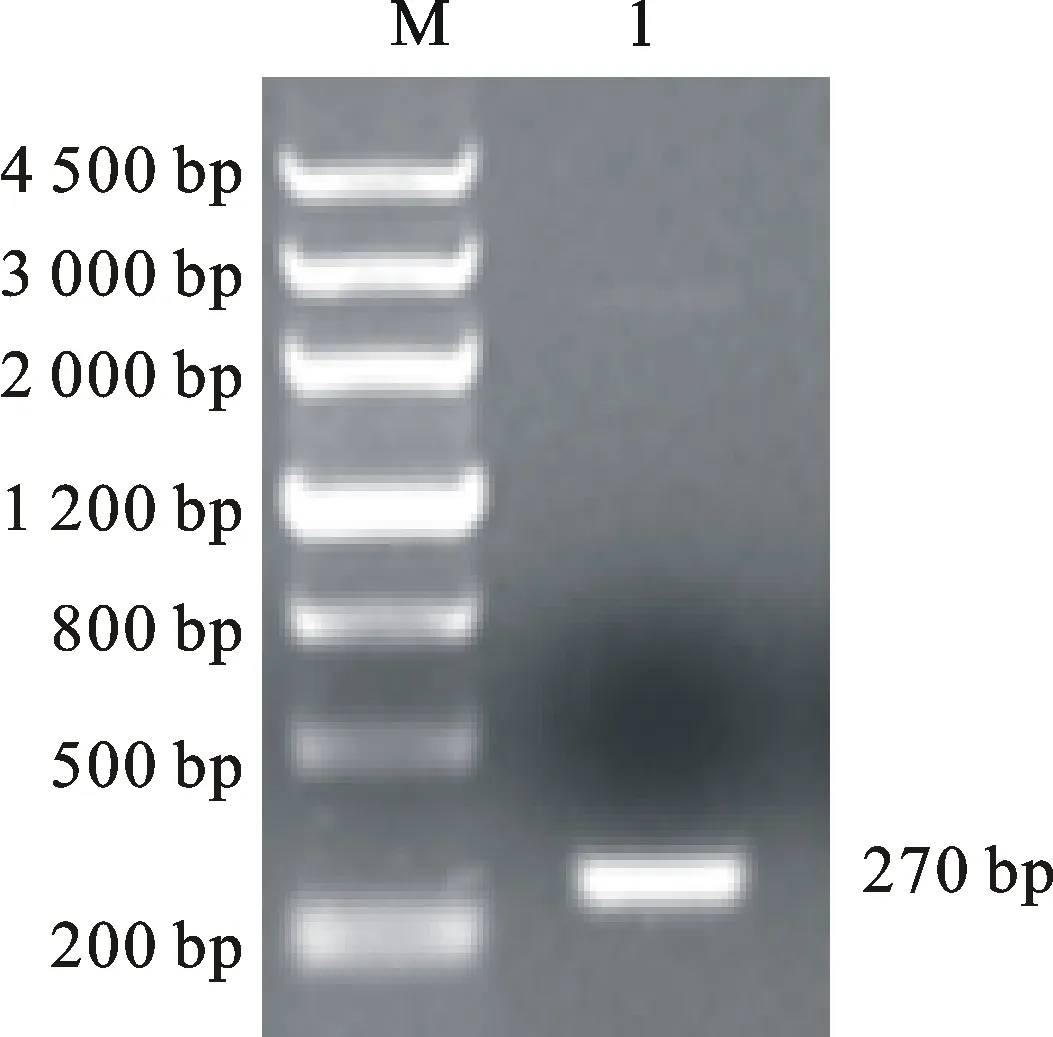
M:DNA分子量标准;1:小麦BBI cDNA的扩增产物。
M:DNA Marker;1:Wheat BBI cDNA amplification.
图1小麦BBI cDNA PCR扩增图
Fig.1Electrophoresis results of PCR amplification of wheat BBI cDNA
2.2小麦BBI基因的克隆及测序结果
采用DNAman 8.0软件分析目的基因的序列,并推导其氨基酸序列,结果如图2。克隆得到的BBI基因序列长270 bp,编码90个氨基酸,推测分子量约为9.6 kD,等电点为8.75。该基因序列与野生二粒小麦WIP1型BBI(Genebank登录号:EU346892.1)基因序列相似性为99.63%,推测的氨基酸序列相似性为100%。
与其他常见单子叶或双子叶植物源BBI相关基因的编码氨基酸序列比对,本试验所得基因编码序列与二棱型啤酒大麦(Hordeumvulgaresubsp. vulgare,GenBank登录号AK375535.1)BBI的氨基酸序列相似性最高,为97.78%;与面包小麦(Triticumaestivum)铝胁迫诱导基因 wail3(GenBank登录号L11881.1)、 wail5(GenBank登录号L11882.1)和 wail6(GenBank登录号L28009.1)编码的氨基酸序列(WIP1型蛋白)相似性分别为65.56%、87.78%、65.56%;与水稻(Oryzasativa, GenBank登录号U76004.1)BBI氨基酸的相似性为42.31%;与玉米(Zeamays, GenBank登录号NM001112240.1)WIP1型BBI有34.29%的氨基酸序列一致。与大豆(Glycinemax, GenBank登录号NM001251618.1)及绿豆(Vignaradiata, GenBank登录号GU121097.1)BBI氨基酸序列的相似性仅分别为22.00%、18.56%(图3)。可见其与小麦类WIP1型BBI的序列相似性很高,推测为小麦WIP1型BBI。
由小麦BBI的 cDNA序列推测的氨基酸序列中含有大量位置保守的半胱氨酸(Cys)残基,分别为Cys32、Cys33、Cys36、Cys45、Cys52、Cys56、Cys59、Cys72、Cys83和Cys87,推测其可形成5个链内二硫键。
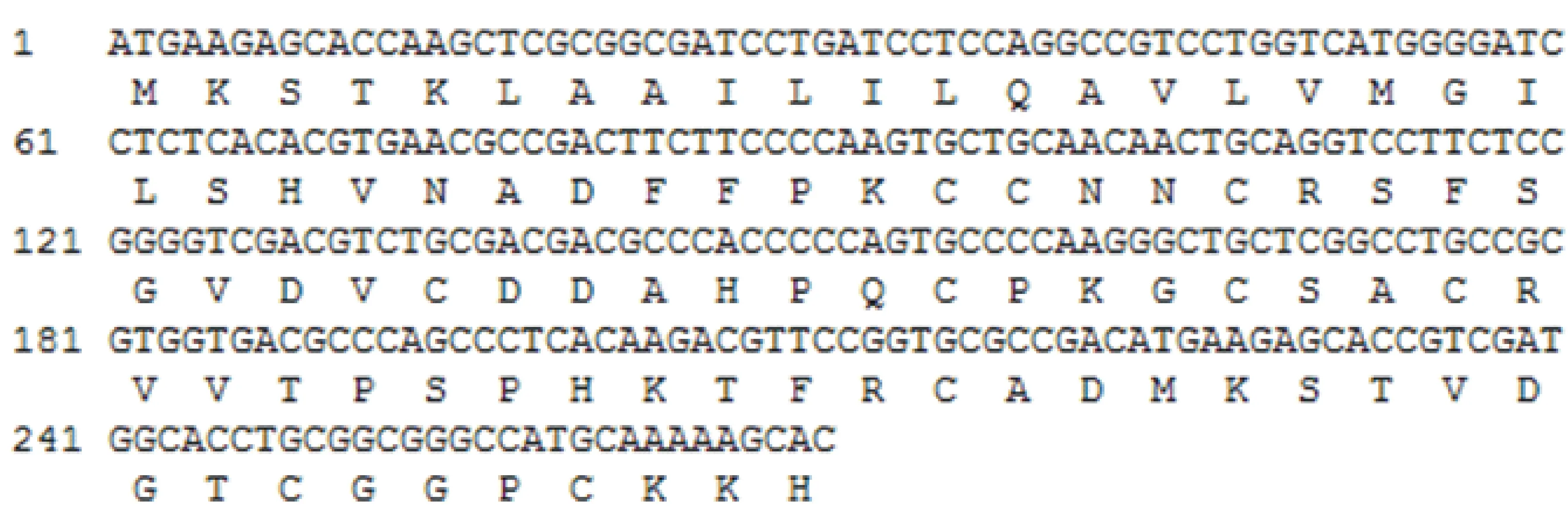
图2 小麦BBI的基因序列和推测的氨基酸序列

黑色阴影背景表示相同的氨基酸残基,灰色阴影背景表示相似的氨基酸残基; *表示推导的活性中心。
Identical amino acid residues are darkly shaded, and similar amino acids are lightly shaded;The active sites are marked by asterisk*.
图3小麦BBI基因推导的氨基酸序列与其他植物源BBI的类比分析
Fig.3Multiple alignment of amino acid sequences derived from sequences of BBI of wheat and other plant
2.3表达载体BBI-pET-30a的构建及BBI的表达纯化
由图4可知,与未经诱导相比,IPTG诱导4 h后转入BBI-pET-30a的重组菌株E.coliBL21在10.5 kD处条带明显,说明在本试验条件下,诱导4h目标基因的表达量最大。对诱导4h的菌体进行超声破碎,其上清液经过超滤浓缩及镍柱层析纯化后,取层析吸附部分进行SDS-PAGE电泳检测(图5)及高效液相检测(图6)。镍亲和层析吸附部分在电泳图上呈现10.5 kD的单一条带;其进一步经TSK-GEL G2000SWxl高效液相色谱检测,在保留时间25.68 min处出现单一蛋白峰。
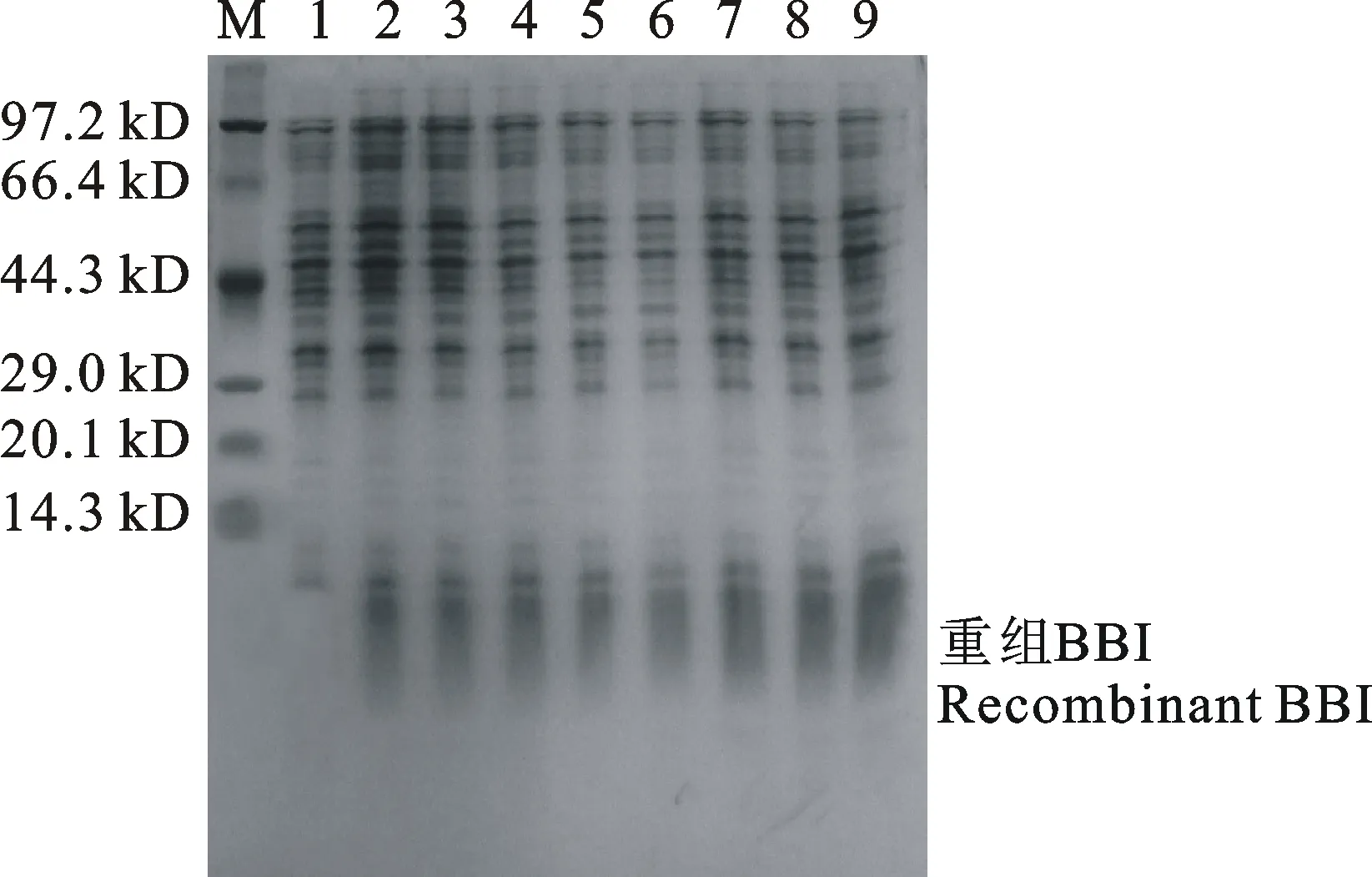
M:Marker; 1:BBI重组菌诱导0 h; 2、3:BBI重组菌诱导1 h; 4、5:BBI重组菌诱导2 h; 6、7:BBI重组菌诱导3 h; 8、9:BBI重组菌诱导4 h。
M:Marker; 1:Recombinant BBI induced for 0 h; 2 and 3:Recombinant BBI induced for 1h; 4 and 5:Recombinant BBI induced for 2 h; 6 and 7:Recombinant BBI induced for 3 h; 8 and 9:Recombinant BBI induced for 4 h.
图4不同诱导时间重组BBI的SDS-PAGE鉴定结果
Fig.4Detection of expressed BBI at different
induced time by SDS-PAGE
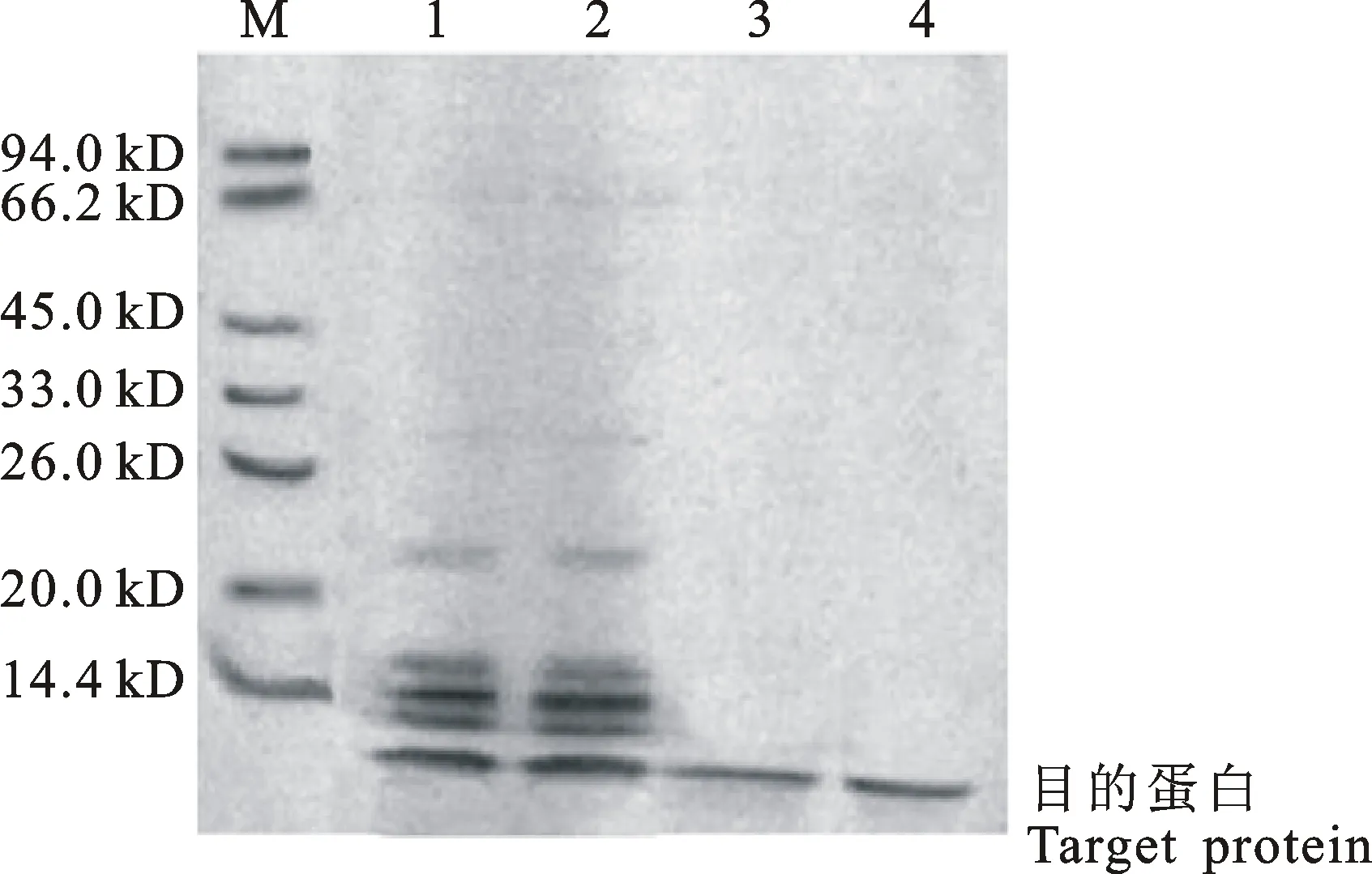
M:Marker; 1、2:菌体破碎后3~30 kD超滤液; 3、4:3~30 kD超滤液镍亲和层析吸附部分。
M:Marker; 1 and 2:BBI extract by 3-30 kD ultrafiltration after breaking down the recombinedE.coli; 3 and 4:BBI extract by Ni2+-NTA agarose affinity after 3-30 kD ultrafiltration.
图5BBI纯化后的SDS-PAGE鉴定结果
Fig.5Detection of purified BBI by SDS-PAGE
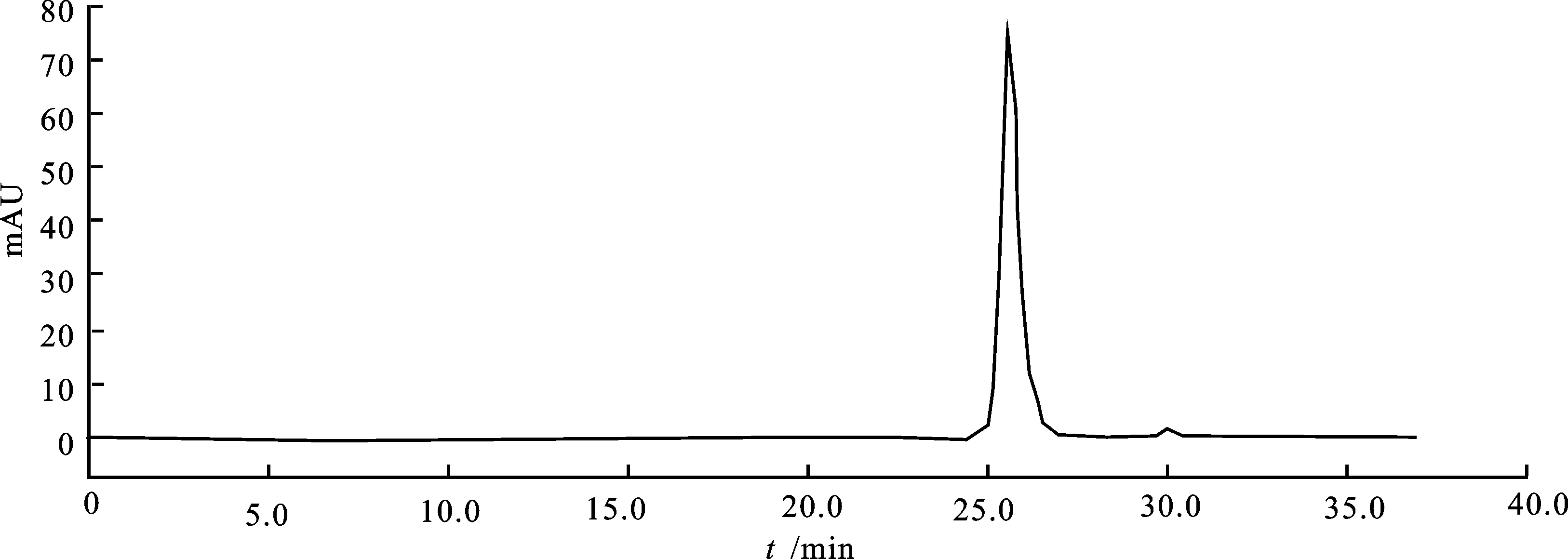
图6 重组小麦BBI层析吸附样的TSK-GEL G2000SWxl凝胶高效液相层析
2.4重组小麦BBI对胰蛋白酶的抑制活性
重组小麦BBI对胰蛋白酶的活性有明显抑制作用,随着小麦BBI加入量的增大,胰蛋白酶活性逐渐下降(图7)。
2.5重组BBI对鲢鱼肌原纤维蛋白自溶反应的抑制作用
本试验制备的鲢鱼背肌肌原纤维蛋白质浓度为4.6 mg·mL-1。205 kD处为肌球蛋白重链(MHC)。
向鲢鱼肌原纤维蛋白溶液中添加5 μg·mg-1重组BBI后,肌原纤维蛋白自溶结果见图8。 由图8B可知,对照组自溶0.5 h后,形成鱼糜凝胶结构的主要蛋白―肌球蛋白重链(MHC)已开始自溶,12h后MHC分解十分显著,24 h后MHC消失殆尽。在重组BBI存在下(图8A),即使自溶反应3 h后,MHC的分解也不明显;自溶12 h后才发生比较明显的水解,但相对对照组而言,这种水解很轻微。表明重组BBI能够十分有效地抑制肌原纤维蛋白中MHC的自溶。
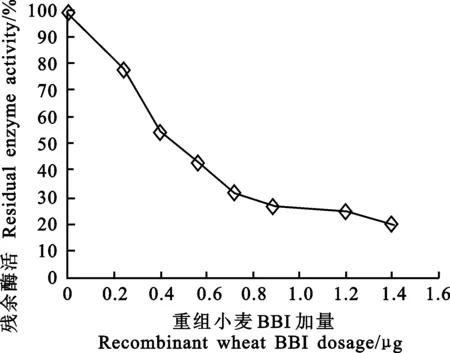
图7 重组小麦BBI对胰蛋白酶的抑制活性
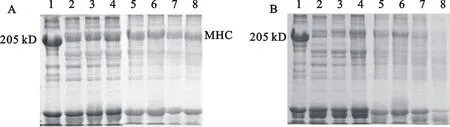
1:自溶0 h;2:自溶0.5 h;3:自溶1 h;4:自溶3 h;5:自溶6 h;6:自溶9 h;7:自溶12 h;8:自溶24 h。
1:Autolysis for 0 h; 2:Autolysis for 0.5 h;3:Autolysis for 1 h; 4:Autolysis for 3 h; 5:Autolysis for 6 h; 6:Autolysis for 9 h; 7:Autolysis for 12 h; 8:Autolysis for 24 h.
图8有(A)、无(B)重组BBI的鲢鱼肌原纤维蛋白自溶SDS-电泳图
Fig.8SDS-PAGE of silver carp myofibrillar protein autolysis with(A) and without(B) recombinant BBI
3 讨 论
本研究以cDNA为模板,成功克隆了小麦(人工合成六倍体SHW-L1)BBI基因,该小麦BBI序列中含有大量的半胱氨酸残基Cys,可形成5个链内二硫键。由其中两对二硫键分别各自连接9个氨基酸残基构成的环形结域,形成了BBI蛋白酶抑制剂家族的双头抑制区[10]。通过序列比对,发现其与单子叶植物BBI氨基酸序列具有很高相似性,与野生二粒小麦(Genebank登录号EU346892.1)、二棱型啤酒大麦(GenBank登录号AK375535.1)及面包小麦铝胁迫诱导基因 wail5(GenBank登录号L11882.1)BBI的氨基酸序列相似性最高,分别为100%、97.78%和87.78%。序列的分子量和结构特征与其他多种单子叶植物源单结构域BBI保持一致,表明该小麦基因可能属于WIP1型的BBI类蛋白。
单子叶植物BBI和双子叶植物BBI的结构存在较大区别。大多数双子叶植物的BBIs含有14个保守的半胱氨酸残基和7对二硫键(C1-C14,C2-C6,C3-C13,C4-C5,C7-C9,C8-C12,C10-C11);而来源于单子叶植物分子量为8 kD的WIP1型BBI在进化过程中可能会丢失2个(C10、C11)或4个(C3、C10、C11、C13或C4、C5、C10、C11)半胱氨酸残基[12]。本研究克隆的小麦BBI与此相似,即与双子叶植物BBI相比,丢失了4个半胱氨酸残基,含有10个半胱氨酸残基,能形成5对二硫键。
双子叶植物BBI的特征是一个结构域,包含2个结合不同丝氨酸蛋白酶的活性位点,如大豆(Genebank登录号:NM001251618.1)的BBI,一个在Lys16-Ser17可以和胰蛋白酶结合,另一个在Leu44-Ser45可与胰凝乳蛋白酶结合[34]。目前对小麦源BBI研究较少,之前报道的面包小麦铝胁迫诱导基因 wail3、wail5和 wail6编码蛋白的第一个活性中心可能为Phe39-Ser40,第二个活性中心可能位于Pro64-Ser65[35]。玉米WIP1型损伤诱导基因编码蛋白的第一个活性中心可能为Phe54-Ser55,第二个活性中心可能位于Tyr82-Ser83[17]。因此,推测本研究克隆的小麦BBI可能有两个活性中心,分别在Phe39-Ser40、Pro64-Ser65。
也有研究认为单子叶植物BBI只有一个抑制活性中心,其结构域与双子叶BBI最大的构象差别在于每个结构域C端的回环,该回环在双子叶BBI中对应胰凝乳蛋白酶抑制反应回环,而由于单子叶BBI的回环附近少了一对类似双子叶中的二硫键的约束,导致其构象变得很松散,影响其结合或抑制任何蛋白酶[19]。单子叶栽培品种大麦(HordeumvulgareL.)中纯化的一种BBI蛋白,具有双结构域,每个结构域只具有一个活性中心,且两个活性中心Arg17和Arg76,都仅抑制胰蛋白酶[19]。本研究克隆的小麦BBI对胰蛋白酶具有明显抑制活性,其仅有N端的一个活性中心具有抑制作用还是两个活性中心都具有抑制相同酶活性的作用,还有待进一步研究。
对重组小麦BBI进行原核表达和纯化后,经TSK-GEL G2000SWxl凝胶高效液相层析检测,在保留时间25.68 min左右处出现单一活性蛋白峰。经SDS-PAGE分析,显示该肽段分子量为10.5 kD,与预测分子量9.6 kD接近。活性测定分析表明,纯化的重组BBI明显抑制了典型丝氨酸蛋白酶—胰蛋白酶的活性,说明该蛋白对丝氨酸蛋白酶具有抑制作用。
通过比较重组小麦BBI的氨基酸同源性、保守序列与活性中心位置以及其对丝氨酸蛋白酶活性的抑制作用,将其归类为WIP1型的BBI。
肌原纤维蛋白中的MHC是鱼糜蛋白的主要成分。鱼糜加热凝胶化过程中,MHC发生有序交联形成三维网络结构是形成鱼糜凝胶制品弹性品质的重要条件[36]。鲢鱼鱼糜适宜凝胶化的pH条件为pH 7.5,在加热过程中容易发生凝胶软化的温度为50 ℃[24-25],此条件下,添加足量纯化的重组BBI后,相对于对照,鲢鱼肌原纤维蛋白中MHC的自溶得到显著抑制,说明有丝氨酸蛋白酶参与了鲢鱼MHC的自溶。
本研究报道的重组BBI能够有效抑制鲢鱼MHC的自溶,推测其在抑制鱼糜制品凝胶软化方面也将具有重要意义。研究结果可为探索小麦来源BBI生物活性及其进一步在鱼糜制品中的应用奠定必要的理论基础和试验方法。
[1]BODE W,HUBER R.Natural protein proteinase inhibitors and their interaction with proteinases [J].EuropeanJournalofBiochemistry,1992,2(204):433-451.
[2]BIRK Y.The Bowman-Birk inhibitor.Trypsin-and chymotrypsin-inhibitor from soybeans [J].InternationalJournalofPeptideandProteinResearch,1985,25(2):113-131.
[3]刘春明,朱 祯,周兆斓,等.豇豆胰蛋白酶抑制剂cDNA在大肠杆菌中的克隆与表达[J].生物工程学报,1993,9(2):152-157.
LIU C M,ZHU Z,ZHOU Z L,etal.cDNA cloning and expressing of cowpea trypsin inhibitor inEscherichiacoli [J].ChineseJournalofBiotechnology,1993,9(2):152-157.
[4]QI R F,LIU Z X,XU S Q,etal.Small peptides derived from the Lys active fragment of the mung bean trypsin inhibitor are fully active against trypsin [J].ChineseAcademyofSciences,2010,1:224-232.
[5]张 梅,朱柞铭.丝氨酸蛋白酶抑制剂的研究及应用[J].生物化学与生物物理进展,1996,23(3):240-244.
ZHANG M,ZHU Z M.Study and application of serine proteinase inhibitor [J].ProgressinBiochemistryandBiophysics,1996,23(3):240-244.
[6]蒋欣静,王锡昌,周常义,等.大豆胰蛋白酶抑制剂对鲢丝氨酸蛋白酶的作用[J].水产学报2005,29(4):502-506.
JIANG X J,WANG X C,ZHOU C Y,etal.The inhibitory effect of soybean trypsin inhibitor on an endogenousserine proteinase of silver carp,hypophthalmichthy molitrix [J].JournalofFisheriesofChina,2005,29(4):502-506.
[7]陈 中.酶钝化豆类种子胰蛋白酶抑制子的研究[J].中外食品工业信息,2001(2):20-20.
CHEN Z.Reseacrh of legumes seeds trypsin inhibitors inactivated by enzyme [J].GlobalFoodIndustryInformation,2001(2):20-20.
[8]BROADWAY R M,DUFFEY S S,BROADWAY R M,etal.Plant proteinase inhibitors:Mechanism of action and effect on the growth and digestive physiology of larvalHeliothiszeaandSpodopteraexiqua[J].JournalofInsectPhysiology,1986,32(10):827-833.
[9]DITTMANN K,LOFFLER H,BAMBERG M,etal.Bowman-Birk proteinase inhibitor(BBI) modulates radiosensitivity and radiation-induced differentiation of human fibroblasts in culture [J].Radiotherapy&Oncology,1995,34(2):137-143.
[10]于颖慧,吴 坤.大豆Bowman-Birk型胰蛋白酶抑制剂(BBI)研究进展[J].中华疾病控制杂志,2005(02):150-153.
YU Y H,WU K.Recent progress on the study of soybean Bowman-Birk trypsin inhibitor [J].ChineseJournalofDiseaseControlandPrevention,2005(2):150-153.
[11]ODANI S,KOIDE T,ONO T.Wheat germ trypsin inhibitors.isolation and structural characterization of single-headed and double-headed inhibitors of the Bowman-Birk type [J].JournalofBiochemistry,1986,100(4):975-983.
[12]MELLO M O,TANAKA A S,SILVA-FILHO M C.Molecular evolution of Bowman-Birk type proteinase inhibitors in flowering plants [J].MolecularPhylogenetics&Evolution,2003,27(1):103-112.
[13]NAGASUE A,TUKAMACHI H,IKENAGA H,etal.The amino acid sequence of barley rootlet trypsin inhibitor(Biological Chemistry) [J].Agricultural&BiologicalChemistry,1988,52:1505-1514.
[14]PRAKASH B,SELVARAJ S,MURTHY M R,etal.Analysis of the amino acid sequences of plant Bowman-Birk inhibitors [J].JournalofMolecularEvolution,1996,42(5):560-569.
[15]LI J Q,JUN C,MEIHUA L,etal.Molecular cloning and functional analysis of a novel type of Bowman-Birk inhibitor gene family in rice [J].PlantPhysiology,2003,133(2):560-70.[16]ECKELKAMP C,EHMANN B,SCHPFER P.Wound-induced systemic accumulation of a transcript coding for a Bowman-Birk trypsin inhibitor-related protein in maize(ZeamaysL.) seedlings [J].FebsLetters,1993,323(1-2):73-76.
[17]ROHRMEIER T,LEHLE L.WIP1,a wound-inducible gene from maize with homology to Bowman-Birk proteinase inhibitors [J].PlantMolecularBiology,1993,22(22):783-792.
[18]TIFFIN P,GAUT B S.Molecular evolution of the wound-induced serine protease inhibitor wip1 inZeaand related genera [J].MolecularBiology&Evolution,2001,18(11):2092-2101.
[19]SONG H K,KIM Y S,JIN K Y,etal.Crystal structure of a 16 kda double-headed bowman-birk trypsin inhibitor from barley seeds at 1.9 resolution 1 [J].JournalofMolecularBiology,1999,293(5):1133-1144.
[20]LEI S,CUI L L,CHEN F,etal.A Bowman-Birk type protease inhibitor is involved in the tolerance to salt stress in wheat [J].PlantCell&Environment,2008,31(8):1128-1137.
[21]PEKKARINEN A I,COLIN L,JONES B L.Kinetics of the inhibition of fusarium serine proteinases by barley(HordeumvulgareL.) inhibitors [J].JournalofAgricultural&FoodChemistry,2007,55(7):2736-2742.
[22]PEKKARINEN A I,JONES B L.Purification and identification of barley(HordeumvulgareL.) proteins that inhibit the alkaline serine proteinases ofFusariumculmorum[J].JournalofAgricultural&FoodChemistry,2003,51(6):1710-1717.
[23]农业部渔业渔政管理局.2014年中国渔业统计年鉴[M].北京:中国农业出版社,2014:217.
The Ministry of Agriculture Fishery and Fishery Administration.China Fishery Statistics Yearbook 2014 [M].Beijing:China Agriculture Press,2014:217.
[24]YUAN C,FUKUDA Y,KANENIWA M,etal.Comparison of gel-forming properties of silver carp(Hypophthalmichthysmolitrix) surimi prepared in different seasons [J].JournalofFoodScience,2005,5:326-331.
[25]胡新颖,刘 欢,张 楠等.白鲢骨骼肌丝氨酸蛋白酶抑制剂的提取、纯化及其特性[J].中国水产科学,2006,13(2):316-321.
HU X Y,LIU H,ZHANG N,etal.Extraction,purification and properties of a serine proteinase inhibitor from silvercarp(Hypophthalmichthysmolitrix) skeletal muscle [J].JournalofFisherySciencesofChina,2005,5:326-331.
[26]纪 蓉,顾伟钢,张进杰,等.鱼糜凝胶劣化现象相关蛋白水解酶[J].生物技术通讯,2011,22(1):143-148.
JI R,GU W G,ZHANG J J,etal.Proteinases involved in the modori phenomena of surimi[J].LettersinBiotechNology,2011,22(1):143-148.
[27]HO M L,CHEN G H,etal.Effects ofMackerelcathepsinsL and L-like,and calpain on the degradation of mackerel surimi [J].FishersScience,2000,66(3):558-568.
[28]刘 玲,蒋然然,彭海鑫,等.鲢鱼卵中低分子CPIs的纯化鉴定及改善鱼糜凝胶强度的效果研究[J].食品科学,2014,35(13):37-42.
LIU L,JIANG R R,PENG H X,etal.Purification and characterization of low-molecular-weight cysteine proteinase inhibitors(CPIs) from silver carp eggs and their effects on improving gel strength of surimi [J].FoodScience,2014,35(13):37-42.
[29]张 宾,汪东风,邓尚贵.豆类胰蛋白酶抑制剂抗鲢鱼鱼糜凝胶劣化的研究[J].食品工业科技,2012,33(14):107-110.
ZHANG B,WANG D F,DENG S G.Inhibitory effect of soybean trypsin inhibitor on surimimodori of silver carp [J].ScienceandTechnologyofFoodIndustry,2012,33(14):107-110.
[30]SUN L C,YOSHIDA A,CAI Q F,etal.Mung bean trypsin inhibitoris effective in suppressing the degradation of myofibrillar proteins in the skeletal muscle of blue scad(Decapterusmaruadsi)[J].JournalofAgricultural&FoodChemistry,2010,58:12986-12992.
[31]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J].Nature,1970,227(5259):680-685.
[32]SCHWERT G W,TAKENAKA Y.A spectroscopic determination of trypsin and chymotrypsin [J].BiochimicaEtBiophysicaActa,1955,16(4):570-575.
[33]ARANISHI F,OGATA H,HARA K,etal.Susceptibility of opioid peptides and myofibrillar proteins toCarpcathepsinL [J].JournalofAgricultural&FoodChemistry,1998,46:388-392.
[34]王长良,张永忠,孙志刚.Bowman-Birk型大豆胰蛋白酶抑制剂研究进展[J].大豆科学,2007,26(5):757-761.
WANG C L,ZHANG Y Z,SUN Z G.Progress on the research of Bowman-Birk soybean trypsin inhibitor [J].SoybeanScience,2007,26(5):757-761.
[35]RICHARDS K D,SNOWDEN K C,GARDNER R C. Wali6 and wali7 genes induced by aluminum in wheat(TriticumaestivumL.) roots [J].PlantPhysiology,1994,105(4):1455-1456.
[36]王 嵬,仪淑敏,李学鹏,等.鱼糜凝胶的形成机制及混合鱼糜研究进展[J].食品安全质量检测学报,2016,7(1):231-237.
WANG W,YI S M,LI X P,etal.Formation mechanism of surimi gelation and research progress on blend surimi [J].JournalofFoodSafetyandQuality,2016,7(1):231-237.
Cloning, Expression and Purification of Wheat Bowman-Birk Inhibitor and the Inhibitory Effect on Surimi Gel Softening
LI Shuhong,CHEN En,JIANG Guangyang,CHEN Zhiguang,LI Ran,YANG Juan,ZHONG Haixia
(College of Food Science, Sichuan Agricultural University, Ya’an 625014, China)
In order to explore the inhibitory activity and inhibitory effect on autolysis reaction of silver carp myofibrillar protein of recombinant wheat BBI, TA cloning was used to clone BBI gene fragment which encoded mature peptide of wheat. The target protein was purified with Ni2+-NTA agarose affinity chromatography after prokaryotic expression system. SDS-PAGE and HPLC of TSK-GEL G2000SWxl were conducted to examine the purified product. On the basis of inhibitory activity of recombinant BBI to trypsin, SDS-PAGE was conducted to analyze the inhibitory effects of BBI on autolysis reaction of silver carp myofibrillar protein. The results of double enzyme cutting indicated that BBI gene fragment was successfully cloned, which shared the sequence identity of 99.63% with the gene related to BBI of wild emmer (GenBank accession No.EU346892.1). The target protein of wheat BBI was purified highly and performed a single band about 10.5 kD and a sharp peak respectively on SDS-PAGE and HPLC of TSK-GEL G2000SWxl.Activity assay revealed that wheat BBI can inhibit trypsin.The analysis about autolysis reaction of silver carp myofibrillar protein at pH 7.5 and 50 ℃ on SDS-PAGE indicated that the degradation of the major textural protein in surimi, myosin heavy chain, was suppressed significantly by the recombinant inhibitor with the concentration of 5 μg·mg-1.
Wheat BBI; Cloning and expression; Purification; Inhibitory activity; Surimi gel softening
2016-01-28
2016-04-07
四川省科技支撑计划项目(2014NZ0003)
E-mail:lish@sicau.edu.cn(李树红);chen663@foxmail.com(陈 恩,与第一作者同等贡献)
李树红(E-mail:lish@sicau.edu.cn)
S512.1;S312
A
1009-1041(2016)09-1241-08
网络出版时间:2016-08-31
网络出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160831.1651.032.html

