金黄色葡萄球菌肠毒素C3过表达慢病毒载体的构建及鉴定①
谢益欣 王 敏 李先平 杨 敏 李碰玲 张婷婷 宋 欢 董智慧 唐爱国
(中南大学湘雅二医院 检验科,长沙410011)
金黄色葡萄球菌肠毒素C3过表达慢病毒载体的构建及鉴定①
谢益欣王敏李先平杨敏李碰玲张婷婷宋欢②董智慧②唐爱国
(中南大学湘雅二医院 检验科,长沙410011)
目的:构建金黄色葡萄球菌肠毒素C3(SEC3)过表达慢病毒载体并体外检测其表达目的基因。方法:聚合酶链反应(PCR)扩增SEC3基因片段;用AgeI 酶切线性化GV365慢病毒载体,通过连接反应构建GV365-SEC3载体,运用PCR方法鉴定阳性克隆载体;转染293T细胞包装慢病毒,观察细胞荧光及Western blot检测慢病毒载体表达,HIV-1 p24 ELISA法测定慢病毒载体滴度。结果:获得目的基因,并成功构建GV365-SEC3慢病毒载体,通过PCR及DNA测序鉴定,证明GV365-SEC3质粒构建正确;转染293T细胞后可观察到大量荧光细胞,经蛋白电泳得到29 kD大小的蛋白条带,与目的基因蛋白相符合,ELISA检测病毒载体滴度为5×108TU/ml。结论:成功构建GV365-SEC3过表达慢病毒载体,为后期研究其体内外对抗肿瘤的作用与机制奠定基础。
金黄色葡萄球菌肠毒素C3;慢病毒;载体构建;过表达
早在上世纪初伯内特提出了免疫监视理论[1],认为机体的免疫系统具有识别、杀伤并及时清除体内突变细胞,防止肿瘤发生的功能。当免疫监视功能过低,无法有效清除突变细胞时,就可能发生肿瘤。肿瘤发生发展的根本原因之一是机体的免疫系统不能对其生长进行有效地控制[2-4]。肿瘤的传统治疗主要依靠手术、放疗和晚期化疗的方式,但疗效并不理想,因此,寻找一种新的抗肿瘤治疗的途径和方法对肿瘤的治疗很有必要。近年来,随着针对免疫节点的单抗在临床抗肿瘤中的成功使用,免疫疗法在肿瘤治疗中备受关注[5],它包括非特异性免疫刺激剂、肿瘤疫苗、过继性免疫细胞疗法以及单抗治疗等[6]。金黄色葡萄球菌肠毒素C(Staphylococc-us aureus enterotoxin,SEC)作为超抗原,可以多克隆活化T细胞,诱发强烈的细胞免疫应答[7,8],是一种很好的免疫调节剂和细胞因子诱导剂,已成为抗肿瘤治疗的一个重要方向。90年代以来,肿瘤治疗的另一个热点基因治疗(Gene therapy)正逐步从实验室进入临床,到2012年全世界完成了超过1 800个临床试验,因此认为基因治疗的核心概念是有用的,基因植入病人能安全的表达[9]。由于肿瘤是多基因、多因素导致的复杂疾病,单一因子或单一机制的疗法对肿瘤的效果往往有限,若将两者结合,通过持续大量地激活自身免疫细胞对肿瘤细胞进行有效杀伤成为极具潜力的抗肿瘤方法。本研究我们利用基因工程技术构建过表达SEC3基因的慢病毒载体,并进行体外转染及鉴定,以期为进一步研究其生物学功能提供依据,并为后期研究其体内外对抗肿瘤的作用与机制奠定基础。
1 材料与方法
1.1主要试剂和仪器SEC3原核表达质粒为本室保存,慢病毒工具质粒载体GV365、病毒包装辅助质粒(Helper 1.0和Helper 2.0)、293T细胞、大肠杆菌菌株DH5α购自上海吉凯基因有限公司,Primer均购自上海捷瑞公司,ClonExpressTMⅡ One Step Cloning Kit购自Vazyme公司,Taq polymerase购自SinoBio公司,限制性内切酶购自NEB公司,Plasmid 抽提 Kit购自Promega公司,胎牛血清FBS和DMEM均购自Gibco,胰酶购自上海化学试剂公司,Opti-MEM购自Invitrogen,Prestained protein marker购自中晶公司,ECL-PLUS/Kit购自Amersham公司,HIV-1 p24 antigen 和ELISA 试剂盒均购自北京达科为生物技术有限公司,PCR仪购自Applied Biosystem公司,DNA电泳仪购自BioRad公司,凝胶成像仪购自天能公司,超声破碎仪购自上海豫明仪器公司,荧光显微镜为奥林巴斯公司产品。
1.2方法
1.2.1SEC3过表达慢病毒载体的构建
1.2.1.1目的基因的获取设计基因引物如下:上游:5′-GAGGATCCCCGGGTACCGGTCGCCACCATG-GAGAGTCAACCAGACCCTATGCCAGATG-3′;下游:5′-TCCTTGTAGTCCATACCTCCATTCTTTGTTGTAA-GGTG-3′(单划线示:交换配对碱基及酶切位点,双划线示:表达增强序列以及目的基因5′端部分序列用于钓取目的基因)。PCR扩增钓取SEC3原核表达质粒的目的基因片段。
1.2.1.2GV365-SEC3载体的构建冰水浴中配置反应如下体系:PCR产物片段1 μl,经AgeⅠ/AgeⅠ酶切的线性化GV365载体2.5 μl,ddH2O 3.5 μl,5×CE Ⅱ Buffer 2 μl,ExnaseTMⅡ 1 μl共10 μl。于37℃反应30 min,随后置于冰水浴中冷却5 min,将交换产物加入到100 μl感受态细胞中,冰上放置30 min,42℃热激90 s,冰水孵育2 min,加入500 μl LB培养基后,于37℃摇床振荡培养1 h。取适量菌液均匀涂布在含有相应抗生素的平板上,在恒温培养箱中倒置培养12~16 h。
1.2.2GV365-SEC3载体的鉴定在平板上挑出其中8个菌落做PCR,鉴定引物为Ubi-F:GGGTCAATATGTAATTTTCAGTG,FLAG-R-2:CCTTATAGTCCTTATCATCGTC,阳性对照为GAPDH内参基因,阴性对照以未插入目的基因的空载体为模板,凝胶电泳检测扩增产物。挑取克隆阳性产物测序,与目的基因序列进行比对分析。最后将测序正确的菌液进行质粒抽提。
1.2.3GV365-SEC3慢病毒载体的包装与检测
1.2.3.1GV365-SEC3载体的转染以DMEM培养基(含10% 胎牛血清)调整293T细胞密度约5×106细胞/15 ml,接种于10 cm细胞培养皿,37 ℃、5%CO2培养箱内培养24 h,待细胞密度达70%~80%时即可用于转染。向一灭菌离心管中加入所制备的各DNA溶液(GV载体质粒20 μg、pHelper 1.0载体质粒15 μg、pHelper 2.0载体质粒10 μg),与相应体积的吉凯转染试剂混合均匀,调整总体积为1 ml,在室温下温育15 min。将混合液缓慢滴加至293T细胞的培养液中,混匀,于37℃、5%CO2细胞培养箱中培养。培养6 h后弃去培养基,并用PBS液洗涤,缓慢加入含10%血清的细胞培养基20 ml,于37℃、含5% CO2培养箱内继续培养。转染24 h后,在荧光显微镜下观察质粒上荧光标记基因的表达情况以判断感染效率,转染36 h后收集细胞进行Western blot检测。
1.2.3.2Western blot检测慢病毒载体表达取出293T细胞,弃去细胞培养液,PBS 洗涤2 次将细胞裂解,离心,超声破碎仪破碎细胞(200 W 共4次,每次5 s,间隔2 s),于4℃、12 000 r/min离心15 min后取上清,测蛋白浓度,每个样品蛋白终浓度均调整为20 μg,用10%分离胶,5%浓缩胶进行SDS-PAGE电泳,80 V 2 h后在 4℃,400 mA 恒流条件下电转120 min,将蛋白转移到PVDF 膜上,最后行ECL免疫显色,X光显影。
1.2.3.3HIV-1 p24ELISA法测定慢病毒载体滴度准备一块24孔板,将浓缩纯化的病毒液稀释105~107倍,将标准品按125、31.3、15.6、7.8 pg/ml,空白孔5个浓度稀释,各取200 μl加入24孔板中,封板膜密封微孔板,37℃静置1.5 h。350 μl Wash Buffer清洗微孔板4遍,每孔加入100 μl HIV-1 P24检测抗体(对照孔除外),封板后37℃静止1 h,吸弃HIV-1 P24 检测抗体,重复上述洗板过程,每孔加入100 μl底物,无需密封,室温避光放置30 min,每孔加入100 μl终止液终止反应,15 min内,使用酶标仪测定A450,制作标准曲线,得到待测病毒滴度。
2 结果
2.1成功构建GV365-SEC3重组载体获取目的基因,PCR后电泳得到765 bp长度的条带 。通过连接反应成功构建GV365-SEC3重组载体后,用鉴定引物PCR结果表明Gene1-8号转化子除Gene3号为阴性克隆外,其余7个转化子均为阳性克隆(大小为960 bp),电泳图见图1,将阳性转化子进行测序及比对验证,测序结果与目的基因序列完全一样。
2.2包装及制备慢病毒GV365-SEC3GV365-SEC3 重组载体、 pHelper 1.0及pHelper 2.0载体质粒体系共同转染293T细胞后,荧光显微镜下可观察到细胞内可见明显的GFP表达绿色荧光,见图2,说明目的质粒基因成功转染到293T细胞并且表达正常。Western blot电泳图见图3,可以观察到29 kD附近处有特征条带,其大小和目的基因融合蛋白相吻合。

图1 GV365-SEC3载体的酶切鉴定图Fig.1 Restriction map of GV365-SEC3 vectorNote: 1.Negative control(ddH2O);2.Negative control(empty vector interconnection);3.Positive control(GAPDH);4.Marker;5-12.Gene 1 to 8 transformants.

图2 GV365-SEC3载体转染293T细胞,绿色荧光与白光对照图(×100)Fig.2 Green fluorescence picture and white light picture of transfected 293T cell by GV365-SEC3 vector(×100)Note: A.White light picture;B.Green fluorescence picture.

图3 纯化的SEC3蛋白电泳图Fig.3 Electrophoretic profile of SEC3 purified proteinNote: 1.Marker SM0441;2.Positive control(WB standard:SURVIVIN-3FLAG-GFP,Molecular weight 48 kD);3.Negative control(293T cell);4.Target gene transfected 293T cells.
表1标准品及待测组吸光度值
Tab.1Absorbance value of standard and test viru groups
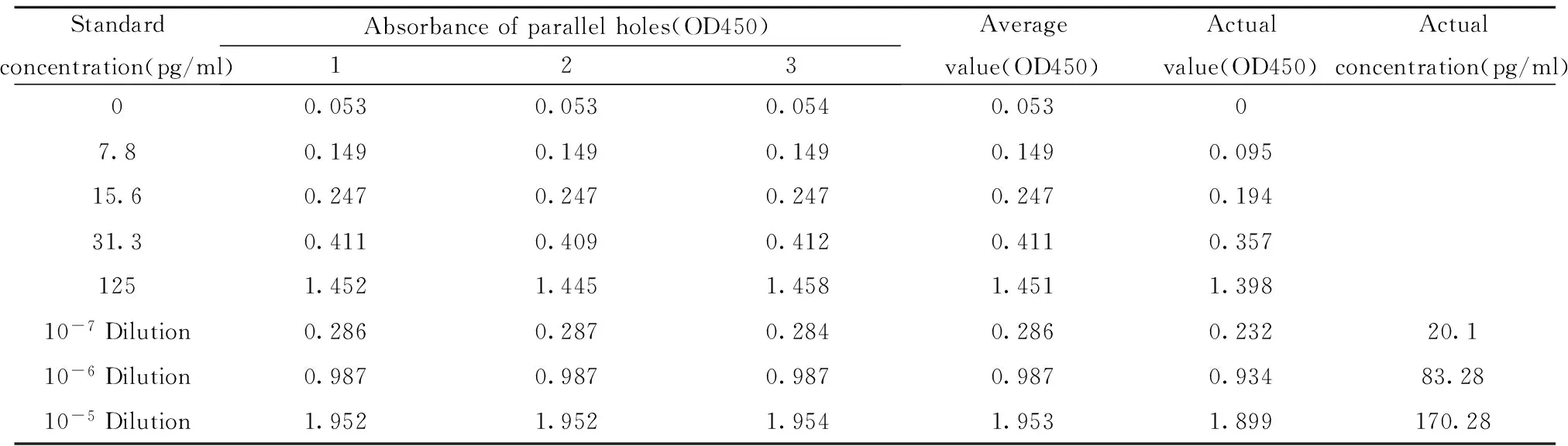
Standardconcentration(pg/ml)Absorbanceofparallelholes(OD450)123Averagevalue(OD450)Actualvalue(OD450)Actualconcentration(pg/ml)00.0530.0530.0540.05307.80.1490.1490.1490.1490.09515.60.2470.2470.2470.2470.19431.30.4110.4090.4120.4110.3571251.4521.4451.4581.4511.39810-7Dilution0.2860.2870.2840.2860.23220.110-6Dilution0.9870.9870.9870.9870.93483.2810-5Dilution1.9521.9521.9541.9531.899170.28

图4 GV365-SEC3的ELISA标准曲线Fig.4 ELISA standard curve of GV365-SEC3
2.3慢病毒载体滴度的检测用酶标仪测定A450对慢病毒滴度进行定量分析,得各组吸光度测定值见表1,制作标准曲线如图4,GV365-SEC3样品为10-7稀释度时OD值为0.232,10-6稀释度时OD值为0.934,10-5稀释度时OD值为1.899,根据标准曲线以及ELISA试剂盒的病毒浓度与滴度的换算关系1 TU/ml=1 pg/ml,所得的病毒滴度为5×108TU/ml。
3 讨论
据2012年全球肿瘤流行病统计数据(GLOBO-CAN2012)显示:2012年全球新增约1 410万例癌症病例,癌症死亡人数达820万,较2008年增加。且全球一半以上癌症新增病例和死亡人数发生在欠发达地区(http://globocan.iarc.fr/Defau-lt.aspx)。我国肿瘤登记中心也进行了最新的分析,数据显示2012年全国新发肿瘤病例约358.6万例,死亡病例218.7万例,均有增加趋势[10],可见肿瘤是中国人口死亡的最主要原因,也已然成为全球主要的公共卫生问题。
对于肿瘤的治疗主要依靠手术、放疗及化疗三大传统治疗措施,但这些治疗方法不良反应较多、效果欠佳。因此,努力寻找一种新型的肿瘤治疗方法很有必要。
近年来肿瘤生物免疫治疗如雨后春笋般蓬勃发展,2013年度Science杂志评选出的10大科技突破,居首位的也是“肿瘤免疫治疗”[11]。肿瘤的免疫治疗的靶细胞不是肿瘤细胞和组织,而是通过激发和增强自身的免疫功能,以达到控制和协助杀灭肿瘤细胞的目的。金黄色葡萄球菌肠毒素C3是一种细菌性超抗原,分子量为26~30 kD。它能直接与MHCⅡ类分子及TCR-β链的V区结合,无需抗原提呈细胞提呈便能活化的大量T细胞并分泌的大量细胞因子,对肿瘤细胞具有强大的杀伤作用,有望成为新一代抗肿瘤治疗分子[12]。在我国,金黄色葡萄球菌滤液制剂作为肿瘤放化疗治疗的辅助药物应用于临床已有十余年,它的主要成分就是金黄色葡萄球菌肠毒素C[13]。目前对金黄色葡萄球菌肠毒素的研究主要是SEA、SEB、SEE及SEC2,很少有关于SEC3的研究。本课题组早期首次将SEC3基因克隆到表达质粒内并实现了可溶性表达,并对重组SEC3的生物学活性进行初步研究,结果表明重组SEC3蛋白具有良好促人外周血单个核细胞增殖活性,并能够增强PBMC对肿瘤细胞的杀伤活性[14,15],这说明重组SEC3蛋白具有良好的超抗原活性,可能用于抗肿瘤治疗。
自1989年人类基因治疗临床试验第一次被批准后,基因治疗成为肿瘤治疗的热点,截止到 2014 年 7 月,全球共批准 2 076 项基因治疗方案进入临床试验[16],部分基因治疗的成果还被Science 杂志入选为2009 年度十大突破之一[17]。这些都显示出基因治疗的蓬勃生机以及肿瘤基因治疗在临床治疗的安全性。单纯由体外表达的SEC3蛋白活化的T细胞有限且作用短暂,不能持久的对抗肿瘤细胞。若将SEC3目的基因整合到靶细胞内,利用靶细胞实现SEC3蛋白持续表达,不仅能活化大量T细胞产生细胞毒作用,并且能提高肿瘤细胞的免疫原性,达到抗肿瘤作用。本研究选用慢病毒作为基因治疗载体,慢病毒是逆转录病毒的一种,可以感染分裂期细胞和非分裂期的细胞,相比于传统的腺病毒载体,慢病毒感染宿主细胞后能将病毒基因组整合于宿主基因组中,实现长时间、稳定表达外源目的基因,应用范围广。慢病毒中的毒性基因已经被剔除并被外源性目的基因所取代,且目前人们对慢病毒进行不断的优化以保证它的安全性[18]。利用同源重组的方法将目的基因SEC3连接到慢病毒工具载体上,在国内外首次构建了GV365-SEC3慢病毒载体,经过鉴定得到960 bp的阳性克隆质粒。将SEC3重组载体质粒与病毒包装质粒共同转染293T细胞进行包装,荧光显微镜下可见大量持续表达的荧光,并成功表达了分子量为29 bp的目的基因融合蛋白,与金黄色葡萄球菌肠毒素C3的分子量相吻合,说明重组载体质粒整合到感染细胞后能良好表达。收集上清中包装成功含目的基因的慢病毒,该慢病毒为“自杀”性病毒,感染目的细胞后不会再感染其他细胞,也不会利用宿主细胞产生新的病毒颗粒,属于假型病毒。可用于进一步研究GV365-SEC3慢病毒过表达载体在体内外感染肿瘤细胞后的抗肿瘤效果,以及实现过表达后联合T细胞对抗肿瘤细胞生物学活性,也可作为肿瘤疫苗持续刺激机体对肿瘤细胞的杀伤,有望成为一种新型的抗肿瘤基因治疗方法,具有一定的前景。
[1]Burnet FM.The concept of immunological surveillance [J].Prog Exp Tumor Res,1970,13:1-27.
[2]Croci DO,Zacarias Fluck MF,Rico MJ,etal.Dynamic cross-talk between tumor and immune cells inorchestrating the immunosupp-ressive network at the tumor microenvironment [J].Cancer Immunol Immunothe,2007,56(11):1687-1700.
[3]Schreiber RD,Old LJ,Smyth MJ,etal.Cancer immunoediting:Integrating immunity′s roles in cancer suppression and promotion [J].Science,2011,331(6024):1565-1570.
[4]Rivoltini L,Carrabba M,Huber V,etal.Immunity to cancer:attack and escape in T lymphocyte-tumor cell interaction [J].Immunol Rev,2002,188:97-113.
[5]Hoos A.Development of immuno-oncology drugs-from CTLA4 to PD1 to the next generations [J].Nat Rev Drug Discov,2016,15(4):235-247.
[6]魏晓莉.肿瘤免疫治疗的研究进展 [J].国际药学研究杂,2014,41(1):57-63.
[7]Binges MM,Orwin PM,Schlievert PM.Exotoxins of staphylococcus aureus [J].Clin Microbiol Rev, 2000,13(1):16-34.
[8]王敏,曹虹,李先平,等.金黄葡萄球菌肠毒素C3基因的克隆及原核表达 [J].中国生物制品学杂志,2010,23(3):256-260.
[9]Ginn SL,Alexander IE,Edelstein ML,etal.Gene therapy clinical trials worldwide to 2012-an update[J].J Gene Med,2013,15(2):65-77.
[10] Chen W,Zheng R,Baade PDetal.Cancer statistics in China,2015 [J].CA Cancer J Clin, 2016,66(2):115-132.
[11]McNutt M.Cancer immunotherapy [J].Science,2013, 342:1432-1433.
[12]Fraser J,Arcus V,Kong P,etal.Superantigens-powerful modifiers of the immune system [J].Mol Med Today,2000,6(3):25-32.
[13]Wang XG,Xu MK,Zhang HW,etal.Enhancement of superan-tigen activity and antitumor response of staphylococcal enterotoxinC2 by site-directed mutagenesis [J].Cancer Immunol Immunother,2009,58(5):677-686.
[14]王敏,马瑞玉,李先平,等.金黄色葡萄球菌肠毒素C3单克隆抗体的制备与鉴定 [J].中国微生态学杂志,2014,26(2):134-138.
[15]李先平,王敏,武婷,等.重组金黄色葡萄球菌肠毒素C3生物学活性的初步研究 [J].中国免疫学杂志,2012,28(7):589-593.
[16]邓洪新,魏于全.肿瘤基因治疗的研究现状和展望 [J].中国肿瘤生物治疗杂志,2015,22(2):171-175.
[17]Naldini L.A comeback for gene therapy [J].Science,2009,326(5954):805.
[18]徐晓明,杨慧,王晓萍.慢病毒载体的构建及优化 [J].中国临床康复,2006,10(9):147-149.
[收稿2016-02-19修回2016-04-17]
(编辑许四平)
Construction and identification of lentiviral vector over-expressing Staphyloco-ccus aureus enterotoxin C3
XIE Yi-Xin,WANG Min,LI Xian-Ping,YANG Min,LI Peng-Ling,ZHANG Ting-Ting,SONG Huan,DONG Zhi-Hui,TANG Ai-Guo.
Department of Laboratory Medicine,The Second Xiangya Hospital,Central South University,Changsha 410011,China
Objective:To construct the lentiviral vector over-expressing Staphylococcus aureus enterotoxin C3 and detect the expression of target gene in vitro.Methods: SEC3 gene were amplificatied by polymerase chain rcaction(PCR).The GV365 lentiviral vectors were digested by AgeⅠ enzyme,which was linked to SEC3 gene and then constructed the GV365-SEC3 lentiviral vetor.Positive clones of vectors were identificd by PCR.Then the positive lentiviral vectors were transfected into 293T cells for lentivirus package.The expression of lentiviral vectors was tested by observating cell fluorescence and Western blot.The virus titer was determined by HIV-1 p24 ELISA.Results: SEC3 gene was amplified and successfully bound to the GV365 lentivirus vectors.The sequences of the recombinant plasmid were confirmed correct by PCR and DNA scqucncing.A large mass of green fluorescent cells were observed after transfecting.And the resulting size of 29 kD protein band of protein electrophoresis,which was consistent with the target gene protein.Viral vector titer was 5×108TU/ml by ELISA detection.Conclusion: Lentiviral vector over-expressing Staphylococcus aureus enterotoxin C3 was successfully constructed,laid the foundation of observing its effect and mechanism against to tumor in vivo and in vitro for later research.
Staphylococcus aureus enterotoxin C3;Lentiviral;Vector construction;Over-expressing
10.3969/j.issn.1000-484X.2016.09.017
谢益欣(1992年-),女,在读硕士,主要从事临床微生物和免疫学研究。
及指导教师:王敏(1976年-),女,博士,副主任技师,主要从事临床微生物学和免疫学研究,E-mail:wangmin0000@aliyun.com。
R730.54
A
1000-484X(2016)09-1323-05
①本文为国家自然科学基金(81470133)和湖南省科技计划项目(2013SK3048)。
②中南大学湘雅医学院医学检验系,长沙410013。

