维生素C联合内皮素-1促进胚胎干细胞向心肌细胞分化及机制
林永青 梁 颖 张海峰 刘文浩 杨 莹 王景峰
(中山大学孙逸仙纪念医院心内科 广东省心电生理与心律失常实验室,广东 广州 510120)
维生素C联合内皮素-1促进胚胎干细胞向心肌细胞分化及机制
林永青梁颖张海峰刘文浩杨莹王景峰
(中山大学孙逸仙纪念医院心内科广东省心电生理与心律失常实验室,广东广州510120)
目的探讨维生素(Vit)-C联合内皮素(ET)-1对胚胎干细胞(ESC)向心肌细胞分化的影响及其可能机制。方法体外培养ESC并给予Vit-C,摸索Vit-C作用于ESC的最佳浓度和干预时间;然后给予ET-1(100 nmol/L)或Vit-C(100 μmol/L)+ET-1(100 nmol/L),观察两组对拟胚体搏动、Nkx 2.5、GATA-4及Shox2表达的影响。同时,以RNA干扰方法沉默Nkx 2.5、GATA-4及Shox2表达,观察沉默相应启动子表达水平后对Vit-C联合ET-1介导的拟胚体搏动增加的影响。结果Vit-C最佳作用浓度为100 μmol/L,最佳干预时间为分化的第4~9天,可使拟胚体搏动增加11.19%,同时上调拟胚体中心肌细胞标志物cTnT以及心肌发育启动子Nkx 2.5、GATA-4及Shox2表达。在Vit-C基础上进一步给予ET-1,可进一步使拟胚体搏动增加11.07%,同时进一步上调cTnT、Nkx 2.5、GATA-4及Shox2表达水平。沉默Shox2基因表达使拟胚体搏动幅度减少最明显,达12.94%。结论Vit-C联合ET-1可获得进一步纯化的心肌细胞,上调Shox2是其促进ESC分化的最重要机制。
维生素C;内皮素-1;胚胎干细胞;心肌细胞;Shox2
起搏细胞退行性变导致的病理生理改变(如病态窦房结综合征等)是老年人常见病之一。但起搏细胞为不可再生细胞,不能通过自身分裂而复制增殖,因此,起搏细胞获取依赖于其他类型细胞的转化。目前,已经证实包括胚胎干细胞(ESCs)、多能干细胞及骨髓间充质干细胞在内的多种细胞均可能向起搏细胞分化,而ESCs因其强大的增殖能力及多向分化潜能而成为起搏细胞研究中的热点〔1〕。尽可能地获得多量纯化的起搏细胞是ESCs分化研究的主要目标,而干预措施及干预时机是关键。笔者前期研究发现在培养的第3~8天加入内皮素(ET)-1不增加拟胚体数量,但可在一定程度上增加拟胚体中心肌细胞数量,但仍不足60%〔2〕。因此,进一步研究获得更多的心肌细胞是ESCs分化中亟待研究的问题。维生素(Vit)-C是一种多效的药物,有少量研究提示其可能促进ESCs及多能干细胞向心肌细胞分化〔3,4〕。然而,Vit-C联合ET-1是否能进一步增加拟胚体中心肌细胞的纯度目前尚不得知。本研究旨在探讨Vit-C联合ET-1是否能够进一步增加拟胚体中心肌细胞数量及其可能机制。
1 材料与方法
1.1材料小鼠胚胎干细胞及其饲养层细胞均购自美国ATCC;培养基、胎牛血清、链霉素及青霉素均购自美国Gibco公司;逆转录试剂盒PrimeScriptTMRT Master Mix (Perfect Real Time)、SYBR®Fast qPCR Mix及内切酶购自大连宝生物公司;病毒包装质粒pLP1、pLP2及p-VSVG购自日本Clontech公司;核苷酸序列由广州锐博生物公司合成;Nkx2.5、GATA-4及Shox2抗体购自美国Abcam公司。
1.2细胞培养ESCs培养于灭活的小鼠胎儿成纤维细胞的饲养层上,培养基为DMEM,含15%胎牛血清、1%青霉素、1%链霉素及1 000 U/ml白血病抑制因子。诱导ESCs分化为心肌细胞方法采用本课题组报道的悬滴培养法〔5〕,即约500个ESC细胞滴于培养皿内维持滴状培养72 h后将其吹散并继续培养48 h以形成拟胚体。拟胚体形成后,将其置于分化培养基中,并于分化开始后的第0~3、4~9及10~14天加入10、100及1 000 μmol/L的Vit-C诱导分化为心肌细胞。同时,取最优的Vit-C作用浓度及干预时间,对比单独使用Vit-C或者联合ET-1(100 nmol/L)对ESC向心肌细胞分化的影响。使用慢病毒介导的基因沉默(见下述)下调心脏发育启动子Nkx2.5、GATA-4及Shox2表达后再观察这些基因下调对Vit-C联合ET-1介导的拟胚体搏动增加的影响。
1.3病毒包装与感染以慢病毒介导ESC外源基因表达。取pLL 3.7载体并以XpaI及XhoI双酶切载体与取退火后Nkx2.5、GATA-4、Shox2或无义(Scramble)RNA干扰序列混合,在连接酶作用下重组为pLL 3.7-shRNA-Nkx2.5、pLL 3.7-shRNA-GATA-4、pLL 3.7-shRNA-Shox2或pLL 3.7-shRNA-Scramble。重组载体与pLP1、pLP2及pVSV-G共转染293T细胞后收集上清,以超高速离心2 h后获得相应慢病毒,以MOI = 50感染ESC。Nkx2.5干扰序列为:5′-TTTAGGATGTCTTTGACTGAG-3′;GATA-4干扰序列为:5′-AAAGAAAATCCCAAATTGGAT-3′;Shox2干扰序列为:5′-AATAATAACACATCAATGGGG-3′。
1.4指标检测采用Real-Time PCR方法测定cTnT、Nkx2.5、GATA-4及Shox2 mRNA表达。收集处理后细胞,以TRIZOL-氯仿法提取总RNA并逆转录;以下述引物用SYBR法行实时荧光定量PCR检测mRNA表达量,以GAPDA为内参;以Western印迹检测上述蛋白表达量。取细胞以蛋白裂解液充分裂解细胞并煮沸变性;经SDS-PAGE电泳分离后转膜及抗体孵育,最后加入化学发光液并以凝胶成像系统捕获图像。Nkx2.5引物序列:正义:5′-CGACGGAAGCCACGCGTGCT-3′;反义:5′-CCGCTGTCGCTTGCACTTG-3′;GATA-4引物序列:反义:5′- CTCGATATGTTTGATGACTTCT-3′;正义:5′-CGTTTTCTGGTTTGAATCCC-3′;Shox2引物序列:正义:5′-GTCGGTGGAGCCTCCTAAG-3′;反义:5′-ATTTTAGTCCCAAGGGCGGG-3′;cTnT引物序列:正义:5′-ATCAACGTTCTGCGAAACCG-3′;反义:5′-TTCTAGCTAAGCCAGCTCCC-3′;GAPDH引物序列:正义:5′-TACAGCAACAGGGTGGTGGAC -3′;反义:5′-GATGGTATTCAAGAGAGTAGGG -3′。
1.5统计学处理使用STATA12.0软件,正态分布计量资料采用单因素方差分析比较,并用SKS方法校正。
2 结 果
2.1Vit-C对ESC分化的影响ESC培养至第5天时开始形成拟胚体(图1),转移拟胚体至培养皿继续培养至第3天时开始出现拟胚体搏动。分化第4~9天加入Vit-C增加搏动拟胚体最明显,达12.89%;0~3 d次之,为8.86%;10~14 d再加入Vit-C对搏动的拟胚体数量无影响。见表1。
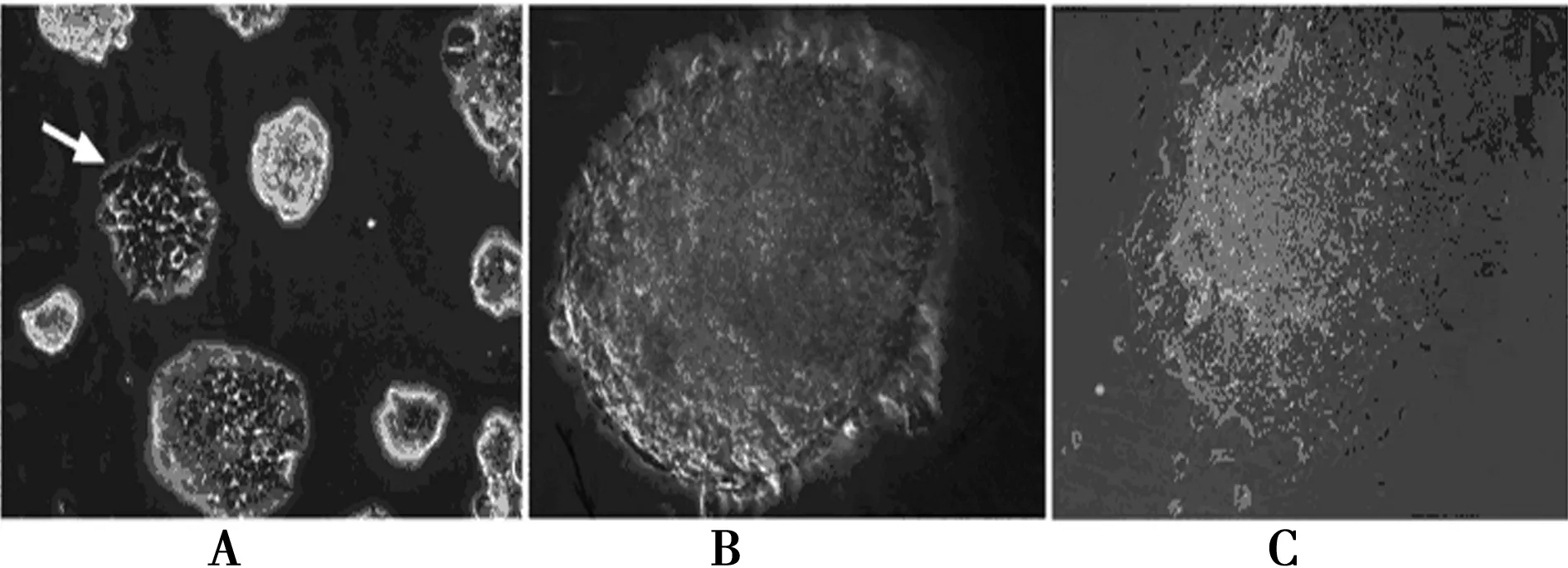
A.胚胎干细胞开始分化;B.悬浮的拟胚体;C.贴壁的拟胚体图1 胚胎干细胞培养形态

时间Control组Vit-C组P值0~3d54.03±6.8162.89±6.380.044~9d58.37±6.2371.26±7.320.00810~14d53.27±4.3356.49±8.320.42
除干预时间点外,Vit-C浓度可能也是影响ESC分化的重要因素。结果显示,在分化第4~9天给予100 μmol/L Vit-C增加搏动的拟胚体数量最为明显,而10 μmol/L及1 000 μmol/L的Vit-C亦能增加搏动拟胚体数量,但增加幅度较100 μmol/L浓度低,与Control组无统计学差异。Control组、10、100、1 000 μmol/L组拟胚体搏动百分比分别为(52.37±6.39)%,(57.37±7.27)%,(67.39±7.07)%,(63.88±8.32)%。
在确认Vit-C增加搏动拟胚体数量后,进一步研究Vit-C对心肌标志蛋白cTnT及心脏发育过程中关键启动子Nkx2.5、GATA-4及Shox2表达的影响。RT-qPCR及Western印迹结果显示,与Control相比,Vit-C可全面上调cTnT、Nkx2.5、GATA-4及Shox2表达,而3个启动子中,以Shox2上调幅度最明显。见图2,表2。

图2 Western印迹分析Vit-C对cTnT、Nkx2.5、GATA-4及Shox2表达的影响

指标RT-qPCRControl组Vit-C组Western印迹Control组Vit-C组cTnT0.73±0.081)1.43±0.150.59±0.071)1.6±0.23Nkx2.50.92±0.081)1.3±0.200.81±0.071)1.26±0.16GATA-40.5±0.041)1.27±0.190.42±0.051)1.36±0.3Shox20.62±0.061)1.62±0.170.5±0.061)1.58±0.32
与Vit-C组比较:1)P<0.01;下表同
2.2Vit-C联合ET-1对ESC分化的影响与单纯加入Vit-C相比,于分化的第4~9天加入Vit-C+ET-1(0.1 μmol/L)能进一步增加搏动的拟胚体数量(Vit-C vs. Vit-C+ET-1:65.93%±7.39% vs 77.0%±9.07%,P=0.04),增幅达11.07%;对cTnT、Nkx2.5、GATA-4及Shox2表达检测亦呈现出类似趋势。见图3,表3。

图3 Western印迹分析Vit-C联合ET-1对cTnT、Nkx2.5、GATA-4和Shox2表达的影响

指标RT-qPCRVit-C组Vit-C+ET-1组Western印迹Vit-C组Vit-C+ET-1组cTnT0.53±0.061.03±0.21)0.67±0.051.13±0.191)Nkx2.50.58±0.050.98±0.091)0.52±0.060.83±0.071)GATA-40.89±0.081.1±0.091)0.81±0.071.03±0.081)Shox20.62±0.051.23±0.131)0.57±0.041.36±0.091)
2.3不同启动子对Vit-C联合ET-1促ESC向心肌细胞分化中的影响RT-qPCR结果显示,shRNA抑制上述启动子表达程度大致相同,约65%~70%。在这种抑制程度下,shRNA-Shox2逆转Vit-C联合ET-1促ESC向心肌分化效应最明显,约减少12.94%搏动的拟胚体;shRNA-Nkx2.5次之,约减少8.31%拟胚体搏动;而shRNA-GATA-4作用最小(减少6.21%拟胚体搏动)。shRNA-Scr、shRNA-Nkx2.5、shRNA-GATA-4、shRNA-shox2拟胚体搏压力分别为74.56%±7.87%,61.11%±7.19%,67.02%±5.69%,57.96%±8.01%,shRNA-Scr与shRNA-shox2、shRNA-NKx2.5比较差异显著(均P<0.05),与shRNA-GATA-4比较无显著差异(P>0.05)。
3 讨 论
Vit-C及ET-1均被单独证实为可能促进ESC向心肌细胞分化,但两者联合作用未明。本研究证实Vit-C联合ET-1可进一步促进ESC向心肌细胞分化。此外,本研究还证实Shox2在Vit-C联合ET-1促ESC心肌分化过程中发挥重要作用。
有研究结果显示Vit-C可促进ESC向心肌细胞分化。早于2003年,Takahashi等〔6〕即已证实Vit-C可使ESC内心肌细胞特异性启动子α-MHC具有转录活性;同时,促进心脏发育相关启动子GATA-4及β-MHC表达。随后不同学者研究均证实了Vit-C具有促进ESC向心肌细胞分化的作用〔4,7,8〕。除此以外,Vit-C亦被证实可能与其他措施协同作用共同促进ESC向心肌细胞分化,Vit-C可协同丹酚酸B促进ESC向心肌细胞分化达3倍,进一步研究显示这种促进作用与其促进胶原生成有关〔9〕。
ESC向心肌分化是一系列心脏发育相关启动子表达的结果,而在这一系列相关启动子中,以对Nkx2.5和GATA-4的研究最为充分〔10〕。Nkx2.5是心脏前体细胞分化的最早期标志之一,是同源盒基因家族NK2型成员,决定着心肌细胞定型及分化,在心肌发育过程中,其表达早于β-MHC等心肌特异性标志物,这一基因的缺失将导致心肌细胞形成受阻〔11〕。GATA-4是心肌细胞发育过程中另一关键启动子,在心肌细胞形成的极早期即可被检出且将一直持续〔11〕。本研究结果显示,在Nkx2.5和GATA-4介导的心脏发育通路可能在其中发挥同等重要的作用。且两者相互作用在房室结及心脏房室传导系统形成中发挥关键作用〔11〕。
相对Nkx2.5及GATA-4、Shox2在心脏发育过程中的研究较晚,但近年持续受到关注。Shox2是同源结构域转录因子,被认为在静脉窦及窦房结中表达且对窦房结细胞起搏功能是必须的〔12〕,Shox2缺失导致胚胎不能存活而Shox2表达低下则可存活但将导致心动过缓且过早死亡〔11〕。近年研究显示,Shox2高表达可促进ESC向起搏细胞分化,同时增强其生物起搏的可应用性〔13〕。值得注意的是,研究结果显示Shox2可能拮抗Nkx2.5并调节细胞分化。研究者使肺静脉附近心房细胞高表达Shox2时,则拮抗了Nkx2.5作用并使细胞呈现出窦房结细胞的电生理特性;而在窦房结细胞高表达Nkx2.5时,则拮抗了Shox2作用,使细胞出现类似病态窦房结综合征这一在老年人中常见病变的状态〔14〕。本研究首次提示Vit-C联合ET-1可能促进ESC更倾向于窦房结细胞分化。因窦房结细胞为生物起搏的理想细胞,故Vit-C联合ET-1除获得更心肌细胞外,其获得的细胞可能更适用于生物起搏。
本研究存在一定不足之处。首先,本研究并未直接证实Shox2与Nkx2.5及GATA-4的相互作用。虽然如上述之Nkx2.5与Shox2相互拮抗已经证据,但这种现象是否亦在ESC存在尚有待阐明。其次,本研究未探讨Vit-C联合ET-1上调Nkx2.5、GATA-4及Shox2的机制,这有待进一步研究来揭示。
1Chong JJ,Murry CE.Cardiac regeneration using pluripotent stem cells-progression to large animal models〔J〕.Stem Cell Res,2014;13(3 Pt B):654-65.
2Chen M,Bi LL,Wang ZQ,etal.Time-dependent regulation of neuregulin-1β/ErbB/ERK pathways in cardiac differentiation of mouse embryonic stem cells〔J〕.Mol Cell Biochem,2013;380(1-2):67-72.
3Chung TL,Brena RM,Kolle G,etal.Vitamin C promotes widespread yet specific DNA demethylation of the epigenome in human embryonic stem cells〔J〕.Stem Cells,2010;28(10):1848-55.
4Gao Y,Han Z,Li Q,etal.Vitamin C induces a pluripotent state in mouse embryonic stem cells by modulating microRNA expression〔J〕.FEBS J,2015;282(4):685-99.
5Chen M,Lin YQ,Xie SL,etal.Enrichment of cardiac differentiation of mouse embryonic stem cells by optimizing the hanging drop method〔J〕.Biotechnol Lett,2011;33(4):853-8.
6Takahashi T,Lord B,Schulze PC,etal.Ascorbic acid enhances differentiation of embryonic stem cells into cardiac myocytes〔J〕.Circulation,2003;107(14):1912-6.
7Ren M,Han Z,Li J,etal.Ascorbic acid delivered by mesoporous silica nanoparticles induces the differentiation of human embryonic stem cells into cardiomyocytes〔J〕.Mater Sci Eng C Mater Biol Appl,2015;56:348-55.
8Bartsch C,Bekhite MM,Wolheim A,etal.NADPH oxidase and eNOS control cardiomyogenesis in mouse embryonic stem cells on ascorbic acid treatment〔J〕.Free Radic Biol Med,2011;51(2):432-43.
9Chan SS,Chen JH,Hwang SM,etal.Salvianolic acid B-vitamin C synergy in cardiac differentiation from embryonic stem cells〔J〕.Biochem Biophys Res Commun,2009;387(4):723-8.
10于爽,察雪湘,吴瑶,等.巴戟天糖链对骨骼肌成肌细胞向心肌样细胞分化的影响〔J〕.中国老年学杂志,2014;34(23):6687-9.
11张清泉,庄涛,孙云甫.心脏及其起搏传导系统的功能和调控研究〔J〕.中国医学前沿杂志(电子版),2013;6(1):48-51.
12Hashem SI,Lam ML,Mihardja SS,etal.Shox2 regulates the pacemaker gene program in embryoid bodies〔J〕.Stem Cells Dev,2013;22(21):2915-26.
13Ionta V,Liang W,Kim EH,etal.Shox2 overexpression favors differentiation of embryonic stem cells into cardiac pacemaker cells,improving biological pacing ability〔J〕.Stem Cell Reports,2015;4(1):129-42.
14Ye W,Wang J,Song Y,etal.A common Shox2-Nkx2-5 antagonistic mechanism primes the pacemaker cell fate in the pulmonary vein myocardium and sinoatrial node〔J〕.Development,2015;142(14):2521-32.
〔2015-06-11修回〕
(编辑曲莉)
Synergistic effect of vitamin C and endothelin-1 in differentiation of cardiomyocytes from embryonic stem cell
LIN Yong-Qing,LIANG Ying,ZHANG Hai-Feng,et al.
Sun Yat-Sen Memorial Hospital,Sun Yat-Sen University,Guangzhou 510120,Guangdong,China
ObjectiveTo explore the effects of vitamin (Vit) -C in combination with endothelin (ET) -1 on embryonic stem cell (ESC) differentiation into cardiomyocytes and underline mechanism.MethodsDifferent Vit-C concentrations and intervention time were tested to optimize Vit-C treatment.After that,Vit-C (100 μmol/L) alone or together with ET-1 (100 nmol/L) were administered to ESC at day 4~9 after differentiation.The beating of embryoid bodies (EBs) were calculated and compared between groups.Expressions of cardiac marker,cTnT,cardiac promoter,Nkx 2.5,GATA-4 and Shox2 were determined.Lentivirus mediated RNA interference was used to knockdown expressions of Nkx 2.5,GATA-4 and Shox2 and EBs beating under Vit-C and ET-1 treatment were observed.ResultsOptimal Vit-C treating concentration was 100 μmol/L and day 4~9 after differentiation was the best time to intervent,which increased EBs beating by 11.19% and increased expression of cTnT,Nkx 2.5,GATA-4 and Shox2 expressions at the same time.In combination with ET-1 further increased EBs beating by 11.07% and expression profiles of the above proteins.Knocking down of Shox2 reversed the effects of Vit-C and ET-1 at the greatest extent,reduced EBs beating by 12.94%.ConclusionsVit-C plus ET-1 produce more purified cardiomyocytes from ESC differentiation.The up-regulation of Shox2 is the most important underline mechanism.
Vitamin C;Endothelin-1;Embryonic stem cell;Cardiomyocyte;Shox2
国家自然科学基金(81300071);广东省自然科学基金(2014A030313655,2014A030313049);广东省战略性新兴产业省级核心攻关项目(2012A080800007);广州市科技科学研究专项(201510010050,201510010048);中山大学青年教师培育项目(13ykpy29)
王景峰(1963-),男,教授,博士生导师,主要从事心力衰竭及干细胞分析研究。
林永青(1977-),男,博士,主治医师,主要从事冠心病介入治疗及干细胞分化研究。
R541.9
A
1005-9202(2016)17-4148-04;doi:10.3969/j.issn.1005-9202.2016.17.005

