硫酸铵提高裂殖壶菌不饱和脂肪酸积累的代谢组学研究
陈胜兰 赵晓艳 任路静 纪晓俊 黄和


摘要:采用基于气相色谱质谱(GCMS)联用技术的代谢组学方法,通过分析裂殖壶菌胞内代谢物的变化,研究(NH4)2SO4提高裂殖壶菌不饱和脂肪酸积累的作用机制。利用GCMS技术对添加0,1.5,2.5和3.5 g/L (NH4)2SO4的发酵样品进行分析,结合KMeans 算法对数据进行聚类分析,得到胞内代谢物的热图。主成分分析(PCA)和偏最小二乘判别分析(OPLSDA)得分图可将不同添加条件下裂殖壶菌胞内物质明显区分。运用PLSDA载荷图及模型的变量重要性因子(VIP)值,发现了7种代谢物可作为区别4种不同条件下的生物标志物。经NIST和Wiley谱库检索,它们分别为葡萄糖、肌醇、甘露醇、果糖、磷酸、乙醇胺、乙胺。代谢途径分析结果表明,(NH4)2SO4是通过弱化糖酵解途径和乙酸合成支路,提高苹果酸酶的活力,强化氨基酸代谢和NADPH的积累,從而提高不饱和脂肪酸积累。
关键词 :裂殖壶菌; 代谢组学; 主成分分析; 硫酸铵; 二十二碳六烯酸
1 引 言
代谢组学是对在某一特定生理时期内生物样品中的所有低分子量代谢产物进行无偏定性和定量分析的一门学科,通过检测代谢物水平在某种刺激下所产生的整体变化(量变以及质变),鉴定出目标差异代谢物[1~3],具有分离效率高、灵敏度高、可选择性地分离检测大量代谢物和同分异构体等优点而被广泛关注。
二十二碳六烯酸(Docosahexaenoic acid,C22∶6,简称DHA)是一种重要的ω3长链多不饱和脂肪酸[4],是神经细胞生长及维持的重要元素,在预防和治疗心血管疾病、防治动脉硬化等方面具有显著功效[5,6]。而裂殖壶菌具有生长速度快、易培养、细胞内脂肪酸组分简单和DHA含量高等优势,是通过发酵生产DHA的优良菌种。
有研究发现[7],通过补加(NH4)2SO4的方式,可以缓解由氮源消耗所引起的DHA含量降低,最终DHA含量达到44.7%,比未添加(NH4)2SO4时提高34.6%。同时,在未添加(NH4)2SO4时,裂殖壶菌油脂中不皂化物的含量高达264.78 mg/g,是正常情况的1.8倍,严重影响了油脂的品质[8]。另外,Ling等[9]报道,在DHA发酵中同时补加谷氨酸钠,可使DHA的含量达到24.74 g/L,比不添加时提高了65.9%。上述研究仅从宏观上发现了氮源在DHA发酵中的显著作用,但氮源促使多不饱和脂肪酸积累的调控机制尚不清楚。本研究利用基于气相色谱质谱联用(GCMS) 技术的代谢组学方法,分析裂殖壶菌Schizochyrium sp. HX308在添加不同浓度(NH4)2SO4条件下胞内代谢物的变化特征,寻找其潜在的代谢差异标志物,获得代谢物变化与发酵性能参数的相互关系,探讨(NH4)2SO4促使DHA高效积累的可能机理。
2 实验部分
2.1 仪器与试剂
Trace GC2000 DSQ气相色谱质谱联用仪(美国Agilent公司);MD2001氮气浓缩仪(杭州奥盛公司); GC2010气相色谱仪(日本Shimadzu公司);SBA40C生物传感分析仪(山东省科学院生物研究所); 3K15高速冷冻离心机(美国Sigma公司)。
甲醇(HPLC级,山东禹王实业有限公司);吡啶(色谱纯,上海凌峰化学试剂有限公司);N甲基N(三甲基硅氧烷基)三氟乙酰胺(NMethylNtrimethylsilyl trifluoracetamide,MSTFA),甲氧胺盐酸盐(上海阿拉丁生化科技股份有限公司);培养基组成物质(国药集团化学试剂公司);核糖醇(≥99%,Sigma公司);实验用水为某品牌纯净水。
2.2 菌种与培养方法
裂殖壶菌(Schizochytrium sp.HX308) CCTCC M209059,由本实验室自主筛选获得,保藏于中国典型培养物保藏中心(CCTCC)。种子、发酵培养基组分参考文献[10],发酵培养基初始葡萄糖浓度为60 g/L,接种量为10%,过程中第一次补糖时同时添加不同浓度(1.5, 2.5和3.5 g/L)(NH4)2SO4,培养条件为30℃,170 r/min。
2.3 发酵表观数据分析
葡萄糖浓度和细胞干重的测定见参照文献[11],苹果酸酶的测定见参照文献[12]。
脂质提取:取100 mL发酵液在50℃预热,用NaOH调至pH 10~12,按3‰(w/V)的比例加破壁酶,50℃下搅拌并保温2 h;按发酵液酒精正己烷(1∶1∶1, V/V)的比例添加有机溶剂萃取,搅拌后静置分层,收集正己烷相,萃取2~3次,旋转蒸干,并烘干至恒重。
脂肪酸甲酯化: 取0.1 g干菌体,加入3 mL 0.5 mol/L KOH甲醇溶液,65℃水浴17 min,冷却;再加入2 mL BF3乙醚甲醇溶液(3∶7, V/V),65℃水浴7 min,冷却;加2 mL饱和NaCl溶液、3 mL正己烷,充分振荡萃取,取萃取液用作DHA分析。
GC分析条件:DB23色谱柱(60 m × 0.25 mm × 0.25 μm, 美国Agilent公司); 载气: 氮气; 分流比: 10∶1;进样口温度:250℃;检测器温度:280℃;进样量:1μL;程序升温:初始柱温100℃,先以25℃/min升至200℃,再以2℃/min升至220℃,保持12 min。柱流速:3.0 mL/min; 尾吹流速: 30 mL/min; 氢气流速: 40 mL/min; 空气流速: 400 mL/min。
GC/MS条件:DB5MS毛细管色谱柱(30 m × 0.25 mm × 0.25 μm,美国 Agilent公司);载气:氦气,采用横流模式,流速1 mL/min(恒流)分流进样,分流比1∶1;进样量1 μL;进样口温度:250℃;梯度升温程序:初始温度70℃,保持2 min,以5℃/min升至300℃,保持3 min;传输线温度:280℃;电子轰击模式,EI源70 eV,离子源温度 230℃;四极杆质量分析器温度:150℃;扫描质量范围m/z 50~600。
2.5 数据处理
采用AMDIS 软件(NIST,v2.69,Gaithersburg,MD,USA)和MSD Chemstation软件(Agilent Technologies,G1701 EA E.02.00.493,USA)对总离子色谱图进行质谱峰的定性和定量分析,获得代谢物的相对含量(与内标峰的比值)。然后将数据导入Expander(version 6.0)软件, 对数据进行聚类分析,以热图表示。最后使用SIMCAP(version 11.0)进行主成分分析(PCA)和正交偏最小二乘法判别分析(xOPLSDA),通过载荷图、t检验和模型的变量重要性因子(Variable importance factor,VIP) 找出裂殖壶菌在添加不同浓度(NH4)2SO4下差异显著的代谢物。
3 结果与讨论
3.1 (NH4)2SO4对细胞生长及DHA积累的影响
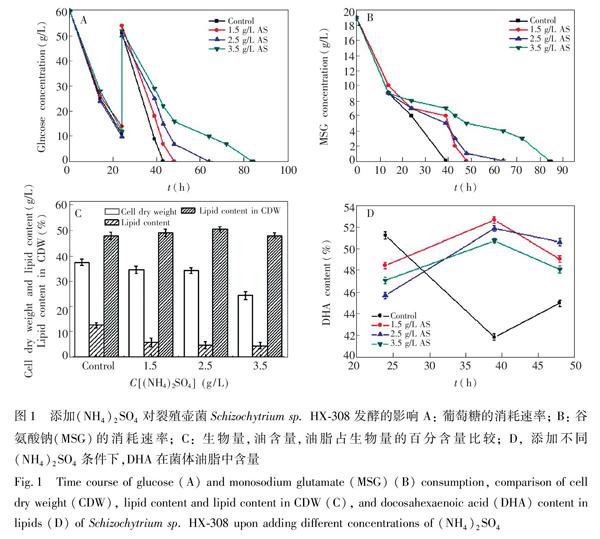
葡萄糖和谷氨酸钠是裂殖壶菌生长所需要的重要碳源和氮源,可作为衡量细胞生理活性的重要指标。如图1所示,添加(NH4)2SO4后, 葡萄糖和谷氨酸钠的消耗速率明显变慢,发酵周期明显延长,添加3.5 g/L (NH4)2SO4时,发酵周期延长至84 h;细胞生长和总油脂的积累也受到抑制,其中油脂的含量由12.67 g/L分别降至5.83, 4.75和4.53 g/L;而油脂占细胞干重的百分含量则保持稳定。在对照实验中,39 h时, DHA含量由初始的51.22%降至41.83%,而添加(NH4)2SO4时,DHA含量并未降低反而增加,当添加1.5 g/L(NH4)2SO4后,39 h时,DHA含量可达到52.63%,比未添加(NH4)2SO4时提高了25.82%。
3.2 裂殖壶菌代谢轮廓差异的分析
利用GC/MS对添加不同浓度(NH4)2SO4条件下胞内代谢物进行检测,共检出代谢物80多种。其中,4种条件下共有的代谢物主要包括氨基酸类、醇类、有机酸类、糖类、脂肪酸类等物质(图2)。添加(NH4)2SO4后, 甘油醛3磷酸、乙酸、苹果酸、α酮戊二酸、富马酸、磷酸、乙醇胺、肌醇等物质代谢明显比较活跃。其中,添加1.5和2.5 g/L (NH4)2SO4后,发酵至39 h时,丙氨酸、焦谷氨酸、4氨基丁酸、甘氨酸、半胱氨酸和缬氨酸的含量较高,说明此时氮代谢活力旺盛[13],氨基酸是碳、氮代谢所必需的物质,同时也是合成细胞组分蛋白质的必要前体。氨基酸含量增加的同时可增加细胞内因环境扰动而形成的异常蛋白的降解,从而合成更多有利蛋白以维持细胞在不良营养环境下的细胞生理功能[14]。
3.3 潜在生物标记物的分析
利用PCA分析添加(NH4)2SO4前后的多维数据,从得分图(图3A)发现,图中4组数据均可以明显区别开,尤其是补加1.5 g/L (NH4)2SO4时,与对照组存在显著差异。图3B为PCA载荷图,图中每个点代表胞内一个代谢物变量,离原点较远的点为潜在的生物标志物。图4为VIP图, VIP 因子可以用来反映代谢物对DHA积累的贡献。在0.95的置信区间内,VIP>1,说明这些代谢物在DHA 积累过程中发挥重要作用(虚线以上)。以DHA占总脂肪酸的百分含量为目标作VIP图,结合PCA的载荷图,最终确定与DHA含量密切相关的关键代谢物为葡萄糖、肌醇、甘露醇、果糖、磷酸、乙醇胺、乙胺,可作为区别4种不同条件下的生物标志物,在各自代谢途径中发挥关键性的功能与作用。
3.4 关键代谢途径的分析
为进一步探究(NH4)2SO4调控不饱和脂肪酸合成的机制,针对热图、载荷图和VIP图获得的关键代谢物进行代谢途径分析,图5为裂殖壶菌胞内合成DHA的主要代谢途径[15]及添加不同浓度(NH4)2SO4 39 h后关键代谢物的浓度差异。
乙酸来源于丙酮酸,在添加(NH4)2SO4后,乙酸含量大大降低,尤其是添加2.5 g/L (NH4)2SO4 时,相比于对照降低了1/3,使代谢流更多地流向TCA循环。
苹果酸酶是合成NADPH的关键酶,而苹果酸是该合成反应的底物也是该酶的激活剂[16]。添加(NH4)2SO4条件下的苹果酸含量均高于不添加的条件,其中添加2.5 g/L (NH4)2SO4时苹果酸含量是不添加条件下的5.43倍。如图6所示,添加2.5 g/L (NH4)2SO4,39 h时苹果酸酶的比活力可达410 U/mg,相比于对照组增加了26.06%。因此,添加(NH4)2SO4能够增强苹果酸酶的活性,从而产生较多脂肪酸合成必需的NADPH。而表1数据显示,添加(NH4)2SO4后,不饱和脂肪酸含量提高,饱和脂肪酸含量降低,可能是脂肪酸合成途徑更易受(NH4)2SO4的影响,从而产生的NADPH主要供应不饱和脂肪酸的合成。此外,据文献[7]报道,(NH4)2SO4会对细胞造成一些毒害,从而诱使细胞膜组分发生变化,以抵抗不利环境,可能迫使细胞合成更多的不饱和脂肪酸以维持细胞生长。
α酮戊二酸、富马酸是氮代谢途径和TCA循环的核心物质,NH+4经谷氨酰胺合成酶及谷氨酸合成酶催化形成谷氨酸,谷氨酸是胞内其它氨基酸生物合成的主要氨基供体,可形成各种有机氮化合物,最后合成各种蛋白质或核酸[17]。细胞氮代谢有关酶活性直接受到培养基氮营养水平的影响,从而直接影响不饱和脂肪酸的产量。添加(NH4)2SO4后,α酮戊二酸、富马酸的含量均明显升高,说明此时TCA循环中代谢流比较活跃。
H3PO4是一种重要的代谢物,不仅是细胞膜磷脂双分子层的重要组成成分,还参与细胞信号转导途径的调节[18]。在真菌中,磷酸化合物会改变磷脂双分子层的组成,进而改变细胞膜流动性[19]。同时。H3PO4还可以激活某些蛋白激酶,调节信号传导通路,使细胞对环境作出应激反应[20]。添加(NH4)2SO4后,H3PO4含量明显升高,在细胞生长过程中,为不饱和脂肪酸的高效合成提供了有效的能量支持和信号传递作用。
肌醇是多元醇中的一種,可以作为碳水化合物的存储体、转运物质、辅酶调节剂和还原力储存物[21,22],是微生物对环境胁迫的应激反应中的一种相容性溶质[23],在补加(NH4)2SO4时,肌醇含量显著升高,可能是为了抵御添加(NH4)2SO4带来的酸性环境胁迫,细胞需要生成更多的肌醇以维护细胞功能。另一方面,肌醇在储存还原力和辅酶调节上也有功效,添加(NH4)2SO4后,苹果酸酶活性提高加速了NADPH的积累,因此需要更多的肌醇来储存大量的还原力和乙酰辅酶A以供细胞合成多不饱和脂肪酸。
4 结 论
本研究利用基于 GCMS 的代谢组学方法研究了添加不同浓度(NH4)2SO4对裂殖壶菌胞内代谢谱的变化。多元统计分析表明,添加不同浓度的(NH4)2SO4组代谢谱存在显著差异,并筛选出7种关键代谢产物,分别为葡萄糖、肌醇、甘露醇、果糖、磷酸、乙醇胺、乙胺。结合代谢途径分析,发现(NH4)2SO4可以弱化糖酵解途径,减少乙酸的生成并加快氨基酸代谢,使代谢流更多的流向TCA循环;还可以提高胞内苹果酸酶的活力,促进NADPH供应量,从而提高裂殖壶菌胞内不饱和脂肪酸的积累,对后期从细胞生理性状角度出发进行发酵调控具有指导意义。
References
1 Koek M M, Jellema R H, Van der Greef J, Tas A C, Hankemeier T. Metabolomics, 2011, 7(3): 307-328
2 XIE YueSheng, PAN GuiXiang, GAO XiuMei, LIU ChangXiao. Chinese J. Anal. Chem., 2006, 34(11): 1644-1648
谢跃生, 潘桂湘, 高秀梅, 刘昌孝. 分析化学, 2006, 34(11): 1644-1648
3 SHI DongDong, WANG GuiMing, KUANG YuanYuan, PENG ZhangXiao, WANG Yan, GU Xue, YAN Chao. Chinese J. Anal.Chem., 2014, 42(8): 1088-1093
史栋栋, 王桂明, 况媛媛, 彭章晓, 王 彦, 谷 雪, 阎 超. 分析化学, 2014, 42(8): 1088-1093
4 Timmins A, Macpherson E J, Ackman R G. Food Chem., 2000, 70(3): 425-426
5 Horrocks L A, Yeo Y K. Pharmacol. Res., 1999, 40(3): 211-225
6 Giusto N, Pasquare S, Salvador G, Castagnet P, Roque M, Ilincheta de Boschero M. Prog. Lipid Res., 2000, 39(4): 315-391
7 Ren L J, Sun L N, Zhuang X Y, Qu L, Ji X J, Huang H. Bioprocess. Biosyst. Eng., 2014, 37(5): 865-872
8 Sun L, Ren L, Zhuang X, Ji X, Yan J, Huang H. Bioresour. Technol., 2014, 159: 199-206
9 Ling X, Guo J, Liu X, Zhang X, Wang N, Lu Y, Ng I S. Bioresour. Technol., 2015, 184: 139-147
10 Ren L J, Sun G N, Ji X J, Hu X C, Huang H. Bioresour. Technol., 2014, 157: 107-113
11 Ren L J, Ji X J, Huang H, Qu L, Feng Y, Tong Q Q, Ouyang P K. Appl. Microbiol. Biotechnol., 2010, 87(5): 1649-1656
12 Hsu R Y, Lardy H A. Methods Enzymol., 1969, 13: 230-235
13 Fritz C, Mueller C, Matt P, Feil R, Stitt M. Plant. Cell. Environ., 2006, 29(11): 2055-2076
14 Li J, Ren L J, Sun G N, Qu L, Huang H. OMICS, 2013, 17(5): 269-281
15 Ratledge C. Biochimie, 2004, 86(11): 807-815
16 Zhang Y, Adams I P, Ratledge C. Microbiology, 2007, 153(7): 2013-2025
17 Pearson C J, Jacobs B C. Aust. J. Agr. Res., 1987, 38(6): 1001-1009
18 Jackowski S, Rock C O. Biochim. Biophys. Acta, Mol. Cell Biol. Lipids, 2013, 1831(3): 469-470
19 Turk M, Mejanelle L, Sentjurc M, Grimalt J O, GundeCimerman N, Plemenitas A. Extremophiles, 2004, 8(1): 53-61
20 Siniossoglou S. Biochim. Biophys. Acta, Mol. Cell Biol. Lipids, 2013, 1831(3): 575-581
21 Jennings D H. Adv. Appl. Microbiol., 1985, 25: 149-193
22 Nikawa J, Yamashita S. Biochim. Biophys. Acta, Mol. Cell Biol. Lipids, 1997, 1348(12): 173-178
23 Ding M Z, Cheng J S, Xiao W H, Qiao B, Yuan Y J. Metabolomics, 2009, 5(2): 229-238
Abstract A metabonomics method based on gas chromatographymass spectrometry (GCMS) was established to analyze the changes of intracellular metabolites and study the mechanism of ammonium sulfate enhancing unsaturated fatty acids accumulation in Schizochytrium sp. Metabolites of cells cultivated at 0, 1.5, 2.5 and 3.5 g/L (NH4)2SO4 were analyzed at different times. Heat map was obtained with KMeans algorithm for data clustering analysis. Principal component analysis (PCA) and partial leastsquares discrimination analysis (OPLSDA) were employed for pattern recognition, and an obvious distinction among different conditions was achieved. According to the LSDA load diagram and variable important factor (VIP) value, 7 biomarkers were determined with significant differences between four different conditions, which were identified as glucose, inositol, mannitol, fructose, phosphoric acid, ethylamine and ethanolamine by searching in NIST and Wiley database. Metabolic pathway analysis indicated that the metabolic flux toward the EmbdenMeyerh ofParnas (EMP) pathway and acetic acid synthesis branch were weakened by ammonium sulfate. Meanwhile, malic enzyme activity increased and the accumulation of NADPH was also enhanced. These might be the reason for the improvement of polyunsaturated fatty acids.
Keywords Schizochytrium sp; Metabonomics; Principal component analysis; Ammonium sulfate; Docosahexaenoic acid

