加速溶剂萃取—硅胶萃取净化—气相色谱/质谱法检测地表水中有机氯农药和多氯联苯
邵阳 杨国胜 韩深 马玲玲 罗敏 刘韦华 徐殿斗

摘要:建立了加速溶剂萃取硅胶固相萃取净化气相色谱/质谱同时检测地表水中15种有机氯农药(OCPs)和82种多氯联苯(PCBs)的方法。对影响OCPs和PCBs回收率的主要因素进行优化,得出最优的萃取条件: 3次静态萃取循环,100℃的萃取温度,丙酮/正己烷(1∶1, V/V)为萃取液,静态萃取10 min。在最优条件下,15种OCPs和82种PCBs在加标水溶液中的回收率分别为70.9%~130%和52.5%~89.1%。日内和日间相对标准偏差分别为1.7%~16.1%和2.4%~33.3%。OCPs和PCBs混合标样在10~800 μg/L范围内线性相关系数(R2)均大于0.995。OCPs和PCBs方法檢测限分别为0.13~0.38 ng/L和0.10~0.32 ng/L。相比于传统萃取方法,本方法回收率高、萃取时间短、试剂用量少。应用本方法测得北京城区地表水中OCPs和PCBs的含量范围分别为n.d.~3.45 ng/L和n.d.~4.88 ng/L。
关键词 :加速溶剂萃取;有机氯农药;多氯联苯;地表水;北京;气相色谱/质谱联用
1 引 言
有机氯农药(OCPs)和多氯联苯(PCBs)是环境中广泛存在的两类持久性有机污染物(POPs)。由于两类物质的大量使用,同时其具有生物累积性、环境难降解性以及对人体的“三致效应”(致癌、致畸、致突变)等,OCPs和PCBs对人体和生态环境造成了极大的危害[1~5]。20世纪60年代,我国曾大量使用OCPs和PCBs。仅滴滴涕(DDTs)和六六六(HCHs)的使用量就分别达到了4.0×105吨和4.9×106吨[6],约占全世界使用量的20%和30%。根据文献调研,20世纪80年代前,全世界范围内工业PCBs的产量达到1.0×106吨,其中大约有1.0×104吨在我国生产[7]。由于OCPs和PCBs的不当管理及使用,我国环境的多种介质中均有两类物质被检测出[1]。水环境的污染尤为严重,OCPs和PCBs通过污水排放、农业灌溉径流、干湿沉降、大气/水交换等方式最终富集进入水环境[8]。
对土壤、大气、干湿沉降以及地表水中OCPs和PCBs含量及来源等方面的研究已多见报道[9~13]。总体而言,环境介质中OCPs和PCBs含量呈现下降趋势。例如,1993年北京郊区土壤中∑HCH和∑DDT 浓度分别为327和1420 ng/g[14],2015年∑HCH和∑DDT浓度降低至16.1和275 ng/g[15]。北京地区大气环境中PCBs浓度由119.6 pg/m3下降至23.1 pg/m3[16,17]。同样地,在北京地区地表水中OCPs和PCBs含量也呈现类似的下降趋势。2002年通惠河水体中∑HCH、∑DDT和∑PCBs平均浓度分别为356.38, 91.81和105.5 ng/L[13];2005年时,其浓度则下降至18.0, 6.22和20.8 ng/L[18]。潮白河则只能检测出极低浓度的PCBs[19]。目前环境样品中常用的处理方法包括液液萃取[12,20]、索氏提取[19]、固相萃取[21]等。虽然这些方法成熟、稳定,但是耗时、耗力,同时消耗大量有毒有害有机试剂。本研究利用XAD2树脂吸附水体中OCPs和PCBs,同时利用加速溶剂萃取(ASE)、硅胶柱净化、气相色谱/质谱联用的技术,检测地表水中痕量OCPs和PCBs。本方法萃取速度快、灵敏度高、检测限低、基质影响小,同时减少有毒有害试剂的使用量并实现自动化。
2 实验部分
2.1 仪器与试剂
78905975C型气相色谱三重四级杆质谱仪(美国Agilent公司);DB5MS色谱柱(60 m×0.25 mm i.d.×0.25 μm);ASE300型加速溶剂萃取仪(美国Dionex公司);EYELA1000旋转蒸发仪(日本Pikakikai公司);氮吹仪(美国Organomation Associates Jnc.公司);超纯水仪(美国Millipore公司)。
15种OCPs包括:γ六六六、δ六六六、七氯、顺氯丹、反氯丹、氧化氯丹、α硫丹、β硫丹、硫丹硫酸酯、4,4′滴滴涕、2,4′滴滴涕、4,4′滴滴伊、2,4′滴滴伊、4,4′滴滴滴和2,4′滴滴滴(德国Dr. Ehrenstorfer公司)。PCBs混合标样包括二氯至九氯共82种PCBs(美国Accustander公司);丙酮、正己烷、二氯甲烷、甲苯(HPLC级,美国Fisher Scientific或J.T Baker公司);XAD2树脂(美国Amberlite公司);100~200目硅胶(德国Merck公司)经过300℃活化后, 加入3.5%硅胶质量浓度的超纯水去活,备用。
2.3 样品分析
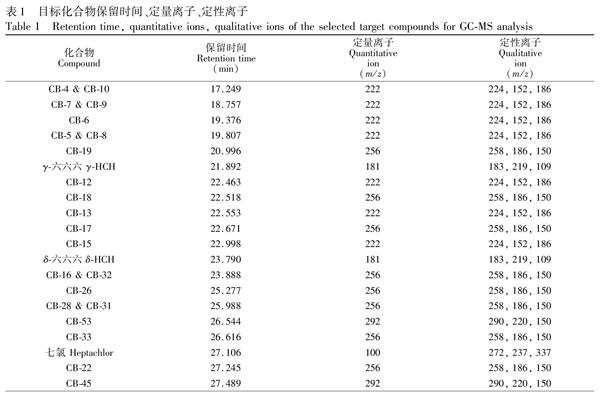
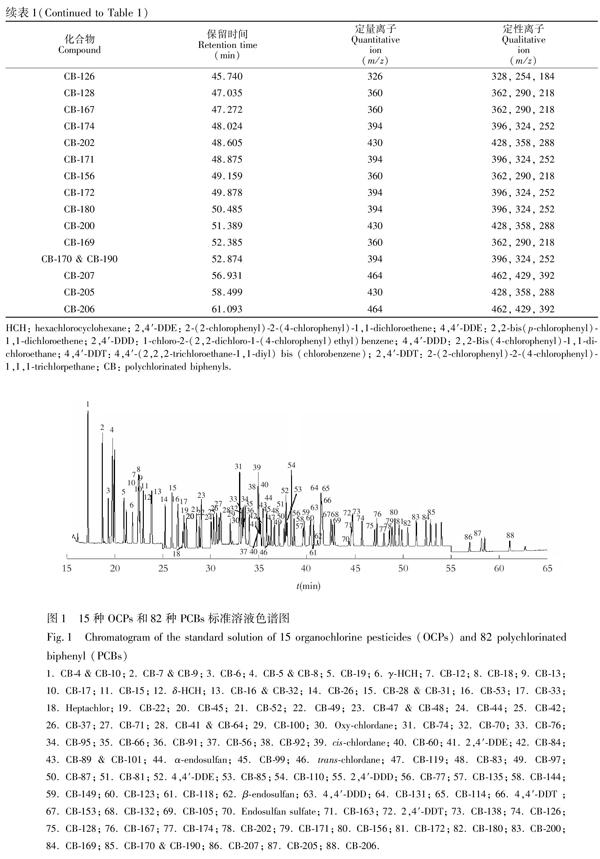
气相色谱条件如下:进样口温度为290℃;进样量为1.0 μL;采用不分流模式进样;色谱质谱接口温度为280℃;升温程序为: 90℃保持1.0 min,以20℃/min升至170℃,以2℃/min升至280℃,并保持5.0 min;载气为纯度>99.999%的氦气;载气流速为0.8 mL/min。质谱条件如下:电离方式为EI模式;电离能量为70 eV;离子源温度为230℃;四极杆温度为150℃;选择离子监测模式(SIM)。气相色谱/质谱的保留时间、定量离子、定性离子如表1所示。标准溶液的色谱图见图1。
3 结果与讨论
3.1 ASE条件优化
本研究中XAD2树脂ASE萃取条件的优化主要参考美国标准方法EPA3545A[23],在萃取压力为1500 psi (10.4 MPa)、淋洗体积为60%、吹扫100 s的条件下优化了循环次数、萃取温度、萃取剂以及静态萃取时间。为保证准确性和精密度,每个条件的优化都研究了3个样品和1个空白样品。
3.1.1 萃取循环次数的优化 萃取循环次数是影响ASE萃取效率的重要因素,大部分目标化合物都在第一次循环中萃取出来[24,25]。但是,随着萃取的继续进行,目标化合物回收率也有提高。为了得到XAD2树脂中OCPs和PCBs萃取最优循环次数,考察了1~5次循环对OCPs和PCBs萃取效率的影响。由图2可知,当循环次数从1次增加到3次时,OCPs和PCBs回收率明显提高,提高约21.1%~54.0%。回收率增加最多的是β硫丹,提高54.0%。萃取循环3次时,回收率在57.3%~138%之间。萃取循环次数增加至4次、5次时,目标化合物回收率再无明显变化。综合考虑目标化合物的回收率和萃取试剂的使用量,本研究选取3次循环作为最优萃取循环次数。
3.1.2 萃取温度的优化 萃取温度影响萃取速度和效率,温度提高,溶剂粘性降低,萃取能力增强,目标化合物更易于被萃取出样品基质。而萃取不同样品时,最优的萃取温度则不同。比如,萃取沉积物中PCBs和PAHs,90℃时回收率最佳[26];萃取尘土中PCBs,140℃时回收率最好[27];而萃取XAD2树脂中的农药表明,150℃为最优萃取温度[28]。过高的萃取温度易造成部分OCPs分解。鉴于此,本研究考察了80℃、100℃、120℃分别对OCPs和PCBs萃取效率的影响。由图3可知,萃取温度为100℃时,OCPs和PCBs回收率最好,为60.4%~124.0%。萃取温度从80℃增加到100℃时,回收率增加范围在0.05% (β硫丹)~33.0% (CB5 & CB8)之间。而120℃时,回收率增加不再明显,而且随着温度升高,二氯代联苯回收率甚至降低至14.5%~36.1%。综上所述,本研究选取100℃为最优的萃取温度。
3.1.3 萃取剂的优化 萃取剂的选择是实现ASE高效萃取的另一重要条件。通过空白加标实验,研究了丙酮、正己烷、丙酮正己烷(1∶1, V/V)作为萃取剂时,对OCPs和PCBs回收率的影响。如图4所示,丙酮正己烷(1∶1, V/V)萃取时回收率最好,平均回收率在60.4%~124.0%之间;其次是丙酮、正己烷作为萃取剂时,平均回收率仅为46.7%。Ottonello等[24]研究了二氯甲烷、乙腈和丙酮正己烷(1∶1, V/V)对ASE萃取鱼肉中PCBs的影响,结果表明,应用丙酮正己烷(1∶1, V/V)时目标化合物的回收率最好。综上所述,本研究选取丙酮正己烷(1∶1, V/V)为最优的萃取剂。
3.1.4 静态萃取时间的优化 通过空白加标实验,研究了静态萃取时间为5, 10和15 min对OCPs和PCBs回收率的影响(图5)。总体而言,随着静态萃取时间从5 min增加到10 min,每种物质平均回收率均有小幅提升,约5%~10%。静态萃取时间从10 min增加到15 min时,回收率增加不明显。利用ASE萃取土壤的研究中也发现了相似结果[29]。考虑到样品处理效率,本研究选取10 min作为最优萃取时间。
3.2 ASE与索氏提取、超声萃取的对比
本研究将ASE方法与传统的索氏提取、超声萃取进行了对比。索氏提取过程如下[19]:空白加标水溶液经过XAD2树脂吸附后,树脂用150 mL丙酮正己烷(1∶1, V/V)进行索氏提取24 h。提取液经过旋转蒸发、净化后再检测。超声萃取过程如下[30]:空白加标水溶液经过XAD2树脂吸附后,树脂通过100 mL丙酮正己烷(1∶1, V/V)超声萃取30 min。重复超声萃取过程两次后,合并萃取液。后续过程与索氏提取相同。ASE、索氏提取、超声萃取3种方法对OCPs和PCBs萃取回收率分别为60.4%~124%、64.3%~133%和21.1%~123%, 结果如图6所示。ASE和超声萃取对每种OCPs和PCBs的萃取均得到较好的回收率。如ASE对4,4′DDD、氧化氯丹、CB87和CB114回收率依次为111%、97.2%、87.3%和85.5%。超声萃取对应的回收率依次为112%、99.9%、87.6%和86.4%。相比而言,索氏提取对二氯、三氯、四氯联苯和OCPs回收率较好,而对其它目标化合物的回收率均较差(<60%)。而且超声萃取所用的有机试剂量是ASE的3倍,萃取时间则是1.5倍。此外,相比ASE而言,超声萃取与索氏提取均不能够实现自动化操作。因此,新开发的ASE方法更适合地表水中OCPs和PCBs的快速检测。
3.3 精密度和准确性
通过6个加标水样验证了XAD2树脂在最优化的条件下OCPs和PCBs回收率及方法精密度。结果表明,OCPs和PCBs混合标样在10~800 μg/L范围内线性相关系数(R2)均大于0.995。15种OCPs和82种PCBs的平均回收率分别为70.9%~130%和52.5%~89.1%。除CB6等个别二氯代联苯回收率偏低外(52.5%~68.7%),其余86%的目标化合物回收率均高于70%。OCPs和PCBs方法检出限分别为0.13~0.38 ng/L和0.10~0.32 ng/L。日内和日间相对标准偏差分别为1.7%~16.1%和2.4%~33.3%。结果表明,本方法萃取速度快、灵敏度高、线性好、有机试剂量消耗少,能够满足環境样品的痕量分析要求。
3.4 实际样品的检测
通过标准添加法对玉渊潭湖水水样进行检测。15种OCPs和82种PCBs总浓度分别为6.47和9.55 ng/L。样品中,含量最多的有机氯农药为α硫丹(3.45 ng/L),其次为硫丹硫酸酯(2.86 ng/L)和β硫丹(0.048 ng/L)。CB45 (4.88 ng/L)在82种PCBs中含量最多,其次为CB5 & CB8 (0.40 ng/L)和CB12 (0.34 ng/L)。玉渊潭湖水OCPs含量与潮河(5.08 ng/L)[19]地表水含量相似,低于太湖(205.6 ng/L)[31]、鄱阳湖(20.65~115 ng/L)[32]、长江下游(14.2 ng/L)[33]水体中OCPs含量。而PCBs则略高于潮河(<0.02 ng/L)[19]、青藏高原(1.35 ng/L)[34]等地水样。
实验结果表明,XAD2树脂吸附ASE萃取固相萃取净化GC/MS检测相结合的方法速度快、灵敏度高,同时又具有线性好、重复性高、回收率相对较高等优点。实际样品分析结果表明, 本方法无基质影响、省时、有机试剂用量少,适用于地表水中OCPs和PCBs的检测。
References
1 Zhang K, Wei Y L, Zeng E Y. Sci. Total Environ., 2013, 463464: 1093-1110
2 Mrema E J, Rubino F M, Brambilla G, Moretto A, Tsatsakis A M, Colosio C. Toxicology, 2013, 307: 74-88
3 DING LiPing, CAI ChunPing, WANG DanHong. Journal of Instrumental Analysis, 2014, 33(10): 1178-1183
丁立平, 蔡春平, 王丹红. 分析测试学报, 2014, 33(10): 1178-1183
4 Nozar S L M, Ismail W R, Zakaria M P. Hum. Ecol. Risk Assess., 2014, 20(6): 1507-1520
5 Sharma B M, Bharat G K, Tayal S, Nizzetto L, Cupr P, Larssen T. Environ. Int., 2014, 66: 48-64
6 HUA XiaoMei, SHAN ZhengJun. Advances in Environmental Science, 1996, 4(2): 33-45
华小梅, 单正军. 环境科学进展, 1996, 4(2): 33-45
7 China SEPA. GEF Project Brief (GF/CPR/02/010) 2003
8 Zhang W, Ye Y B, Hu D, Ou L B, Wang X J. J. Environ. Monit., 2010, 12(11): 2153-2160
9 Zhang Y F, Fu S, Dong Y, Nie H F, Li Z, Liu X C. Bull. Environ. Contam. Toxicol., 2014, 92(4): 466-471
10 Li Y M, Zhang Q H, Ji D S, Wang T, Wang Y W, Wang P, Ding L, Jiang G B. Environ. Sci. Technol., 2009, 43(4): 1030-1035
11 XU PengJun, TAO Bu, LI Nan, ZHENG Sen, ZHAO Hu, FAN Shuang, ZHOU ZhiGuang, REN Yue, QI Li, CHEN JiPing. Chinese J. Anal.Chem., 2015, 43(3): 356-365
许鹏军, 陶 晡, 李 楠, 郑 森, 赵 虎, 范 爽, 周志广, 任 玥, 齐 丽, 陈吉平. 分析化学, 2015, 43(3): 356-365
12 Yang G S, Ma L L, Xu D D, Liu L Y, Jia H L, Chen Y, Zhang Y B, Chai Z F. Atmos. Environ., 2012, 56: 222-227
13 Zhang Z L, Huang J, Yu G, Hong H S. Environ. Pollut., 2004, 130(2): 249-261
14 Shi Y, Meng F, Guo F, Lu Y, Wang T, Zhang H. Arch. Environ. Contam. Toxicol., 2005, 49(1): 37-44
15 Li J, Huang Y, Ye R, Yuan G L, Wu H Z, Han P, Fu S. J. Geochem. Explor., 2015, 158: 177-185
16 Jaward F M, Zhang G, Nam J J, Sweetman A J, Obbard J P, Kobara Y, Jones K C. Environ. Sci. Technol., 2005, 39(22): 8638-8645
17 HONG WeiZhe, LI YingMing, ZHANG LinNan, BAO Jia, WANG Pu, ZHU ChaoFei, ZHANG QingHua. Environmental Chemistry, 2015, 34(3): 410-416
洪維哲, 李英明, 张林楠, 鲍 佳, 王 璞, 朱超飞, 张庆华. 环境化学, 2015, 34(3): 410-416
18 Li X M, Zhang Q H, Dai J Y, Gan Y P, Zhou J, Yang X P, Cao H, Jiang G B, Xu M.Q. Chemosphere, 2008, 72(8): 1145-1151
19 Yu Y, Li Y X, Shen Z Y, Yang Z F, Mo L, Kong Y H, Lou I. Chemosphere, 2014, 114: 136-143
20 Yang G S, Ma L L, Xu D D, Liu L Y, Jia H L, Chen Y, Zhang Y B, Chai Z F. Atmos. Environ., 2012, 61: 614-619
21 Herbert B M J, Halsall C J, Villa S, Jones K C, Kallenborn R. Environ. Sci. Technol., 2005, 39(9): 2998-3005
22 Xu D D, Dan M, Song Y, Chai Z F, Zhuang G S. Atmos. Environ., 2005, 39(22): 4119-4128
23 EPA Method 3545A. Pressurized Fluid Extraction (PFE). United States Environmental Protection Agency, 1996
24 Ottonello G, Ferrari A, Magi E. Food Chem., 2014, 142: 327-333
25 Mercier F, Gilles E, Saramito G, Glorennec P, Bot B. J. Chromatogr. A, 2014, 1336: 101-111
26 WANG DaoWei, ZHAO ShiMin, JIN Wei, SHEN QiuYing, HU Ping, HUANG Bin, PAN XueJun. Chinese J. Anal. Chem., 2013, 41(6): 861-868
王道瑋, 赵世民, 金 伟, 沈秋莹, 胡 平, 黄 斌, 潘学军. 分析化学, 2013, 41(6): 861-868
27 Klees M, Hiester E, Bruckrnann P, Schmidt T C. J. Chromatogr. A, 2013, 1300:17-23
28 Raeppel C, Fabritius M, Nief M, Appenzeller B M R, Millet M. Talanta, 2014, 121: 24-29
29 YAN Rui, SHAO MingYuan, JU FuLong, SONG DaQian, ZHANG HanQi, YU AiMin. Chinese J. Anal. Chem., 2013, 41(2): 315-316
闫 蕊, 邵名媛, 鞠福龙, 宋大千, 张寒琦, 于爱民. 分析化学, 2013, 41(2): 315-316
30 Lv J G, Shi R G, Chai Y M, Liu Y, Wang Z H, Feng J M, Zhang M. Bull. Environ. Contam. Toxicol., 2010, 85(2): 137-141
31 Wu C F, Luo Y M, Gui T, Huang Y J. Sci. Total Environ., 2014, 470: 1047-1055
32 Zhi H, Zhao Z H, Zhang L. Chemosphere, 2015, 119: 1134-1140
33 Tang Z W, Huang Q F, Yang Y F, Zhu X H, Fu H H. Ecotox. Environ. Safe, 2013, 87: 89-97
34 GAI Nan, PAN Jing, CHEN DaZhou, YANG YongLiang. China Environmenalt Science, 2014, 34(4): 996-1003
盖 楠, 潘 静, 陈大舟, 杨永亮. 中国环境科学, 2014, 34(4): 996-1003
Abstract A rapid and sensitive analytical method for the simultaneous determination of 15 organochlorine pesticides (OCPs) and 82 polychlorinated biphenyls (PCBs) in water using accelerate solvent extraction (ASE) and silica gel solid phase extraction (SPE) cleanup followed by gas chromatographymass spectrometry (GCMS) analysis was developed. The main potential influence parameters which affected the recoveries of OCPs and PCBs were investigated for the optimum ASE efficiency. Finally, 3 static extraction cycles, 100℃ of extraction temperature, mixture of acetone and hexane (1∶1, V/V) as extraction solvent, and 10 min of static extraction time were used. Under the optimized conditions, the recoveries of 15 OCPs and 82 PCBs in spiked water were 70.9%-130% and 52.5%-89.1%, respectively. The intraday and interday relative standard deviation was 1.7%-16.1% and 2.4%-33.3%, respectively. The correlation coefficients (R2) for OCPs and PCBs were above 0.995 in the range of 10-800 μg/L. And the method detection limits were characterized as 0.13-0.38 ng/L for OCPs and 0.10-0.32 ng/L for PCBs. Compared to the traditional methods, the developed method had the advantages of higher recoveries and less consumption of extraction time and toxic solvent. Subsequently, the developed method was applied to measure the concentrations of OCPs and PCBs in the surface water of Beijing. The concentrations of OCPs and PCBs were in the range of not detected (n.d.)-3.45 ng/L and n.d.-4.88 ng/L, respectively.
Keywords Accelerate solvent extraction; Organochlorine pesticides; Polychlorinated biphenyls; Surface water; Gas chromatography/mass spectrometry

