纳升液相色谱—高分辨串联质谱分析尿液多肽组及其翻译后修饰
洪晓愉 李水明 王勇


摘要:多肽组是指生物体表达的所有多肽,尿液等体液的多肽组是生物标记物的重要来源。本研究采用氧化石墨烯磷酸镧纳米磁性复合材料分离富集尿液多肽,进行纳升液相色谱高分辨串联质谱分析,从单一样本中鉴定了归属于123个蛋白质的790条肽段。研究表明,这些肽段在蛋白质水平上不是平均分布的。此外,本研究检测到了肽段的氧化、磷酸化和脱氨化等翻译后修饰现象,观察到了尿液多肽的阶梯序列性,从蛋白水平上对尿液多肽组进行了生物信息学分析,结果表明,这些多肽所归属的大部分蛋白质之间存在相互作用。本方法可为在尿液中寻找疾病的标志物提供方法学支持。
关键词 :多肽组; 纳升液相色谱高分辨串联质谱; 尿液; 翻译后修饰
1 引 言
随着基因组学、转录组学和蛋白质组学在生命科学领域中的迅速发展[1],多肽组学的研究也逐渐引起人们的关注。从最简单的腔肠动物到最高等脊椎动物中,大部分动物体内都存在多肽[2]。多肽组学的研究内容包括体液、组织和细胞等生物体内全部内源性多肽的组成、功能和变化规律[3]。有些多肽作为蛋白质合成、加工、降解的产物[4],可以反映机体内蛋白质的异常代谢过程。蛋白质被剪切成不同的肽段后还可发挥特定的功能[5]。有些多肽作为生化信使分子,如多肽激素、神经多肽、细胞因子、酶抑制因子等,组织调控机体内很多生理生化过程,与疾病的产生有着密切的关系。作为蛋白质组学的延伸,多肽组学技术能很好地监测到低分子量蛋白质的变化。
在疾病生物标志物的筛选、疾病诊断、疾病监测、疗效评价及预防等方面,多肽组学也发挥了重要作用[6]。尿液作为机体代谢的终端,用于检测疾病的样本时具有可持续性和非侵袭性的优点[7]。表面增强激光解吸/电离飞行时间质谱仪(SELDITOF MS)、基质辅助激光解吸电离质谱(MAIDITOF MS或者MAIDITOF/TOF MS)[8]以及ESI串联质谱仪,例如三重四级杆质谱仪、离子阱或者四级杆飞行时间质谱仪[9]都可对多肽进行检测和分析。利用MAIDITOF MS,研究者在胃癌、乳腺癌[10]、膀胱癌[11],IgA肾病[12]等的早期诊断研究中寻找到一些多肽生物标志物。但是此类方法在在寻找疾病差异多肽时,重点在于差异峰的比较,不能准确鉴定蛋白质及其翻译后修饰。
氧化石墨烯磷酸镧纳米磁性复合材料(LaGM)是由石墨烯、LaPO4納米棒和Fe3O4纳米粒子构成的三重复合材料,能够应用于低丰度多肽的快速富集,如可有效富集尿液中的多肽[13]。本研究采用LaGM分离和富集尿液多肽,采用纳升液相色谱串联高分辨飞行时间质谱仪鉴定多肽序列和翻译后修饰,1.5 mL尿样单一样本中鉴定出归属于123种蛋白质的790条肽段,其中有91条肽段带有氧化、磷酸化和脱氨化翻译后修饰。本研究为利用尿液多肽组研究疾病生物标志物提供了快速高效的分析方法。
2 实验部分
2.1 仪器与试剂
Eksigent nanoLCUltraTM 2D 二维纳升液相色谱系统、TripleTOF 5600 高分辨质谱仪、Protein Pilot 4.5软件(AB SCIEX,美国);真空冷冻干燥机、超纯水仪(Thermo Scientific,美国);C18反相色谱捕集柱(100 μm × 3 cm, 3 μm, 150 , Eksigent,美国);C18反相色谱分析柱(75 μm×15 cm, 3 μm,120 ,Eksigent美国)。
LaGM按文献[13]方法自行制备; 实验用水为超纯水;纳升反相色谱流动相A:98%水、0.1%甲酸和2%乙腈,纳升反相色谱流动相B:2%水、0.1%甲酸、98%乙腈。
2.3 纳升液相色谱TripleTOF质谱分析
将磁性材料分离后冻干的多肽样品用流动相A溶解。在线NanoRPLC液相色谱在Eksigent nanoLCUltraTM 2D系统进行,样品以2 μL/min的流速上样到C18预柱上(100 μm×3 cm,3 μm,150 ),以2 μL/min流速冲洗脱盐10 min。分析柱为C18反相色谱柱(75 μm×15 cm, 3 μm,120 ),梯度洗脱:0~42 min,5%~25% B;42~56 min,25%~40% B;56~64 min,80% B;64~70 min,5% B。质谱分析采用TripleTOF 5600系统(AB SCIEX)结合纳升喷雾III离子源(AB SCIEX),喷雾电压2.4 kV,气帘气压30 psi,雾化气压5 psi,加热温度150℃,一级TOFMS单张图谱扫描时间为250 ms,每次IDA循环下最多采集35个电荷为2+~8+,且单秒计数大于100的二级图谱,每张二级图谱的累积时间为80 ms。每次循环时间固定为2.5 s, 碰撞室能量设定适用于所有前体离子碰撞诱导解离(CID),动态排除设置为11 s。
2.4 数据分析
采集到的质谱原始wiff图谱文件,采用Protein Pilot Software v. 4.5(AB SCIEX, USA)软件进行数据加工处理和检索分析,数据库为uniprot库中的Homo sapiens人种专一数据库(包含20210条蛋白质序列,2015年1月2日下载),检索参数设置为非酶切、磷酸化强调和生物学修饰,检索方式为彻底分析,假阳性率控制为1%FDR。
2.5 生物信息学分析
在String10(http://www.stringdb.org/)进行蛋白质相互作用网络图分析,String数据库是一个搜寻已知蛋白质之间和预测蛋白质之间相互作用的系统,这种相互作用既包括蛋白质之间直接的物理相互作用,也包括蛋白质之间间接的功能的相关性。蛋白质聚类分析在PANTHER(http://www.pantherdb.org/)上进行,Panther是基于基因本体论对蛋白质进行分类的数据库。
3 结果与讨论
3.1 尿液多肽组及其在蛋白质水平上的分析
本研究采用纳升液相色谱高分辨串联质谱分析,在1.5 mL尿样中共鉴定到790条特异性多肽,其中序列相同、修饰不同的肽段视为不同的肽段,这些肽段的分子量分布在960~6500,理论上等电点分布在3.77~14.38(图1),肽段电荷数2~7。在不考虑修饰的情况下,鉴定到的特异性肽段有721条,即至少在69条肽段上发生一种或多种修饰。这些肽段在蛋白水平上归属于123种蛋白质,95%置信度下这些蛋白质的覆盖率为0.75%~93.88%,然而这些肽段在蛋白质水平分布并不平均,搜库得分排位前10位的蛋白质占50.88%,而排位后23位的蛋白质都各有一条肽段被鉴定,在33种蛋白的肽段中鉴定到翻译后修饰。例如在抗胰蛋白酶的94条肽段中有17条肽段发生翻译后修饰,尿液中常见蛋白分泌型尿调节蛋白鉴定到的40条肽段中有14条发生修饰。排名前25位蛋白质的总肽段数目和翻译后修饰数目如表1所示,翻译后修饰的肽段数与鉴定到的肽段总数之间并没有明显的正相关性。
3.2 翻译后修饰的类型
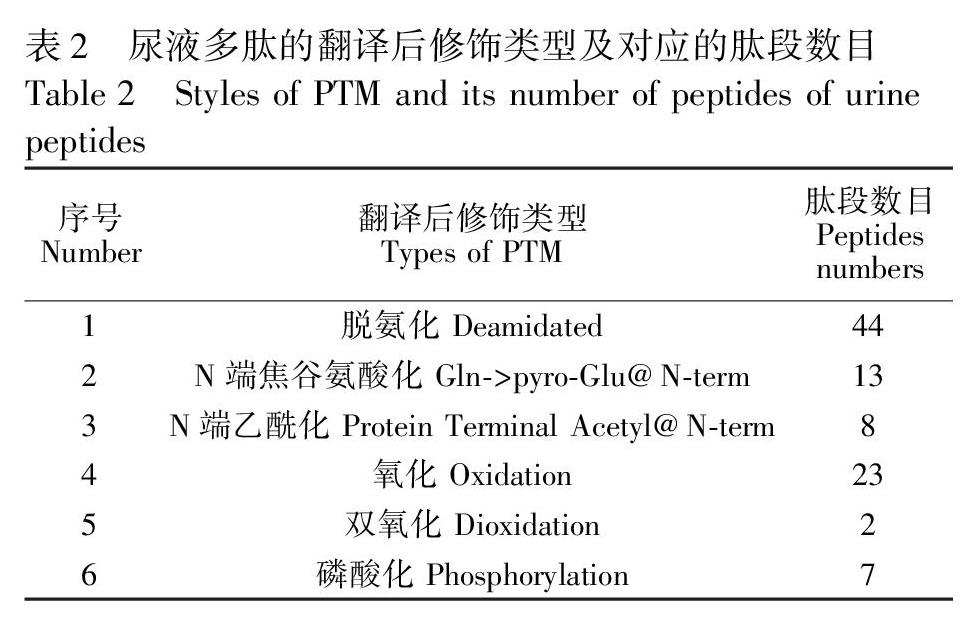
本研究共检测到6种主要的翻译后修饰,即脱氨、N端焦谷氨酸化、N端乙酰化、氨基酸残基氧化、双氧化和磷酸化(表2)。其中发生脱氨反应的共有44条肽段,主要发生在谷氨酰胺和天冬酰胺两种氨基酸上,发生在谷氨酰胺上的有28条,而天冬酰胺上的有16条;发生氧化修饰的共有23条,其中发生在脯氨酸上的有7条,在甲硫氨酸上的有15条(表3),发生在天冬氨酸上的有1条。值得指出的是,肽段发生脯氨酸位点的氧化修饰时,常是多个脯氨酸的位点发生氧化修饰;而肽段发生甲硫氨酸位点的氧化修饰时,则只有一个甲硫氨酸的位点被氧化。甲硫氨酸残基的氧化常与疾病密切相关,蛋白质的甲硫氨酸残基能够被多种类型的活性氧(ROS)氧化, 生成S构型的蛋氨酸亚砜(MetS(O))和R构型的蛋氨酸亚砜(MetR(O)), 导致蛋白功能的降低或丧失。蛋白质甲硫氨酸的氧化与衰老相关的疾病密切相关,例如帕金森病[14]。此外,本研究还鉴定到7条磷酸化修饰肽段。
3.3 尿液多肽组的阶梯序列特征
在鉴定到的尿液的多肽中,存在一系列相互之间无论是N端还是C端只相差一个或几个氨基酸的阶梯状肽段[15](表4和表5)。在血清血浆多肽组中均出现这样階梯多肽的规律,并且这些阶梯多肽在整个血清或血浆多肽组中占主要地位,能够体现体内特定的蛋白水解作用[16]。本研究表明,该现象在尿液多肽组中同样存在。Villanueva等[15]认为,来源于纤维蛋白肽A的9个阶梯多肽可能成为癌症的特征性多肽。在尿液总共鉴定到的123种蛋白中,鉴定到至少2条以上阶梯多肽的蛋白有61个,C端相差一个或几个氨基酸的阶梯肽段如表4所示。在β2巨球蛋白(β2microglobulin)鉴定到的一系列肽段中,LLKNGERIEKVEHSDLSFSK的C端依次增加5个氨基酸D, W, S, F, K,最长的为LLKNGERIEKVEHSDLSFSKDWSFY;在分泌型尿调蛋白(Uromodulin,secreted form)、富亮氨酸α2糖蛋白(Leucinerich α2glycoprotein)鉴定到的肽段中也是如此。肽段N端出现氨基酸依次递增,例如表5中列出的血清丝氨酸蛋白酶抑制因子(Plasma serine protease inhibitor)、朊蛋白(Major prion protein (Fragment))、钠钾转运ATP酶(Sodium/potassiumtransporting ATPase)等。
3.4 尿液多肽组的生物信息学分析
目前,多肽组研究较多根据不同分子量的质谱峰的比较,本研究利用纳升液相色谱高分辨串联质谱分析尿液多肽组学,不仅鉴定了肽段序列信息,并且从这些肽段归属的蛋白质水平分析了这些蛋白质之间的相关性,为后续的蛋白质降解机制研究提供了新的依据。将得到的123种蛋白在String(http://www.stringdb.org/)数据库中进行检索,共检索到99种蛋白质,其中68种蛋白之间存在相互作用关系,如图2所示,在肽段水平上没有看到的潜在联系能够在蛋白质水平上予以分析。在PANTHER数据库(http://www.pantherdb.org/)中对这些蛋白进行聚类分析后发现,在尿液中鉴定到的这些多肽主要参与生物调节(10.8%)、代谢过程(21%)以及细胞进程(15.6%)等(图3A),主要承担催化功能(35.4%)、结合功能(18.8%)以及受体功能(15.6%)等(图3B),主要分布在胞外区(47.1%)和细胞内(17.6%)(图3C)。
4 结 论
本研究采用纳升液相色谱高分辨飞行时间质谱分析尿液多肽组及其翻译后修饰,建立了一种快速灵敏的尿液多肽组学分析方法。研究结果表明,尿液多肽组具有较宽范围的分子量和等电点分布,尿液多肽组在蛋白质水平上分布具有不均一性,说明纳升液相色谱高分辨串联质谱可以更全面细致地给出尿液多肽组信息,为相关医学和生物学研究提供了方法学支持。
References
1 Anderson N L, Matheson A D, Steiner S. Curr. Opin. Biotech., 2000, 11(4): 408-412
2 Baggerman G, Verleyen P, Clynen E, Huybrechts J, De Loof A, Schoofs L. J. Chromatog. B, 2004, 803(1): 3-16
3 Schrader M, SchulzKnappe P. Trends Biotechnol., 2001, 19: 55-60
4 Xiang Y, Kurokawa M S, Kanke M, Takakuwa Y, Kato T. Method Mol. Biol., 2010, 615: 259-271
5 Schulte I, Tammen H, Selle H, SchulzKnappe P. Expert Rev. Mol. Diagn., 2005, 5(2): 145-157
6 XIE Wei, WANG Juan, YU Wei, YANG Li, LIU XiaoLi. Journal of Hygiene Research, 2013, 6: 1031-1035
謝 尉, 王 娟, 于 薇, 杨 笠, 刘小力. 卫生研究, 2013, 6: 1031-1035
7 Dekker L J, Boogerd W, Stockhammer G, Dalebout J C, Siccama I, Zheng P P, Bonfrer J M, Verschuuren J J, Jenster G, Verbeek M M, Luider T M, Smitt P A S. Mol. Cell Proteomics., 2005, 4(9): 1341-1349
8 Verhaert P, UttenweilerJoseph S, de Vries M, Loboda A, Ens W, Standing K G. Proteomics, 2001, 1(1): 118-131
9 Bakun M, Karczmarski J, Poznanski J, Rubel T, Rozga M, Malinowska A, Sands D, Hennig E, Oledzki J, Ostrowski J, Dadlez M. Proteomics Clin. Appl., 2009, 3(8): 932-946
10 Boccardo F, Rubagotti A, Nuzzo P V, Argellati F, Savarino G, Romano P, Damonte G, Rocco M. Profumo A, Int. J. Cancer, 2015, 137(10): 2394-2402
11 Zlotta A R. Euro. Urol., 2006, 49(4): 756-757
12 Graterol F, NavarroMunoz M, Ibernon M, Lopez D,Troya M I, Perez V,Bonet J, Romero R. BMC Nephrol., 2013, 14: 82
13 Cheng G, Wang Z G, Liu Y L, Zhang J L, Sun D H, Ni J Z. Chem. Commun., 2012, 48(82):10240-10242
14 Miotto M C, Rodriguez E E, ValienteGabioud A A, TorresMonserrat V, Binolfi A, Quintanar L, Zweckstetter M, Griesinger C, Fernandez C O. Inorg. Chem., 2014, 53(9): 4350-4358
15 Villanueva J, Shaffer D R, Philip J, Chaparro C A, ErdjumentBromage H, Olshen A B, Fleisher M, Lilja H, Brogi E, Boyd J, SanchezCarbayo M, Holland E C, CordonCardo C, Scher H I, Tempst P. J. Clin. Invest., 2006, 116(1): 271-284
16 Koomen J M, Li D H, Xiao L C, Liu T C, Coombes K R, Abbruzzese J, Kobayashi R. J. Proteome Res., 2005, 4(3): 972-981
Abstract Peptidomics is an emerging field branching from proteomincs that targets endogenous peptides of a whole organism or a subsystem. Many peptides in body fluids including urine are biomarkers with higher clinical sensitivity and specificity. In this study, we separated and enriched these peptides in human urine by the graphene oxidelanthanum phosphate composite nanomaterial (LaGM), then identified and analyzed by nano liquid chromatographyhigh resolution tandem mass spectrometry. In single urine sample, 790 peptides which belong to 123 proteins were identified, and some posttranslational modifications including oxidation, phosphorylation, deamidated etc, were also identified. There existed a series of peptide ladders in urine peptidomic. At last, the string analysis on protein level revealed strong interaction among the proteins which the identified peptides belonged. This method can provide support for finding the biomarkers of disease in urine.
Keywords Peptidomic; Nano liquid chromatographyhigh resolution tandem mass spectrometry; Urine; Posttranslational modifications

