c-junN端蛋白激酶1磷酸化与糖尿病大鼠早期心肌损伤关系研究
陈昕明,刘晓亮,吴 伟
·论著·
c-junN端蛋白激酶1磷酸化与糖尿病大鼠早期心肌损伤关系研究
陈昕明,刘晓亮,吴 伟
目的探讨c-junN端蛋白激酶1(JNK1)磷酸化与糖尿病(DM)大鼠早期心肌损伤的关系。方法2013年10月—2014年7月,80只SPF级雌性SD大鼠适应性喂养1周后,采用随机数字表法选取60只作为DM模型组,给予高糖高脂饮食饲养4周,一次性左下腹腹腔注射1%链脲佐菌素(STZ)溶液(35 mg/kg);另外20只作为对照组(A组),给予普通饮食饲养4周,一次性左下腹腹腔注射等量枸橼酸缓冲液。最终共48只大鼠造模成功,采用随机数字表法分为B组、C组、D组,各16只。C组大鼠腹腔注射SP600125,D组大鼠皮下埋置含有血管紧张素Ⅱ(AngⅡ)+0.9%氯化钠溶液的植入式胶囊渗透压泵,A组、B组大鼠腹腔注射0.9%氯化钠溶液。饲养6周后,采用随机数字表法从4组大鼠中分别选取10只,检测大鼠心体比(H/B)、左心室质量指数(LVMI),HE染色观察心肌组织形态学改变,免疫组化SABC法检测JNK1、磷酸化JNK1(p-JNK1)、瞬时受体电位通道C亚族(TRPC)6、胶原蛋白Ⅰ(collagen Ⅰ)表达水平。结果B组、C组、D组大鼠H/B大于A组,B组、D组大鼠LVMI大于A组(P<0.05);C组大鼠H/B、LVMI小于B组、D组(P<0.05)。A组大鼠心肌细胞排列整齐,细胞间连接紧密,心肌纹理清晰;B组、C组、D组大鼠心肌细胞均有不同程度的肥大性改变,细胞间隙增宽,心肌细胞排列紊乱,心肌纹理欠清晰。B组、C组、D组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平高于A组(P<0.05);C组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平低于B组(P<0.05);D组大鼠p-JNK1、TRPC6、collagen Ⅰ表达水平高于B组、C组,JNK1表达水平高于C组(P<0.05)。结论高糖环境可诱导JNK1磷酸化,进而影响下游TRPC6信号表达,造成胶原蛋白沉积过多,导致心肌细胞肥大和纤维化,从而引起糖尿病心肌病的发生发展。
糖尿病;心肌疾病;c-junN端蛋白激酶1;瞬时受体电位通道C亚族
陈昕明,刘晓亮,吴伟.c-junN端蛋白激酶1磷酸化与糖尿病大鼠早期心肌损伤关系研究[J].中国全科医学,2016,19(27):3281-3286.[www.chinagp.net]
CHEN X M,LIU X L,WU W.Relationship between c-junN terminal kinase 1 and early injury in the myocardium of diabetic rats[J].Chinese General Practice,2016,19(27):3281-3286.
多数糖尿病(DM)患者死于心血管疾病,部分原因为特异性心肌病的存在[1],即糖尿病心肌病(DCM)[2]。DCM是DM引起心脏微血管病变和心肌代谢紊乱所致的心肌广泛性坏死,早期常表现为心肌顺应性降低和舒张期充盈受阻为主的舒张功能不全,晚期以收缩功能不全为主,易发生充血性心力衰竭[3-4]。但DCM的发病机制目前尚未明确。近年来研究认为,可能存在c-junN端蛋白激酶1(JNK1)等信号分子通过瞬时受体电位通道C亚族(TRPC)影响下游信号造成心肌损伤,但其调控机制尚不明确[5]。既往研究表明,血管紧张素Ⅱ(AngⅡ)可以与血管紧张素Ⅱ 1型(AT-1)受体结合,通过活化AT-1受体而激活JNK1信号通路,在一系列心血管系统疾病以及代谢性疾病中起到重要作用[6-7]。SP600125是一种常用的JNK1信号通路高选择性抑制剂,可以通过竞争性结合ATP位点抑制JNK1活性。本研究在既往研究的基础上[8],探讨JNK1磷酸化与DM大鼠早期心肌损伤的关系,寻找DCM发生发展的关键环节,以达到早期预防疾病、开发新型药物乃至提供靶向治疗的目的。
1 材料与方法
1.1实验动物SPF级雌性SD大鼠80只,6周龄,体质量(200±20)g,购自北京维通利华实验动物技术有限公司。
1.2主要仪器与试剂链脲佐菌素(STZ)、AngⅡ购自美国Sigma公司,SP600125购自武汉博士德生物工程有限公司。
1.3研究方法
1.3.1动物模型制备及分组2013年10月—2014年7月,将80只SD大鼠于屏障环境大鼠饲养盒内适应性喂养1周后,采用随机数字表法选取60只作为DM模型组,给予高糖高脂饮食饲养4周后,禁食24 h,期间自由饮水,一次性左下腹腹腔注射1% STZ溶液(35 mg/kg),另外20只作为对照组(A组),给予普通饮食饲养4周后,禁食24 h,期间自由饮水,一次性左下腹腹腔注射等量枸橼酸缓冲液。分别于24 h、48 h后检测血糖,以空腹血糖>11.1 mmol/L,餐后2 h血糖>16.7 mmol/L,且大鼠出现多饮、多食、多尿为成模标准。最终共48只大鼠造模成功,采用随机数字表法分为B组、C组、D组,各16只。C组大鼠腹腔注射SP600125(溶于1%二甲基亚砜),15 mg/kg,隔日1次;D组大鼠皮下埋置含有AngⅡ+0.9%氯化钠溶液的植入式胶囊渗透压泵,700 ng·kg-1·d-1;A组、B组大鼠腹腔注射0.9%氯化钠溶液,20 μg·kg-1·d-1。各组大鼠分组处理,连续饲养6周,其中A组大鼠继续给予普通饮食,B组、C组、D组大鼠给予高糖高脂饮食,自由饮水。
1.3.2检测大鼠心体比(H/B)、左心室质量指数(LVMI)饲养6周后,采用随机数字表法从4组大鼠中分别选取10只,称取体质量后,戊巴比妥钠腹腔注射麻醉,剪开胸骨,暴露心脏,于主动脉根部水平离断,0.9%氯化钠溶液充分冲洗后,用滤纸吸干,称全心质量,分离左心室,称左心室质量。分别计算H/B(H/B=全心质量/体质量)及LVMI(LVMI=左心室质量/体质量)。
1.3.3HE染色观察心肌组织形态学改变垂直于心脏纵轴常规组织切片,经二甲苯脱蜡、梯度乙醇脱水,流动清水漂洗2 min,苏木素染色5 min,再次流动清水漂洗1 min,1%盐酸乙醇分化20 s,流动清水漂洗15 min返蓝,伊红染色1 min,流动清水漂洗30 s,85%乙醇脱水20 s,90%乙醇脱水30 s,95%乙醇脱水1 min (2次),无水乙醇脱水2 min(2次),二甲苯脱水2 min(2次),中性树胶封固,观察心肌组织形态学改变。
1.3.4免疫组化SABC法检测JNK1、磷酸化JNK1(p-JNK1)、TRPC6、胶原蛋白Ⅰ(collagen Ⅰ)表达水平将经免疫组化染色处理过的切片置于显微镜下观察,每份样本观察5个视野,每个视野选取5处染色区,根据积分光密度与面积的比值,计算单位面积平均光密度(MOD),以各个视野的MOD计算每个标本的MOD,以MOD作为JNK1、p-JNK1、TRPC6、collagenⅠ表达水平的半定量参数。
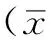
2 结果
2.1一般情况A组大鼠精神状态良好,反应敏捷,毛色白,有光泽,无死亡。DM模型组大鼠出现多饮、多食和消瘦等症状,且精神萎靡,动作迟缓,皮毛无光泽,部分出现烂尾、白内障等症状。其中B组、D组上述症状较为明显,B组死亡4只,D组死亡3只;C组上述症状相对较轻,死亡2只。
2.2H/B、LVMI比较4组大鼠H/B、LVMI比较,差异有统计学意义(P<0.01)。B组、C组、D组大鼠H/B大于A组,B组、D组大鼠LVMI大于A组,差异有统计学意义(P<0.05);C组大鼠H/B、LVMI小于B组、D组,差异有统计学意义(P<0.05,见表1)。
2.3心肌组织形态学改变A组大鼠心肌细胞排列整齐,细胞间连接紧密,心肌纹理清晰;B组大鼠心肌细胞有肥大性改变,细胞间隙增宽,心肌细胞排列明显紊乱,细胞间组织疏松,且有局灶性坏死,心肌纹理欠清晰;C组大鼠心肌细胞肥大、排列紊乱,细胞间组织疏松,心肌纹理欠清晰的现象较B组有所改善,但无法达到A组程度;D组大鼠心肌组织形态学改变较B组更为显著(见图1,本文图1~5彩图见本刊官网www.chinagp.net电子期刊相应文章附件)。
2.4JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平比较4组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平比较,差异有统计学意义(P<0.01)。B组、C组、D组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平高于A组,差异有统计学意义(P<0.05);C组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平低于B组,差异有统计学意义(P<0.05);D组大鼠p-JNK1、TRPC6、collagen Ⅰ表达水平高于B组、C组,JNK1表达水平高于C组,差异有统计学意义(P<0.05,见图2~5、表3)。
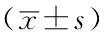
表1 4组大鼠H/B、LVMI比较
注:H/B=心体比,LVMI=左心室质量指数;a为F值;与A组比较,bP<0.05;与B组比较,cP<0.05;与C组比较,dP<0.05
Table 2Comparison of expression level of JNK1,p-JNK1,TRPC6,and collagen Ⅰ among rats in four groups
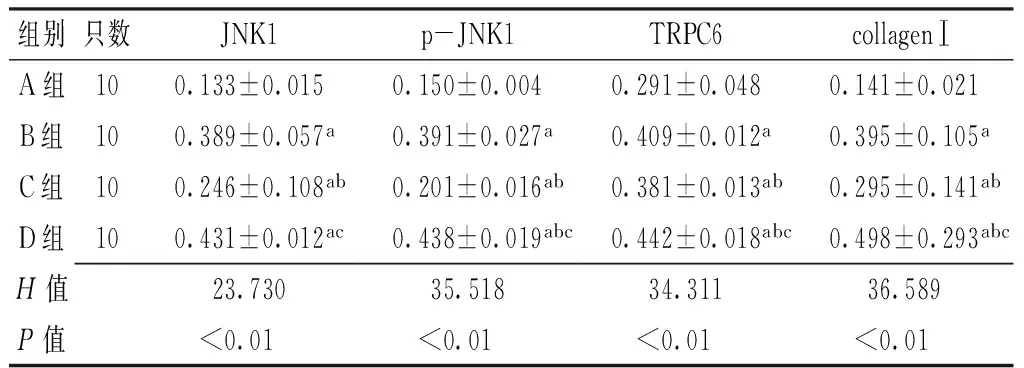
组别只数JNK1p-JNK1TRPC6collagenⅠA组100.133±0.0150.150±0.0040.291±0.0480.141±0.021B组100.389±0.057a0.391±0.027a0.409±0.012a0.395±0.105aC组100.246±0.108ab0.201±0.016ab0.381±0.013ab0.295±0.141abD组100.431±0.012ac0.438±0.019abc0.442±0.018abc0.498±0.293abcH值23.73035.51834.31136.589P值<0.01<0.01<0.01<0.01
注:JNK1=c-junN端蛋白激酶1,p-JNK1=磷酸化JNK1,TRPC=瞬时受体电位通道C亚族,collagenⅠ=胶原蛋白Ⅰ;与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05

图1 各组大鼠心肌组织HE染色结果(×400)
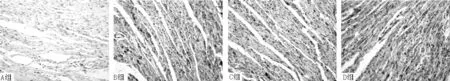
图2 4组大鼠心肌组织JNK1阳性表达情况(免疫组化SABC法染色,×400)
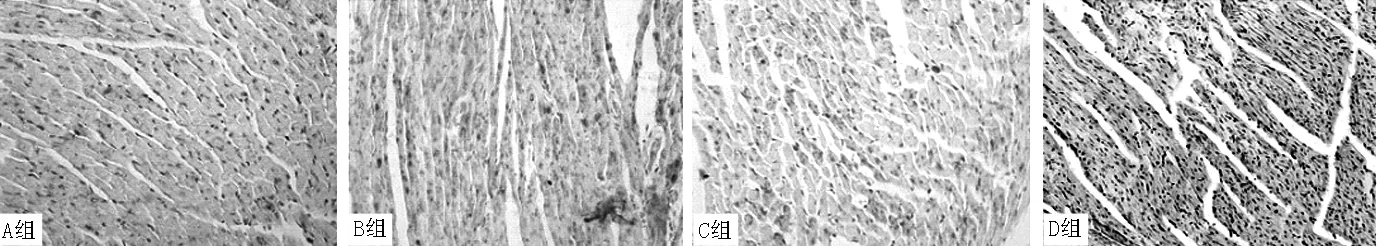
图3 4组大鼠心肌组织p-JNK1阳性表达情况(免疫组化SABC法染色,×400)
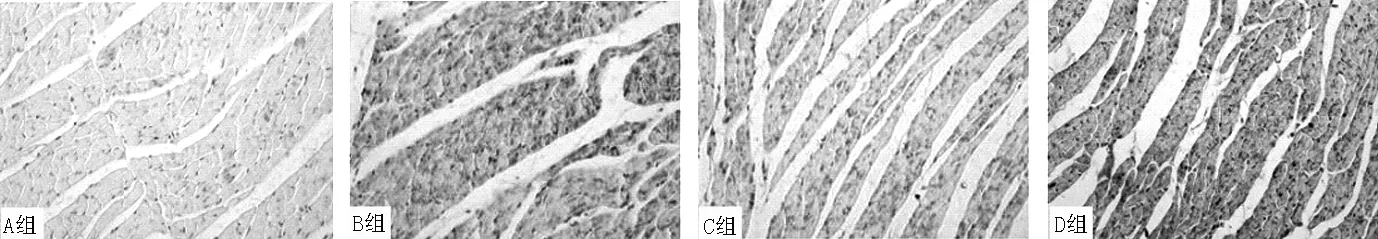
图4 4组大鼠心肌组织TRPC6阳性表达情况(免疫组化SABC法染色,×400)
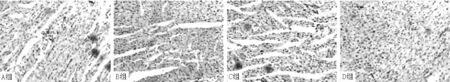
图5 4组大鼠心肌组织collagenⅠ阳性表达情况(免疫组化SABC法染色,×400)
3 讨论
JNK1是丝裂原活化蛋白激酶家族成员,可以受各种细胞外刺激而激活,表现为酪氨酸和苏氨酸残基发生磷酸化,即p-JNK1。TRPC6是位于细胞膜上的重要阳离子通道,是TRPC家族的重要亚型。DCM是DM患者的心血管并发症之一,关于DCM的发生机制,以往主要围绕糖脂代谢异常、离子紊乱、氧自由基异常等方面进行研究[9]。JNK1信号通路是一系列心血管系统疾病以及代谢疾病中的关键因子,其中JNK1磷酸化起到重要作用[10]。心肌纤维化是DCM的重要病理表现之一,与心肌间质胶原蛋白大量沉积有关,其中collagenⅠ是胶原蛋白的重要亚型。
本研究结果显示,B组、C组、D组大鼠H/B大于A组,B组、D组大鼠LVMI大于A组,B组、C组、D组大鼠心肌细胞均有不同程度的肥大性改变、心肌纹理欠清晰,提示在DM早期即出现心脏质量增加,原因主要包括两方面,一是心肌细胞肥大,二是间质纤维增生。既往研究表明,JNK1磷酸化与胰岛素抵抗、心肌细胞肥大、心肌纤维化以及细胞凋亡密切相关[11],作为JNK1的下游基因,TRPC在钙信号转导通路中发挥了重要作用,TRPC相互结合形成同型或异型聚合体后,可形成非选择性离子通道,钙、钠和镁均可由此通道进入细胞内,是钙池操纵性离子通道和受体操纵性离子通道的分子基础,介导钙内流[12-13]。B组、C组、D组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平高于A组,提示高糖可以通过激活JNK1磷酸化,促进TRPC6的表达,钙通道的建立使心肌中钙水平升高,活化多种心肌细胞肥大和心肌纤维化的相关基因,collagenⅠ大量表达、心肌间质胶原沉积,心肌细胞蛋白核酸合成增加,造成心肌细胞肥大以及心肌纤维化[14]。既往研究中,TRPC抑制剂对于DM模型动物血管系统、肾脏系统、神经系统的保护效应已经得到初步证实,抑制TRPC表达可以减轻缺氧引起的心肌肥厚[15],降低血管张力,减轻心脏负荷[16]。干扰RNA抑制TRPC6表达能明显抑制心肌细胞肥大时的肌动蛋白重组和蛋白合成[17]。心肌细胞肥大依赖于TRPC6表达水平,低TRPC6表达水平心肌细胞无形态学改变,但已出现胚胎基因表达,并对肥大刺激因子敏感,随着TRPC6表达水平增加,会出现心脏质量增加等形态学改变,且二者呈正相关[18]。本研究结果显示,C组大鼠JNK1、p-JNK1、TRPC6、collagen Ⅰ表达水平较B组降低,表明阻断TRPC6上游JNK1信号通路可明显下调TRPC6表达水平,减少钙离子内流,抑制成纤维细胞增殖,减轻心肌细胞肥大及心肌纤维化,降低DCM病变程度。D组大鼠p-JNK1、TRPC6、collagen Ⅰ表达水平高于B组、C组,JNK1表达水平高于C组,这从另一方面验证了激活JNK1磷酸化对TRPC6的表达有促进作用。DCM病理改变主要为心肌细胞肥大、变性、局灶性坏死,肌丝纤维大量丢失,心肌细胞外间质不溶性胶原蛋白积聚、纤维化[19]。其中间质纤维化是DCM致病重要因素之一,胶原蛋白大量沉积,增加心室壁的僵硬度,降低心室顺应性,致使心室舒缩功能不全。
人体内环境复杂,JNK1信号通路受多种因素影响,单一的动物模型无法完全模拟DM患者的实际状态,因此尚需大量临床研究佐证本研究结果,今后需进一步完善。
综上所述,高糖环境可诱导JNK1磷酸化,进而影响下游TRPC6信号表达,造成胶原蛋白沉积过多,导致心肌细胞肥大和纤维化,从而引起DCM的发生发展。
作者贡献:陈昕明进行实验设计与实施、资料收集整理、撰写论文、成文并对文章负责;陈昕明、刘晓亮进行实验实施、评估、资料收集;吴伟指导论文书写,并进行质量控制及审校。
本文无利益冲突。
[1]RUBLER S,DLUGASH J,YUCEOGLU Y Z,et al.New type of cardiomyopathy associated with diabetic glomerulosclerosis[J].Am J Cardiol,1972,30(6):595-602.
[2]HAMBY R I,ZONERAICH S,SHERMAN L.Diabetic cardiomyopathy[J].JAMA,1974,229(13):1749-1754.
[3]BUGGER H,BODE C.The vulnerable myocardium.Diabetic cardiomyopathy[J].Hamostaseologie,2014,35(1):17-24.
[4]MURTAGH G,O CONNELL J,O CONNELL E,et al.Importance of risk factor management in diabetic patients and reduction in stage B heart failure[J].QJM,2015,108(4):307-314.
[5]PACHORI A S,CUSTER L,HANSEN D,et al.Bone morphogenetic protein 4 mediates myocardial ischemic injury through JNK-dependent signaling pathway[J].J Mol Cell Cardiol,2010,48(6):1255-1265.
[6]PALOMEQUE J,DELBRIDGE L,PETROFF M V.Angiotensin Ⅱ:a regulator of cardiomyocyte function and survival[J].Front Biosci (Landmark Ed),2009,14:5118-5133.
[7]MEHTA P K,GRIENDLING K K.Angiotensin Ⅱ cell signaling:physiological and pathological effects in the cardiovascular system[J].Am J Physiol Cell Physiol,2007,292(1):C82-97.
[8]LIU X,QI F,WU W.Effect of intervention in the diacylglycerol-protein kinase C signaling pathway on JNK1 expression and its downstream signaling in diabetic cardiomyopathy[J].Mol Med Rep,2014,9(3):979-984.
[9]ANEJA A,TANG W H,BANSILAL S,et al.Diabetic cardiomyopathy:insights into pathogenesis,diagnostic challenges,and therapeutic options[J].Am J Med,2008,121(9):748-757.
[10]LIANG Q,MOLKENTIN J D.Redefining the roles of p38 and JNK signaling in cardiac hypertrophy:dichotomy between cultured myocytes and animal models[J].J Mol Cell Cardiol,2003,35(12):1385-1394.
[11]JIANG S,GAVRIKOVA T A,PEREBOEV A,et al.Adenovirus infection results in alterations of insulin signaling and glucose homeostasis[J].Am J Physiol Endocrinol Metab,2010,298(6):E1295-1304.
[12]JOZSEF L,TASHIRO K,KUO A,et al.Reticulon 4 is necessary for endoplasmic reticulum tubulation,STIM1-Orai1 coupling,and store-operated calcium entry[J].J Biol Chem,2014,289(13):9380-9395.
[13]HOGAN P G,LEWIS R S,RAO A.Molecular basis of calcium signaling in lymphocytes:STIM and ORAI[J].Annu Rev Immunol,2010,28:491-533.
[14]LIN C H,LEE E H.JNK1 inhibits GluR1 expression and GluR1-mediated calcium influx through phoshorylation and stabilization of Hes-1[J].J Neurosci,2012,32(5):1826-1846.
[15]CHU W,WAN L,ZHAO D,et al.Mild hypoxia-induced cardiomocyte hypertrophy via up-regulation of HIF-1α-mediated TRPC signalling[J].J Cell Mol Med,2012,16(9):2022-2034.
[16]SANDOW S L,SENADHEERA S,GRAYSON T H,et al.Calcium and endothelium-mediated vasodilator signaling[J].Adv Exp Med Biol,2012,740:811-831.
[17]ONOHARA N,NISHIDA M,INOUE R,et al.TRPC3 and TRPC6 are essential for angiotensin Ⅱ-induced cardiac hypertrophy[J].EMBO J,2006,25(22):5305-5316.
[18]KUWAHARA K,WANG Y,MCANALLY J,et al.TRPC6 fulfills a calcineurin signaling circuit during pathologic cardiac remodeling[J].J Clin Invest,2006,116(12):3114-3126.
[19]李延辉,吴伟,于艳秋,等.siRNA干扰HIF-1α表达对高糖高胰岛素诱导的肥大心肌细胞的影响[J].中国组织化学与细胞化学杂志,2011,20(3):241-245.
(本文编辑:崔丽红)
Relationship between c-junN Terminal Kinase 1 and Early Injury in the Myocardium of Diabetic Rats
CHENXin-ming,LIUXiao-liang,WUWei.
DepartmentofEmergency,theFirstHospitalofChinaMedicalUniversity,Shenyang110001,ChinaCorrespondingauthor:WUWei,DepartmentofEmergency,theFirstHospitalofChinaMedicalUniversity,Shenyang110001,China;E-mail:wuwei196010@126.com
ObjectiveTo investigate the relationship between c-jun N terminal kinase 1 (JNK1) and early injury in the diabetic myocardium(DM) rats.MethodsFrom October 2013 to July 2014,after one-week adaptive feed of the 80 female Sprague-Dawley (SD) rats at SPF levels,60 rats were selected by random number table method.They were established as DM model group by four-week high glucose and high fat diet and a one-time left lower quadrant intraperitoneal injection of streptozotocin (STZ) at a dose of 35 mg/kg.The other 20 rats,one-time intraperitoneally injected of citrate buffer solution of same volume,were regarded as the control group (group A) with four-week normal diet.In the end,modeling of the 48 rats was established successfully.They were divided into group B,group C and group D with 16 rats in each group by random number table method.Rats in group C were given an intraperitoneal injection of SP600125,rats in group D were subcutaneously implanted with an osmotic pump to infuse angiotensin Ⅱ (Ang Ⅱ) and 0.9% sodium chlo-ride,rats in group A and group B were given an intraperitoneal injection of 0.9% sodium chlo-ride.After six-week feeding,10 rats were selected from each group through random number table method.The heart/body weight ratio (H/B) and left ventricular mass index (LVMI) were detected.The Hematoxylin and Eosin staining were used to observe the myocardial pathological changes.Immunohistochemistry SABC method was used to measure the expression level of JNK1,phosphorylation JNK1 (p-JNK1),transient receptor potential canonical channels (TRPC) 6 and collagen Ⅰ.ResultsThe H/B in group B,group C and group D was higher than that in group A,and LVMI in group B and group D was higher than that in group A (P<0.05);H/B and LVMI of rats in group C were lower than those in group B and group D (P<0.05).The myocardial cells of rats in group A arranged in neat rows with tight junctions and clear myocardial texture;while the myocardial cells of rats in group B,group C and group D had hypertrophic changes of different degrees,characterized by dilated intercellular space,disordered cell arrangement and less clear myocardial texture.The expression level of JNK1,p-JNK1,TRPC6,and collagen Ⅰ of rats in group B,group C and group D was higher than that in group A (P<0.05);the expression level of JNK1,p-JNK1,TRPC6,and collagen Ⅰ of rats in group C was lower that in group B (P<0.05);the expression level of p-JNK1,TRPC6,and collagen Ⅰ of rats in group D was higher than that in group B and group C,the expression level of JNK1 in group D was higher than that in group C (P<0.05).ConclusionHigh glucose environment may induce JNK1 phosphorylation,and affect the expression of TRPC6,which will lead to an increased collagen deposition,and finally result in cardiomyocyte hypertrophy and fibrosis,and cause the occurrence and development of diabetic cardiomyopathy.
Diabetes mellitus;Cardiomyopathies;c-junN terminal kinase 1;Transient receptor potential canonical channels
全国临床医药研究专项基金(L201257);辽宁省科技厅科学技术计划项目(2013225049)
110001 辽宁省沈阳市,中国医科大学附属第一医院急诊科
吴伟,110001 辽宁省沈阳市,中国医科大学附属第一医院急诊科;E-mail:wuwei196010@126.com
R 587.1
A
10.3969/j.issn.1007-9572.2016.27.005
2015-11-18;
2016-04-05)

