Claudin-4在胆管癌中的表达及其临床意义*
王 云 陈 敏 陈 骏 李运红 诸葛宇征
南京医科大学鼓楼临床医学院(210008)
Claudin-4在胆管癌中的表达及其临床意义*
王云#陈敏陈骏李运红&诸葛宇征&
南京医科大学鼓楼临床医学院(210008)
背景:胆管癌是起源于胆管上皮细胞、恶性程度极高的消化系统肿瘤。Claudin-4是细胞间紧密连接结构的关键组分,上皮肿瘤中普遍存在claudin-4表达异常,并与肿瘤发生、发展有密切联系。目的:分析claudin-4在胆管癌中的表达及其与患者临床病理特征和预后的相关性。方法:应用免疫组化方法检测claudin-4在77例胆管癌及其配对癌旁组织中的表达率和表达强度,分析其表达与患者临床病理特征的关系,同时以Kaplan-Meier生存曲线行生存分析。结果:胆管癌组织中claudin-4以强阳性表达为主,癌旁组织以中等和弱阳性表达为主,癌组织免疫组化评分显著高于癌旁组织(9.22±3.62对7.12±4.26,P<0.05)。胆管癌组织中的claudin-4表达与肿瘤部位和分化程度显著相关(P均<0.05),低分化腺癌高表达率显著高于高-中分化腺癌(76.2%对50.0%)。Claudin-4低表达组和高表达组31个月累积生存率分别为29.8%和21.1%,组间差异无统计学意义(P>0.05)。结论:Claudin-4在胆管癌中呈异常高表达,并与肿瘤分化程度呈负相关,因此有望成为胆管癌诊断新的生物学标记物和治疗靶点。
胆管肿瘤;预后;Claudin-4;免疫组织化学
Background: Cholangiocarcinoma (CCA) is a fatal digestive system tumor arising from biliary epithelium. Claudin-4, a key constituent of intercellular tight junction, is aberrantly and widely expressed in various epithelial tumors, and is correlated with tumorigenesis and tumor progression. Aims: To investigate the expression of claudin-4 in CCA and its correlation with clinicopathological characteristics of the tumor and patient’s prognosis. Methods: Immunohistochemistry was used to determine the expression rate and intensity of claudin-4 in CCA tissue and matched paracancerous tissue of 77 CCA patients. Correlation of claudin-4 expression in CCA with its clinicopathological characteristics was analyzed, and survival analysis was conducted by using Kaplan-Meier method. Results: Claudin-4 was strongly expressed in CCA tissue and mildly or weakly expressed in matched paracancerous tissue; the immunohistochemical score was significantly higher in cancerous tissue than in paracancerous tissue (9.22±3.62vs. 7.12±4.26,P<0.05). Claudin-4 expression was significantly correlated with tumor location and tumor differentiation (Pall <0.05); the high expression rate was significantly higher in poorly differentiated CCA than in well or moderately differentiated ones (76.2%vs. 50.0%). The 31-month accumulate survival rates of claudin-4 low-expression group and high-expression group were 29.8% and 21.1%, respectively (P>0.05). Conclusions: Claudin-4 is highly expressed in CCA and negatively correlated with tumor differentiation. It might be a novel diagnostic biomarker and therapeutic target for CCA.
作为整合素家族成员之一,claudin-4是细胞间紧密连接结构的关键组分,在正常上皮组织中发挥固定细胞和调节细胞间通透性的作用。上皮肿瘤中普遍存在claudin-4表达异常,并与肿瘤发生、发展有密切联系[1],已发现claudin-4在卵巢癌、乳腺癌、胰腺癌、前列腺癌、结直肠癌、胃癌、肺腺癌等多种恶性肿瘤中呈高表达[1-6],并与某些恶性肿瘤的预后不良相关[3,6]。Ryu等[7]的研究显示,claudin-4在肝内胆管癌中的表达率显著高于肝细胞癌,是两者鉴别诊断的独立生物学标记物。Bunthot等[8]则发现,claudin-4在肝吸虫相关胆管癌和癌前增生胆管上皮中呈高表达,敲除claudin-4可抑制胆管癌细胞的迁移和侵袭能力。然而亦有研究发现claudin-4在恶性肿瘤中起抑癌作用,如在卵巢癌细胞中,claudin-4可抑制EphA2致癌信号通路激活[9];在胰腺导管腺癌中,claudin-4高表达预示患者预后较好[10]。鉴于claudin-4在恶性肿瘤中的生物学作用存在争议且我国目前尚无关于claudin-4在胆管癌中表达的研究,本研究通过检测claudin-4在77例胆管癌及其配对癌旁组织中的表达,分析其表达与胆管癌患者临床病理特征和预后的相关性,初步探讨claudin-4在胆管癌诊断和治疗中的意义。
材料与方法
一、标本来源
收集2013年3月—2014年8月在南京鼓楼医院接受胆管癌手术治疗患者的冰冻或石蜡包埋组织标本,同时采集患者临床病理资料,电话随访获取生存信息。入组标本HE染色切片由资深病理医师再次读片,与住院期间病理诊断进行比对、确认。排除标准:①再次病理读片确认为非胆管癌;②随访过程中因“非胆管癌”原因死亡;③术前接受放疗或化疗;④临床病理资料不完整。结果共77例胆管癌组织及其配对癌旁组织(肿瘤切缘经病理证实的非癌组织)标本纳入研究,来源病例中男性49例,女性28例,年龄34~79岁,平均(58.8±10.6)岁;肿瘤部位:肝内23例,肝门部31例,远端23例。生存时间定义为术后第1 d至因胆管癌死亡或随访截止时间(2015年10月)的生存月数。
二、免疫组化染色
兔抗人claudin-4单克隆抗体为Abcam plc.产品,SP免疫组化检测试剂盒为北京中杉金桥生物技术有限公司产品。石蜡切片脱蜡水化,3% H2O2室温静置10 min去除内源性过氧化物酶,PBS漂洗3×5 min;柠檬酸热抗原修复,PBS漂洗3×5 min;加入正常山羊血清室温封闭2 h,PBS漂洗2次;加入一抗(1 μg/mL),4 ℃孵育过夜,PBS漂洗3×5 min;加入二抗,室温孵育30 min,PBS漂洗3×5 min;加入DAB染色液,显微镜下观察,自来水冲洗终止染色;苏木精复染,脱水,透明,中性树胶封片,由资深病理医师读片。
结果判断:采用Formwitz半定量积分法。光学显微镜下每张切片随机选取5个100倍视野,计数阳性细胞并观察染色强度。阳性细胞比率:≤5%,0分;6%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。染色强度:无色,0分;淡黄色,1分;黄色,2分;棕黄色,3分。总分为两项评分之积:0分为阴性(-),1~4分为弱阳性(+),5~8分为中等阳性(++),9~12分为强阳性(+++);0~8分为低表达,9~12分为高表达。
三、统计学分析
结 果
一、Claudin-4在胆管癌组织中表达上调
免疫组化染色结果显示,胆管癌组织中claudin-4以强阳性表达为主,癌旁组织以中等和弱阳性表达为主,阳性表达主要定位于胞膜和胞质(图1)。癌组织和癌旁组织中claudin-4免疫组化评分分别为9.22±3.62和7.12±4.26,癌组织明显高于癌旁组织,差异有统计学意义(t=4.18,P<0.05)。
二、胆管癌组织中claudin-4表达与患者临床病理特征的关系
统计分析显示,不同部位胆管癌的claudin-4表达水平差异显著,肝内胆管癌、肝门部胆管癌和远端胆管癌高表达率分别为78.3%、54.8%和39.1%(P<0.05);此外,claudin-4表达水平与胆管癌分化程度亦显著相关,低分化腺癌高表达率显著高于高-中分化腺癌(76.2%对50.0%,P<0.05);claudin-4表达水平与患者性别、年龄、肿瘤大小、TNM分期和有无血管浸润均无相关性(P>0.05)(表1)。

A(C):胆管癌细胞胞膜、胞质claudin-4强阳性表达;B(D):癌旁组织claudin-4弱阳性表达
表1胆管癌组织中claudin-4表达与患者临床病理特征的关系
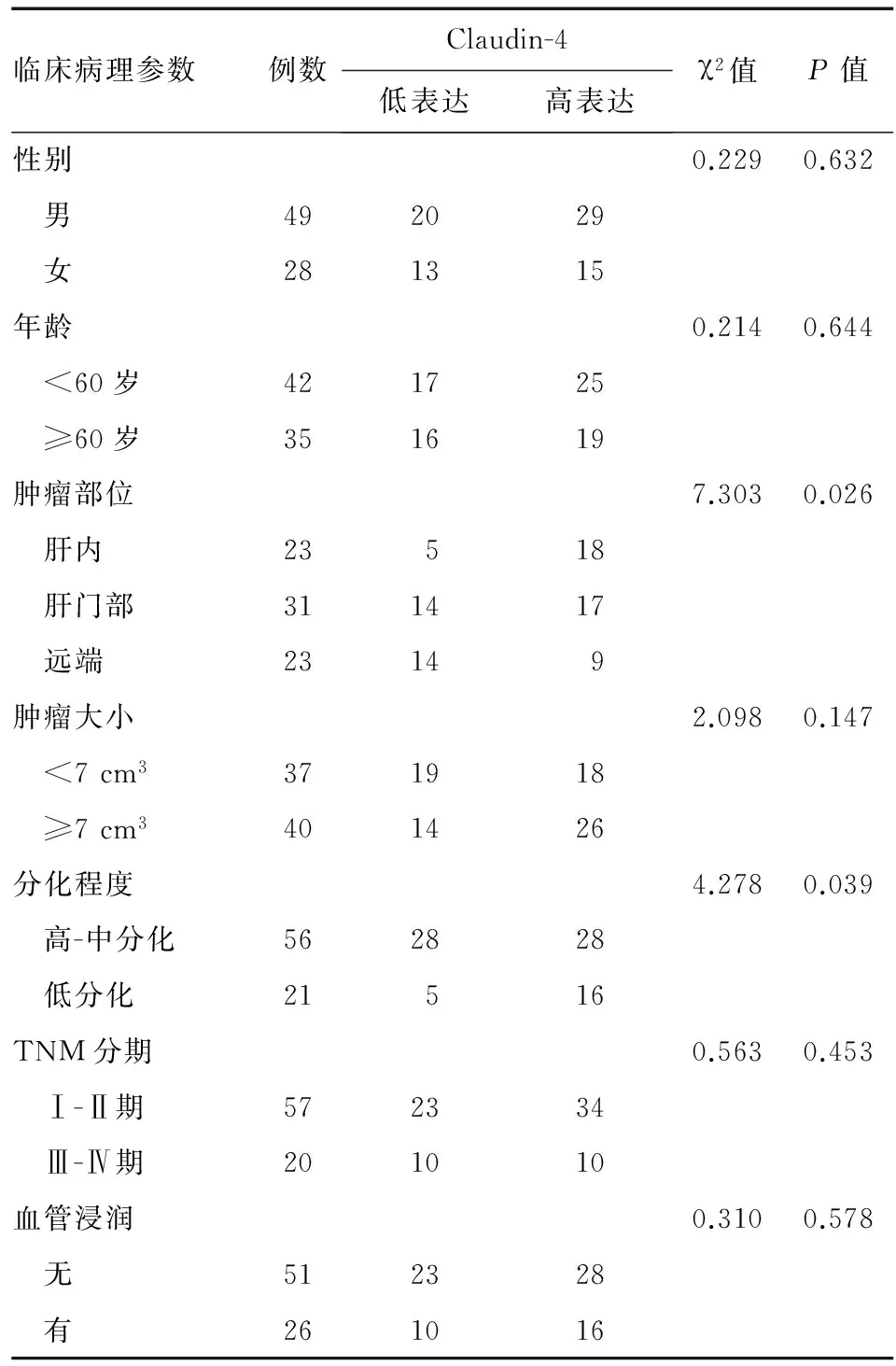
临床病理参数例数Claudin-4低表达高表达χ2值P值性别0.2290.632 男492029 女281315年龄0.2140.644 <60岁421725 ≥60岁351619肿瘤部位7.3030.026 肝内23518 肝门部311417 远端23149肿瘤大小2.0980.147 <7cm3371918 ≥7cm3401426分化程度4.2780.039 高-中分化562828 低分化21516TNM分期0.5630.453 Ⅰ-Ⅱ期572334 Ⅲ-Ⅳ期201010血管浸润0.3100.578 无512328 有261016
鉴于claudin-4在不同部位胆管癌中的表达差异,本研究分别分析了其在不同部位胆管癌中的表达水平与患者临床病理特征的关系,结果显示肝内胆管癌中的claudin-4表达与性别相关,男性高表达率显著高于女性(P=0.033);肝门部胆管癌中的claudin-4表达与肿瘤分化程度相关,低分化腺癌高表达率显著高于高-中分化腺癌(P=0.021)。
三、胆管癌组织中claudin-4表达与患者预后的关系
71例患者获得完整随访资料,中位随访期23个月(14~31个月)。Kaplan-Meier生存曲线分析显示,claudin-4低表达组和高表达组31个月累积生存率分别为29.8%和21.1%,组间差异无统计学意义(χ2=1.566,P=0.211)(图2)。

图2胆管癌组织中claudin-4表达与患者预后的关系(Kaplan-Meier生存曲线)
讨 论
胆管癌是起源于胆管上皮细胞、恶性程度极高的消化系统肿瘤,按其发生部位可分为肝内胆管癌、肝门部胆管癌和远端胆管癌,近年其发病率和死亡率呈逐年上升趋势。由于缺乏特异性诊断指标和有效的晚期肿瘤治疗方案,胆管癌患者预后极差,诊断后5年生存率低[11-13]。因此,寻找胆管癌特异性生物学标记物,对于其早期诊断、早期治疗和疗效提高具有重要意义。Claudin-4为细胞表面跨膜蛋白,近年对其在上皮肿瘤中作用的研究报道不断增多,但涉及胆管癌者尚少。本研究旨在分析claudin-4表达与胆管癌患者临床病理特征和预后的关系,探讨其是否可作为胆管癌诊断和治疗的靶点。
既往国外研究[7-8]和本研究均发现claudin-4在胆管癌组织中呈异常高表达,提示其可能为胆管癌相关抗原之一。今后可考虑对行ERCP操作的胆管癌和非胆管癌患者进行胆汁claudin-4检测,观察是否存在表达差异,以明确其对胆管癌的诊断意义。本研究免疫组化染色结果显示,claudin-4在胆管癌癌旁组织中以中等和弱阳性表达为主,而Bunthot等[8]发现claudin-4在正常胆管组织(非癌旁组织)中呈弱阳性而无中等阳性表达,分析其原因可能为癌旁组织虽保持正常形态,但癌组织对其细胞代谢和分子表达可产生一定影响,导致其claudin-4表达与正常胆管组织存在差异。本研究分析显示,胆管癌组织中的claudin-4表达水平与肿瘤分化程度呈负相关,提示其在胆管肿瘤上皮的分化成熟过程中可能起一定调节作用。恶性肿瘤的分化程度一般与患者预后呈正相关,由此推测claudin-4高表达者预后相对较差,本研究Kaplan-Meier生存曲线分析证实claudin-4高表达者31个月累积生存率低于低表达者(21.1%对29.8%),但组间差异无统计学意义,考虑与本研究样本量较小、入组病例临床分期不均一等因素有关。今后拟累积样本量和病例随访时间,并选择临床分期均一的病例进行分析,以期更好地评估claudin-4对胆管癌患者预后的影响。
Claudin-4为整合素家族成员,具有调节细胞渗透性和物质转运的作用。本实验发现肝内、肝门部和远端胆管癌组织的claudin-4高表达率呈递减趋势,考虑可能与不同部位胆管上皮细胞的上述功能存在差异,以及不同部位胆管癌在起源、病因和发病机制方面本身即存在明显差异有关[13]。进一步分析claudin-4在不同部位胆管癌中的表达水平与患者临床病理特征的关系,发现肝内胆管癌中其表达与患者性别相关,而在肝门部胆管癌中,其表达与肿瘤分化程度相关,此种差异亦提示claudin-4在不同部位胆管癌中所起的作用可能有所不同,其确切生物学功能有待后续累积样本量作进一步研究。
综上所述,本研究发现claudin-4在胆管癌中呈异常高表达,并与肿瘤分化程度呈负相关,因此有望成为胆管癌诊断新的生物学标记物和治疗靶点。有研究[14]将具有claudin-4结合作用而无毒性的产气荚膜梭菌肠毒素羧基端片段(C-CPE)与具有细胞毒作用的白喉毒素片段A(DTA)融合,建立了可特异性靶向claudin-4,进而发挥细胞毒作用的DTA-C-CPE分子,提示了claudin-4用于肿瘤靶向治疗的可行性。Claudin-4表达与胆管癌分化程度呈负相关,与患者预后亦有负相关倾向,提示其在胆管癌中总体上起促癌作用,但其在不同部位胆管癌中的生物学功能及其可能促癌机制仍有待进一步研究。
1 向若兰,苏运超,裴晓庆,等. 紧密连接蛋白claudin-4的研究进展[J]. 生理科学进展, 2012, 43 (4): 310-314.
2 Morin PJ. Claudin proteins in human cancer: promising new targets for diagnosis and therapy[J]. Cancer Res, 2005, 65 (21): 9603-9606.
3 Lanigan F, McKiernan E, Brennan DJ, et al. Increased claudin-4 expression is associated with poor prognosis and high tumour grade in breast cancer[J]. Int J Cancer, 2009, 124 (9): 2088-2097.
4 王琳,李世拥,安萍,等. Claudin-1和Claudin-4在结直肠癌组织中的表达及临床意义[J]. 中华胃肠外科杂志, 2012, 15 (10): 1073-1076.
5 Wang H, Yang X. The expression patterns of tight junction protein claudin-1, -3, and -4 in human gastric neoplasms and adjacent non-neoplastic tissues[J]. Int J Clin Exp Pathol, 2015, 8 (1): 881-887.
6 Chae MC, Park CK, Keum DY, et al. Prognostic significance of claudin 4 in completely resected adenocarcinoma of the lung[J]. Korean J Thorac Cardiovasc Surg, 2014, 47 (3): 262-268.
7 Ryu HS, Lee K, Shin E, et al. Comparative analysis of immunohistochemical markers for differential diagnosis of hepatocellular carcinoma and cholangiocarcinoma[J]. Tumori, 2012, 98 (4): 478-484.
8 Bunthot S, Obchoei S, Kraiklang R, et al. Overexpression of claudin-4 in cholangiocarcinoma tissues and its possible role in tumor metastasis[J]. Asian Pac J Cancer Prev, 2012, 13 Suppl: 71-76.
9 Shang X, Lin X, Howell SB. Claudin-4 controls the receptor tyrosine kinase EphA2 pro-oncogenic switch through β-catenin[J]. Cell Commun Signal, 2014, 12: 59.
10Tsutsumi K, Sato N, Tanabe R, et al. Claudin-4 expression predicts survival in pancreatic ductal adenocarcinoma[J]. Ann Surg Oncol, 2012, 19 Suppl 3: S491-S499.
11Khan SA, Toledano MB, Taylor-Robinson SD. Epidemiology, risk factors, and pathogenesis of cholangiocarcinoma[J]. HPB (Oxford), 2008, 10 (2): 77-82.
12Razumilava N, Gores GJ. Cholangiocarcinoma[J]. Lancet, 2014, 383 (9935): 2168-2179.
13Rizvi S, Gores GJ. Pathogenesis, diagnosis, and management of cholangiocarcinoma[J]. Gastroenterology, 2013, 145 (6): 1215-1229.
14Kakutani H, Kondoh M, Saeki R, et al. Claudin-4-targeting of diphtheria toxin fragment A using a C-terminal fragment ofClostridiumperfringensenterotoxin[J]. Eur J Pharm Biopharm, 2010, 75 (2): 213-217.
(2015-12-04收稿;2016-01-10修回)
Expression of Claudin-4 in Cholangiocarcinoma and its Clinical Significance
WANG Yun, CHEN Min, CHEN Jun, LI Yunhong, ZHUGE Yuzheng.
Drum Tower Clinical Medical College of Nanjing Medical University, Nanjing (210008)Co-correspondence to: LI Yunhong, Email: 13605156761@163.com; ZHUGE Yuzheng, Email: yuzheng9111963@aliyun.com
Bile Duct Neoplasms;Prognosis;Claudin-4;Immunohistochemistry
10.3969/j.issn.1008-7125.2016.08.004
南京市医学科技发展项目医学重点科技发展项目(ZKX11022);南京市医学科技发展项目医药卫生科研课题(YKK12053);南京市医学科技发展项目杰出青年基金项目(JQX14005)
#Email: 972585606@qq.com
&本文共同通信作者,李运红,Email: 13605156761@163.com;诸葛宇征,Email: yuzheng9111963@aliyun.com

